È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Due metodi di Formazione Heterokaryon per scoprire fattori di restrizione HCV
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo due metodi per la condizionale Trans-Complementazione del virus dell'epatite C (HCV), il montaggio e il completamento del ciclo di vita virale, che si basano sulla formazione heterokaryon. Queste tecniche sono adatte allo schermo per linee cellulari che esprimono fattori di restrizione dominanti, che escludono la produzione di progenie infettiva HCV.
Abstract
Virus dell'epatite C (HCV) è un virus epatotropi con un host-range limitato per gli esseri umani e scimpanzé. Sebbene la replicazione di HCV RNA è stata osservata in linee cellulari umane non epatiche e murino, l'efficienza era molto basso e necessarie a lungo termine utilizzando procedure di selezione HCV replicone costruisce esprimere dominanti antibiotico-marcatori selezionabili 1-5. HCV in vitro ricerca è quindi limitato a linee cellulari umane di epatoma permissive per entrata del virus e completamento del ciclo vitale del virus. Grazie alla stretta HCVs tropismo specie, non esiste un modello immunocompetenti piccolo animale a disposizione che sostiene l'intero ciclo di replicazione di HCV 6-8. Inefficiente replicazione di HCV in cellule di origine murina esempio non umani è probabilmente dovuto alla mancanza di incompatibilità genetica di fattori essenziali dipendenza ospite e / o espressione di fattori di restrizione.
Abbiamo studiato se la propagazione è soppresso da HCV fa restrizione dominantectors sia in linee cellulari umane derivate da tessuti non-epatiche o in linee di cellule di fegato di topo. A tal fine, abbiamo sviluppato due indipendenti condizionali trans-complementazione I metodi basati sulla fusione di cellule somatiche. In entrambi i casi, il completamento del ciclo di replicazione virale è possibile solo nelle eterocarionti. Di conseguenza, successo trans-complementazione, che è determinata misurando la produzione de novo di progenie virale infettivo, indica l'assenza di limitazioni dominanti.
In particolare, subgenomici repliconi HCV trasportano un transgene luciferasi sono stati trasfettati in cellule permissive altamente epatoma umano (7,5-Huh cellule). Successivamente, queste cellule sono state co-coltivate e fuse a varie cellule umane e murine esprimono proteine HCV anima strutturale, busta 1 e 2 (E1, E2) e accessorio proteine NS2 e P7. Purché la fusione cellulare è stata iniziata mediante trattamento con polietilene-glicole (PEG), la coltura rilasciato virale infettivo paARTICOLI che le cellule infettate naïve in un recettore-dipendente.
Per valutare l'influenza delle restrizioni dominanti sul ciclo di vita virale, compresa l'iscrizione delle cellule, la traduzione RNA, la replicazione del virus e l'assemblaggio, abbiamo approfittato di una linea cellulare umana fegato (Huh-7 Lunet N celle 9), che manca l'espressione endogena di CD81, un fattore essenziale ingresso di HCV. In assenza di ectopicamente CD81 espresso, queste cellule sono essenzialmente refrattari a infezione da HCV 10. È importante sottolineare che, quando co-coltura e fuse con cellule che esprimono CD81 umano, ma la mancanza di almeno un altro fondamentale fattore di cella (cioè SR-BI, CLDN1, OCLN), solo i eterocarionti risultanti visualizzare l'insieme completo dei fattori di ingresso necessari per l'infezione da HCV. Pertanto, per analizzare se fattori di restrizione dominanti sopprimere completamento del ciclo di replicazione di HCV, si fuse Lunet N celle con varie cellule di origine umana e di topo che soddisfano il critico suddettoeria. Quando co-coltura di cellule sono state transfettate con una proteina altamente fusogenico virale mutante del virus schiumoso prototipo (PFV 11) e successivamente contestata con particelle infettive (HCV HCVcc), la produzione de novo del virus infettivo è stato osservato. Ciò indica che HCV completato con successo il suo ciclo di replica in eterocarionti escludiamo quindi l'espressione di fattori di restrizione dominanti in queste linee cellulari. Questi nuovi condizionali trans-complementazione metodi saranno utili a programmare una grande pannello di linee cellulari e cellule primarie per l'espressione di HCV-specifici fattori di restrizione dominanti.
Protocollo
Fusion cella PEG
1. Coltura cellulare
- Culture Huh-7.5, HeLa e Hep56.1D linee cellulari pretrattati o di confezionamento 12 in piatti di coltura cellulare 15 cm in DMEM completo (DMEM cplt) medie, DMEM supplementato con 2 mM L-glutammina, 1x amminoacidi non essenziali, 100 U / mL di penicillina, 100 pg / ml streptomicina, e 10% siero di vitello fetale. Applicare scelta appropriata per linee cellulari stabili come indicato nella Tabella 1.
2. Trasfezione di HCV RNA
- Lavare Huh 7,5-cellule (uno confluenti piatto 15 cm) per due volte con soluzione tampone fosfato (PBS), Tripsinizzare, e risospendere ad una concentrazione di 1.5x10 7 cellule / ml in Cytomix (120 mM KCl, 0,15 mM CaCl 2, 10 mM K 2 HPO 4 [pH 7,6], HEPES 25 mM, EGTA 2 mM, 5 mM MgCl 2, regolato a pH 7,6 con KOH e sterilizzata per filtrazione) contenente 2 mM ATP e 5 mM glutatione.
- Trasfezione via electroporatione 400 microlitri della sospensione cellulare (6x10 6 cellule) con 10 pg HCV RNA (pFKi389Luc-EI/NS3-3 '_JFH1_dg 13) utilizzando cuvette con un traferro di 0,4 cm e un Gene Pulser Xcell sistema (Biorad) impostato a 975 uF e 270 V come descritto in precedenza 14.
- Trasferire immediatamente trasfettate Huh-cellule 7,5 a 10 ml di terreno DMEM cplt e le sementi la sospensione intero in un piatto singola cultura di 10 cm di diametro. Cellule di coltura per 24 ore a 37 ° C e 5% CO 2.
3. Induzione della fusione a PEG
- Cellule Harvest come descritto al punto 2.1, risospendere in terreno DMEM cplt e portare a 5x10 5 cellule / ml.
- Generare sospensioni monocellulari di Huh-7.5, HeLa, e le cellule packaging Hep56.1D e diluire a 5x10 5 cellule / ml, 2x10 5 cellule / ml, e 2x10 5 cellule / ml, rispettivamente. Si noti che le cellule di imballaggio ectopicamente esprimono proteine HCV core, E1, E2, p7 e NS2 dopo trasduzione con duedipendenti vettori lentivirali trasduzione un C-E1 e E2-P7-NS2 cassetta di espressione, rispettivamente 13, 15.
- Preparare 6 e piastre di coltura con 2-3 buste sterili di copertura in vetro per pozzetto per ulteriori analisi di efficienza fusione.
- Combinare 1 mL di 7,5-trasfettate Huh cellule che ospitano il replicone subgenomico con 1 ml di cellule packaging, seme in un pozzetto di una piastra da 6 pozzetti, e incubare per 24 ore a 37 ° C e 5% CO 2.
- A questo punto di tempo, densità cellulare deve variare tra 60-80% di confluenza prima dell'induzione di fusione cellulare per permettere alle cellule di essere in stretta vicinanza di membrane cellulari di fondere.
- Aspirare il terreno da co-coltura di cellule e lavare una volta con 1 ml di PBS, poi accuratamente aggiungere 500 pl di pre-riscaldato 40% PEG-1500 o PBS come controllo e incubare per 5 min a 37 ° C per indurre la formazione heterokaryon.
- Aspirare PEG e lavare 3-5 volte per 1 minuto (min) per lavaggio con 2 ml di PBS per rimuovere PEG eccesso e infine aggiungere 2mL di terreno DMEM cplt a ciascun pozzetto ed incubare a 37 ° C e 5% CO 2.
- Quarantotto ore dopo la fusione, di raccogliere ogni filtro surnatante e filtrare attraverso un micron 0.45.
- Misura la produzione di particelle infettive in eterocarionti fuse da inoculazione di ingenui Huh-cellule 7,5 (8x10 4 cellule / pozzetto seminate in a 12-pozzetti, 24 ore prima dell'inoculazione) con 500 microlitri di cell-free fluido di coltura e la successiva determinazione della luciferasi attività 14.
4. Immunofluorescenza per determinare l'efficienza Fusion
- Dopo aver raccolto surnatanti di coltura cellulare (sezione 3.8), lavare i pozzetti contenenti vetro scivola una volta con 1 ml di PBS per 1 min. Tutti i passaggi seguenti devono essere eseguiti a temperatura ambiente (RT) e il lavaggio deve essere fatto con 1 ml di PBS per 1 min per lavaggio.
- Fissare cellule con 600 microlitri del 3% paraformaldeide (PFA) in PBS per 15 minuti e poi lavate 3 volte con PBS. Trasferire accuratamente i vetrini coprioggettoin una piastra da 24 pozzetti utilizzando una pinza.
- Permeabile cellule con 500 pl di 0,5% Triton X-100 in PBS per 5 minuti e successivamente lavate 3 volte con PBS.
- Preparare la soluzione primaria di anticorpi in PBS supplementato con siero di capra al 5%. Utilizzare NS5A anticorpo anti-(9E10) ad una concentrazione di 0,5 ug / ml e monoclonale umano anti-E2 anticorpo (CBH-23) ad una concentrazione di 6,4 ng / mL. Applicare 250 pl a ciascun pozzetto ed incubare a temperatura ambiente per 45 min.
- Lavare 3x con PBS e rilevare legati anticorpi primari con 250 microlitri secondario di capra anti-topo di capra o anti-umano di anticorpi coniugati Alexa-Fluor 546 o Alexa-Fluor 488 IgG-specifici, ad una concentrazione di 2 ug / ml in PBS supplementato con 5% siero di capra. Incubare per 30 minuti a RT al buio.
- Quindi, lavare con PBS 1x e successivamente macchia nuclei delle cellule con 250 microlitri DAPI (4 ', 6'-Diamidino-2-fenilindolo dicloridrato) 1:3,000 diluito in PBS, incubare per 1 min a temperatura ambiente al buio.
- Lavare 4 volte con PBS e 1x con H 2 O, quindi montare i vetrini coprioggetto a testa in giù su una goccia di Fluoromount su un vetrino da microscopio, lasciare asciugare nel campione buio e valutare al microscopio a fluorescenza indiretta.
Fusion mediante trasfezione transiente di virus prototipo schiumoso (PFV) glicoproteina
5. Preparazione di inoculo virale
- Produrre un elevato stock di virus titolo di transfezione in vitro HCV RNA trascritto in uh 7,5 cellule e la raccolta supernatante di coltura delle cellule dopo 48 ore e 72 ore come descritto in precedenza 14. Determinare titolo virale limitando test di diluizione (TCID 50) 13.
6. Coltura cellulare, Fusion Cell di Transfection di una glicoproteina fusogenico PFV
- Cultura Lunet N, HeLa e Hep56.1D hCD81 cellule secondo le istruzioni riportate in Tabella 1 in mezzo DMEM contenente cplt selezioni appropriate.
- Staccare le cellule, come descritto in 2.1, preparare sospensioni monocellulari in DMEM cplt medium, e co-coltivare Lunet N cellule HeLa con o Hep56.1D hCD81 linee cellulari a rapporti di appropriate (ad esempio 1:2 per Hep56.1D hCD81 o 1:1 per le cellule HeLa) che producono una densità totale delle cellule di 1.5x10 5 cellule per 12-pozzetto ed incubare per 24 ore a 37 ° C e 5% CO 2.
- Il giorno successivo, transitoriamente trasfettare cellule con la proteina dell'involucro altamente fusogenico PFV (pczHFVenvEM066 16) usando Lipofectamine 2000 secondo le istruzioni del produttore.
7. Saggio di infezione
- Inoculare eterocarionti 30 h dopo la trasfezione con 350 microlitri di stock di virus (MOI di ~ 2.3) per 12 ore durante la notte, lavare una volta con PBS e aggiungere 1 ml di terreno DMEM cplt per bene. Incubare per 48 ore a 37 ° C e 5% CO 2.
- Surnatante Harvest heterokaryon della cultura, attraverso un filtro 0,45 micron filtro e inoculare Huh-7.5 cellule, seminate in piastre a 96 pozzetti (1x10 4 cellule / pozzetto) il giorno prima, in un saggio di diluizione limite 13.
- Dopo 72 h, macchia infettati Huh 7,5-HCV cellule con un anticorpo specifico (NS5A, 9E10) per quantificare la produzione di particelle infettive progenie.
8. Visualizzazione di fusione cellulare
- Per visualizzare eventi di fusione, preparare da 5 a 10 micron di soluzioni coloranti CellTracker in terreno DMEM senza additivi e completare i passaggi riportati di seguito 6 h prima di co-coltura (descritte ai punti 6.2 e 6.3).
- Lavare le cellule aderenti una volta con 5 ml di PBS e poi incubare cellule con 4 ml di soluzione colorante per piatto 10 cm per 45 min a 37 ° C e 5% CO 2 (macchia Lunet N celle con CellTracker arancione CMTMR e HeLa o Hep56.1D hCD81 cellule con CellTracker verde CMFDA, separatamente).
- Lavare le cellule una volta con 5 ml di PBS per 1 min e aggiungere mezzo DMEM cplt, incubare per 6 ore a 37 ° C e 5% CO 2.
- Preparare semina e la trasfezione di cellule marcate come sopra descritto nelle sezioni 6.2 e Tuttavia, aggiungere un vetrino per l'cell piatto di coltura prima della semina.
- 30 h dopo la trasfezione, le cellule lavate accuratamente con 1 ml di PBS per 1 minuto e poi fissare le cellule con 250 microlitri del 3% PFA per 15 minuti a RT. Lavare le cellule una volta con 1 ml di PBS per 1 min, macchia con DAPI per 1 min come descritto nella sezione 4.6, lavare una volta con 1 ml di PBS per 1 min, ripetere il lavaggio con H 2 O e vetrini coprioggetto montaggio su vetrini (vedere paragrafo 4.7 ). Analizzare le cellule con un microscopio a fluorescenza.
| Specie | Linea cellulare | Origine | Mezzo di crescita e selezione |
| Umano | Huh-7.5 | Subclone di Huh-7 linea di epatoma cella 17 | DMEM cplt |
| Huh-7.5 [CE1] [E2p7NS2] | Esprimono stabilmente virale nucleo proteine, E1, E2, p7, e NS2, trasdotte da gene t lentiviraleransfer di due cassette genici indipendenti | DMEM + cplt Blasticidin 5 pg / mL | |
| Huh-7 Lunet N | Subclone di Huh-7 linea di epatoma cella 9 | DMEM cplt | |
| HeLa | Linea cellulare di adenocarcinoma cervicale (ATCC numero: CCL-2) | DMEM cplt | |
| HeLa [CE1] [E2p7NS2] | Esprimono stabilmente virale nucleo proteine, E1, E2, p7, e NS2, trasdotte da trasferimento genico lentivirale di due cassette genici indipendenti | DMEM + cplt G418 750 pg / mL; Blasticidin 5 pg / mL | |
| Mouse | Hep56.1D | Carcinoma epatocellulare primario (gentile dono di J. Encke) C57BL/6J topi adulti | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | Ex stabilmentepremendo virale nucleo proteine, E1, E2, p7, e NS2, trasdotte da trasferimento genico lentivirale di due cassette gene indipendenti | DMEM + cplt G418 750 pg / mL; Blasticidin 5 pg / mL | |
| Hep56.1D hCD81 | Stabilmente esprimenti CD81 umani trasdotti da trasferimento genico lentivirale | DMEM + cplt Blasticidin 5 pg / mL |
Specifiche Tabella 1 sulla condizione origine e cultura di linee cellulari usati: Cplt. Completo, G418: geneticina, h: umano.
9. Risultati rappresentativi
In questo studio, abbiamo applicato due diversi metodi di fusione di cellule somatiche che ci permettono di indagare in particolare l'impatto dei fattori di restrizione al termine del ciclo di replicazione di HCV in eterocarionti. Da notare, il disegno condizionale di trans-complementazione sulla fusione dei due diversi tipi di cellule che assicurasolo in eterocarionti veri tra le cellule di fegato umano e non-permissive linee cellulari, l'assemblaggio del virus (approccio 1) o di ingresso del virus e l'intero ciclo di replicazione di HCV (approccio 2) sia compiuto.
Nel primo approccio Huh-7.5 cellule altamente permissive per HCV, sono state transitoriamente trasfettate con un replicone subgenomico esprime un transgene luciferasi e HCV proteine non strutturali di sostegno subgenomico HCV replicazione RNA (7,5-Huh cellule repliconi). Queste cellule sono state co-coltivate e fusa linee cellulari esprimenti proteine HCV anima strutturale, E1, E2, così come accessorio p7 proteine, e NS2. Figure1A mostra una panoramica della procedura sperimentale. È importante sottolineare che, a seguito di fusione PEG, tutte le proteine necessarie per il montaggio delle particelle dovrebbe essere presente nella heterokaryon formato che può essere confermata mediante immunofluorescenza contro singole proteine virali. Figura 1B rappresenta un evento esemplare di fusione in cui i segnali sia per NS5A espressi in uh 7,5 cellule repliconi e E2espressa in Huh 7,5-[CE1] [E2p7NS2] cellule packaging sono stati rilevati nel citoplasma stesso su PEG-indotta formazione heterokaryon. Quando co-coltura cellule sono state invece trattate con PBS, senza fusione è stata indotta quindi solo singolo cellule positive e non co-localizzazione dei segnali è stata osservata. Inoltre, per controllare l'espressione del transgene, abbiamo effettuato ELISA specifico per il nucleo e E2 (precedentemente riportato in dettaglio 15). In aggiunta alla linea cellulare di controllo di confezionamento Huh 7,5 [CE1] [E2p7NS2], abbiamo generato HeLa e cellule packaging Hep56.1D come rappresentanti per umana non fegato e cellule di fegato di topo, rispettivamente. HCV RNA efficienza replica in queste ultime cellule è l'Assemblea bassa e HCV e il rilascio non è stato dimostrato. La Figura 1C illustra i risultati del dosaggio fusione. I supernatanti sono stati raccolti dalla co-coltura a 48 h dopo l'induzione fusione e usate per inoculare naive Huh 7,5-cellule per le successive analisi luciferasi. In particolare, quando Huh-7.5 replicone cellule sono state fuse sia connaïve o linee cellulari trattati con PBS come controllo, senza infettività è stata rilevata nei fluidi di coltura. Tuttavia, quando la fusione cellulare tra Huh-7.5 replicone e linee cellulari di confezionamento è stata indotta dal PEG, trans-complementazione tra replicone e costitutivamente espresse proteine strutturali salvata la produzione di virus nei eterocarionti risultanti e particelle virali infettive sono stati liberati nel liquido di coltura. Si conclude quindi che la produzione di virus necessaria la fusione cellulare e l'espressione di proteine virali in linee cellulari di confezionamento. Sorprendentemente, non solo i eterocarionti di uh 7,5 cellule di epatoma umano, ma anche con eterocarionti umana non di fegato (HeLa [CE1] [E2p7NS2]) e il mouse del fegato (Hep56.1D [CE1] [E2p7NS2]) Comunicato virus cellule consentito, indicando che il montaggio e il rilascio non sono prevalentemente inibita da fattori di restrizione possibili in questi tipi cellulari. Espressione di proteine strutturali in linee cellulari di packaging e l'ingresso nelle cellule bersaglio autentica è stato mostrato in Frentzen Et al. 15.
Un metodo alternativo di fusione cellulare è stato utilizzato per analizzare le possibili limitazioni che influenzano l'immissione di cella, traduzione di RNA e fasi di replica RNA del ciclo di replica e ad escludere che un elevato carico virale in cellule trasfettate Huh 7,5 replicone precluderebbe individuazione dei fattori di restrizione di saturazione. A questo scopo, abbiamo sviluppato un saggio basato su indipendente inoculazione di eterocarionti con HCVcc e rilevamento di produzione de novo virus in queste cellule. Come illustrato nella Figura 2A, la fusione delle cellule somatiche è stata indotta mediante l'espressione di una glicoproteina fusogenico dopo co-coltivazione delle cellule. Questo metodo è stato scelto perché la sensibilità è stata aumentata probabilmente a causa di un aumento di efficienza di fusione. Eterocarionti sono state visualizzate mediante colorazione linee di cellule separate con coloranti CellTracker prima co-coltivazione. A heterokaryon con coloranti distribuiti omogeneamente all'interno del citoplasma indica fusione di due tipi di cellule, come indicanod in Figura 2B. Solo in eterocarionti di Lunet N cellule con cellule HeLa o Hep56.1D hCD81 cellule sono tutti i fattori di ingresso HCV con l'espressione selettiva rendendo eterocarionti sensibili alle cellule HCV. Sfida con HCVcc portato in replica completa di HCV in eterocarionti che è evidente dalla produzione de novo di malattie infettive progenie virale di circa 10 volte sopra lo sfondo del saggio (Figura 2C). Come controllo, Lunet N celle sono state fuse con Lunet N celle. È importante sottolineare che solo livelli molto bassi di HCV infettiva vicino al limite di rilevazione sono state osservate. Risultati simili sono stati ottenuti quando Lunet N celle sono state fuse con cellule Hep56.1D naive. In entrambi i casi, CD81 umano era assente in modo che HCV non produttivo infettare le eterocarionti. Questo infettività molto basso rilevato in questi due ultimi casi è probabilmente attribuibile al basso livello di infezione di cellule Lunet N e / o bassi livelli di residui di ingresso virus infettivo dal inoculo. In contrasto cellule HeLa e Hep56.1D hCD81 cellule esprimono CD81 umano, completando così il fattore mancanza di immissione di cella nelle eterocarionti e permettendo di entrata HCV delle cellule. Il 10 volte maggiore livello di HCV infettante rilevato nel mezzo di eterocarionti che coinvolgono queste due linee di cellule rispecchia dunque probabile che la produzione de novo di particelle infettive in eterocarionti. Così, abbiamo concluso che il completamento del ciclo di replicazione di HCV non è limitato escludendo l'espressione di fattori dominanti restrizione HCV in queste linee cellulari.
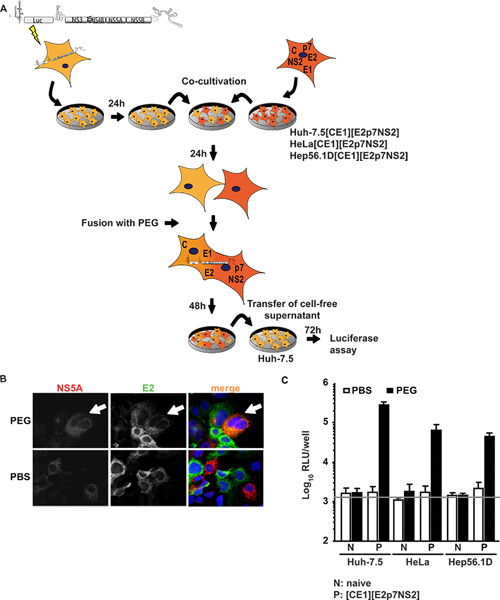
Figura 1. Trans-complementazione di assemblaggio HCV e rilascio in eterocarionti. (A) contorno schematica della procedura sperimentale di PEG-mediata fusione cellulare. Il JFH1 luciferasi giornalista replicone Luc-NS3-5B è stato transfettato in naïve Huh-7.5 cellule mediante elettroporazione. Il giorno dopo, le cellule sono state staccate e co-coltura con cellule naïve o imballaggi cellule che esprimono costitutivamente HCV nucleo, E1, E2, P7 e NS2. 24 h dopo co-coltivazione, la formazione heterokaryon è stata indotta mediante trattamento con 40% PEG utilizzando PBS come controllo negativo. Dopo 48 h, cell-free surnatante è stato raccolto per inoculare ingenui Huh-cellule 7,5. L'infettività è stata determinata mediante attività di luciferasi. (B) Per la rilevazione di eterocarionti, le cellule sono state immunomacchiate utilizzando anticorpi monoclonali contro E2 e NS5A. L'espressione simultanea di entrambe le proteine nelle cellule è indicativa di fusione cellulare. (C) sono state eseguite misurazioni luciferasi per quantificare l'infettività virale prodotta da eterocarionti. Valori medi di tre esperimenti indipendenti e le deviazioni standard dei mezzi sono dati. La barra orizzontale rappresenta la RLU sfondo determinato non infetti Huh-cellule 7,5. Clicca qui per ingrandire la figura .
9/4029fig2.jpg "/>
Figura 2. Completamento del ciclo di replicazione di HCV dopo l'inoculazione del eterocarionti. (A) Schema della procedura sperimentale. Huh-7 Lunet N celle mancanti CD81 state co-coltivate con linee cellulari indicate carente o umano che esprime CD81. È importante, queste ultime cellule mancano di almeno un fattore di HCV entrata e pertanto non può essere produttivamente infettati. Il giorno successivo, la fusione è stato avviato per trasfezione di una proteina virale da fusogenico PFV. Trenta ore dopo, le cellule sono state contestate con particelle infettive HCV. Per misurare l'immissione di cella, la replica e la produzione di RNA virale sostenuta da questi eterocarionti, infettività rilasciato nelle cellule prive di fluidi di coltura è stato determinato 48 h dopo l'inoculazione. A tal fine, naive Huh 7,5-cellule sono state usate come cellule bersaglio in un saggio di diluizione limitante (TCID 50). (B) Per il rilevamento di eterocarionti, le cellule sono state colorate con Green CellTracker o CellTracker Arancione 6 h prima della co-cultivzione e trasfezione. Trenta ore dopo, le cellule sono state fissate e colorate con DAPI. (C) Lunet N celle sono state fuse alle cellule HeLa, cellule naïve Hep56.1D o Hep56.1D che esprimono CD81 umani. Queste colture sono state inoculate con HCVcc (MOI di 2,3). Fluidi di coltura sono stati raccolti 48 ore dopo il rilascio di particelle e de novo da eterocarionti è stata determinata utilizzando TCID 50-naïve Huh 7,5 cellule bersaglio. Valori medi di tre esperimenti indipendenti sono dati. La barra orizzontale rappresenta il limite di rilevazione del test. Clicca qui per ingrandire la figura .
Access restricted. Please log in or start a trial to view this content.
Discussione
Presentiamo due metodi per indurre la formazione heterokaryon in cellule in coltura per l'analisi di restrizione dominanti negative che ne impediscono la replicazione di HCV. Utilizzando queste procedure è stata esclusa la presenza di un fattore dominante costitutivamente espresso o virus-indotto in vari umano non fegato e in linee cellulari murini fegato. Il primo saggio analizza in primo luogo se i fattori di limitazione ostacoli il montaggio HCV e il rilascio della progenie infettiva. Poiché in questo caso le c...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
TP ricevuto compensi per consulenze da Biotest.
Riconoscimenti
Siamo grati a Takaji Wakita e Jens Bukh per JFH1 e isolati J6CF, rispettivamente. Inoltre ringraziamo Charles Rice per uh 7,5 cellule e l'anticorpo 9E10, Steven Foung per la E2-anticorpo specifico CBH-23, e tutti i membri del Dipartimento di Virologia Sperimentale, Twincore per i suggerimenti utili e discussioni.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| DMEM | Invitrogen, Karlsruhe, Germania | 41965-039 | |
| L-glutammina | Invitrogen, Karlsruhe, Germania | 25030-024 | |
| Aminoacidi non essenziali | Invitrogen, Karlsruhe, Germania | 11140-035 | |
| Penicillina / streptomicina | Invitrogen, Karlsruhe, Germania | 15140-122 | |
| Siero fetale di vitello | PAA, Cölbe, Germania | A15151 | |
| α-E2 (CBH23) | gentilmente fornito da Steven Foung 10 | ||
| ATP | Sigma, Steinheim, Germania | A2833-106 | |
| Glutatione | Sigma, Steinheim, Germania | -G4251 1G | |
| Blasticidin | Invivo Gen, San Diego, USA | Ant-bl-1 | |
| G418 (geneticina) | Invitrogen, Karlsruhe, Germania | 11811-064 | |
| Polietilene-glicole-1500 | Roche, Mannheim, Germania | 10783641001 | |
| Paraformaldeide | Roth, Karlsruhe, Germania | 0.335,3 | |
| Triton X-100 | Roth, Karlsruhe, Germania | 3.051,2 | |
| Siero di capra | Sigma, Steinheim, Germania | G9023-5mL | |
| α-NS5A (9E10) | Gentilmente fornito da Charles Rice 7 | ||
| DAPI (4 ', 6'-Diamidino-2-fenilindolo dicloridrato) | Invitrogen | D1306 | |
| Alexa-Fluor 546 - di capra anti-IgG umane | Invitrogen, Karlsruhe, Germania | A21089 | |
| Alexa-Fluor 488 - di capra anti-IgG di topo | Invitrogen, Karlsruhe, Germania | A10680 | |
| Lipofectamine 2000 | Invitrogen, Karlsruhe, Germania | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Germania | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Germania | C2925 | |
| Fluoromount | Sigma, Steinheim, Germania | F4680-25ML | |
| Tutte le altre sostanze chimiche | Roth, Karlsruhe, Germania | ||
| Coltura cellulare materiali | Sarstedt, Nümbrecht, Germania |
Riferimenti
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978(2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029(2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon