Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Два способа формирования гетерокариона Обнаружение вируса гепатита факторы ограничения
В этой статье
Резюме
Мы описываем два метода условных Транс--Дополнения вируса гепатита С (HCV) собраний и завершения полного жизненного цикла вируса, которые опираются на гетерокариона образования. Эти методы предназначены для выявления клеточных линий, которые выражают доминирующие факторы ограничения, которые исключают производство инфекционного гепатита потомства.
Аннотация
Hepatitis C virus (HCV) is a hepatotropic virus with a host-range restricted to humans and chimpanzees. Although HCV RNA replication has been observed in human non-hepatic and murine cell lines, the efficiency was very low and required long-term selection procedures using HCV replicon constructs expressing dominant antibiotic-selectable markers1-5. HCV in vitro research is therefore limited to human hepatoma cell lines permissive for virus entry and completion of the viral life cycle. Due to HCVs narrow species tropism, there is no immunocompetent small animal model available that sustains the complete HCV replication cycle 6-8. Inefficient replication of HCV in non-human cells e.g. of mouse origin is likely due to lack of genetic incompatibility of essential host dependency factors and/or expression of restriction factors.
We investigated whether HCV propagation is suppressed by dominant restriction factors in either human cell lines derived from non-hepatic tissues or in mouse liver cell lines. To this end, we developed two independent conditional trans-complementation methods relying on somatic cell fusion. In both cases, completion of the viral replication cycle is only possible in the heterokaryons. Consequently, successful trans-complementation, which is determined by measuring de novo production of infectious viral progeny, indicates absence of dominant restrictions.
Specifically, subgenomic HCV replicons carrying a luciferase transgene were transfected into highly permissive human hepatoma cells (Huh-7.5 cells). Subsequently, these cells were co-cultured and fused to various human and murine cells expressing HCV structural proteins core, envelope 1 and 2 (E1, E2) and accessory proteins p7 and NS2. Provided that cell fusion was initiated by treatment with polyethylene-glycol (PEG), the culture released infectious viral particles which infected naïve cells in a receptor-dependent fashion.
To assess the influence of dominant restrictions on the complete viral life cycle including cell entry, RNA translation, replication and virus assembly, we took advantage of a human liver cell line (Huh-7 Lunet N cells 9) which lacks endogenous expression of CD81, an essential entry factor of HCV. In the absence of ectopically expressed CD81, these cells are essentially refractory to HCV infection 10 . Importantly, when co-cultured and fused with cells that express human CD81 but lack at least another crucial cell entry factor (i.e. SR-BI, CLDN1, OCLN), only the resulting heterokaryons display the complete set of HCV entry factors requisite for infection. Therefore, to analyze if dominant restriction factors suppress completion of the HCV replication cycle, we fused Lunet N cells with various cells from human and mouse origin which fulfill the above mentioned criteria. When co-cultured cells were transfected with a highly fusogenic viral envelope protein mutant of the prototype foamy virus (PFV11) and subsequently challenged with infectious HCV particles (HCVcc), de novo production of infectious virus was observed. This indicates that HCV successfully completed its replication cycle in heterokaryons thus ruling out expression of dominant restriction factors in these cell lines. These novel conditional trans-complementation methods will be useful to screen a large panel of cell lines and primary cells for expression of HCV-specific dominant restriction factors.
протокол
Слияние клеток с помощью ПЭГ
1. Культуре клеток
- Культура Хух-7.5, HeLa и Hep56.1D наивным или упаковку клеточных линиях 12 на 15 см культуре клеток блюда в полной DMEM (DMEM cplt) среды DMEM с добавлением 2 мМ L-глутамина, 1 без незаменимых аминокислот, 100 U / мл пенициллина, 100 мкг / мл стрептомицина и 10% эмбриональной телячьей сыворотки. Применяют соответствующий выбор в стабильных клеточных линиях, как указано в таблице 1.
2. Трансфекция РНК вируса гепатита С
- Вымойте Ха-7.5 ячеек (одна вырожденная 15 см блюдо) в два раза фосфатным буферным солевым раствором (PBS), trypsinize, и ресуспендируют в концентрации 1.5x10 7 клеток / мл в Cytomix (120 мМ KCl, 0,15 мМ CaCl 2, 10 мМ K 2 HPO 4 [рН 7,6], 25 мМ HEPES, 2 мМ EGTA, 5 мМ MgCl 2, доводят до рН 7,6 с КОН и стерилизовали путем фильтрации), содержащем 2 мМ АТР и 5 мМ глутатион.
- Трансфекции через electroporatион 400 мкл клеточной суспензии (6x10 6 клеток) с 10 мкг РНК ВГС (_JFH1_dg pFKi389Luc-EI/NS3-3 '13), используя кюветы с зазором шириной 0,4 см и Гена генератора Xcell системы (Biorad) установить до 975 мкФ, 270 В, как описано выше 14.
- Немедленно передать трансфицированных Ха-7.5 клеток до 10 мл DMEM cplt среднего и семя всей подвески в одном блюде культуры 10 см в диаметре. Культуры клеток в течение 24 ч при температуре 37 ° С и 5% CO 2.
3. Индукция Fusion с помощью ПЭГ
- Урожай клеток, как описано в 2.1, ресуспендируют в среде DMEM cplt довести до 5x10 5 клеток / мл.
- Создание одноклеточных суспензий Хух-7.5, HeLa и клетки Hep56.1D упаковки и разбавленной до 5х10 5 клеток / мл, 2х10 5 клеток / мл, 2х10 5 клеток / мл, соответственно. Обратите внимание, что упаковка клеток эктопически экспресс белков ВГС ядро, E1, E2, p7 и NS2 после трансдукции с двумя взависимой трансдукции лентивирусов векторов C-E1 и E2-p7-NS2 выражение кассеты, соответственно, 13, 15.
- Подготовка 6-луночных культуры с 2-3 стерильную стеклянную крышку скользит на лунку для дальнейшего анализа эффективности слияния.
- Комбинат 1 мл трансфицированных Ха-7.5 клеток, несущих subgenomic репликон с 1 мл упаковки клеток, семян в одну лунку 6-луночного планшета, и инкубировать в течение 24 ч при температуре 37 ° С и 5% CO 2.
- На этот раз точка, плотность клеток должна составлять от 60-80% до слияния индукции слияния клеток, чтобы позволить клеткам находиться в непосредственной близости для клеточных мембран слить.
- Аспирируйте среды от совместной культуре клеток и мыться раз в 1 мл PBS, затем осторожно добавляют 500 мкл предварительно нагретой 40% ПЭГ-1500, PBS, как контроль и инкубировать 5 минут при 37 ° C, чтобы вызвать гетерокариона образования.
- Аспирируйте PEG и тщательно мыть 3-5 раза в течение 1 минуты (мин) за мытье 2 мл PBS, чтобы удалить избыток ПЭГ и, наконец, добавить 2мл DMEM cplt среду в каждую лунку и инкубировать при температуре 37 ° С и 5% CO 2.
- Сорок восемь часов после слияния, собирают каждый супернатант и фильтруют через 0,45 мкм фильтр.
- Мера производства инфекционных частиц расплавленного гетерокарионах прививкой наивного Ха-7.5 клеток (8x10 4 клеток / лунку высевают в 12-луночного планшета, 24 часов перед посевом) с 500 мкл клеточной культуры, свободной жидкости и последующего определения люциферазы деятельность 14.
4. Иммунофлуоресценции для определения эффективности Fusion
- После сбора клетки культуральной жидкости (см. раздел 3.8), мыть скважин содержащих остекление скользит раз с 1 мл PBS в течение 1 мин. Все последующие шаги должны быть выполнены при комнатной температуре (RT) и промывки должно быть сделано с 1 мл PBS в течение 1 мин в стирке.
- Исправить клеток с 600 мкл 3% параформальдегид (PFA) в PBS в течение 15 минут, а затем вымыть с 3-кратным PBS. Тщательно передачи крышку квитанциив 24-луночного планшета с помощью щипцов.
- Permeabilize клеток с 500 мкл 0,5% Тритон Х-100 в PBS в течение 5 минут, а затем промыть 3 раза с PBS.
- Подготовка первичных решение антител в PBS с добавлением 5% козы сыворотке крови. Используйте против NS5A антитела (9E10) в концентрации 0,5 мкг / мл и человеческие моноклональные анти-Е2 антител (CBH-23) в концентрации 6,4 нг / мл. Применение 250 мкл в каждую лунку и инкубировать при комнатной температуре в течение 45 мин.
- Вымойте 3x с PBS и выявления первичных антител связан с 250 мкл вторичных антимышиного или козьего анти-человеческий IgG-антитела, конъюгированные с Alexa Fluor-546 или Alexa Fluor-488 в концентрации 2 мкг / мл в PBS дополнен 5% козы сыворотке крови. Инкубировать 30 мин при комнатной температуре в темноте.
- Затем вымыть с 1x PBS, а затем окрашивать клеточные ядра с 250 мкл DAPI (4 ', 6'-диамидино-2-фенилиндола дигидрохлорид) разбавляют 1:3000 в PBS, инкубировать 1 мин при комнатной температуре в темноте.
- Вымойте 4x с PBS и 1 с H 2 O, а затем смонтировать крышку скользит вниз на каплю Fluoromount на предметном стекле микроскопа, дайте ему высохнуть в темном и оценки образцов по косвенным микроскопии флуоресценции.
Fusion по временной трансфекции прототипа вируса пенистый (PFV) гликопротеин
5. Подготовка вирусных посевной
- Продукция высокого акции титра вируса путем трансфекции в пробирке транскрипции РНК ВГС в Хух-7.5 клеток и уборки супернатант культуры клеток через 48 ч и 72 ч, как описано выше 14. Определить титр вирусных ограничивая разведение анализа (TCID 50) 13.
6. Культуры клеток, слияние клеток по Трансфекция Fusogenic гликопротеина PFV
- Культура Lunet N, HeLa и Hep56.1D hCD81 клеток в соответствии с инструкциями в таблице 1 DMEM cplt среде, содержащей соответствующий выбор.
- Снимите клеток, как описано в 2.1, подготовить единый суспензий в DMEM cplt мedium, и совместно развивать Lunet N клеток HeLa или Hep56.1D hCD81 клеточных линий в соответствующих коэффициентов (например, 1:2 Hep56.1D hCD81 или 1:1 для клеток HeLa) с получением общей плотности ячейки 1.5x10 5 клеток в 12-и инкубировать в течение 24 ч при температуре 37 ° С и 5% CO 2.
- На следующий день, временно трансфекции клеток с высокой fusogenic PFV конверт белков (pczHFVenvEM066 16) с помощью липофектамина 2000 в соответствии с инструкциями производителя.
7. Инфекция Пробирной
- Инокулировать гетерокарионах 30 ч после трансфекции с 350 мкл вируса акций (МВД ~ 2,3) в течение 12 часов ночи, мыть один раз PBS и добавьте 1 мл DMEM cplt среду на лунку. Выдержите в течение 48 ч при температуре 37 ° С и 5% CO 2.
- Урожай супернатант культуры гетерокариона, процедить через 0,45 мкм фильтр и прививки Ха-7.5 клеток высевали в 96-луночных планшетах (1x10 4 клеток / лунку), за день до этого, в предельном разведении анализа 13.
- После 72 часов, пятно инфицированных Ха-7.5 клеток с HCV-специфических антител (NS5A, 9E10) количественно производство инфекционных частиц потомства.
8. Визуализация Сотовые Fusion
- Чтобы представить себе слияние событий, готовить 5 до 10 мкм решения CellTracker красителей в среде DMEM без добавок и выполнить действия, описанные ниже 6 часов до совместного культуры (описано в разделах 6.2 и 6.3).
- Вымойте прилипшие клетки сразу с 5 мл PBS, а затем инкубируют клетки с 4 мл окрашивание раствора в 10 см блюдо в течение 45 мин при 37 ° С и 5% CO 2 (пятно Lunet N клеток CellTracker оранжевой CMTMR и HeLa или Hep56.1D hCD81 клеток CellTracker Зеленый CMFDA, отдельно).
- Промойте клетки сразу с 5 мл PBS в течение 1 мин и добавить DMEM cplt среды, инкубировать в течение 6 ч при температуре 37 ° С и 5% CO 2.
- Подготовить посева и трансфекции окрашенных клеток, как описано выше в разделах 6.2 и, однако, добавить обложку к скольжениюкультуры клеток блюдо перед посевом.
- 30 ч после трансфекции клетки мыть тщательно с 1 мл PBS в течение 1 мин, а затем исправить клеток с 250 мкл 3% PFA в течение 15 мин при комнатной температуре. Промойте клетки сразу с 1 мл PBS в течение 1 мин, пятно DAPI в течение 1 мин, как описано в разделе 4.6, мыть один раз в 1 мл PBS в течение 1 минуты, повторите мыться с H 2 O и промахи крепление крышки на стеклах (см. раздел 4.7 ). Анализ клеток с флуоресцентным микроскопом.
| Вид | Клеточная линия | Происхождение | Среднего роста и выбор |
| Человек | Ха-7.5 | Субклон Huh-7 клеток гепатомы линии 17 | DMEM cplt |
| Ха-7.5 [CE1] [E2p7NS2] | Стабильно выражения основных вирусных белков, E1, E2, p7, и NS2, трансдуцированных по лентивирусов ген тransfer двух независимых кассеты генов | DMEM cplt + Blasticidin 5 мкг / мл | |
| Ха-7 Lunet N | Субклон Huh-7 клеток гепатомы линии 9 | DMEM cplt | |
| HeLa | Шейки клеточной линии аденокарциномы (АТСС номер: CCL-2) | DMEM cplt | |
| HeLa [CE1] [E2p7NS2] | Стабильно выражения основных вирусных белков, E1, E2, p7, и NS2, трансдуцированных по лентивирусов перенос генов из двух независимых кассеты генов | DMEM cplt + G418 750 мкг / мл; Blasticidin 5 мкг / мл | |
| Мышь | Hep56.1D | Первичная гепатоцеллюлярной карциномой (вид дар Дж. Энке) Взрослые мыши C57BL/6J | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | Стабильно бывшийнажатием вирусных основных белков, E1, E2, p7, и NS2, трансдуцированных по лентивирусов перенос генов из двух независимых кассеты генов | DMEM cplt + G418 750 мкг / мл; Blasticidin 5 мкг / мл | |
| Hep56.1D hCD81 | Стабильно выражения человеческих CD81 трансдуцированных по лентивирусов переноса генов | DMEM cplt + Blasticidin 5 мкг / мл |
Таблица 1. Характеристики о происхождении и культуре состоянии использовать клеточные линии Cplt: полная, G418: генетицину, ч человека.
9. Представитель Результаты
В этом исследовании мы использовали два разных метода слияния соматических клеток, которые позволяют нам конкретно исследовать влияние факторов ограничения по завершении цикла репликации вируса гепатита С в гетерокарионах. Следует отметить, что условные конструкции транс-дополнения на слияние двух различных типов клеток, уверяет, чтотолько в истинной гетерокарионах между человеческими клетками печени и без разрешительных клеточных линий, вирус сборки (подход 1) или входа в вирус и полную репликацию HCV цикла (подход 2) выполнены.
В первом подходе Ха-7.5 клеток, весьма либеральными для ВГС, были временно трансфицированных subgenomic репликон выражения люциферазы трансгена и ВГС неструктурных белков поддержки subgenomic репликации РНК вируса гепатита С (Ха-7.5 репликон клеток). Эти клетки были со-культурный и слит с клеточными линиями выражения ВГС структурное ядро белки, E1, E2, а также аксессуаров p7 белков и NS2. Figure1A показывает обзор экспериментальных процедур. Важно отметить, что после слияния PEG, все белки, необходимые для сборки частицы должны присутствовать в образовавшуюся гетерокариона которой может быть подтверждено с помощью иммунофлуоресценции в отношении отдельных вирусных белков. Рисунок 1B изображен образцовый случай слияния, в которой сигналы для обоих NS5A выражается в Хух-7.5 репликон клеток и E2выражается в Хух-7.5 [CE1] [E2p7NS2] упаковка клетки были обнаружены в том же цитоплазмы на ПЭГ-индуцированного гетерокариона. При совместной культуре клеток, вместо этого были относиться с PBS, не слияние вызывали таким образом, только один-положительных клеток и не со-локализация сигналов не наблюдается. Кроме того, для контроля экспрессии трансгена, мы провели ИФА специфических для ядра и Е2 (ранее сообщалось подробно 15). В дополнение к клеточной линии упаковки контроль Ха 7,5 [CE1] [E2p7NS2], мы получили HeLa и клетки Hep56.1D упаковки, представителей для человека без печени и клетки печени мышей, соответственно. РНК ВГС эффективности репликации в последнее клетках низка и ВГС сборка и выпуск не был показан. Рисунок 1С иллюстрирует результаты слияния анализа. Супернатанты собранные со-культуры в 48 часов индукции слияния почты и используется для прививки наивно Ха-7.5 клеток для последующего люциферазы анализов. Примечательно, что, когда Ха-7.5 репликон клетки сливались с любойНаивно клеточных линий или лечение с PBS в качестве контроля, нет инфекционной был обнаружен в культуре жидкости. Однако, когда слияние клеток между Ха-7.5 репликон и упаковочных линий клеток индуцированных PEG, транс-дополнения между репликон и конститутивно выразил структурных белков вируса спасла производства в результате гетерокарионах и инфекционные вирусные частицы были выпущены в культуре жидкости. Поэтому мы к выводу, что вирус производства требуется слияние клеток и экспрессии вирусных белков в упаковочных линий клеток. Поразительно, что не только гетерокарионах Хух-7.5 человеческих клеток гепатомы, но и гетерокарионах с человека без печени (HeLa [CE1] [E2p7NS2]) и печени мышей (Hep56.1D [CE1] [E2p7NS2]) клеток позволило вирусу релиз о том, что сборка и выпуск не доминантно подавляется возможные факторы ограничения в этих типах клеток. Выражение структурных белков в клеточных линиях упаковки и достоверной вступления в клетках-мишенях было показано в Френтцен И соавт. 15.
Альтернативным методом слияния клеток был использован для анализа возможных ограничений, затрагивающих ячейки ввода, перевод РНК и РНК, репликация стадии цикла репликации, а также исключать, что высокая вирусная нагрузка в трансфицированных Ха 7,5 клеток репликон исключает обнаружение ограничение факторов насыщения. С этой целью мы создали независимый анализ, основанный на прививки гетерокарионах с HCVcc и обнаружение вируса заново производства в этих клетках. Как указано на рисунке 2А, соматических клеток, слияние было вызвано выражение fusogenic гликопротеин после совместного культивирования клеток. Этот метод был выбран потому, что чувствительность была увеличена всего за счет увеличения эффективности слияния. Гетерокарионах были визуализированы окрашиванием отдельных клеточных линий с CellTracker красителей до совместного культивирования. Гетерокариона с однородно распределенной красителей в цитоплазме указывает слияние двух типов клеток, как показываютD на рисунке 2Б. Только в гетерокарионах из Lunet N клеток с клетками HeLa или Hep56.1D hCD81 клетки всех HCV факторов вступления выразить так выборочно оказание гетерокарионах восприимчивы к вирусу гепатита вступление клетки. Проблемы с HCVcc привело к полной репликации вируса гепатита С в гетерокарионах что видно из De Novo производства вирусного потомства примерно в 10 раз выше фона анализа (рис. 2). В качестве контроля Lunet N клетки сливаются с клетками Lunet N. Важно только очень низкий уровень инфекционных ВГС близки к пределу обнаружения не наблюдалось. Аналогичные результаты были получены при Lunet N клетки сливаются с наивным Hep56.1D клеток. В обоих случаях человек CD81 отсутствует, так что ВГС не может продуктивно заразить гетерокарионах. Это очень низкой инфекционности обнаружены в этих двух последних случаях, вероятно, связано с низким уровнем заражения Lunet клеток N и / или низким уровнем остаточных инфекционных вход вируса от посевной. В отличие от клеток HeLa и Онp56.1D hCD81 клетки экспрессируют CD81 человека, дополняя тем самым отсутствие фактора клетки запись в гетерокарионах и разрешений ВГС вступление клетки. 10-кратное повышение уровня инфекционного гепатита обнаружен в среду гетерокарионах с участием этих двух клеточных линий, поэтому, вероятно, отражает заново производство инфекционных частиц в гетерокарионах. Таким образом, мы пришли к выводу, что завершение цикла репликации вируса гепатита С не ограничивается исключением выражение доминирующих факторов ВГС ограничения в этих клеточных линиях.
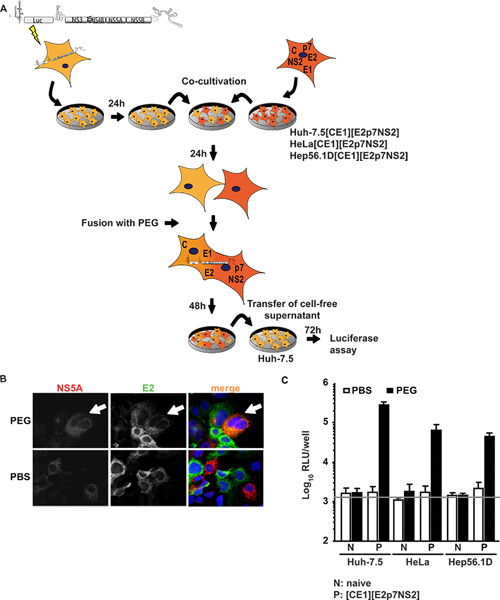
Рисунок 1. Транс-дополнения ВГС сборки и выпуска в гетерокарионах. (А) Схема плана экспериментальной процедуры ПЭГ-опосредованной слияния клеток. JFH1 люциферазы репортер репликон Люк-NS3-5B был трансфекции в наивной Ха-7.5 клеток электропорации. На следующий день, клетки были отделены и совместно культивировали с наивными клетками или упаковке клеток конститутивно выразить ВГС ядро, E1, E2, p7 и NS2. 24 ч после совместного культивирования, гетерокариона формирование было вызвано обращение с 40% PEG использованием PBS в качестве отрицательного контроля. Через 48 ч, бесклеточной супернатант собирали привить наивно Ха-7.5 клеток. Инфекционность определяли активность люциферазы. (B) для обнаружения гетерокарионах, клетки immunostained использованием моноклональных антител против Е2 и NS5A. Одновременная экспрессия обоих белков в клетках, что свидетельствует о слияние клеток. (C) люциферазы Измерения проводились для количественной вирусной инфекционной производится из гетерокарионах. Средние значения трех независимых экспериментов и стандартного отклонения средств даны. Горизонтальная полоса представляет фоне РГ определяется в неинфицированных Ха-7.5 клеток. Нажмите здесь, чтобы увеличить рисунок .
9/4029fig2.jpg "/>
Рисунок 2. Завершение цикла репликации вируса гепатита С после прививки гетерокарионах. (А) Схема обзор экспериментальных процедур. Ха-7 Lunet N клеток CD81 отсутствует были совместно культивировали с указанными клеточных линий не хватает или выражения человеческих CD81. Важно отметить, что эти последние клеток не хватает хотя бы одного вируса гепатита фактор входа и поэтому не может быть продуктивно инфицированных. На следующий день, слияние было инициировано трансфекции fusogenic вирусного белка конверт с PFV. Тридцать часов, клетки были оспорены с инфекционным гепатитом частиц. Для измерения ячейки ввода, РНК, репликация вируса и производства, понесенные этими гетерокарионах, выпущенный инфекционности в бесклеточной жидкости культуры был определен 48 часов после прививки. Для этого, наивно Ха-7.5 клеток были использованы в качестве клеток-мишеней в предельном разбавлении пробы (TCID 50). (B) для обнаружения гетерокарионах, клетки окрашивали зеленой CellTracker или CellTracker оранжевой 6 часов до совместного мотокультиватЦ И А Ц и трансфекции. Тридцать часов спустя, клетки фиксировали и окрашивали DAPI. (C) Lunet N клетки сливаются с клетками HeLa, наивно Hep56.1D или Hep56.1D клеток, экспрессирующих CD81 человека. Эти культуры были привиты с HCVcc (МВД 2.3). Культура жидкости было собрано 48 часов спустя, и заново частиц освобождение от гетерокарионах определялась TCID 50 использованием наивной Ха-7.5 клетках-мишенях. Средние значения трех независимых экспериментов. Горизонтальная полоса представляет предел обнаружения анализа. Нажмите здесь, чтобы увеличить рисунок .
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мы представляем два способа заставить гетерокариона образование в культуре клеток для анализа доминирующих отрицательных ограничений, которые препятствуют репликации ВГС. Использование этих процедур мы исключили наличие доминирующего конститутивно выраженной или вирус-индуциров?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
TP получили консультационные платы от Биотест.
Благодарности
Мы благодарны Такадзи Wakita и Йенс Бух для JFH1 и J6CF штаммов, соответственно. Кроме того, мы благодарим Чарльз Райс Ха-7.5 клеток и антител, 9E10, Стивен Foung для E2-специфических антител CBH-23, и все члены кафедры экспериментальной вирусологии Twincore за полезные советы и обсуждения.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| DMEM | Invitrogen, Карлсруэ, Германия | 41965-039 | |
| L-глютамин | Invitrogen, Карлсруэ, Германия | 25030-024 | |
| Номера для незаменимых аминокислот | Invitrogen, Карлсруэ, Германия | 11140-035 | |
| Пенициллина / стрептомицина | Invitrogen, Карлсруэ, Германия | 15140-122 | |
| Эмбриональной телячьей сыворотки | ПАК, Cölbe, Германия | A15151 | |
| α-E2 (CBH23) | любезно предоставленные Стивен Foung 10 | ||
| ATP | Sigma, Штайнхайм, Германия | A2833-106 | |
| Глутатион | Sigma, Штайнхайм, Германия | G4251-1G | |
| Blasticidin | Invivo Gen, Сан-Диего, США | Ant-BL-1 | |
| G418 (генетицину) | Invitrogen, Карлсруэ, Германия | 11811-064 | |
| Полиэтилен гликоль-1500 | Roche, Мангейм, Германия | 10783641001 | |
| Параформальдегид | Рот, Карлсруэ, Германия | 0335,3 | |
| Тритон Х-100 | Рот, Карлсруэ, Германия | 3051,2 | |
| Коза сыворотке | Sigma, Штайнхайм, Германия | G9023-5 мл | |
| α-NS5A (9E10) | Пожалуйста, при условии Чарльз Райс 7 | ||
| DAPI (4 ', 6'-диамидино-2-фенилиндола дигидрохлорид) | Invitrogen | D1306 | |
| Alexa Fluor-546 - козий анти-человеческий IgG | Invitrogen, Карлсруэ, Германия | A21089 | |
| Alexa Fluor-488 - антимышиного IgG | Invitrogen, Карлсруэ, Германия | A10680 | |
| Липофектамина 2000 | Invitrogen, Карлсруэ, Германия | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Карлсруэ, Германия | C2927 | |
| CellTracker CMFDA | Invitrogen, Карлсруэ, Германия | C2925 | |
| Fluoromount | Sigma, Штайнхайм, Германия | F4680-25МЛ | |
| Все остальные химические вещества | Рот, Карлсруэ, Германия | ||
| Материалы клеточных культур | Sarstedt, Nümbrecht, Германия |
Ссылки
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978(2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029(2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены