Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Heterokaryon Oluşumu İki Yöntemleri HCV Sınırlayıcı Etkenler Discover
Bu Makalede
Özet
Biz, koşullu için iki yöntem tarif Trans-tamamlayamamakta. Bu teknikler bulaşıcı HCV döl üretimi engel baskın kısıtlama faktörler, ifade hücre hatları için ekran uygundur.
Özet
Hepatit C virüsü (HCV), insan ve şempanze sınırlı bir ana-aralığı ile hepatotropic virüstür. HCV RNA çoğaltma insan olmayan karaciğer ve fare hücre hatlarında gözlenmiştir rağmen, verimliliği çok düşük olduğunu ve HCV replikon kullanarak gerekli uzun vadeli seçim prosedürleri baskın antibiyotik seçilebilir işaretleri 1-5 ifade oluşturur. In vitro araştırma HCV nedenle virüs ömrü çevrimi ile virüs girişi ve tamamlanması için ılımlı insan hepatoma hücre çizgileri ile sınırlıdır. Dar türler tropizm HKH'lerinin nedeniyle, tam HCV replikasyon siklusu 6-8 ayakta kullanılabilen bir bağışıklık küçük bir hayvan modeli yoktur. Fare kökenli örneğin insan olmayan hücrelerin HCV verimsiz çoğaltma olasılıkla önemli konak bağımlılık faktörleri ve / veya kısıtlama faktörlerin ifade genetik uyumsuzluk eksikliğinden kaynaklanmaktadır.
Biz HCV yayılım baskın kısıtlama fa tarafından bastırılmış olup olmadığını araştırmaknon-hepatik dokulardan veya fare karaciğer hücre hatlarında edilen insan hücre dizileri ya da ctors. Bu amaçla, somatik hücre füzyonu dayanarak iki bağımsız koşullu trans-tümleme yöntemleri geliştirdi. Her iki durumda da, viral döngüsü tamamlanmasından heterokaryonlar de mümkündür. Sonuç olarak, bulaşıcı döl viral de novo üretiminin ölçülmesi ile tespit edilir başarılı bir trans-tümleme, baskın bir kısıtlama olmadığı gösterir.
Spesifik olarak, bir lusiferaz transgeni taşıyan alt genomik HCV Replikon çok ılımlı insan hepatoma hücreleri (Ha-7,5 hücreleri) içine transfekte edildi. Daha sonra, bu hücreler kültürlendi ve co-HCV yapısal proteinler çekirdek, zarfı 1 ve 2 (E1 ve E2) ve yardımcı proteinler p7 ve NS2 eksprese eden çeşitli insan ve fare hücrelere kaynaşmıştır. Hücre füzyon polietilen-glikol (PEG) ile muamele ile başlatılmıştır koşuluyla, kültür bulaşıcı virüs pa serbestbir reseptör bağımlı bir tarzda naif hücreleri enfekte rticles.
Hücreye girişi, RNA çeviri, çoğaltma ve virüs montaj dahil tam viral yaşam döngüsü baskın kısıtlamaların etkisini değerlendirmek için, biz, CD81 endojen ifade yoksun bir insan karaciğer hücre dizisi (Huh-7 Lunet N hücreler 9) yararlandı HCV temel bir giriş faktörü. Ektopik ifade edilen CD81 yokluğunda, bu hücrelerin HCV enfeksiyonu 10 esasen refrakter vardır. Daha da önemlisi, ortak kültüre ve insan CD81 ancak eksikliği en azından önemli bir başka hücreye girişi faktörü (örneğin SR-BI, CLDN1, OCLN) ifade hücreleri ile kaynaşmış, yalnızca ortaya çıkan heterokaryonlar enfeksiyonu için gerekli HCV giriş faktörlerin komple set gösterilecek. Bu nedenle, egemen kısıtlama faktörler HCV çoğaltma döngüsü tamamlanmasından bastırmak olmadığını analiz etmek, biz yukarıda belirtilen crit yerine fare ve insan kaynaklı çeşitli hücreleri Lunet N hücreleri eritilireria. Co-kültürlenmiş hücrelerde prototipi köpüksü virüs mutantı yüksek bir füzojenik Viral zarfın protein (PFV 11) ile transfekte edilmiş ve daha sonra bulaşıcı parçacıklar HCV (HCVcc) ile karşılaştırılan edildiğinde, bulaşıcı virüsün üretimini de novo gözlenmiştir. Bu HCV başarıyla böylece bu hücre hatları hakim kısıtlama faktörlerin ifadesi ortadan heterokaryonlar kendi çoğaltma döngüsü tamamlanmış olduğunu gösterir. Bu yeni şartlı trans-tümleme yöntemleri HCV-özgü baskın kısıtlama faktörlerin ifadesi için hücre hatları ve birincil hücreler büyük bir paneli taramak için yararlı olacaktır.
Protokol
PEG ile Hücre Fusion
1. Hücre Kültürü
- Kültür Huh-7.5, HeLa ve DMEM komple (DMEM cplt) orta 15 cm hücre kültüründe yemekler naif veya ambalaj hücre hatları 12 Hep56.1D, DMEM 2 mM L-glutamin, 1x olmayan amino asitler, 100 ile takviye U / mL penisilin, 100 ug / ml streptomisin ve% 10 fetal dana serumu. Tablo 1'de belirtilen stabil hücre hatları uygun seçimi uygulayın.
2. HCV RNA Transfeksiyon
- Fosfat ile iki kez Ha-7,5 hücreleri (bir birleşik 15 cm çanağı) yıkayıp salin (PBS), trypsinize tamponlu ve cytomix içinde 7 1.5x10 hücre / mL 'lik bir konsantrasyonda (120 mM KCl, 0.15 mM CaCl2, 10 mM potasyum azından tekrar süspansiyon 2 HPO 4 [pH 7,6], 2 mM ATP ve 5 mM glutation içeren 25 mM HEPES, 2 mM EGTA, KOH ile pH 7.6 'e ayarlanır ve filtre edilerek sterilize 5 mM MgCl2,).
- Transfekte üzerinden electroporat0,4 cm'lik bir boşluk genişliği ve 975 ayarlanmış bir gen üreteci XCell sistemi (BioRad) ile küvet kullanılarak 10 mikrogram HCV RNA (pFKi389Luc-EI/NS3-3 '_JFH1_dg 13) ile hücre süspansiyonu (6x10 6 hücre) iyon 400 uL uF ve 270 V olarak daha önce 14 nitelendirdi.
- Derhal DMEM cplt orta ve 10 cm çaplı tek bir kültür çanağı içine tohumu bütün süspansiyon 10 ml transfekte Ha-7,5 hücreleri transfer. 37 C'de 24 saat kültüre hücreleri ° C'de ve% 5 CO2.
3. PEG ile Fusion indüksiyonu
- Hasat hücreleri gibi, 2.1 'de açıklanan DMEM cplt ortamda tekrar süspansiyon ve 5x10 5 hücre / ml ye tamamlanır.
- , Sırasıyla, tek hücre Ha-7.5 arasında süspansiyonlar, HeLa ve Hep56.1D ambalaj hücreleri ve seyreltik için 5x10 5 hücre / ml, 2x10 5 hücre / mL ve 2x10 5 hücre / mL 'oluşturur. Not iki ile iletimi sonrasında ektopik ambalaj hücreleri ekspres HCV proteinleri çekirdek, E1, E2, p7 ve NS2, sırasıyla, bir C-E1 ve E2-p7-NS2 ifade kaseti, 13, 15 transdüklenmesinden bağımlı lentiviral vektörleri.
- Füzyon etkinliği daha fazla analiz için, çukur başına 2-3 steril cam kapak slipleri ile 6 bölümlü kültür plakaları hazırlayın.
- Bir 6-kuyulu plakanın iyi bir ambalaj haline hücreleri, tohum 1 mL subgenomik replikon barındıran transfekte Ha-7,5 hücrelerinin 1 mL birleşir ve 37 ° C'de ve% 5 CO2 de 24 saat süre ile inkübe edilir.
- Bu zaman noktasında, hücre yoğunluğu hücreleri kaynaştırmak için hücre zarları için yakın olmasını sağlamak için hücre füzyonu indüksiyonundan önce konfluense% 60-80 arasında olmalıdır.
- Co-kültür ortamı aspire hücrelerinden ve 1 mL bir kez PBS ile yıkanması, sonra dikkatle heterokaryon oluşumunu teşvik etmek için 37 ° C'de 5 dakika süreyle inkübe şekilde kontrolü ve önceden ısıtılmış% 40 PEG-1500 veya 500 uL PBS ekleyin.
- PEG aspire ve dikkatle aşırı PEG kaldırmak ve nihayet 2 eklemek için 2 ml PBS ile yıkama başına 1 dakika (dk) için 3-5 kez yıkayınDMEM cplt her iyi orta ve 37 inkübe mL ° C ve% 5 CO 2.
- Kırk sekiz saat sonrası füzyon, her biri 0.45 mikron ile süpernatant ve filtre filtre toplamak.
- 500 hücre içermeyen kültür sıvısının uL ve lusiferaz sonraki kararlılıkla naif Huh-7.5 hücreleri (8x10 / iyi öncesinde aşılama için 12-iyi plaka, 24 saat tohumlanmış 4), hücrelerin inokülasyon ile kaynaşmış heterokaryonlar bulaşıcı maddelerin Tedbir üretimi etkinlik 14.
4. Fusion Verimlilik belirleme İmmünofloresan
- Hücre kültür yüzer (bölüm 3.8) topladıktan sonra, kuyular cam kapak içeren 1 dakika için 1 mL PBS ile bir kez sığar yıkayın. Bütün aşağıdaki adımları oda sıcaklığında (RT) yapılmalıdır ve çamaşır yıkama başına 1 dakika boyunca 1 ml PBS ile yapılması gerekir.
- 15 dakika süreyle PBS içinde% 3 paraformaldehit ile 600 uL (PFA) ile hücre sabitlemek ve sonra PBS ile 3x yıkanır. Dikkatlice kapağı fişleri aktarımıforseps kullanarak 24-iyi plaka içine.
- % 0.5 Triton 5 dakika süreyle PBS içinde X-100 ve 500 uL sahip hücrelerin geçirgenliği ve daha sonra PBS ile 3x yıkanır.
- % 5 keçi serumu ile zenginleştirilmiş PBS içinde primer antikor çözeltisi hazırlayın. 6.4 ng / mL 'lik bir konsantrasyonda 0.5 mg / mL ve insan monoklonal antikoru, anti-E2 (CBH-23) arasında bir konsantrasyonda anti-NS5A antikoru (9E10) kullanabilir. Her iyi 250 uL uygulayın ve 45 dakika oda sıcaklığında inkübe edin.
- PBS ile 3x yıkanır ve 2 ug / ml PBS içinde bir konsantrasyonda, Alexa-Fluor 546 veya Alexa-Fluor 488 ile konjuge 250 uL ikincil keçi anti-fare veya keçi anti-insan IgG antikorları ile birlikte özel bir bağlanmış primer antikorları saptamak ile desteklenmiş % 5 keçi serumu. Karanlık oda sıcaklığında 30 dakika inkübe edilir.
- Daha sonra, PBS ile 1x yıkayın ve daha sonra PBS içinde 1:3,000 seyreltilmiş (6'-diamidino-2-fenilindol dihidroklorür 4 '), 250 uL DAPI, karanlıkta RT az 1 dakika inkübe ile hücre çekirdeği leke.
- H 2 ile PBS ve 1x ile 4x yıkayın O, daha sonra mikroskop slayt üzerinde Fluoromount bir damla üzerine baş aşağı kayar kapak monte, indirekt floresan mikroskop ile karanlık ve değerlendirmek örnek kurumalarını bekleyin.
Prototip köpüklü virüs geçici transfeksiyon (PFV) glikoprotein tarafından Fusion
5.. Viral inokulum hazırlanması
- Huh-7.5 hücrelere in vitro transkripsiyon HCV RNA transfekte ve daha önce 14 olarak açıklanan 48 saat ve 72 saat sonra hücre kültürü süpernatant hasadı yüksek titrede virus stok üretin. Seyreltme assay (TCID 50) 13 sınırlayarak viral titre belirleyin.
6. Bir füzojenik PFV Glikoprotein transfeksiyonu yoluyla hücre kültürü, hücre füzyonunun
- Uygun seçimleri içeren DMEM cplt ortamda Tablo 1'de talimatlara göre Kültür Lunet N, HeLa ve Hep56.1D hCD81 hücreler.
- 2.1 'de açıklandığı gibi hücrelere Ayır, DMEM cplt m tek hücre süspansiyonları hazırlamakedium ve co-yetiştirmek Lunet N başına 1.5x10 hücre 5 toplam hücre yoğunluğu veren uygun oranlarda (Hep56.1D hCD81 ya HeLa hücreleri için 01:01 örneğin 1:02) HeLa az ya Hep56.1D hCD81 hücre çizgileri ile hücreleri 12-kuyucuklu ve 37 C'de 24 saat boyunca inkübe ° C'de ve% 5 CO2.
- Ertesi gün, geçici üreticinin talimatlarına göre lipofektamin 2000 kullanarak son derece füzojenik PFV zarf proteini (pczHFVenvEM066 16) ile hücre transferinde.
7. Enfeksiyon Assay
- Gece 12 saat süreyle virüsü stoku 350 uL (İB ~ 2.3) ile transfeksiyondan sonra heterokaryonlar 30 saat inoküle, PBS ile bir kez yıkayın ve iyi başına DMEM cplt orta 1 ml. 37 de 48 saat boyunca inkübe ° C'de ve% 5 CO2.
- Sınırlayıcı bir seyreltme deneyde, bir gün önce (1x10 4 hücre / çukur) 96-kuyucuklu plaklar tohumlanmış bir 0.45 mikron filtre ve inokülasyon Ha-7,5 hücreleri, filtre aracılığıyla heterokaryon süpernatan hasat kültür, 13.
- Bulaşıcı döl partiküllerin üretimi ölçmek; 72 saat sonra, bir HCV özgü antikor (9E10 NS5A) ile enfekte olmuş hücreler 7,5-Ha leke.
8. Hücre Fusion Görselleştirme
- Füzyon olayları görselleştirmek için, katkı maddesi içermeyen DMEM CellTracker boyalar 5 ila 10 uM çözümleri hazırlamak ve (bölüm 6.2 ve 6.3 olarak açıklanmıştır) ko-kültür 6 saat önce aşağıdaki adımları tamamlayın.
- PBS 5 mL ile bir kez yapışık hücreleri daha sonra yıkanır ve 37 azından 45 dakika süreyle 10 cm tabağı başına çözeltisi lekeleyebilen 4 mL hücreleri inkübe ° C'de ve% 5 CO2 (Lunet N CellTracker Orange CMTMR ve HeLa hücreleri ya Hep56.1D leke CellTracker Yeşil CMFDA, ayrı ayrı) ile hCD81 hücreleri.
- 1 dakika süreyle PBS içinde 5 mL ile bir kez yıkanır ve 37 hücreleri 6 saat boyunca ° C'de ve% 5 CO2 inkübe DMEM ortamı cplt, ekleyin.
- Bölümleri 6,2 yukarıda açıklanan ve Bununla birlikte, bir kapak kayma ilave olarak lekeli hücrelerin tohumlama ve transfeksiyon hazırlamaktohumlama öncesi hücre kültürü çanak.
- 30 saat sonrası transfeksiyon, 1 dakika süreyle 1 ml PBS ile dikkatle hücreleri yıkama ve daha sonra oda sıcaklığında 15 dakika boyunca% 3 PFA ile 250 uL sahip hücrelerin sabitlemek. Bölüm 4.6 açıklandığı gibi 1 dakika için 1 ml PBS ile bir kez hücrelerin yıkayın, 1 dakika DAPI ile leke, (bölüm 4.7 'ye bakın cam lamlara H 2 O ve montaj kapağı fişleri ile yıkayın tekrarlamak, 1 dakika için 1 ml PBS ile bir kez yıkayın ). Bir floresan mikroskop ile hücreleri Çözümle.
| Tür | Hücre hattı | Menşe | Büyüme orta ve seçimi |
| Insan | Huh-7.5 | Huh-7 hepatoma hücre hattı 17 Subclone | DMEM cplt |
| Huh-7.5 [CE1] [E2p7NS2] | Stably viral proteinlerin temel ifade, E1, E2, p7 ve NS2, lentiviral gen t transdükİki bağımsız gen kasetleri ransfer | DMEM cplt + Blasticidin 5 ug / ml | |
| Huh-7 Lunet N | Huh-7 hepatoma hücre hattı 9 Subclone | DMEM cplt | |
| HeLa | Servikal adenokarsinoma hücre çizgisi (ATCC numarası: CCL-2) | DMEM cplt | |
| HeLa [CE1] [E2p7NS2] | Stably viral proteinlerin temel ifade, E1, E2, p7 ve NS2, iki bağımsız gen kasetleri lentiviral gen transferi ile transdük | DMEM cplt + G418 750 ug / ml; Blasticidin 5 ug / ml | |
| Fare | Hep56.1D | Primer hepatosellüler karsinom (J. Encke tür hediye) Yetişkin C57BL/6J fareler | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | Stabil exE1, E2, p7 ve NS2, iki bağımsız gen kasetleri lentiviral gen transferi ile, viral protein çekirdek transdük basarak | DMEM cplt + G418 750 ug / ml; Blasticidin 5 ug / ml | |
| Hep56.1D hCD81 | Stably ifade eden insan CD81 lentiviral gen transferi ile transdük | DMEM cplt + Blasticidin 5 ug / ml |
Tam, G418: genetisin, h: insan. Kullanılan hücre hatları Cplt kökeni ve kültür durumu hakkında Tablo 1 Özellikler.
9. Temsilcisi Sonuçlar
Bu çalışmada, bize özellikle heterokaryonlar içerisinde HCV çoğaltma döngüsü tamamlanması üzerine kısıtlama faktörlerin etkisini araştırmak için izin somatik hücre füzyonu iki farklı yöntem uygulanır. Not olarak, iki farklı hücre tipleri füzyon üzerine trans-tümlemenin koşullu tasarım olmasını sağlarsadece insan karaciğer hücreleri ve non-müsamahakar hücre hatları, virüs montaj (yaklaşım 1) ya da virüs girdi ve tüm HCV çoğaltma döngüsü arasında gerçek heterokaryonlar içinde (yaklaşım 2) gerçekleştirilir.
Birinci yaklaşımın HCV için çok ılımlı Ha-7,5 hücreleri, geçici alt genomik RNA HCV replikasyon (Ha-7,5 replikon hücreleri) destekleyen bir lusiferaz transgen ve HCV yapısal olmayan protein eksprese eden, bir alt genomik replikon ile transfekte edildi. Bu hücreler, co-kültürleme, E1 ve E2 gibi aksesuar proteinleri p7 ve NS2 HCV yapısal proteinler çekirdek eksprese eden hücre serileri için erimiş edildi. Figure1A deneysel işlemin özetini gösterir. Önemli olarak, PEG füzyon takiben, parçacık montajı için gerekli tüm proteinleri bireysel viral proteinlere yönelik imünoflüoresan yöntemiyle teyit edilebilir oluşan heterokaryon mevcut olmalıdır. Şekil 1B hem NS5A için sinyalleri Ha-7,5 replikon hücreleri ve E2 olarak ifade ettiği örnek teşkil eden bir füzyon etkinliği tasvirHa-7,5 olarak ifade [CE1] [E2p7NS2] ambalaj hücreleri PEG ile endüklenen heterokaryon oluşumu üzerine aynı sitoplazması içinde tespit edildi. Co-kültürlenmiş hücrelerde yerine PBS ile muamele edildi, hiçbir füzyon yalnızca tek-pozitif hücreler, böylece oluşturuldu ve sinyallerinin eş-herhangi Lokalizasyon gözlenmiştir. Dahası, transgen ifadesi kontrol etmek için, bu çekirdek ve E2 (daha önce ayrıntılı 15 bildirilmiştir) için özel ELISA'lar gerçekleştirilir. Kontrol ambalaj hücre hattı ek olarak Ha 7.5 [CE1] [E2p7NS2], bu HeLa ve insan olmayan karaciğer ve fare karaciğer hücreleri için temsilcileri, sırasıyla Hep56.1D ambalaj hücreleri oluşturulur. Bu son hücrelerde HCV RNA çoğaltma verimliliği düşük ve HCV montaj ve yayın görülmemiştir. Şekil 1C füzyon testinin sonuçları göstermektedir. Süpernatan 48 saat sonrası füzyon indüksiyonu co-kültürden toplandı ve daha sonra lusiferaz deneyleri için saf Ha-7,5 hücreleri aşılamak için kullanılmıştır. Özellikle, zaman Huh-7.5 replikon hücreleri ya ile kaynaşmıştırkontrol olarak PBS ile muamele saf hücre hatları veya hiçbir enfektivite kültürü sıvılarında tespit edildi. Ancak, Huh-7.5 replikon ve paketleme hücre hatları arasında hücre füzyonu PEG tarafından oluşturuldu zaman replikon ve yapısal olarak ifade yapısal proteinleri arasında trans-tamamlayamamakta çıkan heterokaryonlar virüs üretimi kurtarıldı ve bulaşıcı viral parçacıkların kültür sıvıları içine serbest bırakıldı. Bu nedenle, bu virüsün üretimini ambalaj hücresi hatlarında viral proteinin hücre füzyonu ve ifadesi gerekli sonucuna varılmıştır. Çarpıcı, Ha-7.5 insan hepatoma hücrelerinin heterokaryonlar değil, aynı zamanda insan olmayan karaciğer (HeLa [CE1] [E2p7NS2]) ve fare karaciğerinde (Hep56.1D [CE1] [E2p7NS2]) hücreleri izin virüs sürümü ile heterokaryonlar değil sadece, montaj ve yayın ağırlıklı bu hücre tiplerinin olası kısıtlama faktörler tarafından inhibe edilmez belirten. Ambalaj hücre çizgileri ve hedef hücrelerin içine otantik giriş yapısal proteinler ekspresyon Frentzen gösterilmiştir Ve ark. 15.
Hücre füzyonu alternatif bir yöntem hücreye girişi, RNA çeviri ve replikasyon siklusu RNA replikasyon aşamaları etkileyen olası kısıtlamalar analiz etmek ve transfekte Huh 7.5 replikon hücrelerinde yüksek viral yükü doygunluk tarafından kısıtlama faktörlerinin tespiti engel olacağını dışlamak için kullanılmıştır. Bu amaçla, HCVcc ve bu hücrelerde de novo virüsünün üretimi tespiti ile heterokaryonlar inokulasyonunun göre bağımsız bir tahlil geliştirilmiştir. Şekil 2A özetlendiği gibi, somatik hücre füzyon hücrelerinin co-kültivasyonu sonra bir füzojenik glikoproteinin ifadesi tarafından oluşturuldu. Duyarlılığı artış nedeniyle füzyon etkinliğini muhtemeldir çıkarıldı, çünkü bu yöntem seçildi. Heterokaryonlar co-ekim öncesinde CellTracker boya ile ayrı bir hücre çizgileri boyanarak görüntülenmiştir. Sitoplazma içinde homojen dağıldığı boyalarla bir heterokaryon iki hücre tipinin füzyonu olarak gösterir gösterirŞekil 2B'de d. Sadece Lunet N HeLa hücreleri veya Hep56.1D hCD81 hücreler ile hücre heterokaryonlar tüm HCV giriş faktörler dolayısıyla seçici HCV hücreye girişi duyarlı heterokaryonlar render ifade edilir. HCVcc ile meydan yaklaşık 10 kat daha assay (Şekil 2C), arka plan üzerinde bulaşıcı döl viral de novo üretimi bellidir heterokaryonlar HCV tam replikasyon ile sonuçlanmıştır. Bir kontrol olarak, Lunet N hücreleri Lunet N hücreleri ile kaynaşmış edildi. Önemlisi algılama sınırına bulaşıcı HCV yakın sadece çok düşük seviyelerde gözlendi. Lunet N hücreleri saf Hep56.1D hücreleri ile kaynaşmış da benzer sonuçlar elde edilmiştir. HCV verimli heterokaryonlar bulaşmaz, öyle ki her iki durumda da, insan CD81 yoktu. Bu iki örnekte tespit Bu çok düşük enfektivite Lunet N hücreler ve / veya inokulum gelen kalıntı bulaşıcı virüsün giriş düşük seviyelerde enfeksiyonu için düşük seviyede muhtemeldir ilişkindir. Buna HeLa hücreleri ve O dap56.1D hCD81 hücreleri böylece heterokaryonlar içinde eksik hücreye girişi faktörü tamamlayan ve HCV hücreye giriş izni veren, CD81 insan ifade. Bu iki hücre dizileri içeren heterokaryonlar orta tespit enfeksiyöz HCV 10 kat daha yüksek seviyede bu nedenle büyük olasılıkla heterokaryonlar bulaşıcı parçacıklar de novo üretimi yansıtır. Böylece, HCV replikasyon döngüsünün olduğu tamamlanmasından bu hücre hatları içinde baskın HCV restriksiyon faktörlerin ekspresyonunun hariç sınırlı değildir sonucuna varılmıştır.
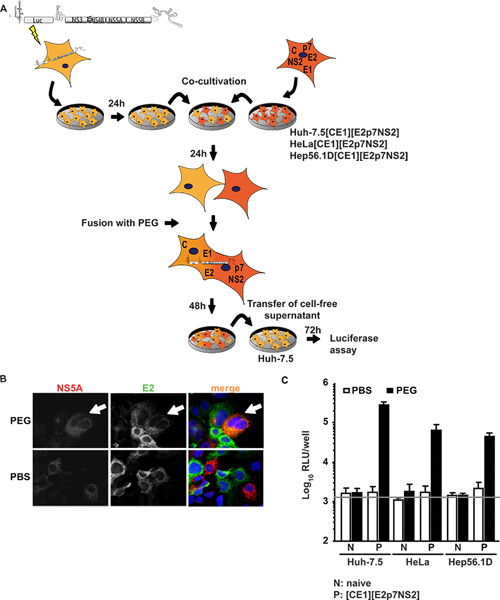
Şekil 1. Trans-tamamlayamamakta HCV montaj ve heterokaryonlar yılında sürümü. PEG aracılı hücre füzyonu deneysel prosedür (A) Şematik anahat. JFH1 lusiferaz reporter replikon Luc-NS3-5B elektroporasyon yoluyla saf Ha-7,5 hücrelerin içine transfekte edildi. Ertesi gün naif hücreleri veya ambalajı ile, hücreler kopartılan ve işbirliği kültürü yapısal olarak HCV çekirdek, E1, E2, p7 ve NS2 ifade hücreler. 24 saat sonrası co-ekimi, heterokaryon oluşumu negatif kontrol olarak PBS kullanarak% 40 PEG tedavisi ile oluşturuldu. 48 saat sonra, hücre içermeyen yüzer kısım saf Ha-7,5 aşılamak için hücreler hasat edilmiştir. Enfektivite lusiferaz aktivitesi ile tespit edildi. (B) heterokaryonlar saptanması için, hücreler E2 ve NS5A karşı monoklonal antikorlar kullanılarak boyama yapıldı. Hücreler içerisinde her iki proteinin de eş zamanlı olarak ifadesi hücre füzyonunun göstermektedir. (C) Lusiferaz ölçümler heterokaryonlar üretilen viral enfeksiyon riskini ölçmek için gerçekleştirildi. , Üç bağımsız deneyin ve araçlarının standart sapmalarının ortalama değerleri verilmiştir. Yatay çubuk bulaşmamış Huh-7.5 hücreleri tespit arka RLU temsil eder. büyük rakam görmek için buraya tıklayın .
9/4029fig2.jpg "/>
Şekil 2. Heterokaryonlar inokülasyonu sonra HCV replikasyon döngüsünün tamamlanması. Deneysel işlemin (A) şematik bakış. CD81 eksikliği Huh-7 Lunet N hücreleri belirtilen hücrenin satır eksik veya insan CD81 ifade ile birlikte kültüre alınmıştır. Önemli olarak, bu ikinci hücreleri, en az bir giriş HCV faktörü yoksundur ve bu nedenle üretken enfeksiyon edilemez. Ertesi gün, füzyon PFV bir füzojenik Viral zarfın protein transfeksiyon etmek suretiyle başlatıldı. Otuz saat sonra hücreler, bulaşıcı parçacıklar HCV ile karşılaştırılan edildi. Bu heterokaryonlar tarafından sürekli hücre girdisini, RNA çoğaltma ve virüs üretimini ölçmek için, hücre-serbest-kültür sıvıları içerisinde piyasaya enfektivite 48 saat sonrası aşılama belirlendi. Bu amaca yönelik olarak, saf Ha-hücrelerinde, bir 7,5 sınırlı inceltme yöntemi (TCID 50) hedef hücre olarak kullanıldı. (B) heterokaryonlar tespiti için, hücreleri önce co-cultiv için CellTracker Yeşil veya CellTracker Turuncu 6 saat ile boyandıtirme ve transfeksiyon. Otuz saat sonra hücreler tespit ve DAPI ile boyandı. (C) Lunet N hücreleri HeLa hücreleri, insan CD81 eksprese eden saf Hep56.1D ya Hep56.1D hücrelere kaynaşmıştır. Bu kültürler HCVcc (MOI 2.3) ile inoküle edildi. Kültür sıvıları 48 saat sonra toplandı ve heterokaryonlar den de novo partikül yayın saf Ha-7,5 hedef hücreler kullanılarak TCID 50 ile tespit edildi. , Üç bağımsız deneyin ortalamasını değerleri verilmiştir. Yatay çubuk testinin algılama sınırı temsil eder. büyük rakam görmek için buraya tıklayın .
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Biz HCV çoğaltma engel dominant negatif kısıtlamaların analizi için kültür hücreleri heterokaryon oluşumunu uyarmak için iki yöntem sunuyoruz. Bu prosedürler kullanılarak çeşitli insan olmayan karaciğer ve murin karaciğer hücre çizgileri baskın bir yapısal olarak ifade edilen veya virüs kaynaklı faktörü varlığında bırakıldı. Kısıtlama faktörler bulaşıcı döl HCV montaj ve salınımını önlemek eğer ilk testi öncelikle analiz eder. Bu durumda ambalaj hücreleri HCV replikon hücr...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
TP Biotest gelen danışmanlık ücreti aldı.
Teşekkürler
Biz Takaji Wakita sırasıyla JFH1 ve J6CF izolatlar için Jens Bukh, minnettarız. Ayrıca biz Charles Huh-7.5 hücreler için Rice ve 9E10 antikor, E2-spesifik antikor CBH-23 Steven Foung ve Deneysel Viroloji, faydalı öneri ve tartışmalar için Twincore Bölümü tüm üyelerine teşekkür ediyorum.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| DMEM | Invitrogen, Karlsruhe, Almanya | 41965-039 | |
| L-glutamin | Invitrogen, Karlsruhe, Almanya | 25030-024 | |
| Olmayan amino asitler | Invitrogen, Karlsruhe, Almanya | 11140-035 | |
| Penisilin / streptomisin | Invitrogen, Karlsruhe, Almanya | 15140-122 | |
| Fetal buzağı serumu | PAA, Cölbe, Almanya | A15151 | |
| α-E2 (CBH23) | nazik Steven Foung 10 tarafından sağlanan | ||
| ATP | Sigma, Steinheim, Almanya | A2833-106 | |
| Glutatyon | Sigma, Steinheim, Almanya | G4251-1G | |
| Blasticidin | İnvivo Gen, San Diego, ABD | Ant-bl-1 | |
| G418 (genetisin) | Invitrogen, Karlsruhe, Almanya | 11811-064 | |
| Polietilen glikol-1500 | Roche, Mannheim, Almanya | 10783641001 | |
| Paraformaldehyde | Roth, Karlsruhe, Almanya | 0335.3 | |
| Triton X-100 | Roth, Karlsruhe, Almanya | 3051.2 | |
| Keçi serumu | Sigma, Steinheim, Almanya | G9023-5ml | |
| α-NS5A (9E10) | Nazik Charles Rice 7 tarafından sağlanan | ||
| DAPI (4 ', 6'-diamidino-2-fenilindol dihidroklorür) | Invitrogen | D1306 | |
| Alexa-Fluor 546 - keçi anti-insan IgG | Invitrogen, Karlsruhe, Almanya | A21089 | |
| Alexa-Fluor 488 - keçi anti-fare IgG | Invitrogen, Karlsruhe, Almanya | A10680 | |
| Lipofektamin 2000 | Invitrogen, Karlsruhe, Almanya | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Almanya | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Almanya | C2925 | |
| Fluoromount | Sigma, Steinheim, Almanya | F4680-25ml | |
| Tüm diğer kimyasal maddeler | Roth, Karlsruhe, Almanya | ||
| Hücre kültürü malzemeleri | Sarstedt, Nümbrecht, Almanya |
Referanslar
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978(2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029(2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır