Method Article
Grabaciones de patch clamp en Inner células del oído pelo Aislado de pez cebra
En este artículo
Resumen
El propósito de este video es para demostrar los procedimientos para obtener las células sanas, intactas pelo de los órganos del oído interno de pez cebra adultos y luego usarlos para estudios de patch clamp objetivo de caracterizar las propiedades biofísicas de los canales dependientes de voltaje.
Resumen
Análisis de patch clamp de los canales dependientes del voltaje en las células ciliadas sensoriales aisladas de una variedad de especies han sido descritas previamente 1-4 pero este vídeo representa la primera aplicación de estas técnicas a las células ciliadas de pez cebra. Aquí se demuestra un método para aislar células sanas intactas, el pelo de todos los finales del oído interno órganos: sáculo, lagena, utrículo y los canales semicirculares. Además, se demuestra la diversidad en el tamaño celular y la morfología del pelo y dar un ejemplo de los tipos de grabaciones de patch clamp que se puede conseguir. La ventaja de la utilización de este sistema de modelo de pez cebra sobre otros se deriva de la disponibilidad de pez cebra mutantes que afectan tanto la audición y el equilibrio. En combinación con el uso de las líneas transgénicas y otras técnicas que utilizan el análisis genético y la manipulación, el aislamiento de células y métodos electrofisiológicos introducido aquí debe facilitar una mayor penetración en las células ciliadas funciones pyacía en la mediación de estas modalidades sensoriales.
Protocolo
1. Pre-experimentales preparativos
- Preparar seis soluciones (véase la Tabla 1 para las composiciones): (a) 100 ml NZR (normal pez cebra de Ringer), (b) 50 ml NZR + tricaína (MS222), (c) 10 ml NZR + BSA; (d) 100 Locas ml (bajo Ca 2 solución +), (e) 10 ml Locas + papaína, (f) 100 ml de K +-solución interna. Soluciones (a), (b), (d) y (f) se puede almacenar durante hasta un mes a 4 ° C. Soluciones (c) y (e) se deben preparar el día de la experimentación. Todas las soluciones deben estar a temperatura ambiente antes de comenzar los experimentos.
- Etiqueta y llenar cuatro 35 mm placas de Petri aproximadamente hasta la mitad con soluciones (a), (c), (d) y (e).
- Hacer un plato de disección llenando una cápsula de Petri de 60 mm con Sylgard (Dow Corning, Midland, MI) y después cortando una cavidad en ella que permitirá que un pez de sentarse erguido sin volcar.
- Preparar al menos dos herramientas de aislamiento de células mediante encolado final folículo de un pelo de perro hasta el final de un vasoPipeta Pasteur con pegamento, lo que permite que el cabello se extienda más allá del extremo de la pipeta por aproximadamente 0,5 cm. Los pelos de los perros de pelaje suave como el Labrador Retriever y Weimaraners funcionan bien.
2. Aislamiento del Auditorio y del laberinto vestibular
- Sacrificar un pez cebra adulto por inmersión en un vaso de precipitados que contiene NZR + tricaína. Visualmente controlar las branquias hasta que todos los movimientos operculares han cesado. Espere otros diez minutos antes de retirar el pescado y enjuague con NZR fresco. Estos procedimientos han sido aprobados por el Cuidado de Animales institucional y el empleo Comisión (IACUC) de la Universidad de Pepperdine, pero la aprobación se debe obtener de su propia institución.
- Pin el pescado a la disección lateral plato dorsal arriba mediante la inserción de un pasador de costura recta estándar (aproximadamente 2,5 cm de largo) a través de cada cuenca del ojo y una tercera clavija a través del eje dorso-ventral alrededor de un tercio a la mitad de la distancia de la cabeza a la cola como se ilustra enFigura 1A.
- Bajo un zoom (0,62-5x) microscopio de disección estéreo equipados con oculares 10x, use tijeras de primavera (Ciencia Fine número de catálogo 15000-02 Herramientas) para exponer el cerebro y un corto segmento de la médula espinal mediante la eliminación de la azotea del cráneo, a unos 0,5 cm caudal al nivel de las branquias hacia adelante a la nariz de los peces. Cortar el cordón espinal y el cerebro levantar con unas pinzas finas (Ciencia Fine número de catálogo Herramientas 11251-30), mientras que cortar los nervios espinales y otros accesorios, quite y deseche el cerebro (Figura 1B).
- La parte ventral de la cápsula cráneo que permanece forma un "bowl" que contiene los órganos del oído interno. Tenga en cuenta las prominentes, otolitos blancos, opacos en los lagenas y sacculi situadas simétricamente en el extremo caudal de cada oído interno y los otolitos utrículo colocados lateralmente más rostral (Figuras 1C y 4A).
- Retire el tazón de hueso mediante la reducción de todas las attachmen ventral y lateralts mientras sacándola suavemente de la cabeza con unas pinzas finas. Colóquelo en la placa de Petri que contiene Locas (figuras 1D y 4B).
- Utilizando dos pares de pinzas finas, romper aparte el recipiente en su línea media, ya sea agarrando los bordes laterales de los huesos y separándolos o, alternativamente, la separación de las mitades derecha e izquierda mediante la inserción de las puntas de las pinzas en el centro de la palanca y las mitades aparte. Quitar los dos laberintos del hueso utilizando unas pinzas finas (Figura 2).
- Inspeccione los laberintos para identificar el auditivo y vestibular finales órganos: los canales semicirculares, utrículos, sacculi y lagenas (Figura 4C). Las zonas rosadas bajo cada otolito son las máculas que contiene las células ciliadas. De manera similar, una tira de color rosa en el interior de las ampollas de los canales semicirculares identifica la cúpula donde las células ciliadas se encuentran.
- Retire con cuidado los otolitos de la lagena utrículo y utilizando las pinzas finas ( Figuras 2 y 4C). No es necesario retirar los otolitos del sáculo ya que podría dañar las células ciliadas saculares.
3. Cabello aislamiento de células
- Uso de una transferencia de pipeta de plástico (número de catálogo Fisher Scientific 13-711-9 a.m.), mover los órganos terminales de la cápsula que contiene Locas + papaína minimizar el volumen de fluido transferido.
- Incubar estas estructuras en esta solución durante treinta minutos a temperatura ambiente.
- Al final del periodo de incubación, se mueven las estructuras de la cápsula que contiene NZR + BSA y se incuban en esta solución durante al menos treinta minutos. Las células ciliadas se mantendrá saludable en esta solución durante hasta cuatro horas, pero se deteriora después de 1-2 horas después del aislamiento (ver después).
- En preparación para el aislamiento de células, mover uno de los órganos de extremo a la cápsula que contiene NZR.
- Para los lagenas y utrículos, use un pelo de perro para levantar suavemente de las hojas de máculas de ti-epitelial rosadoncidencia que contienen las células ciliadas (figura 3A). La mácula se puede sacar con una cuchara (con un pelo de perro) por debajo de los otolitos de los sacculi, y el cupulae de sus ubicaciones dentro de las ampollas de los canales semicirculares.
- El uso de dos herramientas de aislamiento de células preparados en el paso 1,4, se tritura una mácula o la cupula para generar un campo de desechos que contiene las células ciliadas (Figura 3B). Permitir que las células al menos cinco minutos para asentarse en el fondo de la placa antes de moverlo.
- Reubicar el plato a la etapa de un microscopio invertido equipado con óptica de contraste de fase. Observar las células bajo magnificación de 40X y tenga en cuenta la diversidad en la morfología. Muchas células están en forma de aguacate, mientras que otros son largos y delgados. La presencia de haces de pelo apicales los identifica como células ciliadas y fase-brillo asegura su salud. Las fotomicrografías de células ciliadas aisladas se muestra en la Figura 5.
4. Parche de sujeción células de pez cebra Cabello
- En la preparación para perfonominal 5,6 parche grabaciones, preparar anfotericina solución que contiene interno de la siguiente manera: colocar 5 mg de anfotericina B (Sigma A4888) en un tubo de microcentrífuga de 1,5 ml y llenarlo con 100 l de DMSO. Inmediatamente vórtice esta solución durante 10-20 segundos hasta que todo el anfotericina se disuelve. Entonces, pipeta 625 l K +-interno solución en un tubo de microcentrífuga segundo. Añadir 10 l de la solución de anfotericina para el K +-solución interna y vórtice como anteriormente. La solución de anfotericina acciones durará varias horas, pero deseche la solución final después de una hora.
- Fabrique pipetas de parche de BF vidrio borosilicato 150-86-10 (Sutter Instruments) utilizando un extractor multietapa (Sutter P-1000). Pipetas debería haber propina diámetros de aproximadamente 2 micras y tienen resistencias de 1-3 mW con las soluciones en la Tabla 1. Los ajustes en el extractor que funcionan bien son las siguientes: Calor = Rampa minus10, Pull = 0, velocidad = 18, delay = 1, = Presión 600. La forma dela punta de una pipeta bien es evidente a partir de la fotografía en el c inserción de la figura 5. Blunt "en forma de bala" pipetas son preferibles, ya que ofrecen la menor resistencia acceso durante las grabaciones electrofisiológicas.
- Utilice una aguja de calibre 28 jeringa Microfil (MF28G-5; World Precision Instruments) para llenar un electrodo de registro hasta la mitad con la anfotericina K +-que contiene solución interna.
- Colocará el electrodo a la headstage de un amplificador de patch clamp. Aplicar -10 mV, 10 pasos de voltaje ms a 10 Hz y mantener una presión positiva en el electrodo como se maniobra a través de la interfase aire / solución y hacia abajo a la parte inferior del plato de grabación cerca de las células.
- Coloque el electrodo ortogonalmente a una célula de aspecto saludable. Cuando el electrodo es lo suficientemente cerca de la celda de modo que comienza alejarse de la solución fuera de flujo, invertir rápidamente la presión, la aplicación de un ligero vacío al electrodo hasta que la célula "saltos" en la misma. Inmediatamente cesar de succión en the electrodo y aplicar un potencial de mantenimiento de -70 mV en el interior del electrodo. A los pocos segundos un sello gigaohmio se formarán.
- Observar los transitorios de corriente capacitiva en el inicio y la terminación de las etapas de tensión que aparecen poco después de la formación del sello. Continuar controlando la perforación de la membrana bajo el electrodo por la anfotericina observando como los transitorios de crecer en magnitud a su tamaño máximo (en unos diez minutos).
- Para confirmar el establecimiento de células enteras (perforada) de configuración en una célula sana, provocar corrientes de K + hacia el exterior mediante la aplicación de hiperpolarización y despolarización pasos de voltaje. La mayoría de las células ciliadas tienen importantes corrientes hacia el exterior (ver Figura 6).
5. Los resultados representativos
La Figura 4 muestra las imágenes tomadas durante las etapas de aislamiento de células. En el panel A, los otolitos asociados con los lagenas, saccluli y utrículos se puede ver through la capa delgada de hueso que los recubre. Estas estructuras opacas proporcionar puntos de referencia convenientes para ayudar en la eliminación segura de los órganos terminales de los animales durante los pasos subsiguientes de la disección. El panel B muestra el "bowl" de hueso que contiene los laberintos intactos y los otolitos prominentes en los utrículos, lagenas y sacculi. El panel C muestra un laberinto que se ha eliminado del hueso. Nota del otolito grande con el borde festoneado en la lagena, el otolito con forma de carámbano en el sáculo y del otolito en forma de frijol en el utrículo. Algunos de la diversidad en el tamaño y la morfología observada en las células aisladas de la lagena se ilustra en la Figura 5. Una célula sana es fácilmente identificado como fase luminosa, con un perímetro fuerte. Formas de células se pueden dividir en dos clases: aguacate en forma de (AVO) y larga y delgada (THN) a pesar de los tamaños de las células dentro de cada grupo pueden variar notablemente (comparar por ejemplo avo 1 y avo 3). El recuadro muestra un grupo detres celdas que no estaban completamente aislados unos de otros. El color negro y aspecto granular de la célula en b recuadro identifica fácilmente esta célula como muertos. C recuadro muestra la punta de una pipeta de parche que ilustra la forma y las dimensiones apropiadas para la grabación de estas células.
Las trazas de corriente mostrados en la Figura 6 se obtuvieron en respuesta a la hiperpolarización y despolarización pasos de potencial impuestas a una célula lagena similar a la avo 2 se muestra en la Figura 5. Respuestas actuales en células de diferentes tamaños y formas pueden variar ampliamente sugiriendo la diversidad en el complemento de canales dependientes de voltaje.
Figuras 1-3: Dibujos que ilustran pasos en el aislamiento de las células ciliadas.
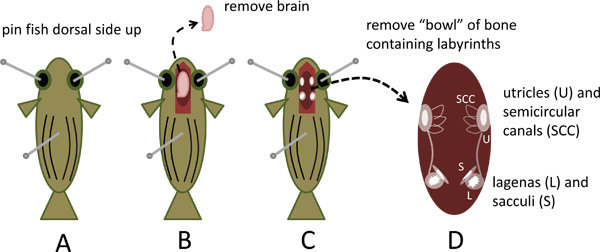
Figura 1. La eliminación del cráneo capsularle contiene los laberintos del oído interno de los peces cebra. A. Pin sacrificado lado dorsal del pez cebra hasta la disección de plato. B. Cráneo abierto, retire y deseche cerebro. C. Observar los otolitos en utrículos, lagenas y D sacculi.. Quítele la parte ventral de la cápsula cráneo que contiene los laberintos.
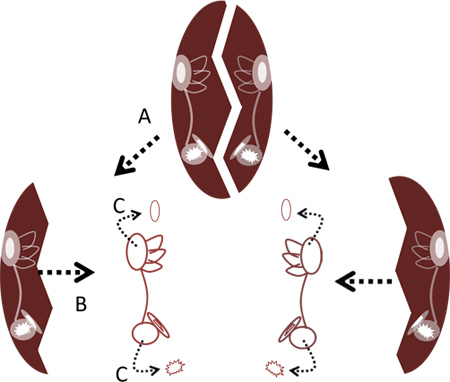
Figura 2. Eliminación de los laberintos de la cápsula cráneo. Una. Grieta aparte cápsula cráneo en su línea media. B. Retire laberintos de los huesos. C. Retire los otolitos de los lagenas y utrículos utilizando fórceps.
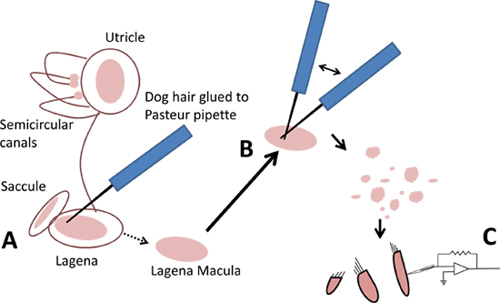
Figura 3. Aislamiento de las células ciliadas de laberintos. Una. Suavemente levante maculae con un pelo de perro. B. Se tritura máculas con dos pelos de perro. C. Use las células aisladas de cabello para patch clamp.
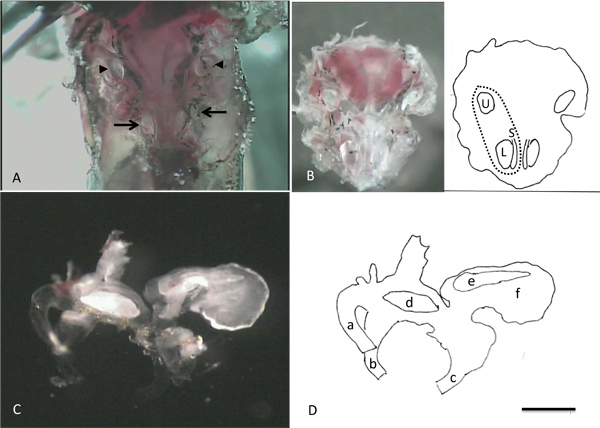
Imágenes de la Figura 4. Tomado durante las etapas en el aislamiento de células individuales. A. Después de la eliminación del cerebro, los otolitos asociados con los dos lagenas y sacculi (flechas) y utrículos (puntas de flecha) puede ser visualizado. B. Después de la eliminación de la ventral parte de la cápsula cráneo que contiene los órganos del oído interno del animal. La caricatura en la mitad derecha de B identifica la ubicación de la izquierda utrículo, el sáculo y lagena. La línea de trazos indica la posición aproximada del laberinto izquierda. C. Laberinto derecha (vista medial) D: Dibujo de la historieta que ilustra porciones clave de laberinto en C. a: semi anteriorcircular canal, b: canal horizontal, c: canal posterior, d: utricular otolito, e: otolitos saculares, f: lagenal otolitos. La barra de escala en D representa 1 mm para A y B, 0,5 mm para C y D.

Figura 5 Las células aisladas y saludables de la lagena que ilustra la diversidad de la morfología; avo:. Aguacate en forma de células; THN: células largas y delgadas. Recuadro A: grupo de tres células aisladas incompleta; recuadro b: células muertas, c recuadro: La punta del electrodo de parche usado en grabaciones electrofisiológicas de las células ciliadas de pez cebra. Barra de escala = 20 micras se aplica a la figura principal y todas las inserciones.
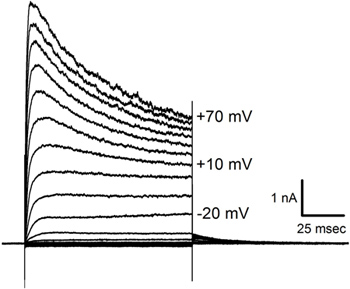
Corrientes Figura 6. Grabados en un parche sujeta célula de pelo. Respuestas promediadas en una celda (t similaresavo o 2 en la Figura 5) a tres presentaciones de etapas de tensión aplicados en incrementos de 10 mV desde -140 mV a +70 mV desde un potencial de mantenimiento de -70 mV. Tenga en cuenta la corriente de inactivación que aparece a potenciales más despolarizados. Magnitudes de tensión de paso se muestran junto a algunos de los rastros.
Discusión
Cuidadosa disección de los órganos terminales y el tratamiento suave de las células es crítico para el éxito en el aislamiento de las células sanas, intactas pelo y fisiológicamente activo. La adhesión a los siguientes consejos para garantizar su éxito:
- Es más fácil de obtener las células sanas de los peces más pequeños (2-2.5 cm de longitud). Los peces más grandes tienen muchas gotitas de grasa más que la visualización oscuro durante el proceso de disección.
- Se debe tener cuidado al extraer los otolitos, que recubren las células ciliadas. Evite tocar las células cuando el acaparamiento de los otolitos con fórceps.
- Los mejores resultados se obtienen cuando las máculas y cupulae estén levantadas como hojas y las células se trituró en el epitelio.
- Nos encontramos con el uso de un pelo de perro para triturar las células a ser superior a otros métodos, incluyendo el uso de pestañas humanos 7 que no son tan cónica y menos flexible.
- Durante parche de sujeción, la aplicación de presión positiva para tél electrodo a medida que pasa a través de la interfase aire / solución es importante para mantener la punta limpia. La liberación de la presión positiva para permitir que la célula de "saltar" sobre el electrodo también es importante. Este método borra un pequeño volumen de solución que contiene anfotericina lejos de la punta, aumentando así la probabilidad de formar un sello gigaohmio con la célula. En nuestros experimentos usamos la técnica de parche perforado de grabación en lugar de la más tradicional configuración de célula completa debido a la fragilidad de las células. El intento de "ir de célula entera" a menudo resulta en la pérdida del sello gigaohmio.
El método descrito aquí se producen cientos de células pilosas sanas por animal. La técnica se puede realizar a temperatura ambiente y no requiere ningún equipo especial más allá de un microscopio de disección. Un informe anterior de JoVE describe la disección del oído interno en el pez cebra mediante un enfoque ventral 8. Estos autores demuestran la dissección de enteros, paraformaldehído-fijo órganos del oído interno. Animamos al lector a ver este video de comparación con nuestros métodos. Una ventaja de los métodos presentados aquí es la obtención de células vivas útiles para investigaciones fisiológicas. Además de su uso en los experimentos de patch clamp para estudiar los canales dependientes de voltaje (como se muestra aquí) el uso de estas células se puede extender a estudiar resonancia celda 9,10, monitor de la liberación de neurotransmisores mediante mediciones de capacitancia 11,12, investigar neuromodulación inducida por la activación del ligando canales cerrados 13, así como aprovechar la gran cantidad de información que se puede extraer de uso mutantes que afectan tanto a la audición y el equilibrio 14.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Financiado por la NSF (0854551).
Materiales
| Name | Company | Catalog Number | Comments |
| Solución Nombre | Receta | ||
| (A) NZR (Normal Zebrafish de Ringer) (en mM) | 116 NaCl, 2 KCl, 2 CaCl 2, 3 Glucosa, 5 Na +-HEPES, pH 7,35. | ||
| (B) NZR + tricaína | NZR + 0,02% de ácido 3-aminobenzoico éster de etilo metano sulfonato (Sigma A5040). | ||
| (C) NZR + BSA | NZR + 0,4% de albúmina de suero bovino (Sigma A2153). | ||
| (D) Locas (Baja Ca 2 Solución +) (en mM) | 100 NaCl, 2 KCl, CaCl 2 0,05, 0,05 MgCl 2, 3 Glucosa, 30 Na +-HEPES, pH 7,35. | ||
| (E) Locas + papaína | Locas + 0,05% de L-cisteína (Sigma c1276) + 0,2% de papaína (Sigma P3375). | ||
| (F) K +-solución interna (en mM) | 52 K 2 SO 4,38 KCl, 1 K +-EGTA, 5 K +-HEPES, pH 7,3. |
Tabla 1. Solutions.
Referencias
- Lewis, R. S., Hudspeth, A. J. Voltage- and ion-dependent conductances in solitary vertebrate hair cells. Nature. 304, 538-5341 (1983).
- Art, J. J., Fettiplace, R. Variation of membrane properties in hair cells isolated from the turtle cochlea. J. Physiol. 385, 207-242 (1987).
- Sugihara, I., Furukawa, T. Morphological and functional aspects of two different types of hair cells in the goldfish sacculus. J. Neurophysiol. 62, 1330-1343 (1989).
- Lee, S., Briklin, O., Hiel, H., Fuchs, P. Calcium-dependent inactivation of calcium channels in cochlear hair cells of the chicken. J. Physiol. 583, 909-922 (2007).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J. Gen. Physiol. 92, 145-159 (1988).
- Rae, J. R., Cooper, K., Gates, P., Watsky, M. Low access perforated patch recordings using amphotericin B. J. Neurosci. Meth. 37, 15-26 (1991).
- Lumpkin, E. A., Hudspeth, A. J. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc. Natl Acad. Sci. U.S.A. 92, 10297-10301 (1995).
- Liang, J., Burgess, S. M. Gross and fine dissection of inner ear sensory epithelia in adult zebrafish (Danio rerio). J. Vis Exp. 27, e1211 (2009).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage- and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 237-274 (1988).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 275-297 (1988).
- Parsons, T. D., Lenzi, D., Almer, W., Roberts, W. M. Calcium-triggered exocytosis in an isolated presynaptic cell: capacitance measurements in saccular hair cells. Neuron. 13, 875-883 (1994).
- Kim, M. -. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis Exp. 59, e3345 (2012).
- Housley, G. D., Ashmore, J. F. Direct measurement of the action of acetylcholine on isolated outer hair cells of the guinea pig cochlea. Proc. R. Soc. Lond. B. 244, 161-167 (1991).
- Nicolson, T. The genetics of hearing and balance in zebrafish. Ann. Rev. Genetics. 39, 9-22 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados