Method Article
Registrazioni patch clamp in cellule interne dell'orecchio Capelli Isolato da Zebrafish
In questo articolo
Riepilogo
Lo scopo di questo video è dimostrare procedure per ottenere cellule sane capelli intatte dagli organi dell'orecchio interno di zebrafish adulti e poi li utilizzano per studi di patch clamp per caratterizzare le proprietà biofisiche di loro canali voltaggio-dipendenti.
Abstract
Analisi di patch clamp dei canali voltaggio-dipendenti in cellule ciliari sensoriali isolate da una varietà di specie sono state descritte in precedenza, ma il video 1-4 rappresenta la prima applicazione di tali tecniche di cellule cigliate di zebrafish. Qui mostriamo un metodo per isolare le cellule ciliate sane, intatte da tutti gli interni dell'orecchio finali organi: sacculo, lagena, utricolo e canali semicircolari. Inoltre, abbiamo dimostrato la diversità di taglia capelli e la morfologia cellulare e dare un esempio dei tipi di registrazioni patch clamp che può essere ottenuta. Il vantaggio dell'utilizzo di questo sistema modello zebrafish sugli altri nasce dalla disponibilità di mutanti di zebrafish che colpiscono sia l'udito e l'equilibrio. In combinazione con l'uso di linee transgeniche e altre tecniche che utilizzano analisi genetica e la manipolazione, l'isolamento cellulare e metodi elettrofisiologici introdotto qui dovrebbe favorire una maggiore comprensione delle cellule cigliate ruoli pconsisteva nel mediare queste modalità sensoriali.
Protocollo
1. Pre-sperimentali Preparazioni
- Preparare sei soluzioni (cfr. tabella 1 per le composizioni): (a) 100 ml NZR (normale zebrafish Ringer), (b) 50 ml NZR + Tricaine (MS222), (c) 10 ml NZR + BSA, (d) 100 Locas ml (partire Ca 2 + soluzione), (e) 10 ml + Locas papaina, (f) 100 ml K +-soluzione interna. Soluzioni (a), (b), (d) e (f) può essere conservato fino ad un mese a 4 ° C. Soluzioni (c) e (e) deve essere preparato il giorno di sperimentazione. Tutte le soluzioni devono essere a temperatura ambiente prima di iniziare esperimenti.
- Etichetta e riempire quattro 35 millimetri Petri circa metà con soluzioni (a), (c), (d) ed (e).
- Fai un piatto dissezione compilando un piatto 60 millimetri Petri con Sylgard (Dow Corning, Midland, MI) e poi tagliando una cavità in esso che permetterà un pesce per poter stare seduti senza ribaltarsi.
- Preparare almeno due utensili di isolamento delle cellule mediante incollaggio alla fine di un follicolo capelli cane alla fine di un vetroPipetta Pasteur con supercolla, permettendo al capello di estendersi oltre l'estremità della pipetta di circa 0,5 cm. I peli di soft-pelo cani come i Labrador Retriever e Weimaraners funzionano bene.
2. Isolamento di uditivo e del labirinto vestibolare
- Sacrifica uno zebrafish adulto per immersione in un recipiente contenente NZR + Tricaine. Monitorare visivamente le branchie fino a quando tutti i movimenti opercolari sono cessate. Attende altri dieci minuti prima di togliere i pesci e risciacquo con NZR fresco. Queste procedure sono state approvate dalla cura degli animali e uso Comitato Istituzionale (IACUC) della Pepperdine University ma l'approvazione dovrebbe essere ottenuto dal proprio istituto.
- Pin il pesce alla dissezione lato dorsale piatto fino inserendo un pin standard cucitura diritta (circa 2,5 cm) in ciascuna cavità oculare e un terzo perno attraverso il dorso-ventrale asse circa un terzo alla metà della distanza dalla testa alla coda come illustrato inFigura 1A.
- Sotto uno zoom (0.62-5x) stereo microscopio da dissezione dotato di oculari 10x, usare le forbici a molla (arti Scienza catalogo Strumenti numero 15000-02) per esporre il cervello e un breve segmento del midollo spinale, eliminando il tetto cranio da un punto a circa 0,5 centimetri caudale al livello delle branchie avanti con il naso del pesce. Tagliare il midollo spinale e sollevare il cervello con una pinza sottile (Fine Scienza catalogo Strumenti numero 11251-30), mentre il taglio dei nervi spinali e altri accessori, rimuovere il cervello ed eliminare (Figura 1B).
- La metà ventrale della capsula cranio che rimane forma una "ciotola" che contiene gli organi dell'orecchio interno. Rispettare le prominenti, bianchi, opachi otoliti nelle lagenas e sacculi situati simmetricamente alla fine caudale di ciascun orecchio interno e gli otoliti utricolo posizionate lateralmente più rostrale (figure 1C e 4A).
- Rimuovere la vaschetta di osso, tagliando tutti i attachmen ventrali e lateralits mentre delicatamente sollevando fuori della testa con una pinza sottile. Inserire nella scatola di Petri contenente Locas (Figure 1D e 4B).
- Utilizzando due coppie di pinze sottili, a parte rompere la ciotola nella linea mediana da una afferrando i bordi laterali del tessuto osseo e Separandoli o alternativamente, separando le metà destra e sinistra inserendo i punti della pinza del centro e le metà indiscreti a parte. Rimuovere i due labirinti dalle ossa con una pinza sottile (Figura 2).
- Controllare i labirinti per identificare il uditivo e vestibolare finali organi: i canali semicircolari, otricoli, sacculi e lagenas (Figura 4C). Le aree rosato sotto ogni otoliti sono macule contenente le cellule ciliate. Allo stesso modo, una striscia di colore rosa all'interno del ampolle dei canali semicircolari identifica la cupola in cui si trovano le cellule ciliate.
- Rimuovere con cautela le otoliti dal lagena e utricolo utilizzando le pinza sottile ( figure 2 e 4c). Non è necessario rimuovere il otoliti dal sacculo in quanto ciò potrebbe danneggiare le cellule ciliate sacculari.
3. Capelli cella di isolamento
- Utilizzando una pipetta di plastica trasferimento (numero di catalogo Fisher Scientific 13-711-09:00), spostare gli organi terminali al piatto contenente Locas + papaina minimizzare il volume di fluido trasferito.
- Incubare queste strutture in questa soluzione per 30 minuti a temperatura ambiente.
- Al termine del periodo di incubazione, spostare le strutture al piatto contenente NZR + BSA e incubare in questa soluzione per almeno 30 minuti. Le cellule dei capelli rimarrà sano in questa soluzione per un massimo di quattro ore, ma si deteriora dopo 1-2 ore dopo l'isolamento (vedere i passi successivi).
- In preparazione per l'isolamento delle cellule, spostare uno dei finali organi al piatto contenente NZR.
- Per i lagenas e otricoli, utilizzare un peli di cane per sollevare delicatamente al largo delle macule-fogli di rosa ti epitelialeUMERO che contengono le cellule dei capelli (Figura 3A). Il macule può essere scavato (con un pelo di cane), da sotto le otoliti del sacculi, e il cupulae dalle posizioni all'interno del ampolle dei canali semicircolari.
- Utilizzando strumenti cella due isolamento preparati nel passo 1,4, triturare una macula o cupula per generare un campo di detriti che contiene le cellule dei capelli (Figura 3B). Permettere alle cellule di almeno cinque minuti per risolvere sul fondo del piatto prima di spostarlo.
- Spostare il piatto alla fase di un microscopio invertito dotato di ottica di contrasto di fase. Osservare le cellule sotto ingrandimento 40X e notare la diversità nella morfologia. Molte cellule sono a forma di avocado, mentre altri sono lunghi e sottili. La presenza di fasci di capelli apicali li identifica come cellule cigliate e fase-luminosità assicura la loro salute. Microfotografie di cellule isolate capelli sono mostrati in Figura 5.
4. Patch di serraggio cellule ciliate zebrafish
- In preparazione per la perfonominale 5,6 patch di registrazioni, preparare amfotericina contenente soluzione interna come segue: posto 5 mg amfotericina B (Sigma A4888) in una provetta da 1,5 ml microcentrifuga e riempire con 100 microlitri di DMSO. Immediatamente vortex questa soluzione per 10-20 secondi finché tutti i amfotericina è disciolto. Poi, pipetta 625 microlitri + K-interno soluzione in una provetta secondo. Aggiungere 10 ml della soluzione di amfotericina al K +-soluzione interna e vortice come sopra. La soluzione amfotericina magazzino durerà diverse ore, ma scartare la soluzione finale dopo un'ora.
- Realizzare pipette di patch da BF 150-86-10 vetro borosilicato (Sutter Instruments) con un estrattore a più stadi (Sutter P-1000). Pipette dovuto consigliato diametri di circa 2 micron e hanno resistenze di 1-3 MW con le soluzioni in Tabella 1. Le impostazioni della estrattore che funzionano bene sono i seguenti: calore = Rampa minus10, Pull = 0, Velocità = 18, Delay = 1, pressione = 600. La forma dila punta di una pipetta buona è evidente dalla fotografia in c riquadro di figura 5. Blunt "proiettile a forma di" pipette sono da preferire in quanto offrono la resistenza almeno l'accesso durante le registrazioni elettrofisiologiche.
- Utilizzare un calibro 28 ago della siringa Microfil (MF28G-5; Strumenti di precisione del Mondo) per riempire un elettrodo di registrazione a metà con l'amfotericina contenente K +-interno soluzione.
- Apporre l'elettrodo al headstage di un amplificatore di patch clamp. Applicare -10 mV, 10 ms gradini di tensione a 10 Hz e mantenere una pressione positiva in quanto l'elettrodo viene manovrato in aria / soluzione di interfaccia e fino al fondo del piatto registrazione vicino alle cellule.
- Posizionare l'elettrodo ortogonalmente ad una cella sano. Quando l'elettrodo è abbastanza vicino alla cella in modo che inizi allontana dal fuori-fluente soluzione, invertire rapidamente la pressione, applicando una leggera depressione sull'elettrodo fino alla cella "salta" su di esso. Cessare immediatamente di aspirazione su °e elettrodo e applicare un potenziale di mantenimento di -70 mV all'interno dell'elettrodo. Nel giro di pochi secondi un sigillo gigaohm formerà.
- Osservare i transitori capacitivi attualmente in corso a l'inizio e la cessazione delle misure di tensione che appaiono subito dopo la formazione del sigillo. Continuare a monitorare la perforazione della membrana sotto l'elettrodo dal amfotericina osservando i transitori crescono in grandezza a loro dimensione massima (in circa dieci minuti).
- Per confermare la creazione di cellule intere (perforata) configurazione in una cellula sana, suscitare esteriori K + correnti applicando iperpolarizzante depolarizzanti e fasi di tensione. Maggior parte delle cellule dei capelli sono importanti correnti verso l'esterno (vedi figura 6).
5. Risultati rappresentativi
La figura 4 mostra immagini scattate durante le fasi di isolamento cellulare. Nel pannello A, le otoliti associati ai lagenas, saccluli e otricoli può essere visto through lo strato sottile di osso che li ricopre. Queste strutture opache forniscono punti di riferimento comodo per aiutare nella rimozione sicura degli organi finali di l'animale durante le fasi successive della dissezione. Pannello B mostra la "ciotola" di osso che contiene i labirinti intatti e gli otoliti eminenti, le lagenas otricoli e sacculi. Pannello C illustra un labirinto che è stata rimossa dal tessuto osseo. Si noti il otoliti grande con il bordo smerlato in lagena, il ghiacciolo a forma di otoliti nel sacculo e la forma di fagiolo otoliti nel utricolo. Alcune delle diversità in dimensione e morfologia visto in cellule isolate dal lagena è illustrato in figura 5. Una cellula sana è facilmente identificato come fase luminosa, con un perimetro tagliente. Forme delle celle possono essere suddivise in due classi: a forma di avocado (AVO) e lungo e sottile (THN), anche se le dimensioni delle celle all'interno di ogni gruppo può variare notevolmente (cfr. ad esempio avo 1 e avo 3). Un inserto presenta un grappolo ditre celle che non sono state completamente isolate l'una dall'altra. Il colore nero e granuloso della cella in b riquadro identifica prontamente questa cella come morto. C inserto mostra la punta di una pipetta di patch che illustra la forma e le dimensioni appropriate per la registrazione da queste cellule.
Le tracce corrente mostrati in Figura 6 sono stati ottenuti in risposta a iperpolarizzazione e depolarizzante passi di potenziale imposti una cella lagena simile alla AVO 2 illustrato nella Figura 5. Attuali risposte in cellule di diverse dimensioni e forme possono variare ampiamente suggerendo diversità nel complemento di canali voltaggio-dipendenti.
Figure 1-3: Cartoni animati che illustrano fasi l'isolamento delle cellule ciliate.
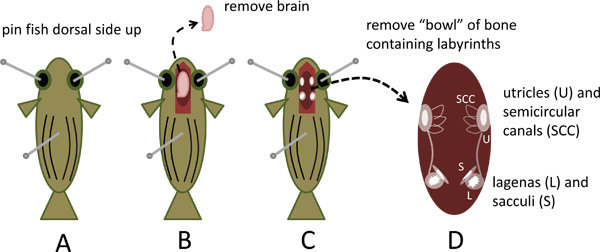
Figura 1. Rimozione della capsu craniole contenente i labirinti dell'orecchio interno di zebrafish. A. Pin sacrificato zebrafish lato dorsale fino a dissezione piatto. B. Cranio aperto, rimuovere ed eliminare il cervello. C. Osservare otoliti in otricoli, lagenas e sacculi. D. Rimuovere parte ventrale della capsula cranio contenente i labirinti.
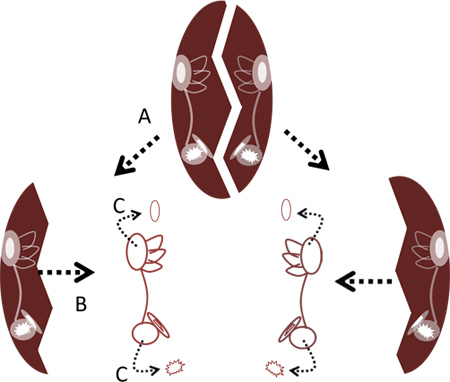
Figura 2. Rimozione di labirinti di capsula cranio. A. Crack a parte capsula cranio alla sua linea mediana. B. Rimuovere labirinti dalle ossa. C. Rimuovere le otoliti dalle lagenas e otricoli con una pinzetta.
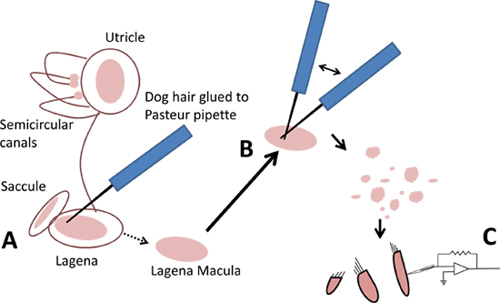
Figura 3. Isolamento di cellule ciliate di labirinti. A. Sollevare delicatamente fuori maculae con i capelli cane. B. Triturare macule con due peli di cane. C. Utilizzare cellule ciliate isolate per patch clamp.
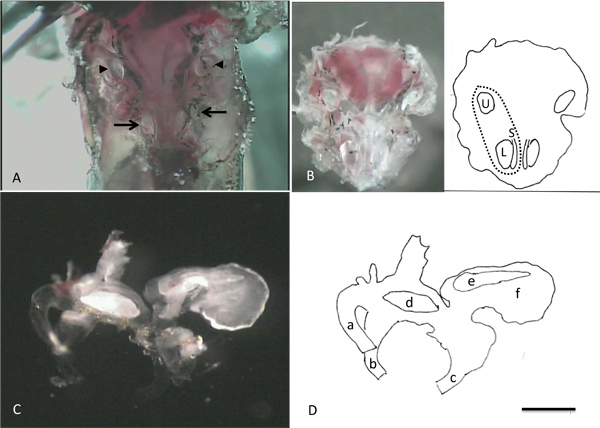
Immagini Figura 4. Presa durante passaggi l'isolamento di singole cellule. A. Dopo la rimozione del cervello, le otoliti associati alle due lagenas e sacculi (frecce) e otricoli (frecce) possono essere visualizzati. B. Dopo la rimozione del ventrale porzione della capsula cranio che contiene gli organi dell'orecchio interno dalla animale. Il fumetto nella parte destra di B identifica le posizioni della sinistra utricolo, lagena e sacculo. La linea tratteggiata indica la posizione approssimativa del labirinto sinistra. C. Labirinto destro (vista mediale) D: disegno del fumetto che illustra porzioni chiave del labirinto in C. a: semi anteriorecircolare canale, b: canale orizzontale, c: canale posteriore, d: utricolari otoliti, e: sacculare otoliti, f: lagenal otoliti. Barra della scala in D rappresenta 1 mm per A e B, 0,5 mm per C e D.

Figura 5 isolati, le cellule sane dal lagena illustra la diversità di morfologia; avo:. Cellule a forma di avocado; thn: lunghe, sottili cellule. Inserite un: gruppo di tre celle non completamente isolate; riquadro b: cellule morte, c riquadro: punta dell'elettrodo cerotto usato a registrazioni elettrofisiologiche di cellule ciliate zebrafish. Barra di scala = 20 micron si applica alla figura principale e tutti inserti.
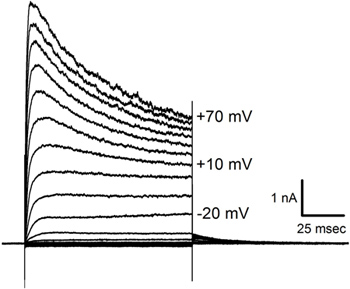
Correnti Figura 6. Registrati in una patch bloccato cella capelli. Risposte mediate in una cella (t similio avo 2 in Figura 5) per tre presentazioni di gradini di tensione applicati in incrementi di 10 mV da -140 mV a +70 mV da un potenziale di mantenimento di -70 mV. Nota la corrente di inattivazione che appare da più potenziali depolarizzata. Grandezze gradino di tensione sono indicati accanto ad alcune delle tracce.
Discussione
Un'attenta dissezione degli organi terminali e trattamento delicato delle cellule è critico per il successo di isolamento cellule sane capelli intatti e fisiologicamente attiva. Attenersi ai seguenti suggerimenti assicurare il successo:
- E 'più facile ottenere cellule sane da pesci più piccoli (2-2,5 cm di lunghezza). I pesci più grandi hanno molti più goccioline di grasso che oscura di visualizzazione durante il processo di dissezione.
- Bisogna fare attenzione quando si rimuove la otoliti, che si sovrappongono le cellule ciliate. Evitare di toccare le cellule quando afferrando le otoliti con una pinza.
- I migliori risultati si ottengono quando il maculae e cupulae sono sollevati in fogli e le cellule sgranato dall'epitelio.
- Troviamo l'uso di un capello cane per triturare cellule di essere superiore ad altri metodi, compreso l'utilizzo di ciglia umani 7 che non sono rastremate e meno flessibile.
- Durante patch di bloccaggio, l'applicazione di pressione positiva per tegli elettrodo che passa attraverso l'aria / soluzione interfaccia è importante per mantenere la punta pulita. Il rilascio della pressione positiva per consentire la cella di "saltare" sull'elettrodo è importante. Questo metodo cancella un piccolo volume di soluzione contenente amfotericina lontano dalla punta, aumentando così la probabilità di formare una tenuta gigaohm con la cella. Nei nostri esperimenti usiamo il perforato tecnica di registrazione cerotto al posto del più tradizionale configurazione whole-cell a causa della fragilità delle cellule. Il tentativo di "andare a cellula intera" si traduce spesso nella perdita del sigillo gigaohm.
Il metodo qui descritto produrrà centinaia di cellule dei capelli sani per animale. La tecnica può essere eseguita a temperatura ambiente e non richiede particolari attrezzature di là di un microscopio da dissezione. Un rapporto precedente JoVE descrive la dissezione dell'orecchio interno in zebrafish con un approccio ventrale 8. Questi autori dimostrano la diffuction di interi, paraformaldeide-fissi organi dell'orecchio interno. Invitiamo il lettore a guardare questo video per il confronto con i nostri metodi. Un vantaggio dei metodi presentati qui è l'ottenimento di cellule vive utili per le indagini fisiologiche. Oltre al loro uso negli esperimenti patch clamp per studiare i canali voltaggio-dipendenti (come qui mostrato) l'uso di queste cellule può essere esteso per studiare risonanza cella 9,10, monitor rilascio di neurotrasmettitore effettuando misurazioni di capacità 11,12, indagare neuromodulazione indotta da l'attivazione di canali ligando gated 13 e sfruttare la ricchezza di informazioni che possono essere raccolte da utilizzare mutanti che influenzano sia l'udito e l'equilibrio 14.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Finanziato dalla NSF (0.854.551).
Materiali
| Name | Company | Catalog Number | Comments |
| Soluzione Nome | Ricetta | ||
| (A) NZR (Normal Zebrafish Ringer) (in mM) | 116 NaCl, KCl 2, 2 CaCl 2, 3 Glucosio, 5 Na +-HEPES, pH 7,35. | ||
| (B) + NZR Tricaine | NZR + 0,02% 3-aminobenzoico solfonato estere etilico metano (Sigma A5040). | ||
| (C) NZR + BSA | NZR + 0,4% di sieroalbumina bovina (Sigma A2153). | ||
| (D) Locas (Low Ca 2 Soluzione +) (in mM) | 100 NaCl, KCl 2, CaCl 2 0,05, 0,05 MgCl 2, 3 Glucosio, 30 Na +-HEPES, pH 7,35. | ||
| (E) Locas + papaina | Locas + 0.05% L-cisteina (Sigma C1276) papaina + 0,2% (Sigma P3375). | ||
| (F) K +-soluzione interna (in mM) | 52 K 2 SO 4,38 KCl, 1 K +-EGTA, 5 K +-HEPES, pH 7,3. |
Tabella 1. Solutions.
Riferimenti
- Lewis, R. S., Hudspeth, A. J. Voltage- and ion-dependent conductances in solitary vertebrate hair cells. Nature. 304, 538-5341 (1983).
- Art, J. J., Fettiplace, R. Variation of membrane properties in hair cells isolated from the turtle cochlea. J. Physiol. 385, 207-242 (1987).
- Sugihara, I., Furukawa, T. Morphological and functional aspects of two different types of hair cells in the goldfish sacculus. J. Neurophysiol. 62, 1330-1343 (1989).
- Lee, S., Briklin, O., Hiel, H., Fuchs, P. Calcium-dependent inactivation of calcium channels in cochlear hair cells of the chicken. J. Physiol. 583, 909-922 (2007).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J. Gen. Physiol. 92, 145-159 (1988).
- Rae, J. R., Cooper, K., Gates, P., Watsky, M. Low access perforated patch recordings using amphotericin B. J. Neurosci. Meth. 37, 15-26 (1991).
- Lumpkin, E. A., Hudspeth, A. J. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc. Natl Acad. Sci. U.S.A. 92, 10297-10301 (1995).
- Liang, J., Burgess, S. M. Gross and fine dissection of inner ear sensory epithelia in adult zebrafish (Danio rerio). J. Vis Exp. 27, e1211 (2009).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage- and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 237-274 (1988).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 275-297 (1988).
- Parsons, T. D., Lenzi, D., Almer, W., Roberts, W. M. Calcium-triggered exocytosis in an isolated presynaptic cell: capacitance measurements in saccular hair cells. Neuron. 13, 875-883 (1994).
- Kim, M. -. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis Exp. 59, e3345 (2012).
- Housley, G. D., Ashmore, J. F. Direct measurement of the action of acetylcholine on isolated outer hair cells of the guinea pig cochlea. Proc. R. Soc. Lond. B. 244, 161-167 (1991).
- Nicolson, T. The genetics of hearing and balance in zebrafish. Ann. Rev. Genetics. 39, 9-22 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon