Method Article
Les enregistrements de patch-clamp en cellules ciliées de l'oreille Isolé du poisson zèbre
Dans cet article
Résumé
Le but de cette vidéo est de montrer les procédures d'obtention de cellules saines intactes cheveux des organes de l'oreille interne du poisson zèbre adulte, puis de les utiliser pour les études de patch-clamp visant à caractériser les propriétés biophysiques de leurs canaux voltage-dépendants.
Résumé
Analyses de patch-clamp des canaux voltage-dépendants dans des cellules ciliées sensorielles isolées d'une variété d'espèces ont été décrites précédemment 1-4, mais cette vidéo est la première application de ces techniques aux cellules ciliées de poisson zèbre. Ici, nous démontrons une méthode pour isoler les cellules saines intactes cheveux de toutes les oreille interne organes terminaux: saccule, lagena, utricule et les canaux semi-circulaires. De plus, nous démontrons la diversité de la taille et de la morphologie des cellules ciliées et de donner un exemple des types d'enregistrements de patch-clamp qui peuvent être obtenus. L'avantage de l'utilisation de ce système de modèle de poisson zèbre sur les autres découle de la disponibilité de mutants poisson-zèbre qui affectent à la fois l'audition et de l'équilibre. En combinaison avec l'utilisation de lignées transgéniques et d'autres techniques qui utilisent l'analyse génétique et la manipulation, l'isolement cellulaire et les méthodes électrophysiologiques présenté ici devrait faciliter une meilleure idée des rôles dans les cellules de cheveux préside dans la médiation de ces modalités sensorielles.
Protocole
1. Les préparatifs pré-expérimentales
- Préparez six solutions (voir le tableau 1 pour les compositions): (a) 100 ml NZR (normal poisson zèbre Ringer), (b) 50 ml NZR + tricaïne (MS222), (c) 10 ml NZR + BSA; (d) 100 Locas ml (faible solution de Ca 2 +), (e) 10 ml + Locas papaïne, (f) 100 ml K +-solution interne. Les solutions (a), (b), (d) et (f) peut être stocké pendant jusqu'à un mois à 4 ° C. Solutions (c) et (e) doit être préparée le jour de l'expérimentation. Toutes les solutions doivent être à température ambiante avant de commencer les expériences.
- Étiquette et remplir quatre boîtes de Pétri de 35 mm environ à mi-chemin avec des solutions (a), (c), (d) et (e).
- Faire un plat à dissection en remplissant une boîte de 60 mm de Pétri avec du Sylgard (Dow Corning, Midland, MI), puis en coupant une cavité dans ce qui permettra à un poisson de se tenir debout sans basculer.
- Préparer au moins deux outils d'isolement des cellules par collage à la fin d'un follicule de cheveux de chien à l'extrémité d'un verrePipette Pasteur avec de la colle, ce qui permet d'étendre les cheveux delà de l'extrémité de la pipette d'environ 0,5 cm. Les poils de fourrure douce comme des chiens Labrador Retrievers et Weimaraners bien fonctionner.
2. L'isolement de l'audition et un labyrinthe vestibulaire
- Sacrifier un poisson zèbre adulte par immersion dans un bécher contenant NZR + tricaïne. Contrôler visuellement les branchies jusqu'à ce que tous les mouvements operculaires ont cessé. Délai supplémentaire de dix minutes avant de retirer le poisson et le rinçage avec NZR frais. Ces procédures ont été approuvées par la protection des animaux institutionnel et l'utilisation comité (IACUC) de l'Université de Pepperdine, mais l'approbation doit être obtenue à partir de votre propre institution.
- Épingler le poisson à la dissection côté dorsal plat par l'insertion, une broche de couture droite standard (environ 2,5 cm de long) à travers chaque orbite et une troisième broche par l'axe dorso-ventrale environ un tiers à la moitié de la distance de la tête à la queue comme illustré dansFigure 1A.
- En vertu d'un zoom (0.62-5x) stéréo microscope de dissection équipé d'oculaires 10x, utilisez des ciseaux à ressort (Fine numéro de catalogue Outils scientifiques 15000-02) pour exposer le cerveau et un court segment de la moelle épinière en enlevant le toit du crâne à partir d'un point situé à environ 0,5 cm caudal au niveau des ouïes avant du nez du poisson. Couper la moelle épinière et le cerveau soulever avec une pince fine (Fine numéro de catalogue Outils scientifiques 11251-30) tout en réduisant les nerfs spinaux et autres accessoires, retirer et jeter le cerveau (figure 1B).
- La moitié ventrale de la capsule crâne qui reste forme une «cuvette» qui contient les organes d'oreille interne. Respecter les éminents, blanc, opaque otolithes dans les lagenas et sacculi situés symétriquement à l'extrémité caudale de chaque oreille interne et les otolithes utricule latéralement positionnées plus rostrale (figures 1C et 4A).
- Retirer le bol de l'os en coupant toutes attachmen ventrales et latéralests tout en le soulevant doucement de la tête avec une pince fine. Placez-le dans la boîte de Pétri contenant Locas (1D figures et 4B).
- L'utilisation de deux paires de pinces fines, se fissurer à part le bol à sa ligne médiane soit par l'accaparement des bords latéraux de l'os et les tirant ou encore, en séparant les moitiés droite et gauche en insérant les points de la pince dans le centre et soulevant les moitiés de l'autre. Retirez les deux labyrinthes de l'os à l'aide de pinces fines (figure 2).
- Inspectez les labyrinthes d'identifier le auditives et vestibulaires organes terminaux: les canaux semi-circulaires, utricules, sacculi et lagenas (figure 4C). Les zones rosées sous chaque otolithe sont des macules contenant les cellules ciliées. De même, une bande de rose à l'intérieur des ampoules des canaux semi-circulaires identifie la cupule où les cellules ciliées sont situés.
- Retirez délicatement les otolithes de l'utricule et lagena à l'aide des pinces fines ( Figures 2 et 4C). Il n'est pas nécessaire de retirer les otolithes du saccule, car cela pourrait endommager les cellules ciliées sacculaires.
3. Isolement cellulaire cheveux
- En utilisant une pipette de transfert en plastique (nombre Fisher Scientific catalogue 13-711, 9 heures), déplacer les organes d'extrémité de la capsule contenant Locas + papaïne minimiser le volume de fluide transféré.
- Incuber ces structures dans cette solution pendant 30 minutes à température ambiante.
- A la fin de la période d'incubation, de déplacer les structures dans le plat contenant NZR + BSA et incuber dans cette solution pendant au moins trente minutes. Les cellules ciliées restera dans cette solution pendant un maximum de quatre heures, mais va se détériorer au bout de 1-2 heures après l'isolement (voir les prochaines étapes).
- En préparation pour l'isolement cellulaire, déplacez l'un des organes de bout-en le plat contenant NZR.
- Pour les lagenas et utricules, utilisez un poil de chien pour soulever doucement les draps macules-épithéliale de ti roséquest ce que contiennent les cellules ciliées (figure 3A). La macula peut être évidé (en utilisant un poil de chien) sous les otolithes de la sacculi, et le cupules de leur emplacement à l'intérieur des ampoules des canaux semi-circulaires.
- À l'aide de deux outils d'isolement des cellules préparées dans l'étape 1,4, triturer une cupule macula ou pour générer un champ de débris contenant les cellules ciliées (figure 3B). Laisser les cellules au moins cinq minutes pour régler sur le fond du plat avant de le déplacer.
- Déplacer l'antenne vers le platine d'un microscope inversé équipé d'une optique à contraste de phase. Respecter les cellules sous un grossissement de 40X et notez la diversité morphologique. De nombreuses cellules sont d'avocat en forme tandis que d'autres sont longs et minces. La présence de faisceaux de poils apicaux les identifie comme des cellules ciliées et la phase luminosité assure leur santé. Photomicrographies de cellules ciliées isolées sont présentés dans la figure 5.
4. Patch de serrage cellules ciliées de poisson-zèbre
- En préparation pour perfoPatch nominale 5,6 enregistrements, préparer l'amphotéricine solution contenant interne comme suit: lieu de 5 mg d'amphotéricine B (Sigma A4888) dans un tube de 1,5 ml et remplir avec 100 ul de DMSO. Immédiatement vortex cette solution pendant 10-20 secondes jusqu'à ce que tout l'amphotéricine est dissoute. Puis, une pipette 625 ul K +-solution interne dans un tube de seconde. Ajouter 10 ul de la solution d'amphotéricine au K +-solution et vortex interne comme ci-dessus. La solution d'amphotéricine actions durera plusieurs heures, mais jetez la solution finale après une heure.
- Fabriquer pipettes de patch de BF verre borosilicate 150-86-10 (Sutter Instruments) à l'aide d'un extracteur à étages multiples (Sutter P-1000). Pipettes aurait dû faire pencher diamètres d'environ 2 microns et ont des résistances de 1-3 MQ avec les solutions dans le tableau 1. Les paramètres de l'extracteur qui fonctionnent bien sont les suivantes: Chaleur = Rampe minus10, Pull = 0, vitesse = 18, Delay = 1, Pression = 600. La forme desla pointe d'une pipette bonne est évident à partir de la photographie dans le c encart de la figure 5. Blunt "balle" en forme de pipettes sont préférés car ils offrent le moins de résistance lors de l'accès des enregistrements électrophysiologiques.
- Utilisez une aiguille de calibre 28 seringue Microfil (MF28G-5; World Precision Instruments) pour remplir une électrode d'enregistrement à moitié avec de l'amphotéricine K contenant interne +-solution.
- Apposer l'électrode à la headstage d'un amplificateur de patch-clamp. Appliquer -10 mV, 10 ms échelons de tension à 10 Hz et à maintenir une pression positive dans l'électrode tel qu'il est manoeuvré par l'interface air / solution et vers le bas au fond de la cuvette d'enregistrement à proximité des cellules.
- Placez l'électrode perpendiculairement à une cellule saine. Lorsque l'électrode est assez près de la cellule pour qu'elle commence s'éloigner de la solution à fluide, inverser rapidement la pression, en appliquant un léger vide à l'électrode de la cellule jusqu'à ce que «saute» sur elle. Cesser immédiatement d'aspiration sur ee électrode et appliquer un potentiel de maintien de -70 mV à l'intérieur de l'électrode. En quelques secondes, un joint gigaohm se former.
- Respecter les transitoires capacitifs actuels au début et la fin des mesures de tension qui apparaissent peu de temps après la formation du joint. Continuer à surveiller la perforation de la membrane sous l'électrode par l'amphotéricine en observant que les transitoires ampleur croissante de leur taille maximale (en environ dix minutes).
- Pour confirmer la mise en place de la cellule entière (perforée) de configuration dans une cellule saine, susciter des courants K + vers l'extérieur en appliquant l'hyperpolarisation et dépolarisation des mesures de tension. La plupart des cellules de cheveux ont éminents courants sortants (voir figure 6).
5. Les résultats représentatifs
La figure 4 montre des images prises pendant les étapes d'isolement cellulaire. Dans la partie A, les otolithes sont associés aux lagenas, saccluli et utricules peut être vu Through la couche mince de l'os qui les recouvre. Ces structures opaques fournir des points de repère pratiques pour aider à l'élimination sûre des organes terminaux de l'animal au cours des étapes ultérieures de la dissection. Le panneau B montre la «cuvette» de l'os qui contient les labyrinthes intacts et les otolithes de premier plan dans les utricules, lagenas et sacculi. Panneau C montre un labyrinthe qui a été retirée de l'os. Notez l'otolithe grande avec le bord festonné dans le lagena, l'otolithe en forme de glaçon dans le saccule et l'otolithe en forme de haricot dans l'utricule. Une partie de la diversité de la taille et de la morphologie observée dans les cellules isolées à partir de la lagena est illustré à la figure 5. Une cellule saine est facilement identifié comme étant la phase lumineuse avec un périmètre pointu. Formes cellulaires peuvent être divisés en deux classes: l'avocat en forme (avo) et longue et mince (THN), bien que la taille des cellules au sein de chaque groupe peuvent varier considérablement (comparer par exemple avo 1 et avo 3). Encart montre un groupe detrois cellules qui n'ont pas été complètement isolés les uns des autres. La couleur noire et d'aspect granuleux de la cellule b encadré identifie aisément cette cellule comme mort. C encart montre la pointe d'une pipette de patch illustrant la forme et les dimensions appropriées pour l'enregistrement de ces cellules.
Les traces de courant illustré à la figure 6 ont été obtenues en réponse à l'hyperpolarisation et dépolarisation étapes de potentiel imposé sur une cellule lagena similaire à la avo 2 représenté sur la figure 5. Les réponses actuelles dans les cellules de différentes tailles et formes peuvent varier considérablement suggérant la diversité de l'effectif des canaux voltage-dépendants.
Figures 1-3: Dessins animés illustrant des étapes dans l'isolement des cellules ciliées.
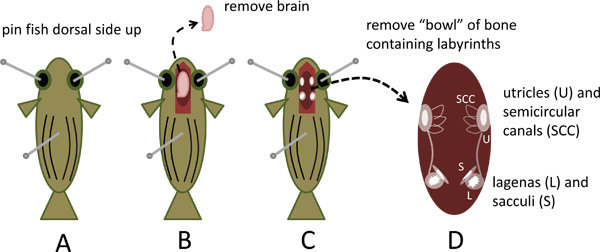
Figure 1. Suppression de la capsu crânele contenant dans les labyrinthes de l'oreille interne du poisson zèbre. A. Broche sacrifié poisson zèbre face dorsale jusqu'à disséquer plat. B. Crâne ouvert, retirez et jetez le cerveau. C. Respecter les otolithes dans utricules, lagenas et sacculi. D. Retirer la partie ventrale de la capsule contenant les labyrinthes du crâne.
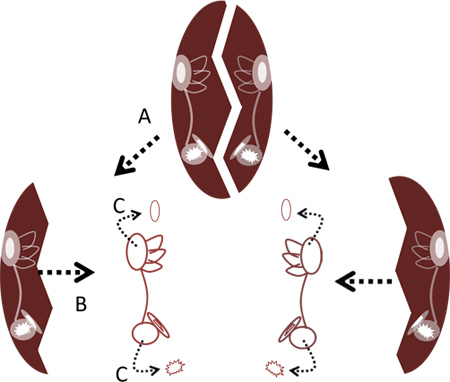
Figure 2. Suppression des labyrinthes de capsule crâne. A. Crack part capsule crâne à sa ligne médiane. B. Retirer les labyrinthes de l'os. C. Retirer les otolithes des lagenas et utricules à la pince.
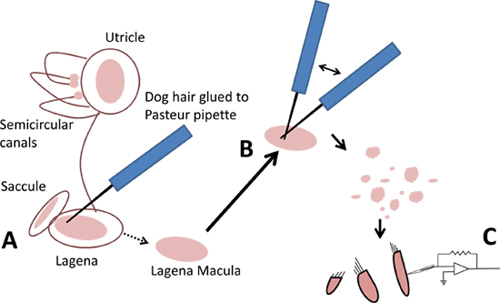
Figure 3. Isolement des cellules ciliées de labyrinthes. A. Soulevez doucement hors maculae avec un poil de chien. B. Triturer avec deux macules poils de chien. C. Utilisation des cellules ciliées isolées pour patch-clamp.
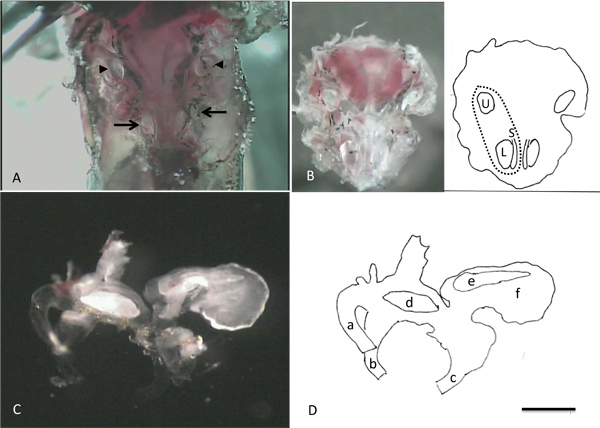
Images Figure 4. Prise au cours des étapes de l'isolement des cellules individuelles. A. Après l'élimination du cerveau, les otolithes sont associés aux deux lagenas et sacculi (flèches) et utricules (pointes de flèches) peuvent être visualisées. B. Après le retrait de la face ventrale partie de la capsule crâne qui contient les organes de l'oreille interne de l'animal. La bande dessinée dans la moitié droite de B identifie les emplacements de l'utricule gauche, lagena et le saccule. La ligne en pointillé indique la position approximative du labyrinthe gauche. C. Labyrinthe à droite (vue médiale) D: Cartoon dessin illustrant des parties importantes de labyrinthe dans C. a: demi antérieurecirculaire canal, b: canal horizontal, c: canal postérieur, d: utriculaire otolithes, e: otolithe sacculaire, f: lagenal otolithes. La barre d'échelle dans D représente 1 mm pour A et B, 0,5 mm pour C et D.

Figure 5 isolées, les cellules saines de la lagena illustrant la diversité de la morphologie; avo:. Avocat des cellules de forme; thn: longues, des cellules minces. Insérez un: groupe de trois cellules incomplètement isolés; encart b: cellule morte; c médaillon: la pointe de l'électrode de patch utilisé dans des enregistrements électrophysiologiques de cellules ciliées de poisson zèbre. Barre d'échelle = 20 um s'applique à la figure principale et tous les encarts.
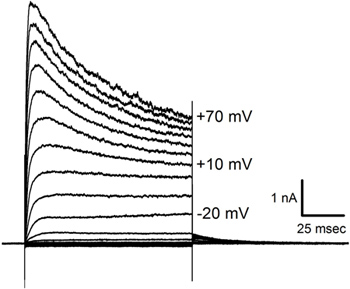
Courants Figure 6. Enregistrées dans un patch serré cellules ciliées. Réponses moyennées dans une cellule (t similaireso avo 2 sur la figure 5) à trois présentations de mesures de tension appliquées par incréments de 10 mV de -140 mV à +70 mV à un potentiel de maintien de -70 mV. Notez le courant inactivation qui apparaît à des potentiels plus dépolarisées. Grandeurs échelon de tension sont indiquées à côté de quelques-unes des traces.
Discussion
Dissection minutieuse des organes cibles et le traitement en douceur des cellules est essentielle à la réussite de l'isolement sains, les cellules ciliées intactes et physiologiquement active. En respectant les conseils suivants vous assurer le succès:
- Il est plus facile d'obtenir des cellules saines de poissons de petite taille (2-2,5 cm de longueur). Les gros poissons ont beaucoup plus de matières grasses que les gouttelettes de visualisation obscure pendant le processus de dissection.
- Des précautions doivent être prises lors du retrait des otolithes, qui recouvrent les cellules ciliées. Evitez de toucher les cellules lors de l'acquisition des otolithes avec des pinces.
- Les meilleurs résultats sont obtenus lorsque la macula et cupules sont soulevées comme des feuilles triturées et les cellules de l'épithélium.
- On retrouve l'utilisation d'un poil de chien de triturer les cellules pour être supérieure aux autres méthodes, y compris en utilisant des cils humains 7 qui ne sont pas aussi effilée et moins souple.
- Au cours de patch-clamp, l'application d'une pression positive à til électrode lors de son passage à travers l'interface air / solution est important de garder à l'extrémité propre. La libération de la pression positive afin de permettre à la cellule de «sauter» sur l'électrode est également importante. Ce procédé autorise un faible volume de la solution contenant l'amphotéricine distance de la pointe, ce qui augmente la probabilité de formation d'un joint d'étanchéité gigaohm avec la cellule. Dans nos expériences, nous utilisons la technique du patch perforé d'enregistrement au lieu de la traditionnelle configuration cellule entière en raison de la fragilité des cellules. Tentative d '«aller cellule entière" se traduit souvent par la perte de l'étanchéité gigaohm.
La méthode décrite ici donnera des centaines de cellules des cheveux sains par animal. La technique peut être réalisée à température ambiante et ne nécessite aucun équipement spécial au-delà d'un microscope à dissection. Un rapport précédent de JoVE décrit la dissection de l'oreille interne chez le poisson zèbre en utilisant une approche ventrale 8. Ces auteurs démontrent le dissection des entiers, des organes fixes paraformaldéhyde l'oreille interne. Nous encourageons le lecteur à regarder cette vidéo de comparaison avec nos méthodes. Un avantage des méthodes présentées ici est l'obtention de cellules vivantes utiles pour les enquêtes physiologiques. Outre leur utilisation dans des expériences de patch-clamp pour étudier les canaux voltage-dépendants (comme illustré ici) l'utilisation de ces cellules peut être prolongée pour étudier 9,10 résonance cellulaire, la libération des neurotransmetteurs moniteur en effectuant des mesures de capacitance 11,12, enquêter sur la neuromodulation induite par l'activation des canaux dépendants du ligand 13 ainsi qu'à puiser dans la richesse des informations qui peuvent être tirées de l'utilisation de mutants qui affectent à la fois l'audition et de l'équilibre 14.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Financé par la NSF (0854551).
matériels
| Name | Company | Catalog Number | Comments |
| Nom de solution | Recette | ||
| (A) NZR (Normal Zebrafish Ringer) (en mM) | 116 NaCl, 2 KCl, CaCl 2 2, 3 glucose, 5 Na +-HEPES, pH 7,35. | ||
| (B) NZR + tricaïne | NZR + 0,02% acide 3-aminobenzoïque d'éthyle méthane sulfonate ester (Sigma A5040). | ||
| (C) NZR + BSA | NZR + 0,4% albumine de sérum bovin (Sigma A2153). | ||
| (D) Locas (Low Ca 2 Solution +) (en mM) | NaCl 100, 2 KCl, 0,05 CaCl 2, 0,05 MgCl 2, 3 Glucose, 30 Na +-HEPES, pH 7,35. | ||
| (E) Locas + papaïne | Locas + 0,05% de L-cystéine (Sigma c1276) papaïne + 0,2% (Sigma P3375). | ||
| (F) K +-solution interne (en mM) | 52 K 2 SO 4,38 KCl, 1 K +-EGTA, 5 K +-HEPES, pH 7,3. |
Tableau 1. Solutions.
Références
- Lewis, R. S., Hudspeth, A. J. Voltage- and ion-dependent conductances in solitary vertebrate hair cells. Nature. 304, 538-5341 (1983).
- Art, J. J., Fettiplace, R. Variation of membrane properties in hair cells isolated from the turtle cochlea. J. Physiol. 385, 207-242 (1987).
- Sugihara, I., Furukawa, T. Morphological and functional aspects of two different types of hair cells in the goldfish sacculus. J. Neurophysiol. 62, 1330-1343 (1989).
- Lee, S., Briklin, O., Hiel, H., Fuchs, P. Calcium-dependent inactivation of calcium channels in cochlear hair cells of the chicken. J. Physiol. 583, 909-922 (2007).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J. Gen. Physiol. 92, 145-159 (1988).
- Rae, J. R., Cooper, K., Gates, P., Watsky, M. Low access perforated patch recordings using amphotericin B. J. Neurosci. Meth. 37, 15-26 (1991).
- Lumpkin, E. A., Hudspeth, A. J. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc. Natl Acad. Sci. U.S.A. 92, 10297-10301 (1995).
- Liang, J., Burgess, S. M. Gross and fine dissection of inner ear sensory epithelia in adult zebrafish (Danio rerio). J. Vis Exp. 27, e1211 (2009).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage- and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 237-274 (1988).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 275-297 (1988).
- Parsons, T. D., Lenzi, D., Almer, W., Roberts, W. M. Calcium-triggered exocytosis in an isolated presynaptic cell: capacitance measurements in saccular hair cells. Neuron. 13, 875-883 (1994).
- Kim, M. -. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis Exp. 59, e3345 (2012).
- Housley, G. D., Ashmore, J. F. Direct measurement of the action of acetylcholine on isolated outer hair cells of the guinea pig cochlea. Proc. R. Soc. Lond. B. 244, 161-167 (1991).
- Nicolson, T. The genetics of hearing and balance in zebrafish. Ann. Rev. Genetics. 39, 9-22 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon