Method Article
Antígeno Artificial célula presentadora (AAPC) La activación mediada y expansión de linfocitos T citolíticos naturales
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí se describe un método para activar y expandir las células NKT de granel poblaciones de células T usando células artificiales presentadoras de antígenos (AAPC). El uso de CD1d basado AAPC proporciona un método estandarizado para la generación de un número elevado de células NKT funcionales.
Resumen
T asesinas naturales (NKT) las células son un subconjunto único de células T que muestran marcadores característicos de tanto natural killer (NK) y células T 1. A diferencia de las células T clásicas, las células NKT reconocer antígeno lipídico en el contexto de las moléculas CD1 2. Las células NKT expresan un reordenamiento de la cadena invariante TCRα: Vα14Jα18 en ratones y en seres humanos Vα24Jα18, que se asocia con cadenas de Vβ limitada diversidad 3-6, y se conocen como canónicas o invariante NKT (i NKT) células. Similar a las células T convencionales, las células NKT se desarrollan a partir CD4-CD8-tímicos células precursoras T después de la señalización apropiada por CD1d 7. El potencial para utilizar las células NKT con fines terapéuticos ha aumentado significativamente con la capacidad de estimular y expandir las células NKT humanos con α-galactosilceramida (α-GalCer) y una variedad de citoquinas 8. Es importante destacar que estas células conservan su phenotyp originalese, citocinas secretadas, y la función muestra citotóxica contra líneas de células tumorales. Así, expandidas ex vivo células NKT permanecer funcionales y se puede utilizar para la inmunoterapia adoptiva. Sin embargo, basado en célula NKT-inmunoterapia ha sido limitado por el uso de células autólogas presentadoras de antígeno y la cantidad y calidad de estas células estimuladoras puede variar sustancialmente. DC derivadas de monocitos de pacientes con cáncer se ha informado que expresan niveles reducidos de moléculas coestimuladoras y producen citoquinas inflamatorias menos 9,10. De hecho, en lugar de DC murino APC autólogas se han utilizado para probar la función de las células NKT de pacientes con LMC 11. Sin embargo, este sistema sólo puede ser utilizado para los ensayos in vitro ya que las células NKT no puede ser expandido en DC murina y entonces se utiliza para la inmunoterapia adoptiva. Por lo tanto, un sistema normalizado que se basa en células de antígeno artificiales Presentación (AAPC), podría producir los efectos estimulantes de DC sin los inconvenientes de alo o xenogénica cells 12, 13. En este documento, se describe un método para generar CD1d basado AAPC. Dado que el compromiso del receptor de células T (TCR) por los complejos antígeno-CD1d es un requisito fundamental de la activación de las células NKT, antígeno: CD1d-Ig complejos proporcionan un método fiable para aislar, activar y expandir las poblaciones de células efectoras NKT.
Protocolo
1. Generación de AAPC
- Antes de añadir proteínas a los granos, preparar todos los reactivos y tampones: tampón borato 0,1 M, 1x D-PBS (sin Ca 2 + y Mg 2 +); Buffer bolas de lavado (1X PBS 5% de suero humano AB + azida sódica al 0,02%) ; medio completo (medio RPMI 100 mM de piruvato de sodio, 10 mM no esencial solución de vitaminas, 100 mM de solución de vitamina MEM, 1% de 2-mercaptoetanol, 10 mM ciprofloxacina, 5% de suero humano AB); tampón de MACS (1 L PBS libre de Ca 2 + y Mg 2 +, 5 g de BSA, y 2 mmol EDTA).
- Enjuague 1 ml Dynabeads M-450 perlas de epoxi con 3 ml de tampón estéril 0,1 M de borato (ácido bórico y agua, pH 7,0 a 7,4) en un vial de 5 ml de vidrio claro de borosilicato roscado.
- En otro tubo de microcentrífuga de 1,5 ml, añadir 100 g hCD1d Ig-dímero y 20 moléculas coestimuladoras microgramos (ejemplo: anti-CD28mAb) a 1 ml de PBS w / o Ca 2 + o Mg 2 +.
- Colocar cordón vial de vidrio que contiene el imán y el tampón borato aspirado de cuentas. Agregue la mezcla de proteína de 1,2 a paso vial de vidrio y coloque la tapa. Mezclar inmediatamente por inversión del vial, cubra la tapa con parafilm, y el lugar en un mezclador y se incuban durante la noche a 4 ° C.
- El día siguiente, vial de vidrio en lugar del imán y eliminar mezcla de proteínas, evitando cuidadosamente perlas. Lavar las perlas mediante la adición de 3 ml de bolas de tampón de lavado (PBS con 5% de suero AB 0,02% de azida sódica), e incubando a 4 ° C en un agitador rotatorio durante 5 min. Repita dos veces.
- Perlas se pueden almacenar en esta mezcla de lavado de perlas. Para hacer AAPC funcional, quitar una pequeña parte alícuota y contar las perlas usando un hemocitómetro. Comprobar que las proteínas se cargan de forma estable sobre las perlas por tinción con anticuerpos (por ejemplo, PE-conjugado anti-IgG1 de ratón) y la realización de análisis de citometría de flujo.
- Para cargar perlas con antígeno, quitar 5 x 10 7 perlas, y agregar a un pequeño vial de vidrio de 1,5 ml, enjuague perlas con 1 ml de PBS estéril. Resuspend lavado bolas con 1 ml de PBS estéril y añadir antígeno; ejemplo: Carga con α-GalCer/KRN7000 (5mg/ml). * Nota: Si bien, no hemos detectado ningún problema con solubilidad en lípidos o la formación de micelas, los lípidos deben ser manejados de acuerdo con las recomendaciones del fabricante. Específicamente, KRN7000 se reconstituyó en DMSO (1mg/ml) para estos estudios. KRN7000 y otros antígenos glicolípidos también se puede disolver en 0,2 mg / ml de PBS que contenía 0,5% de Tween-20 (sonicar 2 hr. A 37 ° C). IMPORTANTE-La AAPC necesitan ser cargados durante al menos 48-72 horas antes de su uso.
2. Aislamiento de CD161 + CD3 + células
- Recoger las células mononucleares de sangre periférica (PBMC). Para la separación de densidad de Ficoll centrifugación en gradiente de linfocitos procedentes de un paquete de la capa leucocitaria o leucoféresis, primero diluir sangre heparinizada con un volumen igual de 1X PBS a temperatura ambiente.
- Añadir 15 ml de Ficoll (calentó a temperatura ambiente) a tubos de 50 ml cónicos. Poco a poco superposición25 ml de la mezcla de sangre diluida en la parte superior de la Ficoll. Centrifugar a 2.000 rpm durante 30 min a temperatura ambiente con el freno quitado.
- Retire con cuidado la interfaz de linfocitos (anillo blanco entre los medios de comunicación y Ficoll) con una pipeta Pasteur y transferirlos a un nuevo tubo de 50 ml cónico.
- Lavar las células llenando el tubo de 50 ml con PBS y centrifugar a 1.500 rpm durante 5 min. Eliminar el sobrenadante y se combinan los tubos de un solo individuo a un solo tubo y lavar las células mononucleares de sangre periférica (PBMC) de nuevo con 20 ml de PBS. Luego, cuente las CMSP y volver a suspender a una concentración de 5 x 10 7 células / ml en tampón de MACS (1 l de PBS libre de Ca 2 + y Mg 2 +, 5 mmol g de BSA, y EDTA 2).
- Con el fin de aislar la fracción de células T, comenzar con 2 ml de PBMC (10 8 células) y añadir 100 ml de solución Pan enriquecimiento de células T del Kit de EasySep humano Enriquecimiento T Cell. Incubar a temperatura ambiente durante 10 min.
- Añadir 100 l de partículas magnéticas a la solución y se incuba a temperatura ambiente durante otros 10 min. Llevar el volumen final de disolvente de 2,5 ml y colocar el tubo en el imán púrpura por 5 min. Rápidamente verter el CD3 + fracción en un tubo cónico de 15 ml.
- Lavar las células mediante la adición de 5 ml de tampón de MACS frío, contar el número de células viables, y una alícuota para la tinción de FACS.
- Para seleccionar las células CD161 +, primero se resuspenden las células T enriquecidas en 980 l de hielo frío tampón de MACS, añadir 10 g mAb anti-CD161, e incubar en la nevera durante 10 min.
- Centrifugar las células a 1.500 rpm a 4 ° C durante 5 min. Entonces reconstituir el sedimento celular en 800 l de tampón de MACS. Añadir 200 l de anti-IgG1 de ratón y microperlas de incubar la solución durante 10 min a 4 ° C.
- Durante esta etapa de incubación, equilibrar una columna LS mediante la adición de 3 ml de tampón MACS.
- A continuación, se lavan las células por centrifugación de 1.500 rpm a 4 ° C durante 5 min. Resupasar las células en 3 ml de tampón MACS. Entonces pipetear las células en la columna LS MACS separación. Asegúrese de evitar la generación de burbujas pipeteando lentamente. Lavar la columna mediante la adición de 3 ml de tampón de MACS. Repita dos veces.
- Añadir 3 ml de tampón MACS fresco y eliminar la columna de imán. Colocar la columna en un tubo cónico de 15 ml. Inserte el émbolo y empujar contenido para obtener purificados CD161 + CD3 + células. Recuento de células NKT enriquecido fracción. Usted debe tener 2-4 millones de células.
3. AAPC mediada por la expansión de células NKT
- Configurar el co-cultivo mediante la adición de 10 6 enriquecidos CD161 + CD3 + células T y 10 AAPC 6 en 16 ml de medio completo (medio completo + IL-2, 100 U / ml). Placa de esta mezcla por adición de 160 l / pocillo volumen final de 96 pocillos a un cultivo de tejidos de poliestireno tratada, placa de fondo en U con tapa baja evaporación. Realizar cambio de medio cada día 7 th mediante la adición de 80 l de medio fresco.
- Cosechacélulas, contar y realizar la tinción FACS en el día 12-14.
- Los expandidas células NKT se puede replated como se describe anteriormente en el paso 3,1, específicamente resuspender 10 6 células T expandidas y 10 AAPC 6 en 16 ml de medio completo. Placa de esta mezcla mediante la adición de 160 l / pocillo a una U de 96 pocillos de la placa inferior. Continuar para actualizar medio de cocultivo cada día 7 th mediante la adición de 80 l de medio fresco.
- Lo mejor es congelar las células NKT adicionales después de la segunda ronda de expansión (1 x10 6 / criovial en 1 ml-5% de DMSO / 95% de FBS.)
4. Prueba funcional: AAPC mediada por la estimulación de las células NKT
- Configurar 5x10 4 células NKT / pocillo con 5x10 5 AAPC en 200 l de volumen final (medio completo) en U de 96 pocillos de la placa inferior.
- Harvest sobrenadante de cultivo celular para ELISA después de 24-48 horas.
Resultados
Aquí se describe un método para generar CD1d-Ig basado AAPC, mediante acoplamiento covalente de CD1d-Ig y mAb anti-CD28 a perlas magnéticas para estimular las células NKT como un método estandarizado para la propagación de las células NKT (Figura 1). Primero, uno debe demostrar que las proteínas de fusión de Ig-CD1d son establemente inmovilizado sobre la superficie de las perlas magnéticas. Como se muestra en la Figura 2A, CD1d Ig-y anti-CD28 anticuerpos fueron ambas expresadas en la superficie de las perlas magnéticas. Para examinar la capacidad estimulante de la AAPC, nosotros los co-cultivos de hibridomas de células NKT con AAPC sobrenadantes cosechados durante la noche, la cultura y mide la IL-2 por ELISA. Se encontró que el CD1d-Ig basado AAPC fueron capaces de estimular los hibridomas de células NKT en niveles iguales o superiores a sus homólogos celulares (Figura 3, no se muestran datos). Curiosamente, hemos encontrado que nuestros ratón hibridomas de células NKT se estimulan por CD1d humano basado AAPC (Figura 2B), que proporciona un método simple para probar cada lote de AAPC.
Continuación, se trató de demostrar el potencial de propagación de AAPC, las células T tanto humanos fueron aisladas de la sangre periférica. En primer lugar el CD161 + CD3 + fracción de células T fue enriquecido por la separación de esferas magnéticas. Entonces, las células T fueron estimulados cada dos semanas con α-GalCer-cargado AAPC. Es importante destacar, encontramos que incluso con una relativamente baja población inicial de células NKT (0,03%), hemos sido capaces de expandir las células a ~ 67% Vα24 Vβ11 + + (Figura 3). Hemos ampliado las células NKT de la PBMC de muchos voluntarios sanos y pacientes de cáncer y han encontrado que la α-GalCer cargado AAPC fueron capaces de ampliar la población de células NKT en ambos grupos. En particular, el ritmo de expansión fue altamente dependientes del donante. Como se esperaba la mayor de la población inicial de células Vα24 +, mayor es el porcentaje de expansión. Además,cuando se utiliza una población inicial de 2 millones de células CD161 + células T CD3 +, se puede obtener> 10 7 células después de dos rondas de expansión (Tabla 1). Aproximadamente el 80-90% de las ampliadas células NKT son CD4 +, ~ 5% CD8 +, y el resto son presumiblemente CD4-CD8-dobles negativos células NKT. Estos expandidas células NKT se puede utilizar para los estudios funcionales, como se muestra en la Figura 4A-C. Hemos encontrado que nuestro ex vivo ampliado las células NKT de responder a los α-GalCer estimulación y son productores potentes de la IL-17A, TNF α-, y IFN-γ. Cabe señalar que si la población inicial de células T enriquecimiento es bajo y uno es incapaz de realizar la segunda etapa de enriquecimiento CD161, la expansión AAPC mediada por no dar los resultados esperados (véase la Figura 4D, Donante 1). Sin embargo, si el porcentaje de células en circulación NKT es superior a 0,1%, todavía debe ser capaz de obtener una expansión significativai de las células NKT. Colectivamente, estos datos demuestran que CD1d basado AAPC se puede utilizar para ampliar eficazmente y estimular las células NKT humanas primarias.

Figura 1. Diagrama esquemático de CD1d: Ig basados aAPCs porciones extracelulares de la molécula CD1d se fusionan a la región constante de una cadena pesada de inmunoglobulina proteína separados por un enlazador de aminoácidos corta. Estas moléculas se pueden cargar fácilmente con antígenos lipídicos, tales como α-GalCer, simplemente mediante su incubación con un exceso de los lípidos de interés. AAPC se hicieron mediante el acoplamiento de CD1d-Ig y Abs anti-CD a perlas magnéticas. En este sistema, CD1d-Ig se utiliza para proporcionar el cognado específica de antígeno a través de la señal de TCR y anti-CD28 mAb proporciona la señal coestimuladora.

Figura 2. . Tinción FACS de proteínas de superficie sobre aAPCs A aAPCs) se ensayaron para la presencia de CD1d: IgG dímero (a través de la tinción con PE-conjugado anti-ratón IgG1) así como el anticuerpo anti-CD28 (utilizando conjugado con FITC anti-ratón IgG2a) . histogramas abiertos indican control de isotipo; histogramas rellenos representan los anticuerpos indicados. CD1d-Ig Expresando AAPC puede estimular la producción de IL-2 por las células NKT. B) El Vα14 + NKT de ratón de células de hibridoma, DN32.D3, se co-cultivaron con medio, antígeno soluble (α-GalCer), descargada AAPC o AAPC α-GalCer-cargado. Los sobrenadantes de cultivo se recogieron y estándar ELISA de tipo sándwich se utilizó para medir la producción de IL-2.

Figura 3. La expansión de las células NKT por CD1d-Ig células recubiertas de antígeno artificiales que presentan. (A) primaria CD3 + CD161 + células doble positivas se aislaron a partir de PBMCs utilizando separación magnética. Las células clasificadas se estimularon con α-GalCer cargado, CD1d-Ig AAPC recubierto durante 14 días. Las células se tiñeron para Vα24 y Vβ11 estimulación AAPC siguiente. (B) células NKT humanas primarias mediada lisis de una línea celular de linfoma B. C1R-CD1d células incubadas con células NKT en las relaciones indicadas en la presencia o ausencia de antígeno, un GalCer-(100 ng / ml) en 96-así placas de fondo en U de 20-24 h. Células NKT lisis celular mediada se evaluó por norma por ensayo de liberación de 51Cr.
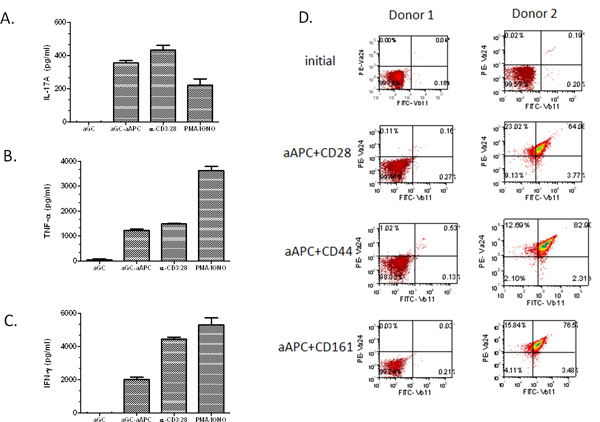
Figura 4. Perfiles de citoquinas de AAPC-expandidas células NKT. Después de la estimulación con α GalCer cargado AAPC durante dos semanas, las células NKT expandidas (1 x 10 5 / así) se co-cultivaron con α-soluble GalCer, PMA / ionomicina, microperlas anti-CD3/28 o α-GalCer AAPC cargado (2 x 10 5 / pocillo) durante 48 hr. (A) IL-17A, (B) de TNF-α, y (C) IFN-γ se midió la producción de citocinas por ELISA estándar. Los datos mostrados son la producción de citoquinas neta después de restar los controles negativos (medios de comunicación y perlas vacías). (D) las células T primarias fueron aisladas a partir de PBMC utilizando la separación de esferas magnéticas. Las células clasificadas se estimularon por dos semanas con la indicación de un-GalCer cargado-AAPC. Las células se tiñeron utilizando Abs específicos para Vα24 + y + Vβ11 y se analizaron por citometría de flujo.
Discusión
AAPC puede ser usado para estudiar los requisitos básicos para la activación de las células NKT y que tiene un valor clínico potencial para la expansión ex vivo de células T NK para la inmunoterapia adoptiva. Mescher et al. Describe uno de los primeros sistemas basados en el talón, donde la clase I del MHC murino biotinilado-péptido-constructos individuales de la cadena se combinaron con moléculas coestimuladoras biotinilados B7.1 y B7.2 través de la estreptavidina a la superficie de microesferas de látex 14, 15. Este enfoque ha sido utilizado con éxito para estimular antígenos específicos de células T de ratones transgénicos. Además, dado que este método utiliza una sola cadena de MHC-péptido para asegurar una carga homogénea de las moléculas del MHC, cada antígeno de péptido diana requeriría una nueva transfección para la expresión de la deseada cadena única MHC-péptido, por lo tanto limitar la generalidad de la enfoque. Es importante destacar que el grupo del Dr. Schneck fue pionero en la cuenta de base AAPC, desarrollando otro no celular AAPC basada en grano, Mediante acoplamiento HLA-Ig, la señal 1, y anti-CD28, señal 2, sobre perlas magnéticas. HLA-Ig, una forma única multimérico de HLA fusionado a una inmunoglobulina molecular andamio 16, 17 fue desarrollado por su grupo. Posteriormente, se desarrollaron MHC-Ig basado AAPC, que se ha demostrado que ampliar eficazmente CMV y MART-1 CTL específicos 18. Aquí, hemos demostrado que CD1d-Ig AAPC base puede utilizarse para expandir las células NKT funcionales. Un estudio ha utilizado un sistema similar para examinar la interacción física de las células NK con CD1d 19.
En particular, hemos diseñado una célula artificial que presenta antígeno que es adaptable a cualquier requerimiento que considere necesarios para la proliferación de células NKT óptima. El método de expansión de AAPC ofrece un método sencillo y fiable para la expansión y enriquecimiento de las células NKT humanos. Nuestra AAPC puede ser modificado para evaluar sistemáticamente el papel de un grupo de moléculas coestimuladoras potenciales y evaluar su papel en la proliferación de células NKTción y función. Así, AAPC representan una tecnología versátil robusta útiles para inducir y expandir las células NKT. La generación de aAPCs tarda menos de una semana y es adecuado para la producción de grandes cantidades de perlas. Sin embargo, un paso crítico en la generación de la AAPC es confirmar que CD1d-Ig se forma estable inmovilizado sobre la superficie de las perlas y para evaluar su funcionalidad para asegurar la consistencia de lote a lote. Una limitación potencial del sistema es que no hay un mecanismo para desactivar la estimulación, distinta de la separación mecánica de las perlas. Específicamente, el compromiso del receptor de células T (TCR) con el complejo antígeno: CD1d/MHC típicamente generar la sinapsis inmunológica en concierto con moléculas accesorias / de adhesión, lo que puede resultar en la inducción de factores de inhibición o supresión tanto de la célula T y célula presentadora de antígeno. En el sistema de AAPC, estos factores pueden ser regulado positivamente por la célula T, pero el talón no se expresan los ligandos afinespara estos receptores.
Además, las células CD4 + células NKT se ha demostrado que suprimen las respuestas antitumorales en ratones y seres humanos, por lo que es posible que la activación no selectiva de todas las células NKT (es decir, la estimulación global con α-GalCer) o la activación del subconjunto incorrecto podría resultar en inmunológica no deseada resultados. Por consiguiente, uno debe fenotípica y funcionalmente caracterizar la población de AAPC-expandida de células NKT. Como se muestra en la Figura 4, se ha encontrado que la estimulación con α-GalCer-cargado AAPC expresar anti-CD28 puede dar lugar a células NKT productoras de Th1, Th2, Th17 y citoquinas de tipo. Murino estudios han informado de que desafío con IL-33, una citoquina recientemente identificada, como resultado mayores niveles circulantes de citoquinas inflamatorias tales como IL-5 e IL-13-. El tratamiento de células NKT con IL-33 aumentaron su producción de citocinas 20. IL-33 es un ligando específico para ST2 y se ha demostrado que ca ST2 solublen bloque IL-33 de señalización. Así, como un ejemplo de una aplicación en el futuro, ST2 AAPC expresar podría ser generado y utilizado para determinar si uno podría inhibir selectivamente la producción de citocinas Th2 mientras que la inducción de la secreción de citocinas Th1 por las células NKT. También se ha informado de que la inyección iv de Kb-expresión de AAPC en C57BL / 6 ratones resultó en la metástasis pulmonar disminuida de tumor 21. Es importante destacar que estos datos demuestran que el tráfico de AAPC en el pulmón y son capaces de activar los subconjuntos de células T efectoras. Por lo tanto, se podría generar múltiples tipos de AAPC y examinar la interacción entre antígenos específicos subconjuntos de células T. En resumen, estos estudios demuestran que CD1d-Ig AAPC base se puede utilizar para reemplazar APC celular normal, y que el potencial de mejorar los actuales enfoques clínicos para la célula NKT-adoptiva basada en la inmunoterapia.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Priyanka Subrahmanyam útil para los debates. Los autores no tienen ningún interés financiero compitiendo. Este trabajo fue apoyado por becas de la Sociedad Americana del Cáncer, NIH / NCI K01 CA131487, CA162273 R21, R21 CA162277 y P30 inmunología tumoral y el Programa de Inmunoterapia en TJ Webb. El contenido es de exclusiva responsabilidad de sus autores y no representan necesariamente la opinión oficial del Instituto Nacional del Cáncer o los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Ficoll-Paque PLUS | GE Life Sciences | 17-1440 | |
| EasySep de células T humano Enriquecimiento Kit | StemCell Tecnologías | 19051 | |
| Aloficocianina CD161 humano mAb | Pharmingen | 550968 | |
| EasySep Imán | StemCell Tecnologías | 18002 | |
| Anti-ratón IgG1 microperlas | Miltenyi Biotec | 130-047-101 | |
| Dimer XI soluble recombinante dimérica Ratón CD1d: Proteína IG Fusion | BD Biosciences | 557599 | |
| Anti-CD28 mAb | BioLegend | 302914 | |
| M-450 Epoxy perlas | Life Technologies | 150-11 | |
| Alfa-galactosilceramida (KRN7000) | Axxora, LLC | BML-SL232-0100 | |
| RPMI 1640 Medium | Sigma Aldrich | R 0883 | |
| Piruvato de sodio | Gibco | 11360-070 | |
| No esenciales de aminoácidos | Gibco | 11140-050 | |
| Vitamina Solution | Gibco | 11120-052 | |
| 2-mercaptoetanol | Gibco | ||
| La ciprofloxacina | Alexis Bioquímicos | 380-288-G025 | |
| PE-Vα24Jα18 | BioLegend | 342904 | |
| PE-Vα24 (clon C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Clon C21) | Beckman Coulter | A66905 | |
| PE-CD1d | BioLegend | 123510 | |
| PE anti-ratón IgG1 | BD Biosciences | 556650 | |
| FITC anti-ratón IgG2a | BioLegend | 407105 | |
| DPBS, sin calcio, magnesio no | Life Technologies | 14190250 | |
| Sodio azida | Sigma Aldrich | S8032 | |
| Albúmina de suero bovino | Americana Bioanalytical | AB00440-00100 | |
| EDTA | Sigma Aldrich | 431788 | |
| IL-2 (Proleukin) | BD Biosciences | 354043 | |
| Suero humano AB | Atlanta Biológicos | S40110 | |
| Rotator Tube Labquake | Fisher Scientific | 13-687-10Q | |
| BD Falcon de poliestireno de 5 ml de fondo redondo tubos | Fisher Scientific | 14 a 959-1A | |
| Wheaton Glass viales de muestra con tapa | Fisher Scientific | Small (03-343-6A) Grande (03-343-6E) |
Referencias
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados