Method Article
Antigen Presenting artificiale cellulare (AAPC) Attivazione mediata ed espansione delle cellule Natural Killer T
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui si descrive un metodo per l'attivazione ed espandere cellule NKT dal bulk popolazioni di cellule T usando cellule presentanti antigene artificiali (AAPC). L'uso di CD1d basata AAPC fornisce un metodo standard per la generazione di numeri elevati di cellule NKT funzionali.
Abstract
Natural killer T (NKT) cellule sono un sottogruppo di cellule T che visualizzano marcatori caratteristici di entrambi natural killer (NK) e le cellule T 1. Diversamente classici cellule T, cellule NKT riconoscono antigeni lipidi nel contesto di molecole CD1 2. Cellule NKT esprimere un riarrangiamento catena invariante TCRα: Vα14Jα18 in topi e Vα24Jα18 nell'uomo, che è associata con catene Vβ limitata diversità di 3-6, e sono indicati come canoniche o invarianti NKT (i NKT) cellule. Simile a cellule T convenzionali, cellule NKT sviluppano da cellule precursori CD4-CD8-T timici seguendo la segnalazione appropriata CD1d 7. Il potenziale di utilizzare cellule NKT per scopi terapeutici è aumentato significativamente la capacità di stimolare ed espandere cellule NKT con α-Galactosylceramide (α-GalCer) e una varietà di citochine 8. È importante sottolineare che queste cellule mantenuto il loro originale phenotype, citochine secrete e visualizzata funzione citotossica contro linee cellulari tumorali. Così, espanse ex vivo cellule NKT rimanere funzionale e può essere utilizzato per l'immunoterapia adottiva. Tuttavia, cellule NKT based-immunoterapia è stato limitato con l'uso di cellule che presentano l'antigene autologhe e la quantità e la qualità di queste cellule stimolatrici può variare sostanzialmente. DC derivate da monociti di pazienti affetti da cancro sono stati segnalati per esprimere livelli ridotti di molecole costimolatorie e producono citochine infiammatorie meno 9,10. Infatti, DC murine anziché APC autologhe sono stati utilizzati per testare la funzione delle cellule NKT da pazienti CML 11. Tuttavia, questo sistema può essere utilizzato solo per la sperimentazione in vitro cellule NKT poiché non può essere espansa murino DC e quindi utilizzati per l'immunoterapia adottiva. Quindi, un sistema standardizzato che si basa su cellule artificiali Antigen Presenting (AAPC) potrebbe produrre gli effetti stimolanti della DC senza le insidie di allo-o xenogeniche ceLLS 12, 13. Qui, si descrive un metodo per generare CD1d basata AAPC. Poiché l'impegno del recettore delle cellule T (TCR) di CD1d-antigene è un requisito fondamentale di attivazione delle cellule NKT, antigene: CD1d-Ig complessi forniscono un metodo affidabile per isolare, attivare, ed espandere popolazioni di cellule effettrici NKT.
Protocollo
1. Generazione di AAPC
- Prima di aggiungere proteine di perle, preparare tutti i reagenti e tamponi: tampone borato 0,1 M; 1X D-PBS (senza Ca 2 + e Mg 2 +); (azide 1X PBS + 5% siero umano AB + di sodio 0,02%), il tampone di lavaggio perlina ; terreno completo (medium RPMI 100 mM piruvato di sodio, 10 mM non essenziali soluzione di vitamine, 100 mM MEM soluzione Vitamina, 1% di 2-mercaptoetanolo, 10 mM ciprofloxacina, 5% di siero umano AB); tampone MACS (1 L PBS libera di Ca 2 + e Mg 2 +, 5 g BSA, e 2 mmol EDTA).
- Sciacquare 1 ml Dynabeads M-450 perle di resina epossidica con 3 ml di soluzione salina 0,1 M tampone borato (acido borico e acqua, pH 7,0-7,4) in un flaconcino da 5 ml in vetro borosilicato trasparente filettata.
- In un altro tubo 1,5 ml microcentrifuga, aggiungere 100 mg hCD1d Ig-dimero e 20 molecole co-stimolatorie mcg (esempio: anti-CD28mAb) a 1 ml di PBS w / o Ca 2 + o Mg 2 +.
- Luogo perla fiala di vetro contenente il magnete e tampone borato aspirato da perline. Aggiungete il composto di proteine da 1,2 a passo flacone di vetro e sostituire il tappo. Mescolare subito capovolgendo il flacone, coprire il tappo con parafilm, e posto su un mixer e incubare una notte a 4 ° C.
- Il giorno successivo, il flacone di vetro posto sul magnete e rimuovere miscela proteica, evitando accuratamente perline. Lavare le perline aggiungendo 3 ml tallone tampone di lavaggio (PBS con 5% di siero AB sodio azide 0,02%), e incubando a 4 ° C su un agitatore per 5 min. Ripetere due volte.
- Perline possono essere memorizzati in questa miscela di lavaggio tallone. Per rendere AAPC funzionale, rimuovere una piccola aliquota e contare le perline utilizzando un emocitometro. Controllare che le proteine sono stabilmente caricati i beads di colorazione con anticorpi (es. PE-coniugato anti-topo IgG1) ed eseguendo analisi citofluorimetrica.
- Per caricare le perline con l'antigene, togliere 5 x 10 7 perline, e aggiungere un piccolo flaconcino di 1,5 ml in vetro, perle di sciacquare con 1 ml di PBS sterile. Resuspend perle lavato con 1 ml di PBS sterile e aggiungere l'antigene; esempio: carico con α-GalCer/KRN7000 (5mg/ml). * Nota: Anche se, non abbiamo rilevato alcun problema con solubilità lipidica e la formazione di micelle, i lipidi devono essere trattati secondo le raccomandazioni del fabbricante. Specificamente, KRN7000 è stato ricostituito in DMSO (1mg/ml) per questi studi. KRN7000 e altri antigeni glicolipidi possono anche essere sciolto in 0,2 mg / ml di PBS contenente 0,5% Tween-20 (sonicare 2 hr. A 37 ° C). IMPORTANTE-La AAPC devono essere caricati per almeno 48-72 ore prima dell'uso.
2. Isolamento di CD161 + cellule CD3 +
- Raccogliere le cellule mononucleate del sangue periferico (PBMC). Per la separazione di densità centrifugazione su gradiente Ficoll di linfociti da un buffy coat o pacco leucoferesi, prima diluire sangue eparinizzato con un volume uguale di 1X PBS a temperatura ambiente.
- Aggiungere 15 ml di Ficoll (riscaldata a temperatura ambiente) a 50 ml provette coniche. Lentamente overlay25 ml della miscela sangue diluito in cima al Ficoll. Centrifugare a 2000 rpm per 30 min a temperatura ambiente con il freno.
- Rimuovere con attenzione l'interfaccia di linfociti (anello bianco tra la media e Ficoll) con una pipetta Pasteur e trasferire in un nuovo tubo da 50 ml.
- Lavare le cellule con il riempimento del tubo di 50 ml con PBS e centrifugazione a 1500 rpm per 5 min. Eliminare il supernatante e combinare i tubi da un unico individuo ad un unico tubo e lavare le cellule mononucleate del sangue periferico (PBMC) di nuovo con 20 ml di PBS. Poi conta il PBMC e risospendere ad una concentrazione di 5 x 10 7 cellule / ml in tampone MACS (1 L PBS privo di Ca 2 + e Mg 2 +, 5 mmol g BSA, e 2 EDTA).
- Per isolare la frazione di cellule T, iniziare con 2 ml di PBMC (10 8 cellule) e aggiungere 100 ml di soluzione Pan arricchimento delle cellule T dal Kit EasySep arricchimento umano cellule T. Incubare a temperatura ambiente per 10 min.
- Aggiungere 100 pl di particelle magnetiche alla soluzione e incubare a temperatura ambiente per 10 min. Portare il volume finale di 2,5 ml di solvente e inserire il tubo nel magnete viola per 5 min. Velocemente versare l 'CD3 + frazione in una provetta da 15 ml conica.
- Lavare le cellule con l'aggiunta di 5 ml di tampone freddo MACS, contare il numero di cellule vitali, e prelevare un'aliquota per la colorazione FACS.
- Per selezionare le cellule CD161 +, in primo luogo arricchiti risospendere le cellule T nel 980 microlitri tampone ghiacciata MACS, aggiungere 10 mg contro CD161 mAb, e incubare in frigo per 10 minuti.
- Centrifugare le cellule a 1500 rpm a 4 ° C per 5 min. Poi ricostituire il pellet di cellule in 800 microlitri di tampone MACS. Aggiungere 200 pl di anti-topo IgG1 microperline e incubare la soluzione per 10 minuti a 4 ° C.
- Durante questa fase di incubazione, equilibrare una colonna LS aggiungendo 3 ml tampone MACS.
- Successivamente, lavare le cellule per centrifugazione 1500 rpm a 4 ° C per 5 min. Resutrascorrere le cellule in 3 ml di tampone MACS. Pipettare quindi le celle nella colonna LS MACS separazione. Assicurati di evitare di generare bolle pipettando lentamente. Lavare la colonna con l'aggiunta di 3 ml di tampone MACS. Ripetere due volte.
- Aggiungere 3 ml di tampone fresco MACS e rimuovere colonne da magnete. Colonna Inserire in una provetta da 15 ml conica. Inserire il pistone e spingere fuori il contenuto per ottenere purificate CD161 + cellule CD3 +. Conteggio delle cellule NKT arricchito frazione. Si dovrebbe avere 2-4 milioni di cellule.
3. AAPC mediata da cellule NKT di espansione
- Impostare co-coltura con l'aggiunta di 10 6 arricchiti CD161 + CD3 + cellule T e 10 6 AAPC in 16 ml di mezzo completo (completo medie + IL-2, 100 U / ml). Piatto questa miscela con l'aggiunta di 160 microlitri / pozzetto volume finale di un ben 96 tessuto-cultura polistirene trattate, U-piastra di fondo a bassa evaporazione coperchio. Eseguire scambio media ogni giorno 7 ° con l'aggiunta di 80 ml di mezzo fresco.
- Raccoltocellule, contare ed eseguire colorazione FACS il giorno 12-14.
- Le cellule NKT espanse possono essere saltuariamente come descritto sopra nella fase 3.1, specificamente risospendere 10 6 cellule T espanse e 10 6 AAPC in 16 ml di mezzo completo. Piastra questa miscela aggiungendo 160 pl / pozzetto di una ben 96 U-piastra inferiore. Continuare a rinfrescare medio co-coltura ogni giorno 7 ° con l'aggiunta di 80 ml di mezzo fresco.
- Si consiglia di congelare le cellule NKT supplementari dopo il secondo turno di espansione (1 x10 6 / provetta Microbank ™ in 1 ml di DMSO-5% / 95% FBS.)
4. Test funzionale: AAPC-mediata stimolazione delle cellule NKT
- Impostare 5x10 4 cellule NKT / bene con 5x10 5 AAPC in 200 microlitri di volume finale (terreno completo) in 96 e U-piastra inferiore.
- Harvest supernatante di coltura cellulare per ELISA dopo 24-48 ore.
Risultati
Qui si descrive un metodo per generare CD1d-Ig basata AAPC, realizzato mediante accoppiamento covalente di CD1d-Ig e anti-CD28 mAb a perline magnetiche per stimolare le cellule NKT come metodo standardizzato per la propagazione delle cellule NKT (Figura 1). Primo, uno deve dimostrare che i CD1d-Ig proteine di fusione sono stabilmente immobilizzato sulla superficie dei granuli magnetici. Come mostrato in Figura 2A, CD1d-Ig e anticorpi anti-CD28 sono stati sia espresso sulla superficie delle perle magnetiche. Per esaminare la capacità stimolante della AAPC, noi co-coltura di cellule NKT ibridomi con AAPC surnatanti raccolti durante la notte, la cultura e le misurata produzione di IL-2 da ELISA. Abbiamo trovato che CD1d-Ig basata AAPC erano in grado di stimolare le cellule NKT ibridomi a livelli pari o superiore al corrispettivo cellulari (Figura 3, i dati non mostrati). È interessante notare che, abbiamo scoperto che il nostro mouse ibridomi di cellule NKT sono stimolati da umano CD1d basata AAPC (Figura 2B), che fornisce un metodo semplice per testare ogni lotto di AAPC.
Successivamente, si è cercato di dimostrare il potenziale propagazione AAPC, quindi le cellule T umane sono state isolate da sangue periferico. In primo luogo il CD161 + CD3 + frazione di cellule T è stata arricchita da separazione magnetica tallone. Quindi, le cellule T sono state stimolate bisettimanale con α-GalCer caricato AAPC. È importante sottolineare che, abbiamo scoperto che anche con un relativamente basso iniziale popolazione di cellule NKT (0,03%), siamo stati in grado di espandere le cellule a ~ 67% Vα24 Vβ11 + + (Figura 3). Abbiamo ampliato le cellule NKT dal PBMC di molti volontari sani e pazienti affetti da cancro e hanno scoperto che α-GalCer caricato AAPC stati in grado di espandere la popolazione di cellule NKT in entrambi i gruppi. In particolare, il tasso di espansione è stata molto donatore dipendente. Come previsto maggiore è la popolazione iniziale di cellule Vα24 +, maggiore è la percentuale di espansione. Inoltre,quando si utilizza una popolazione iniziale di 2 milioni di cellule CD161 + CD3 + cellule T, si può ottenere> 10 7 cellule dopo due cicli di espansione (Tabella 1). Circa 80-90% delle cellule NKT espanse sono CD4 +, ~ 5% CD8 +, e le restanti sono presumibilmente negativi cellule CD4-CD8-doppie NKT. Queste cellule NKT espanse possono essere utilizzati per studi funzionali come mostrato in Figura 4A-C. Abbiamo trovato che il nostro ex vivo espanse cellule NKT continuare ad adattarsi ai α-GalCer stimolazione e sono potenti produttori di IL-17A, TNF-α e IFN-γ. Occorre notare che se la prima popolazione di cellule T arricchimento è bassa e si è in grado di eseguire la seconda fase di arricchimento CD161, il AAPC mediata espansione non può dare i risultati attesi (vedere Figura 4D, donatori 1). Tuttavia, se la percentuale di cellule circolanti NKT è superiore a 0,1%, si dovrebbe essere ancora in grado di ottenere una significativa espansionei di cellule NKT. Nel complesso, questi dati dimostrano che CD1d based-AAPC può essere utilizzato per espandere in modo efficace e stimolare cellule primarie umane NKT.

Figura 1. Diagramma schematico di CD1d: Ig basati aAPCs porzioni extracellulari della molecola CD1d sono fusi alla regione costante di una catena pesante di immunoglobulina proteine separate da un linker breve amminoacido. Queste molecole possono essere facilmente caricate con antigeni lipidici, come α-GalCer, semplicemente mediante incubazione con un eccesso di lipidi di interesse. AAPC state realizzate con l'accoppiamento CD1d-Ig e anti-CD Abs a sfere magnetiche. In questo sistema, CD1d-Ig viene utilizzato per fornire l'affine antigene-specifico segnale attraverso il TCR e anti-CD28 mAb fornisce il segnale di costimolazione.

Figura 2. . Colorazione FACS di proteine di superficie su aAPCs aAPCs A) sono stati testati per la presenza di CD1d: IgG dimero (tramite colorazione con PE-coniugato anti-topo IgG1) e anticorpo anti-CD28 (con FITC-coniugato anti-topo IgG2a) istogrammi. aperti indicano controllo isotipico; istogrammi pieni rappresentano gli anticorpi indicati. CD1d-Ig Esprimere AAPC possono stimolare produzione di IL-2 da parte delle cellule NKT. B) Il + Vα14 topo NKT cellulare di ibridomi, DN32.D3, è stato co-coltivate sia con media, antigene solubile (α-GalCer), scaricate AAPC o α-GalCer caricato AAPC. Supernatanti di coltura sono stati raccolti e standard sandwich ELISA è stato utilizzato per misurare la produzione di IL-2.

Figura 3. Espansione delle cellule NKT da cellule rivestite CD1d-antigene artificiali presentano. (A) primario CD3 + CD161 + doppie cellule positive sono state isolate da PBMC mediante separazione magnetica. Le cellule sono state stimolate con filtrate α-GalCer caricato, CD1d-Ig AAPC rivestito per 14 giorni. Le cellule sono state colorate per Vα24 e Vβ11 seguito di stimolazione AAPC. (B) Primary cellula umana NKT mediato lisi di una linea di linfoma a cellule B. C1R-CD1d cellule incubate con cellule NKT ai rapporti indicati in presenza o assenza di antigene, un GalCer (100 ng / ml) a 96 pozzetti con fondo a U piastre per 20-24 hr. Lisi delle cellule NKT cellulo-mediata è stata valutata dalla norma 51Cr-release test.
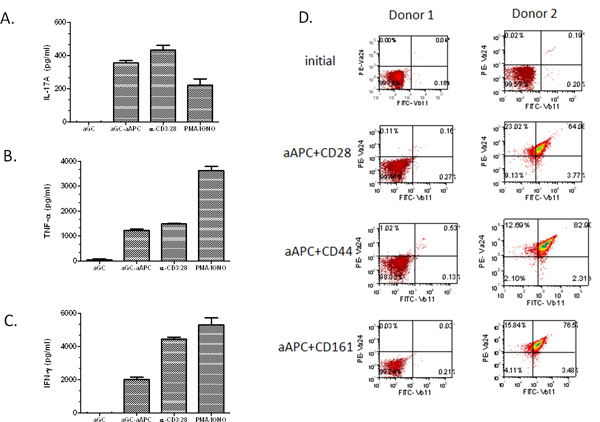
Figura 4. Profili delle citochine di AAPC-espanse cellule NKT. Dopo stimolazione con α GalCer caricato AAPC per due settimane, le cellule NKT espanse (1 × 10 5 / pozzetto) sono state co-coltivate con α-solubile GalCer, PMA / ionomicina, anti-CD3/28 microperle, o α-GalCer loaded AAPC (2 × 10 5 / pozzetto) per 48 ore. (A) IL-17A, (B), TNF-α, e (C) IFN-γ produzione di citochine è stata misurata mediante ELISA standard. I dati indicati sono al netto della produzione di citochine dopo aver sottratto i controlli negativi (media e perle vuote). (D) cellule T primarie sono state isolate da PBMC mediante separazione magnetica tallone. Le cellule sono state stimolate filtrate per due settimane con l'indicazione a-GalCer caricato-AAPC. Le cellule sono state colorate usando Abs specifici per Vα24 + e + Vβ11 ed analizzate al citofluorimetro.
Discussione
AAPC possono essere utilizzati per studiare i requisiti di base per l'attivazione delle cellule NKT e ha il potenziale valore clinico per l'espansione ex vivo di cellule NKT per immunoterapia adottiva. Mescher et al. Descritto uno dei primi sistemi basati tallone, dove murino biotinilato classe MHC-peptide-singoli costrutti catena sono stati combinati con molecole costimolatorie biotinilati B7.1 e B7.2 tramite streptavidina alla superficie delle microsfere lattice 14, 15. Questo approccio è stato utilizzato con successo per stimolare cellule T antigene-specifiche di topi transgenici. Inoltre, poiché questo approccio utilizza una singola catena MHC-peptide per garantire loading omogenea delle molecole MHC, ciascun antigene peptide desiderato richiederebbe una nuova trasfezione per l'espressione della singola catena desiderata MHC-peptide, limitando così la generalità di approccio. È importante sottolineare che il gruppo del Dr. Schneck ha aperto la strada al tallone based-AAPC, attraverso lo sviluppo di un altro non cellulare AAPC tallone base, Realizzato accoppiando HLA-Ig, segnale 1, e anti-CD28, segnale 2, su biglie magnetiche. HLA-Ig, una forma unica multimerica di HLA fusa ad una immunoglobulina patibolo molecolare 16, 17 è stata sviluppata dal suo gruppo. Successivamente, hanno sviluppato MHC-Ig basata AAPC, che hanno dimostrato di espandere efficacemente CMV e MART-1 specifica CTL 18. Qui, abbiamo dimostrato che CD1d-Ig AAPC base può essere utilizzato per espandere cellule NKT funzionali. Uno studio ha utilizzato un sistema simile per esaminare l'interazione fisica delle cellule NK con CD1d 19.
In particolare, abbiamo progettato una cellula artificiale presentanti l'antigene che è adattabile a qualsiasi esigenza troviamo necessaria per ottimizzare la proliferazione delle cellule NKT. Il metodo di espansione AAPC fornisce un metodo semplice e affidabile per estendere e arricchire cellule NKT. Il nostro AAPC può essere modificato per valutare sistematicamente il ruolo di un gruppo di molecole di costimolazione potenziali e valutare il loro ruolo sulla proliferazione delle cellule NKTzione e la funzione. Così, AAPC rappresentano una tecnologia robusta versatile utile per l'induzione e l'espansione delle cellule NKT. La generazione di aAPCs richiede meno di una settimana ed è adatto per la produzione di grandi quantità di perle. Tuttavia, un passo critico nel generare il AAPC è confermare che CD1d-Ig è stabilmente immobilizzato sulla superficie delle perle e valutare la loro funzionalità di coerenza da lotto a lotto. Un limite potenziale del sistema è che non vi è un meccanismo atto a spegnere stimolazione, oltre rimozione meccanica delle perle. Specificamente, l'impegno del recettore delle cellule T (TCR) con l'antigene: complesso CD1d/MHC generano tipicamente sinapsi immunologica in concerto con accessori / molecole di adesione, che può provocare l'induzione di fattori inibitori o soppressiva sia sulla cellula T e cellule presentanti l'antigene. Nel sistema AAPC, questi fattori possono essere upregulated dalla cellula T, ma il tallone non si esprimono i ligandi congiuntiper questi recettori.
Inoltre, le cellule CD4 + NKT hanno dimostrato di sopprimere le risposte antitumorali nei topi e umani, quindi è possibile che l'attivazione non selettivo di tutte le cellule NKT stimolazione (cioè globale con α-GalCer) o attivazione del sottoinsieme errato potrebbe provocare indesiderati immunologica risultati. Di conseguenza, si deve fenotipicamente e funzionalmente caratterizzano la AAPC espanso popolazione di cellule NKT. Come mostrato in figura 4, abbiamo trovato che la stimolazione con α-GalCer-loaded AAPC esprimere anti-CD28 può provocare cellule NKT producono Th1, Th2 e citochine di tipo Th17. Studi murini hanno riportato che sfida con IL-33, una citochina recentemente identificato, portato a un aumento dei livelli circolanti di citochine infiammatorie come IL-5 e IL-13. Trattamento di cellule NKT con IL-33 potenziato la loro produzione di citochine 20. IL-33 è un ligando specifico per ST2 ed è stato dimostrato che ST2 solubile can blocchi IL-33 di segnalazione. Quindi, come esempio di una futura applicazione, ST2 AAPC esprimendo potrebbe essere generato e utilizzato per determinare se si potesse inibire selettivamente la produzione di citochine Th2 mentre induce secrezione di citochine da Th1 cellule NKT. E 'stato anche riportato che l'iniezione iv di Kb-AAPC esprimere in topi C57BL / 6 provocato metastasi polmonari ridotte del tumore 21. Importante, questi dati dimostrano che il traffico AAPC al polmone e sono in grado di attivare cellule T effettrici sottoinsiemi. Pertanto, si potrebbe generare diversi tipi di AAPC ed esaminare l'interazione tra sottopopolazioni di cellule T antigene specifiche. Per riassumere, questi studi dimostrano che CD1d-Ig AAPC base può essere utilizzato per sostituire normale APC cellulare, e hanno il potenziale per migliorare attuali approcci clinici per cellule NKT based-immunoterapia adottiva.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Priyanka Subrahmanyam per le discussioni utili. Gli autori non hanno concorrenti interesse finanziario. Questo lavoro è stato sostenuto da finanziamenti della American Cancer Society, NIH / NCI K01 CA131487, CA162273 R21, R21 CA162277, P30 e immunologia dei tumori e Programma di Immunoterapia TJ Webb. Il contenuto è di esclusiva responsabilità degli autori e non necessariamente rappresentano le opinioni ufficiali del National Cancer Institute e il National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Ficoll-Paque PLUS | GE Life Sciences | 17-1440 | |
| EasySep umano delle cellule T Kit di arricchimento | StemCell Technologies | 19051 | |
| Alloficocianina CD161 umano mAb | Pharmingen | 550968 | |
| EasySep Magnet | StemCell Technologies | 18002 | |
| Anti-topo IgG1 Microsfere | Miltenyi Biotec | 130-047-101 | |
| Dimero XI ricombinante solubile dimerica mouse CD1d: proteina di fusione IG | BD Biosciences | 557599 | |
| Anti-CD28 mAb | Biolegend | 302914 | |
| M-450 epossidiche perline | Life Technologies | 150-11 | |
| Alpha-galactosylceramide (KRN7000) | Axxora, LLC | BML-SL232-0100 | |
| RPMI 1640 | Sigma Aldrich | R 0883 | |
| Sodio piruvato | Gibco | 11360-070 | |
| Aminoacidi non essenziali | Gibco | 11140-050 | |
| Vitamina Soluzione | Gibco | 11120-052 | |
| 2-mercaptoetanolo | Gibco | ||
| Ciprofloxacina | Alexis Biochemicals | 380-288-G025 | |
| PE-Vα24Jα18 | Biolegend | 342904 | |
| PE-Vα24 (Clone C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Clone C21) | Beckman Coulter | A66905 | |
| PE-CD1d | Biolegend | 123510 | |
| PE contro topo IgG1 | BD Biosciences | 556650 | |
| FITC anti-topo IgG2a | Biolegend | 407105 | |
| DPBS, no calcio, magnesio no | Life Technologies | 14190250 | |
| Di sodio azide | Sigma Aldrich | S8032 | |
| Albumina di siero bovino | Americana Bioanalytical | AB00440-00100 | |
| EDTA | Sigma Aldrich | 431788 | |
| IL-2 (Proleukin) | BD Biosciences | 354043 | |
| Siero umano AB | Atlanta Biologicals | S40110 | |
| Tubo Rotator Labquake | Fisher Scientific | 13-687-10Q | |
| BD Falcon 5 ml in polistirolo a fondo tondo tubi | Fisher Scientific | 14-959-1A | |
| Wheaton Vial in vetro con tappo | Fisher Scientific | Piccolo (03-343-6A) Grande (03-343-6E) |
Riferimenti
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon