Method Article
Künstliche Antigen-präsentierenden Zelle (AAPC) vermittelte Aktivierung und Expansion der Natural Killer-T-Zellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Verfahren zur Aktivierung und Ausbau menschlichen NKT-Zellen aus losem T-Zellpopulationen mit künstlichen Antigen-präsentierende Zellen (AAPC). Die Verwendung von CD1d basierenden AAPC bietet eine standardisierte Verfahren zur Erzeugung hoher Anzahl funktioneller NKT-Zellen.
Zusammenfassung
Natürliche Killer-T (NKT-Zellen) sind eine eindeutige Untergruppe von T-Zellen, die Marker Merkmal sowohl natürliche Killerzellen (NK-Zellen) und T-Zellen 1 anzuzeigen. Im Gegensatz zu klassischen T-Zellen, NKT-Zellen zu erkennen Lipid-Antigen in Zusammenhang mit CD1-Moleküle 2. NKT-Zellen exprimieren einen invarianten Kette TCRα Umlagerung: Vα14Jα18 bei Mäusen und Vα24Jα18 bei Menschen, die mit Ketten von Vß begrenzten Vielfalt 3-6 verbunden ist, und werden als kanonische oder invariante NKT (i NKT-Zellen) bezeichnet. Ähnlich wie bei konventionellen T-Zellen entwickeln NKT-Zellen von CD4-CD8-Thymus-Vorläufer-T-Zellen nach der entsprechenden Signalisierung durch CD1d 7. Das Potential, NKT-Zellen zu therapeutischen Zwecken zu nutzen hat wesentlich mit der Fähigkeit zur Stimulierung und erweitern menschlichen NKT-Zellen mit α-Galactosylceramid (α-GalCer) und einer Reihe von Cytokinen 8 erhöht. Wichtig ist, erhalten diese Zellen ihre ursprüngliche Phänotype, sekretierten Zytokine und erscheint zytotoxische Funktion gegen Tumorzelllinien. Somit bleiben ex vivo expandierten NKT-Zellen funktionsfähig und kann für die adoptive Immuntherapie verwendet werden. Allerdings hat NKT-Zell-basierte Immuntherapie durch die Verwendung von Antigen präsentierenden Zellen autolog sind gering, und die Menge und die Qualität dieser Stimulatorzellen kann erheblich variieren. Monozyten abgeleiteten DC von Krebspatienten wurde berichtet, reduzierte Mengen an costimulatorischen Moleküle exprimieren und herzustellen weniger inflammatorischen Zytokinen 9,10. In der Tat haben murinen DC anstatt autologen APC verwendet worden, um die Funktion von NKT-Zellen aus CML-Patienten 11 zu testen. Allerdings kann dieses System nur für in-vitro-Tests eingesetzt werden, da NKT-Zellen nicht durch murine DC erweitert werden und dann für die adoptive Immuntherapie verwendet. So könnte ein standardisiertes System, das auf künstlichen Antigen-präsentierende Zellen (AAPC) setzt die stimulierende Wirkung von DC ohne die Fallstricke der allo-oder xenogenen ce produzierenlls 12, 13. Hier beschreiben wir ein Verfahren zur Erzeugung CD1d basierenden AAPC. Da der Eingriff der T-Zell-Rezeptor (TCR) von CD1d-Antigen-Komplexe ist eine grundlegende Anforderung von NKT-Zellen-Aktivierung, Antigen: CD1d-Ig-Komplexe eine zuverlässige Methode zu isolieren, zu aktivieren und zu erweitern Effektor NKT Zellpopulationen.
Protokoll
Ein. Generation von AAPC
- Bevor die Zugabe von Proteinen Perlen, bereiten alle Reagenzien und Puffer: 0,1 M Boratpuffer, 1x D-PBS (ohne Ca 2 + und Mg 2 +); Bead Waschpuffer (1X PBS +5% humanem AB-Serum + 0,02% Natriumazid) ; Komplettes Medium (RPMI Medium, 100 mM Natriumpyruvat, 10 mM nicht-essentielle Vitaminlösung, 100 mM MEM Vitamin-Lösung, 1% 2-Mercaptoethanol, 10 uM Ciprofloxacin, 5% humanem AB-Serum); MACS-Puffer (1 l PBS freien der Ca 2 + und Mg 2 +, 5 g BSA und 2 mmol EDTA).
- Spülen 1 ml Dynabeads M-450 Epoxy Perlen mit 3 ml sterilem 0,1 M Boratpuffer (Borsäure und Wasser, pH 7,0 bis 7,4) in einem 5 ml Borosilikatglas Gewinde Fläschchen.
- In einem separaten 1,5 ml Mikrozentrifugenröhrchen, fügen Sie 100 ug hCD1d-Ig Dimer und 20 ug kostimulatorische Moleküle (Beispiel: Anti-CD28mAb) auf 1 ml PBS w / o Ca 2 + oder Mg 2 +.
- Place bead mit Glasfläschchen auf Magnet und saugen Boratpuffer aus Perlen. Fügen Protein Mischung aus Schritt 1,2 bis Glasfläschchen und wieder aufsetzen. Sofort durch Umdrehen des Fläschchens, decken Sie die Kappe mit Parafilm, und auf einem Rotator und über Nacht bei 4 ° C.
- Am nächsten Tag, Ort Glasfläschchen auf Magnet und entfernen Proteinmischung, während sorgfältig vermieden Perlen. Waschen der Kügelchen durch Zugabe von 3 ml Wulst Waschpuffer (PBS mit 5% AB-Serum 0,02% Natriumazid), und Inkubieren bei 4 ° C auf einem Rotator für 5 min. Zweimal wiederholen.
- Kügelchen können in diesem Wulst wash Gemisch gelagert werden. Um funktionale AAPC machen, entfernen Sie ein kleines Aliquot und zählen Sie die Perlen mit einem Hämazytometer. Überprüfen, dass die Proteine stabil sind auf die Kügelchen durch Färbung mit Antikörpern (zB PE-konjugierten Anti-Maus-IgG1) und Durchführen durchflusszytometrische Analyse geladen.
- Um Perlen mit Antigen zu laden, entfernen Sie 5 x 10 7 Perlen, und fügen Sie zu einem kleinen 1,5 ml Glasflasche, spülen Perlen mit 1 ml steriler PBS. Resuspend gewaschen Perlen mit 1 ml steriler PBS und fügen Antigen; Beispiel: Belastung mit α-GalCer/KRN7000 (5mg/ml). * Hinweis: Während wir keine Probleme mit Lipidlöslichkeit oder Micellenbildung haben erkannt, Lipide sollten nach den Empfehlungen des Herstellers behandelt werden. Insbesondere wurde KRN7000 in DMSO (1mg/ml) für diese Studien rekonstituiert. KRN7000 und anderen Glycolipid Antigene können auch in 0,2 mg / ml PBS, enthaltend 0,5% gelöst werden Tween-20 (2 Std. beschallen. Bei 37 ° C). Die WICHTIGER-AAPC müssen für mindestens 48-72 h vor der Verwendung geladen werden.
2. Isolierung von CD161 + CD3 +-Zellen
- Collect peripheren mononukleären Blutzellen (PBMC). Für Ficoll-Dichtegradientenzentrifugation Trennung von Lymphozyten aus einer Leukozytenmanschette oder Leukopherese Packung zunächst verdünnte heparinisiertem Blut mit einem gleichen Volumen von 1X PBS bei Raumtemperatur.
- 15 ml Ficoll (auf Raumtemperatur erwärmt) auf 50 ml konischen Röhrchen. Langsam Overlay25 ml des verdünnten Blut-Gemisch auf der Oberseite des Ficoll. Zentrifugieren bei 2000 rpm für 30 min bei Raumtemperatur mit der Bremse ausgeschaltet.
- Entfernen Sie vorsichtig die Lymphozyten-Schnittstelle (weißer Ring zwischen den Medien und Ficoll) mit einer Pasteurpipette und übertragen auf ein neues 50 ml konischen Röhrchen.
- Waschen der Zellen durch Auffüllen des Rohres auf 50 ml mit PBS und Zentrifugieren bei 1500 UpM für 5 min. Verwerfen des Überstandes und verbinden die Rohre aus einem einzigen Individuum zu einem einzigen Rohr und waschen die peripheren mononukleären Blutzellen (PBMC) erneut mit 20 ml PBS. Dann zählen die PBMC und resuspendieren in einer Konzentration von 5 x 10 7 Zellen / ml in MACS-Puffer (1 l PBS frei von Ca 2 + und Mg 2 +, 5 g BSA und 2 mmol EDTA).
- Um die T-Zell-Fraktion zu isolieren, mit 2 ml PBMC (10 8 Zellen) beginnen und mit 100 ul der Pan-T-Zell Bereicherung Lösung aus dem EasySep humanen T-Zell Enrichment Kit. Inkubieren bei Raumtemperatur für 10 min.
- Je 100 ul magnetischen Partikel zu der Lösung hinzugefügt und bei Raumtemperatur für weitere 10 min. Bringt das Endvolumen von 2,5 ml Lösungsmittel zu und das Reagenzglas in der purpurroten Magnet für 5 min. Schnell abgießen CD3 + Fraktion in einem 15 ml konischen Röhrchen.
- Waschen der Zellen durch Zugabe von 5 ml kaltem MACS-Puffer, zählen die Anzahl von lebensfähigen Zellen und Entfernen eines Aliquots für FACS-Färbung.
- Um die CD161 + Zellen, erste resuspendieren angereicherte T-Zellen in 980 ul eiskaltem MACS-Puffer auswählen, hinzufügen 10 ug anti CD161 mAb und inkubieren im Kühlschrank für 10 min.
- Zentrifugation der Zellen bei 1500 rpm bei 4 ° C für 5 min. Dann rekonstruieren das Zellpellet in 800 ul MACS-Puffer. Fügen Sie 200 ul Anti-Maus-IgG1 Mikroperlen und inkubieren die Lösung für 10 min bei 4 ° C.
- Während dieser Inkubationsschritt äquilibrieren eine LS Säule durch Zugabe von 3 ml MACS-Puffer.
- Weiter, wäscht die Zellen durch Zentrifugieren 1500 rpm bei 4 ° C für 5 min. Resuverbringen die Zellen in 3 ml MACS-Puffer. Dann pipettieren der Zellen in den LS MACS Trennkolonne. Achten Sie darauf, zu vermeiden Erzeugung von Blasen durch Pipettieren langsam. Spülen der Säule durch Zugabe von 3 ml von MACS-Puffer. Zweimal wiederholen.
- 3 ml frisches MACS-Puffer und entfernen Spalte von Magneten. Ort Spalte in eine 15 ml konischen Röhrchen. Legen Kolben und schieben Sie Inhalte gereinigte CD161 + CD3 + Zellen zu erhalten. Graf NKT-Zelle angereicherten Fraktion. Sie sollten haben 2-4 Millionen Zellen.
3. AAPC-vermittelte NKT Zellexpansion
- Einrichten Kokultur durch Zugabe von 10 6 angereicherten CD161 + CD3 + T-Zellen und 10 6 AAPC in 16 ml Vollmedium (Vollmedium + IL-2, 100 U / ml). Platte dieses Gemisch durch Zugabe von 160 ul / Vertiefung Endvolumen auf einer 96-Well-Gewebekultur-behandelten Polystyrol, U-Bodenplatte mit niedrigem Verdampfen Deckel. Führen Austausch des Mediums jeden 7. Tag durch Zugabe von 80 ml frisches Medium.
- ErnteZellen zu zählen, und führen FACS-Färbung am Tag 12-14.
- Die expandierten NKT-Zellen können wie oben beschrieben ausplattiert in Schritt 3.1 werden, und zwar zu resuspendieren 10 6 expandierten T-Zellen und 10 6 AAPC in 16 ml Vollmedium. Platte dieses Gemisch durch Zugabe von 160 ul / Vertiefung einer 96-Well-U-Bodenplatte. Weiter zu Kokultur Medium aktualisieren jeden 7. Tag durch Zugabe von 80 ml frisches Medium.
- Am besten ist es, zusätzliche NKT-Zellen nach der zweiten Runde der Expansion einzufrieren (1 x10 6 / Kryoröhrchen in 1 ml-5% DMSO / 95% FBS.)
4. Functional Test: AAPC-vermittelte Stimulation der NKT-Zellen
- Einrichten 5x10 4 NKT Zellen / Well mit 5x10 5 AAPC in 200 ul Endvolumen (komplettes Medium) in 96-Well-U-Bodenplatte.
- Ernte Zellkulturüberstand für ELISA nach 24-48 Stunden.
Ergebnisse
Hier beschreiben wir ein Verfahren zur Erzeugung CD1d-Ig basierten AAPC, durch kovalente Kupplung von CD1d-Ig und anti-CD28-mAb an magnetische Beads zu NKT-Zellen als standardisiertes Verfahren zur Vermehrung von NKT-Zellen (Abb. 1) anzuregen hergestellt. Zuerst muß man zeigen, dass die CD1d-Ig-Fusionsproteine stabil auf die Oberfläche der magnetischen Kügelchen immobilisiert. Wie in 2A, CD1d-Ig und anti-CD28-Antikörper dargestellt wurden sowohl auf der Oberfläche der magnetischen Kügelchen ausgedrückt. Um die stimulierende Eigenschaft des AAPC untersuchen wir kokultivierten NKT-Zell-Hybridomen mit AAPC über Nacht, die Kulturüberstände geerntet und gemessenen IL-2-Produktion durch ELISA. Wir fanden, dass CD1d-Ig basierten AAPC Lage, die NKT-Zell-Hybridomen in Mengen gleich oder höher als ihre zellulären Gegenstücken stimulieren (Abbildung 3, Daten nicht gezeigt) waren. Interessanterweise fanden wir, dass unsere Maus NKT-Zell-Hybridome durch menschliche CD1d-basierte AAPC (Fi stimuliert werdengure 2B), die einfaches Verfahren zum Testen der einzelnen Charge von AAPC bereitstellt.
Als nächstes wir die Ausbreitung Potential AAPC demonstrieren gesucht wurden somit humanen T-Zellen aus dem peripheren Blut isoliert. Zuerst wird die CD161 + CD3 + T-Zell-Fraktion wurde durch Magnetkügelchen Trennung angereichert. Dann wurden die T-Zellen mit α-biweekly GalCer beladenen AAPC stimuliert. Wichtig ist, fanden wir, dass selbst bei einem relativ niedrigen anfänglichen NKT-Zell-Population (0,03%), konnten wir die Zellen zu ~ 67% Vα24 + Vβ11 + (Abbildung 3) ausbauen konnten. Wir haben NKT-Zellen aus der PBMC von vielen gesunden Probanden und Krebspatienten erweitert und haben festgestellt, dass α-GalCer beladenen AAPC Lage, die NKT-Zellen Population in beiden Gruppen ausdehnen. Bemerkenswerterweise war der Ausbau hoch im Kurs Spenders abhängig. Wie erwartet, je höher die ursprüngliche Population von Vα24 +-Zellen, je größer der Anteil der Expansion. Zusätzlichbei Verwendung einer Ausgangspopulation von 2 Millionen Zellen CD161 + CD3 + T-Zellen, kann man> 10 7 Zellen nach zwei Runden der Expansion (Tabelle 1) zu erhalten. Ungefähr 80-90% der expandierten NKT-Zellen sind CD4 +, ~ 5% CD8 +, und der verbleibende sind vermutlich CD4-CD8-doppelt negativ NKT-Zellen. Diese erweiterten NKT-Zellen kann für funktionelle Untersuchungen verwendet werden, wie in 4A-C dargestellt. Wir haben festgestellt, dass unsere ex vivo expandierten NKT Zellen bleiben, die auf α-GalCer Stimulation und sind potente Produzenten von IL-17A, TNF-α und IFN-γ. Es sollte beachtet werden, dass, wenn die erste T-Zell-Anreicherung Bevölkerung ist gering und man ist nicht in der Lage, um den zweiten CD161 Anreicherung Schritt ausführen, der AAPC-vermittelte Expansion möglicherweise nicht die erwarteten Ergebnisse (siehe Abbildung 4D Donor 1). Wenn jedoch der Anteil der zirkulierenden NKT-Zellen ist höher als 0,1% liegt, sollte man noch in der Lage, eine signifikante Erweiterung zu erhalteni von NKT-Zellen. Zusammengenommen zeigen diese Daten, dass CD1d based AAPC verwendet werden, um effektiv zu erweitern und zu stimulieren primären humanen NKT-Zellen sind.

Abbildung 1. Prinzipskizze CD1d: Ig-basierten aAPCs Extrazelluläre Abschnitte des CD1d Molekül an die konstante Region einer Immunglobulin-schwere Kette-Protein von einer kurzen Aminosäurelinker abgetrennt fusioniert. Diese Moleküle können mit Lipid-Antigene, wie α-GalCer geladen werden kann, einfach durch Inkubation mit einem Überschuss des Lipids von Interesse. AAPC wurden durch Kopplung CD1d-Ig und Anti-CD-Abs an magnetische Perlen. In diesem System wird CD1d-Ig verwendet, um den verwandten Antigen-spezifischen Signal durch die TCR-und Anti-CD28-mAb liefert die kostimulatorische Signal bereitzustellen.

Abbildung 2. . IgG Dimer (über Anfärbung mit PE-konjugiertem anti-Maus-IgG1) sowie Anti-CD28-Antikörper (mit FITC-konjugiertem Anti-Maus-IgG2a): FACS-Färbung von Oberflächenproteine auf aAPCs A) aAPCs wurden auf das Vorhandensein von getesteten CD1d . Offene Histogramme zeigen Isotypenkontrolle; gefüllte Histogramme stellen die angegebenen Antikörper. CD1d-Ig Ausdruck AAPC kann IL-2-Produktion durch NKT-Zellen zu stimulieren. B) Die Vα14 + Maus NKT-Zell-Hybridom, DN32.D3, wurde entweder mit Medium, lösliches Antigen (α-GalCer), entladen AAPC oder α-GalCer-loaded AAPC cokultiviert. Kulturüberstände wurden geerntet und Standard-Sandwich-ELISA wurde verwendet, um IL-2-Produktion zu messen.

Abbildung 3. Ausbau der NKT-Zellen durch CD1d-Ig beschichtet künstliche Antigen-präsentierenden Zellen. (A) Primäre CD3 + CD161 + doppelt positiven Zellen wurden aus PBMCs mittels magnetischer Separation isoliert. Die sortierten Zellen wurden mit α-GalCer geladen, CD1d-Ig beschichtet AAPC für 14 Tage stimuliert. Die Zellen wurden für Vα24 und Vβ11 folgenden AAPC Stimulation angefärbt. (B) Primäre humane NKT-Zell-vermittelte Lyse von einem B-Zell-Lymphom Linie. C1R-Zellen mit CD1d NKT-Zellen zu den angegebenen Verhältnissen in der Gegenwart oder Abwesenheit von Antigen, a-GalCer (100 ng / ml) in 96-Well-Platten mit U-Boden für 20-24 Stunden inkubiert. NKT-Zell-vermittelten Zell-Lyse wurde durch durch Standard 51Cr-Release-Assay beurteilt.
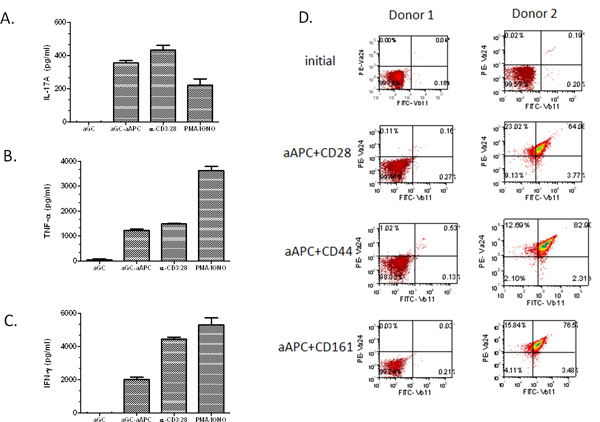
Abbildung 4. Zytokin-Profile von AAPC expandierten NKT-Zellen. Nach Stimulation mit α GalCer geladenen AAPC für zwei Wochen, die erweiterten NKT-Zellen (1 × 10 5 / Vertiefung) wurden mit löslichem α-GalCer, PMA / Ionomycin, anti-CD3/28 Mikrokügelchen oder α-GalCer geladenen AAPC kokultiviert (2 × 10 5 / Well) für 48 Stunden. (A) IL-17A, (B) TNF-α und (C) IFN-γ-Produktion wurde durch Standard-Zytokins ELISA gemessen. Die angegebenen Daten sind Nettopreise Zytokin-Produktion nach Abzug der negativen Kontrollen (Medien und leere Kügelchen). (D) primären T-Zellen wurden aus PBMC mit Magnetkügelchen Trennung isoliert. Die sortierten Zellen wurden für zwei Wochen mit der Indikation a-loaded-GalCer AAPC stimuliert. Die Zellen wurden unter Verwendung Abs spezifisch für Vα24 + und Vβ11 + und mittels Durchflusszytometrie analysiert.
Diskussion
AAPC können verwendet werden, um die grundlegenden Anforderungen für NKT-Zell-Aktivierung zu untersuchen, und es hat auch potenzielle klinische Wert für ex vivo Expansion von NK-T-Zellen für den adoptiven Immuntherapie. Mescher et al. Beschrieben eine der ersten Sicke basierten Systemen, wo murine biotinylierten MHC-Klasse-I-Peptid-einkettige Konstrukte wurden mit biotinyliertem kostimulatorische Moleküle B7.1 und B7.2 über Streptavidin an der Oberfläche der Latex-Mikrokugeln 14, 15 kombiniert. Dieser Ansatz wurde erfolgreich verwendet, um Antigen-spezifische T-Zellen von transgenen Mäusen stimulieren. Da außerdem dieser Ansatz verwendet ein einzelnes MHC-Peptid-Komplex, um eine homogene Beladung der MHC-Moleküle zu gewährleisten, soll jedes Ziel Peptidantigen erfordern einen neuen Transfektion zur Expression des gewünschten Einzelketten-MHC-Peptid-Komplex, wodurch die Allgemeingültigkeit der Ansatz. Wichtig ist, Pionier Dr. Schneck die Gruppe den Wulst based-AAPC, durch die Entwicklung von weiteren nicht-zellulären bead based AAPC, Hergestellt durch Kuppeln HLA-Ig, das Signal 1 und Anti-CD28-, Signal 2, an magnetische Kügelchen. HLA-Ig, einem einzigartigen multimerer Form von HLA fusioniert mit einem Immunglobulin molekulare Gerüst 16, 17 wurde durch seine Gruppe entwickelt. Anschließend entwickelten sie MHC-Ig basierte AAPC, die gezeigt haben, um effektiv zu erweitern CMV und MART-1-spezifischen CTL 18. Hier haben wir gezeigt, dass CD1d-Ig basierten AAPC verwendet werden, um funktionelle NKT-Zellen zu expandieren. Eine Studie hat ein ähnliches System verwendet, um die physikalische Wechselwirkung von NK-Zellen mit 19 CD1d untersuchen.
Bemerkenswert ist, haben wir einen künstlichen Antigen-präsentierenden Zelle, die anpassungsfähig an jede Anforderung finden wir für optimalen NKT Zellproliferation konzipiert. Die AAPC Ausbau-Methode bietet eine einfache und zuverlässige Methode für die Erweiterung und Bereicherung menschlichen NKT-Zellen. Unsere AAPC können modifiziert werden, um systematisch die Rolle von einem Panel von potenziellen kostimulatorische Moleküle und beurteilen ihre Rolle auf NKT Zellproliferation werdention und Funktion. Somit stellen AAPC eine robuste vielseitige Technologie nützlich für die Induktion und den Ausbau NKT-Zellen. Die Erzeugung von aAPCs dauert weniger als eine Woche und ist geeignet für die Herstellung von großen Mengen von Perlen. Jedoch ist ein kritischer Schritt bei der Erzeugung des AAPC zu bestätigen, dass CD1d-Ig stabil auf der Oberfläche der Kügelchen immobilisiert und ihre Funktionalität zu beurteilen, um die Konsistenz von Charge zu Charge zu gewährleisten. Eine mögliche Einschränkung des Systems ist, dass es keinen Mechanismus, um auszuschalten Stimulierung, andere als mechanische Entfernung der Kügelchen. Insbesondere ist der Eingriff des T-Zell-Rezeptor (TCR) mit dem Antigen: CD1d/MHC komplexen erzeugen typischerweise die immunologische Synapsen im Konzert mit Zubehör / Adhäsionsmoleküle, die an der Induktion von inhibitorischen Faktoren oder suppressive sowohl auf der T-Zelle und zur Folge haben kann Antigen-präsentierende Zelle. Im AAPC Systems können diese Faktoren durch die T-Zelle hochreguliert werden, aber der Wulst nicht drücken die zugehörigen Ligandenfür diese Rezeptoren.
Zusätzlich CD4 + NKT-Zellen nachgewiesen wurde Antitumor Antworten in Mäusen und Menschen zu unterdrücken, daher ist es möglich, dass nicht selektive Aktivierung aller NKT-Zellen (dh globalen Stimulation mit α-GalCer) oder der Aktivierung des falschen Teilmenge könnte zu unerwünschten immunologischen führen Ergebnisse. Folglich muss ein phänotypisch und funktionell zu charakterisieren den AAPC-expanded NKT-Zellpopulation. Wie in 4 gezeigt, haben wir gefunden, dass Stimulation mit α-GalCer beladenen AAPC anti-CD28 exprimieren kann NKT-Zellen produziert Th1, Th2 und Th17 Typs Zytokinen kommen. Murine Studien wurde berichtet, dass Herausforderung mit IL-33, ein kürzlich identifizierten Cytokin, in erhöhten Konzentrationen von zirkulierenden inflammatorischen Zytokinen wie IL-5 und IL-13 führte. Behandlung von NKT-Zellen mit IL-33 verstärkt ihrer Zytokinproduktion 20. IL-33 ist ein spezifischer Ligand für ST2 und es hat sich gezeigt, dass lösliches ST2 ca.n Block IL-33-Signalisierung. Somit, als ein Beispiel für eine zukünftige Anwendung könnte AAPC exprimieren ST2 erzeugt und verwendet werden, um zu bestimmen, ob eine selektiv könnte hemmen die Produktion von Th2 Zytokine unter Induzierung Th1 Zytokinsekretion von NKT-Zellen. Es wurde auch berichtet, dass iv Injektion von Kb-exprimierenden AAPC in C57BL / 6 Mäusen führte zu einer verringerten Lungenmetastasen von Tumor 21. Wichtig ist, zeigen diese Daten, dass AAPC Datenverkehr an die Lunge und sind in der Lage, Effektor-T-Zell-Untergruppen aktivieren. Daher könnte ein zu generieren mehrere Arten von AAPC und untersuchen das Zusammenspiel von Antigen-spezifischen T-Zell-Untergruppen. Zusammenfassend zeigen diese Studien, dass CD1d-Ig basierte AAPC verwendet werden, um normale zelluläre APC zu ersetzen, und haben das Potenzial, um aktuelle klinische Ansätze für NKT zellbasierten-Immuntherapie verbessern.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Priyanka Subrahmanyam für hilfreiche Diskussionen danken. Die Autoren haben keine konkurrierenden finanzielles Interesse. Diese Arbeit wurde durch Zuschüsse aus dem American Cancer Society, NIH / NCI K01 CA131487, R21 CA162273, R21 CA162277 und P30 Tumorimmunologie und Immuntherapie Programm zum TJ Webb unterstützt. Der Inhalt ist allein in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung des National Cancer Institute oder dem National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Ficoll-Paque PLUS | GE Life Sciences | 17-1440 | |
| EasySep humanen T-Zell Enrichment Kit | StemCell Technologies | 19051 | |
| Allophycocyanin CD161 menschlichen mAb | Pharmingen | 550968 | |
| EasySep Magnet | StemCell Technologies | 18002 | |
| Anti-Maus-IgG1 Microbeads | Miltenyi Biotec | 130-047-101 | |
| Dimer XI rekombinante, lösliche Dimere Maus CD1d: IG Fusion Protein | BD Biosciences | 557599 | |
| Anti-CD28 mAb | BioLegend | 302914 | |
| M-450 Epoxy Perlen | Life Technologies | 150-11 | |
| Alpha-Galactosylceramid (KRN7000) | Axxora, LLC | BML-SL232-0100 | |
| RPMI 1640 Medium | Sigma Aldrich | R 0883 | |
| Natriumpyruvat | Gibco | 11360-070 | |
| Nicht-essentielle Aminosäuren | Gibco | 11140-050 | |
| Vitaminlösung | Gibco | 11120-052 | |
| 2-Mercaptoethanol | Gibco | ||
| Ciprofloxacin | Alexis Biochemicals | 380-288-G025 | |
| PE-Vα24Jα18 | BioLegend | 342904 | |
| PE-Vα24 (Klon C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Klon C21) | Beckman Coulter | A66905 | |
| PE-CD1d | BioLegend | 123510 | |
| PE-anti-Maus-IgG1 | BD Biosciences | 556650 | |
| FITC-anti-Maus IgG2a | BioLegend | 407105 | |
| DPBS, kein Kalzium, kein Magnesium | Life Technologies | 14190250 | |
| Natriumazid | Sigma Aldrich | S8032 | |
| Rinderserumalbumin | Amerikanischen Bioanalytical | AB00440-00100 | |
| EDTA | Sigma Aldrich | 431788 | |
| IL-2 (Proleukin) | BD Biosciences | 354043 | |
| Humanem AB Serum | Atlanta Biologicals | S40110 | |
| Labquake Tube Rotator | Fisher Scientific | 13-687-10Q | |
| BD Falcon 5 ml Polystyrol Rundboden-Röhrchen | Fisher Scientific | 14-959-1A | |
| Wheaton Glass Probenflaschen mit Cap | Fisher Scientific | Klein (03 bis 343-6A) Groß (03-343-6E) |
Referenzen
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten