Method Article
Antigen המלאכותי הצגת תא הפעלה (aAPC) מתווכות והרחבת תאי T קטלניים טבעיים
* These authors contributed equally
In This Article
Summary
כאן אנו מתארים שיטה להפעלה והרחבת תאי NKT אדם מאוכלוסיות תאי T בתפזורת באמצעות תאי מציגי אנטיגן מלאכותיים (aAPC). השימוש בaAPC CD1d המבוסס מספק שיטה סטנדרטית ליצירת מספר רב של תאי NKT פונקציונליים.
Abstract
רוצח תאי T טבעיים (NKT) הם תת קבוצה ייחודית של תאי T המציגים סמנים אופייניים לשניהם רוצח טבעי (NK) תאים ותאי T 1. בניגוד לתאי T קלסיים, תאי NKT להכיר אנטיגן שומנים בהקשר של מולקולות CD1 2. תאי NKT להביע התארגנות שרשרת TCRα invariant: Vα14Jα18 בעכברים וVα24Jα18 בבני אדם, אשר מזוהים עם שרשרות Vβ גיוון מוגבל 3-6, והם מכונים תאים קנוניים או invariant NKT (i NKT). בדומה לתאי T קונבנציונליים, תאי NKT מתפתחים מתאי T מסוג CD4-CD8 מבשרים-הרתי לאחר האיתות המתאימה של 7 CD1d. הפוטנציאל לניצול תאי NKT למטרות טיפוליות גדל באופן משמעותי ביכולת לעורר ולהרחיב תאי NKT אדם עם α-Galactosylceramide (α-GalCer) ומגוון של ציטוקינים 8. חשוב מכך, תאים אלה נשמרים phenotyp המקורי שלהםדואר, ציטוקינים מופרשים, ותפקוד ציטוטוקסיות מוצג נגד שורות תאים סרטניות. לכן, תאי גופיים מורחבים NKT להישאר פונקציונליים ויכולים לשמש לחיסון מאמצת. עם זאת, טיפול חיסוניים מבוסס-תא NKT הוגבל על ידי השימוש בתאי מציגי אנטיגן autologous והכמות והאיכות של תאי ממריץ אלה יכולים להשתנות במידה ניכרת. DC Monocyte המופק מחולי הסרטן כבר דיווח להביע רמות הנמוכות של מולקולות costimulatory ולייצר ציטוקינים דלקתיים פחות 9,10. למעשה, DC עכברי ולא APC העצמי כבר בשימוש על מנת לבחון את תפקודם של תאי NKT מחולי CML 11. עם זאת, מערכת זו יכולה לשמש רק לבדיקות במבחנה שכן לא ניתן להרחיב על ידי תאי NKT DC העכברי ולאחר מכן משמשים לחיסון מאמצת. לפיכך, מערכת סטנדרטית המסתמכת על תאים המציגים Antigen מלאכותיים (aAPC) יכולה לייצר את ההשפעות הממריצות של DC ללא חסרונות של allo או xenogeneic ce12 LLS, 13. בזאת, אנו מתארים שיטה ליצירת aAPC CD1d מבוסס. מאז האירוסים של הקולטן תא T (TCR) קומפלקסי אנטיגן CD1d הוא דרישה בסיסית של הפעלת NKT תא, אנטיגן: קומפלקסי CD1d-IG לספק שיטה אמינה לבודד, להפעיל, ולהרחיב את אוכלוסיות תאי NKT מפעיל.
Protocol
1. דור של aAPC
- לפני הוספת חלבונים לחרוזים, להכין את כל המגיבים וחוצצים: 0.1M borate החיץ; 1X D-PBS (ללא Ca 2 + וMg 2 +); מאגר שטפי חרוז (1X PBS +5% אנוש א.ב. סרום + 0.02% יזיד נתרן) ; בינוני שלם (100 פירובט RPMI הבינוני mM נתרן, ויטמין פתרון שאינו חיוני 10 מ"מ, 100 מ"מ פתרון MEM ויטמין, 1% -2 mercaptoethanol, ציפרופלוקסאצין מיקרומטר 10, 5% אנוש א.ב. סרום); חיץ MACS (1 ליטר PBS החופשי של Ca 2 + וMg 2 +, 5 גרם BSA, וmmol EDTA 2).
- שטוף 1 M-450 חרוזי מיליליטר Dynabeads אפוקסי עם חיץ 3 מ"ל סטרילי 0.1 מ 'borate (חומצה בורה ומים, ה-pH 7.0-7.4) בבקבוקון 5 מ"ל ברור ורוסיליקט זכוכית מושחלת.
- בצינור נפרד microcentrifuge 1.5 מ"ל, להוסיף 100 מיקרוגרם איג hCD1d-dimer ו20 מולקולות costimulatory מיקרוגרם (לדוגמה: אנטי CD28mAb) למיליליטר PBS w / o Ca 1 2 + או Mg 2 +.
- מקום חרוז המכיל בקבוקון זכוכית על מגנט וחיץ borate aspirate מחרוזים. מוסיף את תערובת חלבונים מצעד 1.2 לבקבוקון ולהחליף כובע. מערבב מייד על ידי היפוך הבקבוקון, לכסות את המכסה עם parafilm, ומניח על כתף ודגירת הלילה ב 4 ° C.
- למחרת, בקבוקון זכוכית המקום על מגנט ולהסיר תערובת חלבונים, תוך הימנעות חרוזים בזהירות. שטוף את החרוזים על ידי הוספת 3 מיליליטר חיץ חרוז לשטוף (PBS עם 5% AB סרום 0.02% יזיד נתרן), ודוגרים ב 4 ° C על כתף למשך 5 דקות. חזור פעמים.
- חרוזים יכולים להיות מאוחסנים בתערובת לשטוף החרוז הזה. כדי להפוך aAPC הפונקציונלי, להסיר aliquot קטן ולספור את החרוזים באמצעות hemacytometer. בדקו כי החלבונים נטענים ביציבות על החרוזים ע"י השאירו עם נוגדנים (אנטי עכבר דוגמה PE-מצומדות IgG1) וביצוע ניתוחיים תזרים cytometric.
- כדי לטעון חרוזים עם אנטיגן, להסיר 5 x 10 7 חרוזים, ולהוסיף לבקבוקון 1.5 מ"ל, לשטוף עם חרוזי המ"ל סטרילי PBS 1. Resuspend שטף עם חרוזי המ"ל סטרילי PBS 1 ולהוסיף אנטיגן; דוגמה: טעינה עם α-GalCer/KRN7000 (5mg/ml). * הערה: אמנם, יש לנו לא זוהו בעיות כלשהן עם מסיסות שומנים או היווצרות micelle, שומנים צריכים יטופל בהתאם להמלצות יצרן. באופן ספציפי, KRN7000 הורכב מחדש בDMSO (1mg/ml) ללימודים אלה. KRN7000 ואנטיגנים glycolipid אחרים יכולים גם להיות מומס ב0.2 מ"ג / המ"ל PBS המכיל 0.5% Tween-20 (sonicate 2 שעות. על 37 מעלות צלזיוס). חשוב-aAPC צריך להיות טעון לפחות 48-72 שעות לפני שימוש.
2. בידוד של CD161 + + תאי CD3
- איסוף תאי mononuclear דם היקפיים (PBMC). להפרדת Ficoll צפיפות שיפוע צנטריפוגה של לימפוציטים ממעייל באפים או חפיסת leukopheresis, לדלל את דם heparinized ראשון עם נפח שווה של 1X PBS בטמפרטורת חדר.
- הוסף 15 מ"ל של Ficoll (חמם לטמפרטורת חדר) עד 50 צינורות חרוטי מ"ל. לאט כיסוי25 מ"ל של תערובת הדם המדוללת על גבי Ficoll. צנטריפוגה בסל"ד 2000 למשך 30 דקות בטמפרטורת חדר עם הבלם כבוי.
- מוציא בזהירות את ממשק הלימפוציטים (טבעת לבנה בין התקשורת וFicoll) עם פיפטה פסטר ולהעביר לצינור חדש 50 מיליליטר חרוטים.
- לשטוף את התאים על ידי מילוי הצינור עד 50 מ"ל עם PBS וצנטריפוגה בסל"ד 1500 למשך 5 דקות. בטל supernatant ולשלב את השפופרות מאדם אחד ליחיד צינור ולשטוף את תאי mononuclear דם ההיקפיים (PBMC) שוב עם 20 המ"ל PBS. ואז לספור PBMC וresuspend בריכוז של 5 10 7 תאים / מ"ל במאגר MACS x (1 ליטר PBS ללא Ca 2 + וMg 2 +, 5 גרם BSA, ו 2 mmol EDTA).
- כדי לבודד את החלק היחסי של תאי T, להתחיל עם 2 מ"ל של PBMC (10 8 תאים) ולהוסיף 100 μl של פתרון פאן תא T העשרה מקיט EasySep אנוש T Cell ההעשרה. דגירה בטמפרטורת חדר למשך 10 דקות.
- הוסף 100 μl של חלקיקים מגנטיים לפתרון ולדגור בטמפרטורת חדר למשך 10 דקות נוספות. להביא את הנפח הסופי של מיליליטר הממס ל -2.5 ולמקם את הצינור במגנט הסגול למשך 5 דקות. מהירות לשפוך את CD3 + השבריר לתוך צינור חרוטים 15 מ"ל.
- לשטוף את התאים על ידי הוספת 5 מיליליטר חיץ קר MACS, לספור את מספר תאי קיימא, ולהסיר aliquot להכתמת FACS.
- כדי לבחור את CD161 + תאים, תאי T מועשר 1 resuspend במאגר 980 μl קרח קר MACS, להוסיף 10 מיקרוגרם אנטי CD161 מאב, ודגירה במקרר למשך 10 דקות.
- צנטריפוגה התאים ב 1500 סל"ד ב 4 מעלות צלזיוס למשך 5 דקות. ואז לשחזר את התא גלול ב 800 μl של חיץ MACS. הוסיפו 200 μl של IgG1 microbeads אנטי עכבר ודגירת הפתרון עבור 10 דקות ב 4 ° C.
- במהלך שלב דגירה זה, לאזן עמודת LS ידי הוספת חיץ 3 מ"ל MACS.
- בשלב בא, לשטוף את התאים על ידי צנטריפוגה 1500 סל"ד ב 4 מעלות צלזיוס למשך 5 דקות. Resuמבלה את התאים בחיץ 3 מ"ל MACS. אז פיפטה את התאים לעמודה המפרידה MACS LS. הקפידו להימנע מיצירת בועות על ידי pipetting באיטיות. שטוף את העמודה על ידי הוספת 3 מ"ל של חיץ MACS. חזור פעמים.
- הוסף 3 מיליליטר חיץ MACS טרי ולהסיר עמודה ממגנט. עמודת מקום לתוך צינור חרוטי 15 מ"ל. הכנס בוכנה ולדחוף את התכולה להשיג מטוהרים CD161 + CD3 + תאים. תא NKT רוזן מועשר שבריר. אתה צריך 2-4000000 תאים.
3. הרחבת תא NKT aAPC בתיווך
- הגדרת שיתוף תרבות על ידי הוספת 10 6 מועשרים CD161 + CD3 + תאי T ו10 6 aAPC במדיום שלם מ"ל 16 (בינוני מלאים + IL-2, 100 U / ml). צלחת תערובת זו על ידי הוספת הנפח 160 μl / גם סופי ל96 פוליסטירן טופל רקמות תרבות היטב, צלחת U-תחתונה עם מכסה-אידוי נמוך. לבצע חילופים בינוניים בכל יום 7 בידי הוספת 80 μl של מדיום טרי.
- קצירתאים, לספור ולבצע צביעת FACS ביום 12-14.
- תאי NKT המורחבים ניתן replated כפי שתואר לעיל בשלב 3.1, במיוחד resuspend 10 6 תאי T מורחבים ו10 6 aAPC במדיום 16 מ"ל מלא. צלחת תערובת זו על ידי הוספת 160 μl / גם ל96 גם צלחת U-תחתונה. תמשיך לרענן בינוני coculture כל יום 7 בידי הוספת 80 μl של מדיום טרי.
- עדיף להקפיא תאי NKT נוספים בעקבות הסיבוב השני של רחבה (1 6 x10 / cryovial ב1 מ"ל-5% DMSO / 95% FBS).
4. מבחן פונקציונלי: גירוי aAPC בתיווך של תאי NKT
- הגדרת 5x10 4 תאי NKT / היטב עם 5x10 5 aAPC בנפח 200 μl סופי (בינוני מלא) ב96 גם צלחת U-תחתונה.
- supernatant קציר תא התרבות לELISA לאחר 24-48 שעות.
תוצאות
מסמך זה אנו מתארים שיטה ליצירת CD1d-איג aAPC מבוסס, שנעשה על ידי צימוד קוולנטי של CD1d-איג ואנטי CD28 מאב לחרוזים מגנטיים כדי לעורר תאי NKT כשיטה סטנדרטית להפצת תאי NKT (איור 1). ראשית, יש להוכיח כי חלבוני היתוך CD1d-IG הם משותקים ביציבות על פני השטח של החרוזים המגנטיים. כפי שמוצג באיור 2 א, CD1d-איג ואנטי CD28 נוגדנים הן הביעו על פני השטח של החרוזים המגנטיים. כדי לבחון את היכולת של גירוי aAPC, אנחנו hybridomas סלולארי שיתוף עם תרבית NKT aAPC הלילה, נקצר supernatants התרבות וייצור IL-2 שנמדד על ידי ELISA. מצאנו כי CD1d-איג המבוסס aAPC הצליח לעורר את hybridomas הסלולרי NKT ברמות שווות או גבוהות יותר מאשר עמיתיהם הסלולריים (איור 3, נתונים אינם מוצגים). מעניין, מצא כי hybridomas הסלולרי NKT עכברנו מומרצים ע"י aAPC האנושי CD1d המבוסס (Figure 2B), אשר מספק שיטה פשוטה לבדיקה של כל אצווה של aAPC.
בשלב בא, אנו מבקשים להדגים את פוטנציאל ההתפשטות של aAPC, תאי T וכך אדם בודדו מהדם ההיקפי. ראשית CD161 + + CD3 שבריר תא T הועשר על ידי הפרדת חרוז מגנטית. לאחר מכן, תאי T היו מגורה מידי שבועות עם α-GalCer הטעון aAPC. חשוב מכך, מצאנו כי גם באוכלוסייה נמוכה יחסית ראשונית NKT תא (0.03%), הצליח להרחיב את התאים ל ~ 67% + Vα24 Vβ11 + (איור 3). הרחבנו תאי NKT מPBMC של מתנדבים בריאים וחולי סרטן רבים ומצאנו כי α-GalCer הטעון aAPC הצליח להרחיב את אוכלוסיית NKT תאים בשתי הקבוצות. יש לציין, כי קצב ההתפשטות היה מאוד תורם תלוי. כצפוי אוכלוסייה הראשונית הגבוהה יותר של תאי Vα24 +, האחוז הגדול יותר של התרחבות. בנוסף,בעת שימוש באוכלוסיית מוצא של 2 מיליון תאים CD161 + CD3 + תאי T, ניתן לקבל> 10 7 תאים אחרי שני סיבובים של התרחבות (טבלה 1). כ 80-90% מתאי NKT המורחבים הם מסוג CD4 +, 5% ~ CD8 +, והנותרים הם כנראה תאי NKT שליליים CD4-CD8-כפולים. תאי NKT מורחבים אלו יכולים לשמש למחקרים פונקציונליים כפי שמוצגים באיור 4A-C. אנחנו גילינו שvivo לשעבר שלנו התרחב תאי NKT יישארו מגיבים לגירוי α-GalCer ומפיקים עצמה של IL-17A, TNF-α, IFN-γ ו. יש לציין שאם אוכלוסיית העשרת תא T הראשונית היא נמוכה, והוא אינו מסוגל לבצע את צעד העשרת CD161 השני, התרחבות aAPC בתיווך לא תניב את התוצאות מקוות (ראה איור 4D, תורם 1). עם זאת, אם אחוז התאים במחזור NKT גבוה מ -0.1%, אחד עדיין צריכה להיות מסוגל לקבל הרחבה משמעותיתשל תאי i NKT. באופן קולקטיבי, נתונים אלה מראים כי מבוססי aAPC CD1d ניתן להשתמש ביעילות כדי להרחיב ולעורר תאי NKT אנושיים ראשוניים.

איור 1. תרשים סכמטי של CD1d: aAPCs איג מבוסס מנות תאיות של מולקולת CD1d מתמזגים לאזור הקבוע של שרשרת כבדה חלבון אימונוגלובולין מופרד על ידי מקשר חומצת אמינו קצר. מולקולות אלה ניתן לטעון בקלות עם אנטיגנים שומנים, כגון α-GalCer, פשוט על ידי דוגר אותם עם עודף של השומנים בדם של עניין. aAPC נעשה על ידי צימוד CD1d-איג ואנטי תקליטור Abs לחרוזים מגנטיים. במערכת זו, CD1d-איג משמש כדי לספק את האות מאותו המקור של אנטיגן הספציפי לדרך TCR ואנטי CD28 MAB מספק את אות costimulatory.

איור 2. . מכתים FACS של חלבונים שעל פני aAPCs) A aAPCs נבדקו לנוכחות של CD1d: IgG דימר (באמצעות צביעה עם PE-מצומדות IgG1 אנטי עכבר) כמו גם הנוגדן אנטי-CD28 (באמצעות אנטי עכבר IgG2a FITC מצומדות) היסטוגרמות. פתוחה מצביעה שליטת אלוטיפ; היסטוגרמות מלאה מייצגת את הנוגדנים שצוינו. CD1d-איג aAPC הבעה יכולה לעורר IL-2 ייצור על ידי תאי NKT. B) Vα14 + עכבר NKT תאי היברידומה, DN32.D3, הייתה cocultured עם או בינוני, אנטיגן המסיס (α-GalCer), נפרק aAPC או α-GalCer הטעון aAPC. supernatants התרבות נקצרו והכריך ELISA הסטנדרטי שמש למדידת IL-2 ייצור.

איור 3. התרחבות של תאים על ידי תאי NKT CD1d-IG מצופים מלאכותיים מציגי אנטיגן. () ראשוני CD3 + CD161 + תאים חיוביים כפולים בודדו מPBMCs באמצעות הפרדה מגנטית. התאים הממוינים היו מגורה עם α-GalCer טעון, aAPC המצופה CD1d-איג במשך 14 ימים. התאים היו מוכתמים לגירוי Vα24 וVβ11 aAPC הבא. (ב) תא NKT האנושי ראשוני מתווך תמוגה של קו לימפומה תא B. תאי C1R-CD1d מודגרות עם תאי NKT ביחסים המצוינים בנוכחותו או היעדריו של אנטיגן,-GalCer (100 ng / ml) בצלחות U-96-תחתון גם עבור 20-24 שעות. תמוגה תא בתיווך תא NKT הוערכה על ידי על ידי assay הסטנדרטי 51Cr לשחרור.
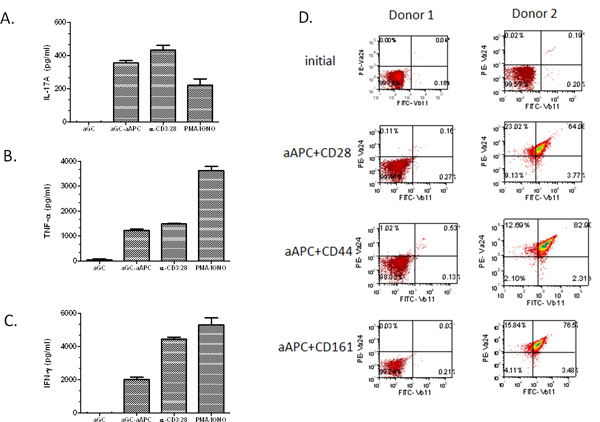
איור 4. פרופילי ציטוקינים של תאי NKT aAPC-מורחבים. לאחר גירוי עם α GalCer הטעון aAPC במשך שבועות, את תאי NKT המורחבים (1 × 10 5 / הטובים) היו cocultured עם מסיס α-GalCer, PMA / Ionomycin, anti-CD3/28 microbeads, או α-GalCer הטעון aAPC (2 × 10 5 / טוב) עבור 48 שעות. () IL-17 א, (ב) TNF-α, ו( C) IFN-γ ייצור נמדד על ידי ציטוקינים ELISA הסטנדרטית. נתונים המוצגים הם ייצור ציטוקינים נטה לאחר הפחתת הפקדים השליליים (תקשורת וחרוזים ריקים). (ד) תאי T ראשוניים בודדו מPBMC באמצעות הפרדת חרוז מגנטית. התאים הממוינים היו מגורה במשך שבועות עם האינדיקציה טעונה-aAPC-GalCer. התאים הוכתמו באמצעות שרירי בטן ספציפיים לVα24 + + וVβ11 ונותח על ידי cytometry זרימה.
Discussion
aAPC ניתן להשתמש כדי ללמוד את הדרישות הבסיסיות להפעלת תא NKT ויש לה ערך קליני פוטנציאל התרחבות vivo לשעבר של תאי NK T לחיסון מאמצת. Mescher et al. תאר אחת מהמערכות המבוססות על החרוז הראשונות, שבו כיתת MHC עכברית biotinylated I-פפטיד בודד מבני שרשרת בשילוב עם מולקולות costimulatory biotinylated B7.1 וB7.2 דרך streptavidin למשטח הלטקס microspheres 14, 15. גישה זו הצלחה נוצלה כדי לעורר תאי T אנטיגן ספציפיים מעכברים מהונדסים. בנוסף, מאחר שגישה זו משתמשת מורכבת שרשרת אחת MHC-פפטיד כדי להבטיח טעינה הומוגנית של מולקולות MHC, כל אנטיגן פפטיד היעד ידרוש transfection חדש לביטוי המורכב שרשרת האחת הרצוי MHC-פפטיד, ובכך להגביל את הכלליות של גישה. חשוב מכך, קבוצתו של ד"ר שנק חלוץ מבוסס aAPC חרוז, על ידי פיתוח aAPC מבוסס חרוז אחר בלתי תאי, שנעשה על ידי צימוד HLA-איג, אות 1, ואנטי CD28, אות 2, על חרוזים מגנטיים. HLA-איג, צורת multimeric ייחודית של HLA התמזגה לאימונוגלובולינים 16 פיגום מולקולרי, 17 פותח על ידי קבוצתו. כתוצאה מכך, הם פתחו איג-MHC המבוסס aAPC, אשר הוכח ביעילות להרחיב CMV וMART-1 CTL 18 ספציפי. הנה, יש לנו הראינו כי aAPC המבוסס CD1d-איג יכול לשמש כדי להרחיב את תאי NKT פונקציונליים. מחקר אחד השתמש במערכת דומה כדי לבחון את האינטראקציה הפיסית של תאי NK עם CD1d 19.
יש לציין, שתוכננו תא מציג אנטיגן מלאכותי הניתן להתאמה לכל דרישות שאנו מוצאים הכרחיים לשגשוג תאי NKT אופטימלי. שיטת התרחבות aAPC מספקת שיטה פשוטה ואמינה להרחבה והעשרת תאי NKT אדם. aAPC שלנו יכולה להיות שונה באופן שיטתי כדי להעריך את תפקידו של פנל של מולקולות costimulatory פוטנציאליות ולהעריך את תפקידם בתא NKT proliferation ותפקודו. לפיכך, aAPC מייצג טכנולוגיה תכליתית חזקה שימושית לזירוז והרחבת תאי NKT. הדור של aAPCs לוקח פחות משבוע והוא מתאים לייצור כמויות גדולות של חרוזים. עם זאת, שלב קריטי בהפקת aAPC הוא לאשר שCD1d-איג משותק ביציבות על פני השטח של החרוזים ולהעריך את הפונקציונליות שלהם על מנת להבטיח עקביות מ תצוו תצווה. הגבלת פוטנציאל של המערכת היא שאין מנגנון במקום כדי לכבות את הגירוי, מלבד הסרה מכאנית של החרוזים. באופן ספציפי, המעורבות של הקולטן התא T (TCR) עם אנטיגן: המורכב בדרך כלל לייצר CD1d/MHC סינפסה האימונולוגית בתיאום עם מולקולות אבזר / הדבקה, מה שיכול לגרום לאינדוקציה של גורמים מעכבים או מדכאים הוא בתא וטי מציגי אנטיגן תא. במערכת aAPC, גורמים אלה עשויים להיות upregulated ידי תא T, אבל החרוז לא יביע את ligands מאותו המקורלקולטנים אלה.
בנוסף, תאים מסוג CD4 + NKT הוכחו לדכא תגובות antitumor בעכברים ובבני אדם, ולכן ייתכן כי הפעלת סלקטיבי של כל תאי NKT (גירוי הגלובלי כלומר עם α-GalCer) או ההפעלה של המשנה השגוי עלולה לגרום חיסוני לא רצוי תוצאות. כתוצאה מכך, יש phenotypically ופונקציונלי לאפיין את אוכלוסיית תא NKT aAPC-המורחבת. כפי שמוצג בתרשים 4, שגילינו כי גירוי עם α-GalCer הטעון aAPC להביע אנטי CD28 יכול לגרום תאי NKT ייצור Th1, Th2, וציטוקינים סוג Th17. מחקרי Murine דיווחו כי אתגר עם IL-33, ציטוקינים זוהו לאחרונה, הביא לעלייה ברמות מחזור ציטוקינים דלקתיים כגון IL-5 ו IL-13. טיפול בתאי NKT עם IL-33 שופר ייצור ציטוקינים 20 שלהם. IL-33 הוא ספציפי לליגנד ST2 והוכיח שמסיס ST2 can לחסום IL-33 איתות. כך, כדוגמה ליישום בעתיד, ST2 להביע aAPC יכול להיות שנוצר ומשמש כדי לקבוע אם אחד סלקטיבי יכול לעכב את הייצור של ציטוקינים Th2 תוך גרימת הפרשת ציטוקינים על ידי תאי Th1 NKT. כמו כן, דווח כי זריקת IV של Kb-להביע aAPC לC57BL / 6 עכברים גרמו לגרורות ריאות ירידה של 21 גידול. חשוב לציין, הנתונים אלה מראים כי תנועת aAPC לריאות והם מסוגלים להפעיל את תאי ה T תת מפעיל. לכן, אפשר להפיק סוגים שונים של aAPC ולבחון את יחסי הגומלין בין תת קבוצות של תאי T הספציפיות לאנטיגן. לסיכום, מחקרים אלה מראים כי aAPC המבוסס CD1d-איג יכול לשמש תחליף APC הסלולרי הרגיל, ויש לפוטנציאל לשפר גישות קליניות נוכחיות לטיפול חיסוני תא NKT מבוסס מאמץ.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
המחברים מבקשים להודות לPriyanka Subrahmanyam לדיונים מועילים. המחברים לא היו מתחרים אינטרס כלכלי. עבודה זו נתמכה על ידי מענקים מהאגודה האמריקנית לסרטן, NIH / NCI CA131487 K01, R21 CA162273, R21 CA162277, ואימונולוגיה של גידולים P30 ותכנית חיסונית לTJ ווב. התוכן הוא באחריות בלעדית של הכותבים ולא בהכרח מייצג את הדעות הרשמיות של מכון הלאומי לסרטן או המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| Ficoll-Paque PLUS | GE מדעי חיים | 17-1440 | |
| ערכת EasySep אנוש T Cell העשרה | טכנולוגיות StemCell | 19051 | |
| Allophycocyanin CD161 האנושי MAB | Pharmingen | 550968 | |
| EasySep מגנט | טכנולוגיות StemCell | 18002 | |
| אנטי עכבר IgG1 microbeads | Miltenyi BIOTEC | 130-047-101 | |
| דימר XI רקומביננטי המסיס dimeric העכבר CD1d: חלבון היתוך IG | BD Biosciences | 557599 | |
| Anti-CD28 MAB | Biolegend | 302914 | |
| חרוזי M-450 אפוקסי | חי טכנולוגיות | 150-11 | |
| Alpha-galactosylceramide (KRN7000) | Axxora, LLC | BML-SL232-0100 | |
| 1640 בינוניים RPMI | סיגמה אולדריץ | R 0883 | |
| פירובט נתרן | Gibco | 11360-070 | |
| חומצות אמינו לא חיוניות | Gibco | 11140-050 | |
| פתרון ויטמין | Gibco | 11120-052 | |
| 2-mercaptoethanol | Gibco | ||
| ציפרופלוקסאצין | Biochemicals אלקסיס | 380-288-G025 | |
| PE-Vα24Jα18 | Biolegend | 342904 | |
| PE-Vα24 (Clone C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Clone C21) | Beckman Coulter | A66905 | |
| PE-CD1d | Biolegend | 123510 | |
| PE אנטי העכבר IgG1 | BD Biosciences | 556650 | |
| FITC אנטי עכבר IgG2a | Biolegend | 407105 | |
| DPBS, לא סידן, מגנזיום לא | חי טכנולוגיות | 14190250 | |
| יזיד הנתרן | סיגמה אולדריץ | S8032 | |
| שור הסרום אלבומין | אמריקאי Bioanalytical | AB00440-00100 | |
| EDTA | סיגמה אולדריץ | 431788 | |
| IL-2 (Proleukin) | BD Biosciences | 354043 | |
| אדם א.ב. סרום | אטלנטה ביולוגית | S40110 | |
| Rotator Tube Labquake | הפישר סיינטיפיק | 13-687-10Q | |
| BD פלקון 5 צינורות קלקר מיליליטר ישבן עגול | הפישר סיינטיפיק | 14-959-1A | |
| בקבוקוני זכוכית לדוגמא יטון עם כובע | הפישר סיינטיפיק | קטן (03-343-6A) גדול (03-343-6E) |
References
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved