Method Article
Искусственные антигенпрезентирующей клетки (AAPC) Активация опосредованной и расширение естественных клеток-T убийца
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы опишем метод для активизации и расширения человеческих клеток NKT от объемных T клеточных популяций с использованием искусственных антиген представляющих клеток (AAPC). Использование CD1d на основе AAPC обеспечивает стандартизированный метод для генерации большого числа функциональных клеток NKT.
Аннотация
Природные убийцы T (NKT) клетки являются уникальными подмножество Т-клеток, которые отображают характерные маркеры как естественные киллеры (NK) клетки и Т-клетки 1. В отличие от классических Т-клетки, NKT-клетки распознают антиген липидов в контексте CD1 молекул 2. NKT клетки экспрессируют инвариантной TCRα перестройкой цепочки: Vα14Jα18 у мышей и Vα24Jα18 у людей, которые связаны с Vβ цепи ограниченное разнообразие 3-6, и называются каноническими или инвариантной NKT (я NKT) клеток. Как и обычные Т-клетки, NKT клетки развиваются из CD4-CD8-тимуса клеток-предшественников Т после соответствующей сигнализацией по CD1d 7. Потенциал использования NKT клеток в терапевтических целях, значительно возросло с возможностью стимулирования и расширения человеческих клеток NKT с α-Galactosylceramide (α-GalCer) и различные цитокины 8. Важно отметить, что эти клетки сохранили свои оригинальные phenotypе, секретируемых цитокинов, и отображается цитотоксические функции в отношении опухолевых клеточных линий. Таким образом, экс естественных условиях расширенного NKT клетки остаются функциональными и могут быть использованы для приемных иммунотерапии. Тем не менее, NKT клетки на основе-иммунотерапии было ограничено использование аутологичных антиген представляющих клеток, количество и качество этих стимуляторов клетки могут существенно отличаться. Моноцитов постоянного тока от онкологических больных были зарегистрированы, чтобы выразить снижение уровня костимуляторных молекул и производят меньше воспалительных цитокинов 9,10. В самом деле, мышиный DC, а не аутологичных APC были использованы для тестирования функции клеток NKT от больных ХМЛ 11. Тем не менее, эта система может быть использована только в пробирке тестирования, так как NKT клетки не могут быть расширены путем мышиный DC, а затем использоваться для приемных иммунотерапии. Таким образом, стандартизированная система, которая опирается на искусственном антиген представляющих клеток (AAPC) может производить стимулирующие эффекты постоянного тока без подводных камней алло-и ксеногенных се12 ООО, 13. Здесь мы опишем метод генерации CD1d на основе AAPC. Так как участие Т-клеточного рецептора (TCR) по CD1d-антиген является фундаментальным требованием NKT активации клеток, антиген: CD1d-Ig комплексы обеспечивают надежный способ, чтобы изолировать, активировать и расширить эффекторные клетки NKT населения.
протокол
1. Генерация AAPC
- Перед добавлением белков, бисер, подготовить все реагенты и буферы: 0,1 Борат буфера; 1X D-PBS (без Ca 2 + и Mg 2 +); бисера промывочного буфера (PBS 1X +5% сыворотки человека AB + 0,02% азида натрия) , полная среды (RPMI среде +100 мм пирувата натрия, 10 мМ несущественные витамина решения, 100 мМ MEM Витамин раствора, 1% 2-меркаптоэтанола, 10 мкМ ципрофлоксацина, 5% сыворотки человека AB); MACS буфера (1 л PBS бесплатно Са 2 + и Mg 2 +, 5 г BSA, и 2 ммоль ЭДТА).
- Промыть 1 мл Dynabeads M-450 бусин Эпоксидные с 3 мл стерильного 0,1 М бората буфере (борная кислота и вода, рН 7.0-7.4) в 5 мл прозрачного стекла боросиликатного резьбовых флаконе.
- В отдельной трубке микроцентрифужных 1,5 мл, добавляют 100 мкг hCD1d-Ig димера и 20 мкг костимуляторных молекул (например, анти-CD28mAb) в 1 мл PBS без Ca 2 + и Mg 2 +.
- Место шарик стеклянный флакон, содержащий от магнита и аспирата буфера борат из бисера. Добавить белковая смесь с шагом от 1,2 до стеклянный флакон и заменить крышку. Смешать сразу обращением флакон, покрытие крышки с парафином, и место на ротатор и инкубировать в течение ночи при 4 ° C.
- На следующий день, место стеклянный флакон на магните и удалить белковая смесь, тщательно избегая бисера. Вымойте бисером, добавив 3 мл борта промывочного буфера (PBS с 5% сывороткой AB +0,02% азида натрия), и инкубации при 4 ° С на ротатор в течение 5 мин. Повторите два раза.
- Бусины могут быть сохранены в этой смеси шарик стирки. Для того, чтобы функциональной AAPC, удалить небольшие аликвоты и считать бусины помощью гемацитометре. Убедитесь, что белки стабильно загружены на бусин путем окрашивания с антителами (например, PE-сопряженных анти-мышиных IgG1) и выполнение проточной цитометрии анализа.
- Чтобы загрузить бусины с антигеном, удалить 5 х 10 7 бусин, и добавить к небольшой стеклянный пузырек 1,5 мл, промойте бусины с 1 мл стерильной PBS. Resuspend промывают бусины с 1 мл стерильной PBS и добавляют антиген, например: нагрузка с α-GalCer/KRN7000 (5mg/ml). * Примечание: в то время, мы не обнаружили никаких проблем с растворимостью липидов или мицеллообразования, липиды должны быть обработаны в соответствии с рекомендациями завода-изготовителя. В частности, KRN7000 была воссоздана в ДМСО (1mg/ml) для этих исследований. KRN7000 гликолипидов и других антигенов может быть растворено в 0,2 мг / мл PBS, содержащем 0,5% твин-20 (разрушать ультразвуком 2 час. При 37 ° C). ВАЖНО: AAPC должны быть загружены, по крайней мере 48-72 часов перед использованием.
2. Выделение CD161 + CD3 + клеток
- Сбор мононуклеарных клеток периферической крови (МПК). Для Ficoll центрифугирования в градиенте плотности разделения лимфоцитов из светлого сгустка крови или leukopheresis упаковке, в первую разбавлять гепаринизированной крови с равным объемом 1X PBS при комнатной температуре.
- Добавить 15 мл Ficoll (нагревают до комнатной температуры) до 50 мл конические пробирки. Медленно наложением25 мл разбавленной смеси крови в верхней части Ficoll. Центрифуга при 2000 оборотов в минуту в течение 30 мин при комнатной температуре с тормозной прочь.
- Осторожно снимите лимфоцитов интерфейс (белое кольцо между СМИ и Ficoll) с пипетки Пастера и перенести в новый 50 мл коническую трубку.
- Вымойте клетки, заполняя трубы до 50 мл PBS и центрифугирования при 1500 оборотах в минуту в течение 5 мин. Удалите супернатант и объединить трубы от одного человека к одной трубке и мыть мононуклеарных клеток периферической крови (МПК) снова с 20 мл PBS. Затем посчитайте PBMC и ресуспендируют в концентрации 5 х 10 7 клеток / мл в буфере MACS (1 л PBS бесплатно Ca 2 + и Mg 2 +, 5 г BSA, и 2 ммоль ЭДТА).
- Для того, чтобы изолировать T фракции клеток, начните с 2 мл PBMC (10 8 клеток) и добавить 100 мкл Pan Т-клеток обогащения решение от EasySep правам T Kit обогащению Cell. Выдержите при комнатной температуре в течение 10 мин.
- Добавить 100 мкл магнитных частиц в растворе и инкубируют при комнатной температуре в течение еще 10 мин. Принесите конечный объем растворителя до 2,5 мл и поместить трубку в фиолетовый магнита в течение 5 мин. Быстро слейте CD3 + доля в 15 мл коническую трубку.
- Вымойте клеток путем добавления 5 мл холодной MACS буфера, подсчет количества жизнеспособных клеток, и удалить аликвоты для окрашивания FACS.
- Для выбора CD161 + клеток, в первую ресуспендирования обогащенного Т-клеток в 980 мкл буфера ледяной MACS, добавить 10 мкг анти CD161 МАБ, и инкубировать в холодильник на 10 мин.
- Центрифуга клетки при 1500 оборотов в минуту при температуре 4 ° С в течение 5 мин. Тогда восстановить осадок клеток в 800 мкл буфера MACS. Добавить 200 мкл анти-мышиных IgG1 микрошариков и инкубировать раствор в течение 10 мин при 4 ° C.
- Во время этой инкубации, равновесие LS колонки, добавив 3 мл MACS буфера.
- Далее, мыть клетки центрифугированием 1500 оборотов в минуту при температуре 4 ° С в течение 5 мин. RESUпровести клеток в 3 мл буфера MACS. Затем пипеткой клеток в отделение LS MACS колонки. Убедитесь в том, чтобы избежать образования пузырьков с помощью пипетки медленно. Промойте колонку, добавив 3 мл буфера MACS. Повторите два раза.
- Добавьте 3 мл свежего буфера MACS и удалить столбец из магнита. Место колонку в 15 мл коническую трубку. Вставьте поршень и вытолкнуть содержимое для получения очищенного CD161 + CD3 + клеток. Граф NKT клетки обогащенные фракции. Вы должны иметь 2-4 миллионов клеток.
3. AAPC-опосредованной NKT сотовых расширения
- Настройка совместного культивирования путем добавления 10 6 обогащенного CD161 + CD3 + Т-клеток и 10 6 AAPC в 16 мл полной среды (полного среднего + IL-2, 100 Ед / мл). Плита эта смесь путем добавления 160 мкл / лунку конечного объема в 96 и тканевых культур рассматривается полистирола, U-нижняя пластина с низким испарением крышкой. Выполнить средний обменный каждый 7-й день, добавляя 80 мкл свежей среды.
- Урожайклетки, считать и выполнять FACS окрашивание в день 12-14.
- Расширенный клетки NKT может быть replated, как описано выше в пункте 3.1, в частности ресуспендируйте 10 6 расширенном Т-клеток и 10 6 AAPC в 16 мл полной среды. Плита эта смесь путем добавления 160 мкл / лунку в 96-луночные U-нижней пластине. Продолжить, чтобы обновить coculture средних каждый 7-й день, добавляя 80 мкл свежей среды.
- Лучше всего, чтобы заморозить дополнительные клетки NKT после второго раунда расширения (1 x10 6 / криопробирку в 1 мл-5% DMSO / 95% FBS).
4. Функциональное тестирование: AAPC-опосредованной стимуляции клеток NKT
- Установить 5x10 4 NKT клеток / лунку с 5x10 5 AAPC в 200 мкл конечного объема (полный среда) в 96 U-нижней пластине.
- Урожай культуры клеток супернатант для ИФА через 24-48 часов.
Результаты
Здесь мы опишем метод генерации CD1d-Ig на основе AAPC, сделанные ковалентной связью CD1d-Ig и анти-CD28 МКА на магнитных шариков, чтобы стимулировать NKT клеток в качестве стандартного метода для размножения клетки NKT (рис. 1). Во-первых, надо показать, что CD1d-Ig белков слияния стабильно иммобилизованных на поверхности магнитных шариков. Как показано на рисунке 2А, CD1d-Ig и анти-CD28 антител и экспрессируется на поверхности магнитной бусины. Для изучения стимулирующий потенциал AAPC, мы со-культурный NKT клетки гибридом с AAPC ночь, собранных супернатантах культуры и измеряется ИЛ-2 методом ИФА. Мы обнаружили, что CD1d-Ig на основе AAPC смогли стимулировать гибридом NKT клетки на уровне, равном или выше, чем их коллеги сотового (рис. 3, данные не приведены). Интересно, мы обнаружили, что наша мышь гибридом NKT клетки стимулируются человека CD1d на основе AAPC (Fiрисунке 2B), который обеспечивает простой метод для проверки каждой партии AAPC.
Далее, мы стремились продемонстрировать распространения потенциала AAPC, таким образом, человеческий Т-клеток, выделенных из периферической крови. Первый CD161 + CD3 + Т-клеток фракция пополнилась магнитных гранул разделения. Тогда Т-клетки стимулировали раз в две недели с α-GalCer загруженных AAPC. Важно отметить, что мы обнаружили, что даже при относительно низкой исходной клетки NKT населения (0,03%), мы смогли расширить клетки ~ 67% Vα24 Vβ11 + + (рис. 3). Мы расширили NKT клеток от РВМС многих здоровых добровольцев и больных раком и обнаружили, что α-GalCer загруженных AAPC смогли расширить населения NKT клеток в обеих группах. Следует отметить, что скорость расширения была очень донора зависит. Как и следовало ожидать, чем выше начальная популяция Vα24 + клеток, тем больший процент расширения. Кроме того,При использовании начиная населением 2 миллиона клеток CD161 + CD3 + Т-клеток, можно получить> 10 7 клеток после двух раундов расширения (табл. 1). Приблизительно 80-90% расширенном NKT клеток являются CD4 +, ~ 5% CD8 +, а остальные, предположительно, CD4-CD8-двойные негативные клетки NKT. Эти расширенные клетки NKT могут быть использованы для функциональных исследований, как показано на рисунке 4A-C. Мы обнаружили, что наши бывшие естественных расширен NKT клетки остаются реагировать на α-GalCer стимуляции и являются мощными производителями IL-17A, TNF-α и ИФН-γ. Следует отметить, что если начальная Т-клеток обогащения населения низка, и один не в состоянии выполнять вторую CD161 обогащения шаг, AAPC-опосредованного расширения может не дать ожидаемых результатов (см. рис 4D, доноры 1). Однако, если процент циркулирующих клеток NKT выше, чем 0,1%, надо еще быть в состоянии получить значительное расширениеЯ из NKT клеток. В совокупности, эти данные показывают, что на основе CD1d-AAPC может быть использован для эффективного расширения и стимулирования первичных клеток человека NKT.

Рисунок 1. Принципиальная схема CD1d: Ig основе aAPCs внеклеточной части молекулы CD1d слиты с константной области иммуноглобулина тяжелой белковой цепи, разделенные короткими аминокислот компоновщик кислоты. Эти молекулы могут быть легко загружены с липидными антигенами, такими как α-GalCer, просто путем инкубации их с избытком липидов интерес. AAPC выступили связи CD1d-Ig и анти-CD АБС магнитных шариков. В этой системе, CD1d-Ig используется для родственных антиген-специфические сигнал через TCR и анти-CD28 МКА предоставляет костимуляторных сигнала.

Рисунок 2. . FACS окрашивания поверхности белки на aAPCs) aAPCs были протестированы на наличие CD1d: IgG димера (с помощью окрашивания PE-сопряженных анти-мышиных IgG1), а также анти-CD28 антител (с использованием FITC-конъюгированные анти-мышиный IgG2a) . Открытое гистограммы показывают изотипа контроля; заполненные гистограммы представляют указанных антител. CD1d-Ig выражая AAPC может стимулировать IL-2 производства NKT клетками. B) Vα14 + мышь NKT клеток гибридомы, DN32.D3, был cocultured либо среда, растворимые антигены (α-GalCer), выгружено AAPC или α-GalCer загруженных AAPC. Супернатанты культуры были собраны и стандартных сэндвич-ELISA был использован для измерения IL-2.

Рисунок 3. Расширение клетки NKT по CD1d-Ig покрытые искусственным антиген представляющих клеток. (A) Первичная CD3 + CD161 + двойной положительные клетки выделяли из РВМС использованием магнитной сепарации. Отсортировано клетки стимулировали α-GalCer загружен, CD1d-Ig покрытием AAPC течение 14 дней. Клетки окрашивали для Vα24 и Vβ11 следующие AAPC стимуляции. (B) Первичные человеческие клетки NKT опосредовано лизис B-клеточной лимфомы линии. C1R-CD1d клетки инкубировали с клетками NKT в указанных соотношениях в присутствии или в отсутствии антигена-GalCer (100 нг / мл) в 96-и U-нижней плиты в течение 20-24 часов. NKT клеточного лизиса клеток оценивали по стандартной 51Cr-релизе анализа.
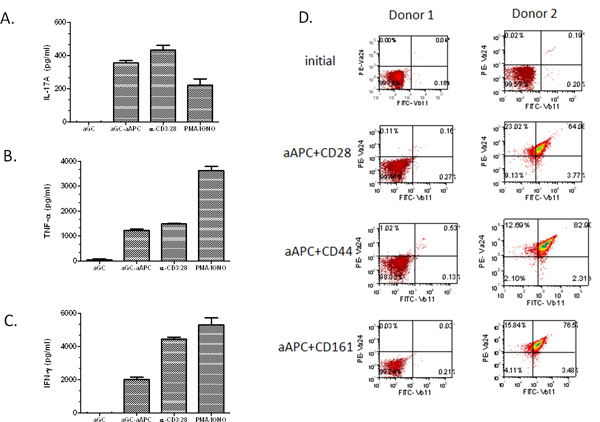
Рисунок 4. Цитокинов профили AAPC расширенной клетки NKT. После стимуляции α GalCer загруженных AAPC в течение двух недель, расширенные клетки NKT (1 × 10 5 / лунку) cocultured с растворимым α-GalCer, PMA / иономицином, anti-CD3/28 микрошарики, или α-GalCer загруженных AAPC (2 × 10 5 / лунку) в течение 48 часов. (A) IL-17A, (B) TNF-α и (C) ИФН-γ производства измерялась стандартным цитокинов ELISA. Данные указаны чистой продукции цитокинов после вычитания отрицательных элементов управления (средства массовой информации и пустые шарики). (D) Первичные Т-клетки были выделены из PBMC использованием магнитных гранул разделения. Отсортировано клетки стимулировали в течение двух недель с указанием-GalCer загруженной-AAPC. Клетки окрашивали с использованием антител, специфичных для Vα24 + + и Vβ11 и анализировали с помощью проточной цитометрии.
Обсуждение
AAPC может быть использована для изучения основных требований к активации клеток NKT и имеет потенциальное клиническое значение для бывших расширения естественных НК Т-клетки для приемных иммунотерапии. Mescher и соавт. Описал одну из первых систем, основанных на борт, где биотинилированных мышиных класса MHC I-пептида одной конструкции цепи были объединены с биотинилированным костимуляторных молекул B7.1 и B7.2 через стрептавидин на поверхности латексных микросфер, 14, 15. Этот подход был успешно использован для стимуляции антиген-специфические Т-клетки трансгенных мышей. Кроме того, поскольку этот подход использует единую цепь MHC-пептидный комплекс для обеспечения однородной загрузки MHC молекул, каждая антигена-мишени пептида потребует новых трансфекции для выражения нужного одной цепи MHC-пептидный комплекс, тем самым ограничивая общности подход. Важно отметить, что группа доктора Шнек по первым бортом ориентированного AAPC, развивая другую непористые шарик на основе AAPC, Сделанный связи HLA-Ig, сигнал 1, и анти-CD28, сигнал 2, на магнитных шариков. HLA-Ig, уникальный мультимерные форме HLA слитый с иммуноглобулином молекулярные строительные леса 16, 17 был разработан его группы. Впоследствии они разработали MHC-Ig на основе AAPC, который, как было показано эффективно расширять ЦМВ и MART-1 ЦТЛ 18. Здесь мы показали, что CD1d-Ig на основе AAPC может быть использован для расширения функциональных клеток NKT. В одном исследовании использовали подобные системы для изучения физического взаимодействия NK клеток с CD1d 19.
В частности, мы разработали искусственную антигенпрезентирующих клетка, которая может адаптироваться к любым требованиям, мы находим необходимые для оптимальной пролиферации клеток NKT. AAPC метод расширения обеспечивает простой и надежный способ для расширения и обогащения человеческих клеток NKT. Наши AAPC может быть изменен, чтобы систематически оценивать роль панель потенциальных костимуляторных молекул и оценить их роль в NKT клетки пролиферацииния и функции. Таким образом, AAPC представляют собой надежную универсальная технология полезна для стимулирования и расширения NKT клеток. Поколения aAPCs занимает менее одной недели и подходит для производства большого количества бусин. Тем не менее, важный шаг в формировании AAPC подтверждает, что CD1d-Ig стабильно иммобилизованных на поверхности гранул и оценить их функциональность для обеспечения согласованности от партии к партии. Потенциальные ограничения системы является то, что нет механизма, чтобы отключить стимуляцию, кроме механического удаления бисера. В частности, взаимодействие Т-клеточный рецептор (TCR) с антигеном: CD1d/MHC комплекса обычно генерируют иммунологических синапсов во взаимодействии с аксессуаром / молекул адгезии, которые могут привести к индукции ингибирующих или подавляющих факторов как на Т-клеток и антигенпрезентирующих клеток. В AAPC системы, эти факторы могут быть усиливает свою активность на Т-клеток, но шарик не будет выражать родственными лигандамидля этих рецепторов.
Кроме того, CD4 + NKT клеток было показано, что подавление противоопухолевого ответа у мышей и людей, поэтому вполне возможно, что неселективные активации всех клеток NKT (т.е. глобальный стимуляции α-GalCer) или активации неправильно подмножество может привести к нежелательным иммунологическим результаты. Следовательно, необходимо фенотипически и функционально характеризуют AAPC расширенной NKT клеток в популяции. Как показано на рисунке 4, мы обнаружили, что стимуляция α-GalCer загруженных AAPC выражения анти-CD28 может привести NKT клеток, продуцирующих Th1, Th2, Th17 и цитокинов типа. Мышиные исследования показали, что проблема с Ил-33, недавно идентифицированных цитокинов, привели к увеличению уровня циркулирующих воспалительных цитокинов, таких как IL-5 и IL-13. Обработка клеток NKT с Ил-33 повысили свою продукцию цитокинов 20. Ил-33 является специфическим лигандом для ST2 и было показано, что растворимый ST2 окп блока ИЛ-33 сигнализацией. Таким образом, в качестве примера применения в будущем, AAPC выражения ST2 может быть создан и использован, чтобы определить, можно избирательно подавляют производство Th2 цитокинов, в то время как индукции Th1 цитокинов клетками NKT. Он также сообщил, что внутривенного введения Kb экспрессирующих AAPC в C57BL / 6 мышей привело к снижению легких метастазы опухоли 21. Важно, что эти данные показывают, что AAPC трафика на легких и способны активировать эффекторные T подмножеств клеток. Таким образом, можно создавать несколько типов AAPC и изучить взаимодействие между антигеном конкретных подмножеств Т-клеток. Подводя итог, эти исследования показывают, что CD1d-Ig на основе AAPC может быть использован для замены нормальной клеточной APC, и должны потенциал для повышения текущих клинических подходов к NKT клетки на основе-приемные иммунотерапии.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Приянка Subrahmanyam за полезные обсуждения. Авторы не конкурирующих финансовых интересов. Эта работа была поддержана грантами от Американского общества рака, NIH / NCI K01 CA131487, R21 CA162273, R21 CA162277, и P30 опухоли иммунологии и иммунотерапии Программа для TJ Уэбб. Этот материал предназначен исключительно ответственности авторов и не обязательно отражают официальную точку зрения Национального института рака и Национальный институт здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| Ficoll-Paque PLUS | GE Life Sciences | 17-1440 | |
| EasySep человека Т-клеток по обогащению Kit | StemCell технологий | 19051 | |
| Аллофикоцианин CD161 человека мАт | Pharmingen | 550968 | |
| EasySep Magnet | StemCell технологий | 18002 | |
| Anti-IgG1 мыши микрошарики | Miltenyi Biotec | 130-047-101 | |
| Димер XI рекомбинантного растворимого Димерные мышь CD1d: И. гибридного белка | BD Biosciences | 557599 | |
| Anti-CD28 МКА | Biolegend | 302914 | |
| M-450 Эпоксидная бисера | Life Technologies | 150-11 | |
| Альфа-galactosylceramide (KRN7000) | Axxora, ООО | BML-SL232-0100 | |
| RPMI 1640, | Sigma Aldrich | R 0883 | |
| Пируват натрия | Gibco | 11360-070 | |
| Номера для незаменимых аминокислот | Gibco | 11140-050 | |
| Витамин решение | Gibco | 11120-052 | |
| 2-меркаптоэтанола | Gibco | ||
| Ципрофлоксацин | Алексис Biochemicals | 380-288-G025 | |
| PE-Vα24Jα18 | Biolegend | 342904 | |
| PE-Vα24 (Clone C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Clone C21) | Beckman Coulter | A66905 | |
| PE-CD1d | Biolegend | 123510 | |
| PE борьбе IgG1 мыши | BD Biosciences | 556650 | |
| FITC анти-мышиный IgG2a | Biolegend | 407105 | |
| DPBS, ни кальций, ни магний | Life Technologies | 14190250 | |
| Азид натрия | Sigma Aldrich | S8032 | |
| Бычьего сывороточного альбумина | Американский Биоаналитическая | AB00440-00100 | |
| EDTA | Sigma Aldrich | 431788 | |
| IL-2 (Пролейкин) | BD Biosciences | 354043 | |
| Сыворотка человека AB | Атланта биологические | S40110 | |
| Labquake Rotator труб | Fisher Scientific | 13-687-10Q | |
| BD Falcon 5 мл полистирола с круглым дном трубы | Fisher Scientific | 14-959-1A | |
| Уитон образца стекла Флаконы с крышкой | Fisher Scientific | Малый (03-343-6A) Большой (03-343-6E) |
Ссылки
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены