Method Article
Procesamiento de mamoplastia de reducción y tejidos humanos Mastectomía para el cultivo celular
En este artículo
Resumen
Un método para procesar humano material de descarte mamaria quirúrgica se describe. Tejido procesado, en forma de organoides, se pueden almacenar indefinidamente congelados o ponen en cultivo para crecimiento a largo plazo. Este método permite el examen experimental de la normalidad biología celular epitelial humana, y los efectos de las perturbaciones exógenas.
Resumen
Experimental examen de lo normal de células epiteliales mamarias humanas (HMEC) el comportamiento, y cómo las células normales adquieren propiedades anormales, puede ser facilitado por en sistemas de cultivo in vitro que más exactamente modelo en biología vivo. El uso de material humano obtenidos para el estudio de la diferenciación celular, el envejecimiento, la senescencia y la inmortalización es particularmente ventajosa teniendo en cuenta las muchas diferencias significativas en estas propiedades moleculares entre las células de roedores y humanos utilizados comúnmente 1-2. Células mamarias presentan un sistema de modelo conveniente porque grandes cantidades de tejidos normales y anormales se encuentran disponibles debido a la frecuencia de mamoplastia de reducción y cirugías de mastectomía.
La glándula mamaria se compone de una mezcla compleja de muchos tipos de células diferentes, por ejemplo, adiposo epiteliales, endoteliales, mesenquimal,. Las células epiteliales son responsables de la función diferenciada mamaria de la lactancia,y también son el origen de la gran mayoría de los cánceres de mama humanos. Hemos desarrollado métodos para procesar tejidos de la glándula mamaria quirúrgicos de descarte en puras componentes epiteliales así como las células mesenquimales 3. El material procesado puede almacenar congelada indefinidamente, o iniciados en cultivo primario. Material de descarte quirúrgico se transporta al laboratorio y se disecaron manualmente para enriquecer en tejido epitelial que contiene. Digestión subsiguiente del tejido diseccionado utilizando colagenasa y hialuronidasa material de tiras de estroma de los epitelios en la membrana basal. Las piezas resultantes pequeñas del árbol epitelial (organoides) se puede separar de la estroma digerido por filtración secuencial en las membranas de tamaño de poro fijo. Dependiendo del tamaño de poro, las fracciones se puede conseguir que consiste de grandes ductales / alveolar, piezas pequeñas agrupaciones alveolares, o células estromales. Hemos observado un crecimiento superior cuando las culturas se inician como organoides y no como disasociada células individuales. La colocación de organoides en la cultura, baja fatiga medios inductores de apoyo a largo plazo el crecimiento de HMEC normal con marcadores de linaje tipos múltiples (mioepiteliales, progenitor luminal) 4-5. Un número suficiente de células pueden ser obtenidas a partir de tejido de un individuo para permitir el examen extenso experimental utilizando lotes estandarizados de células, así como de interrogación utilizando las modalidades de alto rendimiento.
HMEC Cultured se han empleado en una amplia variedad de estudios que examinan los procesos normales que regulan el crecimiento, la diferenciación, el envejecimiento y la senescencia, y cómo estos procesos normales se alteran durante la transformación maligna inmortal y 4-15,16. Los efectos de crecimiento en la presencia de material de matriz extracelular, otros tipos de células, y / o cultivo 3D puede ser comparado con el crecimiento en el plástico 5,15. HMEC Cultivadas, comenzando con las células normales, proporcionar un sistema experimentalmente tratable para examinar los factores que lospuede impulsar o impedir el envejecimiento humano y la carcinogénesis.
Protocolo
1. Tejido de procesamiento y digestión
- Obtener tejido mamario humano como material de descarte de los procedimientos quirúrgicos. Mamoplastias de reducción puede proporcionar células normales o benignos; fibroadenomas y ginecomastias proporcionar células benignas; tejidos no tumorales (periféricos o mastectomía contralateral a un tumor, o subcutánea) proporcionar células que pueden variar desde normal a benigno a microtumores contienen. Asegúrese de que la aprobación del IRB con la debida anterioridad a la obtención del material de descarte. Todo el material debe ser tratado de acuerdo con los reglamentos contenidos en la sangre patógenos.
- Coloque el material en recipientes estériles que contienen tampón o medio (medio modificado de Dulbecco por ejemplo, 1:1 de Eagle y Ham F-12) suplementado con 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 5 ug / ml de Fungizone, 50U/ml polimixina B, y 10% de suero fetal bovino, y el transporte al laboratorio a 4 º C. Tejido mamoplastia de reducción puede almacenarse o transportarse a 4 º C durante 72 horas sin afectar significativamente Sula viabilidad celular bsequent. Pequeños trozos de tejido mamoplastia de reducción puede no requerir un procesamiento más rápido.
- Separar las zonas epiteliales de la matriz de estroma de tejido adiposo, el tejido conjuntivo y los vasos sanguíneos utilizando una combinación de fórceps estériles de bisturí, y una tijera. Corte las piezas de tejido con tijeras y colocar en un plato de cristal estéril grande (por ejemplo, 150 mm). Suavemente diseccionar las áreas epiteliales, que aparecen como hebras blancas incrustadas en la matriz estromal más amarillo, usando las pinzas para sujetar el material y el bisturí para raspar el material groseramente graso. Para facilitar la digestión, cortar el tejido epitelial en pequeños trozos de 3-4 mm ~ utilizando escalpelos opuestas y colocarlo en un tubo de ensayo de 50 ml. Si grandes cantidades de tejido están siendo procesados, frescos hojas de bisturí pueden ser necesarios. Retire el material graso del plato para su eliminación de acuerdo con las regulaciones institucionales.
- En los tejidos fibrosos en gran medida (por ejemplo, subcutánea mastectomies con enfermedad fibroquística severa), no habrá más sólido blanco, no epiteliales material. Puede ser difícil para diseccionar las células epiteliales de matrices fibrosas tales. Los pedazos grandes de material fibroso se puede cortar en piezas más pequeñas que son cuadrados ~ 1-3 mm de área y se digirió por separado.
- Coloque el tejido diseccionado epitelial en un tubo cónico de centrífuga (50 ml o 15 ml) con el tejido que comprende no más de un tercio del volumen del tubo. Llevar el tubo hasta el volumen completo, dejando solamente un pequeño espacio de aire para permitir la mezcla durante la rotación, usando una mezcla de digestión de los tejidos (DME/F-12 o equivalente, 10 mg / ml de insulina, antibióticos como anteriormente, y la concentración final de 10 % de FCS, 200 U / ml de colagenasa crudo y 100 hialuronidasa U / ml.
- Colocar los tubos en un tubo rotatorio HulaMixer y giran 360 º a 8 rpm durante la noche a 37 ° C.
- Centrifugar los tubos a 600 xg durante 5 min. Deseche la grasa sobrenadante y medio plazo para acuerdo de enajenaciónING a las regulaciones institucionales.
- Entrada para la terminación de la digestión mediante la dilución de una pequeña alícuota del sedimento en medio. La digestión es completa cuando el examen microscópico muestra grupos de células (organoides) con estructuras de apariencia lisa ductales, alveolar, o ductal alveolar libres de estroma adjunto (Figura 1A). Tejidos mamoplastia de reducción generalmente siguen mostrando estroma adjunto después de una digestión durante la noche y requerirá tiempo de digestión adicional.
- Resuspender el pellet no digeridos en mezcla fresca digestión de los tejidos y re-incuba con rotación a 37 º C durante otra hora 4-12. Repita los pasos 1,6 y 1,7. Si la digestión es todavía incompleta, de nuevo añadir mezcla de digestión a la pella y re-incubar con rotación a 37 ° C durante la noche. La concentración de las enzimas puede reducirse para evitar la sobre-digestión durante la noche.
- Cuando la digestión es completa, centrifugar los tubos a 600 xg durante 5 min, aspirar el digestoion mezcla, resuspender el pellet en medio de más antibióticos en el tubo de aproximadamente 15 ml ml/50, 5 ml/15 ml tubo.
2. La filtración y la congelación de los materiales digeridos
- Transferir alícuotas de la sedimento resuspendido en un filtro estéril de 100 micras sobre un tubo estéril de 50 ml. Deje que caiga el medio en el tubo, a continuación, lavar nuevamente los organoides en mejores 1-2x veces con 2-3 ml de medio. Repetir hasta que todo el sedimento resuspendido se ha transferido. Si hay demasiados organoides en el filtro y el medio ya no drena fácilmente, utilizar un filtro nuevo (s) para el material restante. Con cuidado, darle la vuelta al filtro (s) en la parte superior de otro tubo estéril y lavar los organoides en el tubo con más medio. Esta es la piscina de 100 m organoide.
- Tome el material que drena en el tubo original 50 ml y repetir el proceso de 2,1 micras utilizando un colador 40, para obtener de la piscina 40 micras organoide, que contiene principalmente estructuras alveolares. El material que se vierte en thtubo electrónico constituye el filtrado de la piscina, que contiene grupos individuales / pequeños de células mesenquimales y epiteliales y pequeños trozos de la vasculatura.
- Pellet las 100 micras, 40 micras y piscinas filtrado a 600 xg durante 5 min.
- Aspirar el sobrenadante reconstituir, cada tubo en CPM II (DME/F-12 o equivalente con 44% de FCS y 6% de DMSO) con aproximadamente 1 ml de CPMII por 0,1 ml del paquete de pellet. Conservar a 4 ° C.
- Semilla un plato de prueba para las 2 piscinas organoides colocando 0,1 ml de material resuspendido en una gota de cultivo de tejidos de 35 mm plato de plástico a gota como en 3.2. La piscina de filtrado se puede sembrar directamente sobre plástico de cultivo de tejidos con medio de fibroblastos (DME/F-12 o equivalente con 10 ug / ml de insulina y 10% de FBS).
- Alícuota del material restante resuspendido en ampollas de tipo Nunc congelador (1 ml / ampolla de 2 ml). Congelar durante la noche a -80 ° C y luego se transfieren rápidamente a almacenamiento en nitrógeno líquido. No se ha observado ninguna pérdida significativa de viabilidaden nuestras ampollas originales almacenadas congeladas desde finales de los años 1970.
3. Siembra Organoides congelados y subcultura de cultivos primarios
- Descongelar rápidamente la ampolla congelado que contiene los organoides en un baño de agua a 37 ° C. Seed los organoides en 2 a 10 (normalmente ~ 6) 60 mm platos, o 1-3 placas de 100 mm, dependiendo de la estimación visual de la cantidad de organoides en la ampolla. Organoides aproximadamente 20-40 sembradas por placa de 60 mm es óptimo.
- Organoides descongeladas se colocan cuidadosamente, gota a gota, sobre la superficie del plato con una pipeta de 1 ml o pipeta Pasteur para una distribución uniforme de organoides. Organoides colocados juntos se tiene un espacio limitado para la excrecencia, dando lugar a un menor número de células para el subcultivo o congelación. Evite rayar la superficie del plato (células tienden a no crecer más allá de las superficies rayadas). Espere 1-2 minutos para permitir que los organoides para unir y luego, lentamente, se añade medio de crecimiento para evitar que se desprenda los organoides (por ejemplo, 2-3 ml/60 plato mm). Yoncubate a 37 ° C en CO 2 humidificado incubadora. Estos son los cultivos primarios. Actualmente usamos M87A + oxitocina (X) medio para el crecimiento HMEC más robusta (Figura 2).
- Después de 1 día, compruebe que los organoides se adjuntan. Añadir medio adicional (por ejemplo 2-3 ml/60 plato mm). La migración celular a partir de los organoides debe ser visible por 24-48 horas, y el crecimiento externo mitótico por 48-72 horas después de la siembra (Figura 1B, C). A veces, el apego es pobre después de 24 horas, sobre todo si enchapado organoides overdigested o organoides de las mujeres mayores, pero la mayoría de las preparaciones se fijará un plazo de 72 horas. Pequeñas piezas de la vasculatura puede conectar y dar lugar a consecuencia celular de fibroblastos (Figura 1D).
- Alimentar cultivos al menos 3 veces por semana. Las células cultivadas en medios de comunicación de tipo M87A crecer hasta cerca de la confluencia en 5-8 días, dependiendo de la densidad de siembra.
- Si no hay crecimiento de fibroblastos significativa, tripsinización diferencial (DT), basado en eldesmontaje rápido de los fibroblastos de la superficie de plástico, se necesita para eliminar los fibroblastos. Cuando los parches epiteliales convertido en grandes medios de comunicación, del aspirado, plato de lavado (por ejemplo, 1-2 ml/60 plato mm) con STE (solución salina, 0,05% de tripsina, 0,02% de EDTA), aspirado, agregar fresco 0,5 STE ml y dejar a temperatura ambiente por alrededor de 1 minuto con la observación microscópica continua. Cuando los fibroblastos separar las células epiteliales, pero son todavía adherente, suavemente pero bruscamente golpear el lado del plato contra una superficie dura para desalojar los fibroblastos y luego aspirar rápidamente. Lavar una vez con PBS, y aspirar de nuevo. Culturas altamente contaminados con fibroblastos pueden necesitar un DT adicional.
- Subcultivar cultivos primarios cuando grandes manchas epiteliales están presentes, pero antes de su confluencia. La densidad de siembra organoide y la unión influirá en el tiempo requerido. Para conservar el cultivo primario y generar múltiples cultivos secundarios, espaciados en el tiempo, realizamos Trypsinizations parciales (PT).
- Medios de comunicación Aspirar, lavar un plato de 60 mm con 1-2 STE ml, agregar 0,5 ml de STE fresco al plato. Observar desprendimiento de células bajo el microscopio a temperatura ambiente durante 1-5 min, con golpeteo suave de la cápsula para promover la separación de células. La tripsinización se detuvo cuando ~ 50% de las células se han desprendido. A principios PT suelen tener desprendimiento celular rápida. Para más tarde TT, las células se pueden colocar a 37 º C para acelerar la separación, con un cuidadoso control, como todas las células se podría salir rápidamente.
- Añadir 2 ml de medio que contiene suero al plato, repipette para lavar, y transferir a un tubo estéril de 15 ml. Repetir 2x con otra ~ 1-2 ml de medio, añadiendo el lavado en el tubo. Vuelva a introducir el plato principal y el retorno a la incubadora. Contar las células en el tubo con el hemocitómetro. PT puede repetirse alrededor de 4 a 8 veces con la regeneración celular bueno en los platos principales y el crecimiento a largo plazo equivalente de los secundarios subcultured o congelados (células segundo paso se llaman secundarias, una vez subcultivo, las células no son longer primarias). Una vez que el material organoide ya no está presente en los cultivos primarios, secundarios subcultured muestran una disminución a largo plazo el potencial de duplicación de la población.
- Para subcultivo a las secundarias, células de semillas directamente desde el tubo en platos. La siembra de 2.1 x 10 5 mm plato células/100 en un medio sólido, como M87A + X dará lugar a la confluencia en 4-7 días. Añadimos la toxina del cólera al medio a paso para aumentar segundo potencial proliferativo; toxina del cólera se omite en cultivo primario ya que conduce a excrecencia celular de múltiples capas de los organoides.
- Para la congelación como secundarios, tubo pellet en 600 xg durante 5 min, y se resuspende en CPMII con una densidad final de 10 6 células / ml. Alícuota se resuspendieron las células en ampollas Nunc tipo de congelación, congelar durante la noche a -80 ° C y luego se transfieren rápidamente a almacenamiento en nitrógeno líquido.
- Se recomienda para congelar las células de la PT primero para su custodia, yutilizar células de la PT segunda subcultura. PTs adicional se puede almacenar congelado para uso futuro.
Resultados
Figuras representativas de los tejidos digeridos apropiadamente a organoides y colocan en cultivo se muestra en la figura 1. Tejido no digeridos se muestran material todavía unido a la parte exterior de estas estructuras, y probablemente tendrá un cierto crecimiento celular fibroblástica en cultivo primario, requiriendo DT de eliminar. Tejido Overdigested mostrará las fronteras exteriores menos suaves, y puede tomar más tiempo para fijar en cultivo primario. Excrecencia epitelial debe comenzar dentro de 48-72 hr (1B, C). Pequeños trozos de vasculatura (1D) puede ser una fuente de la excrecencia de las células mesenquimales. Excrecencias epiteliales muestran poblaciones morfológicamente heterogéneas, con poblaciones proliferativas que contienen las mezclas de células con marcadores asociados con el progenitor mioepiteliales, y linajes luminales (1E, 3C-E). El crecimiento en medios bajos de estrés tales como M87A suplementadas con la toxina del cólera y la oxitocina apoyará superior a largo plazocrecimiento de normal pre-estasis HMEC en comparación con formulaciones de medios anteriores (Figura 2). M87A de tipo medios de comunicación también apoyar el crecimiento de las células luminales y progenitoras a través de pasos 4-8 (Figuras 3C-E, 4); después de eso, la mayoría de las células muestran marcadores de linaje sólo mioepiteliales. HMEC cultivadas en plástico pueden retener su capacidad para formar 3D adecuado auto-organización en micropatterned 3D micropocillos, con células luminales interiores a las células mioepiteliales (Figura 4A, B), y para formar estructuras organizadas cuando chapada en Matrigel (4C, D).
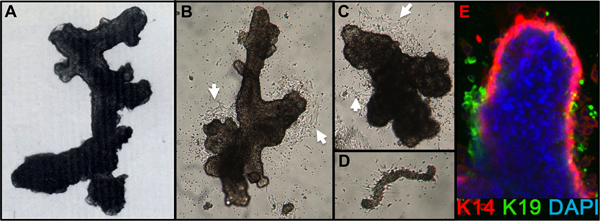
Figura 1. Organoides HMEC y la cultura primaria. (A) organoide muestran ductal-alveolar estructura después de la digestión y la filtración. (B, C) que muestran Organoides estructura ductal y alveolar 2 días después de la colocación en cultivo primario; nota de la célula outgr principioowth (flechas blancas). (D) los vasos sanguíneos pequeños fijados y con el inicio de los cultivos de fibroblastos consecuencia mismos como B, C. (E) derivación de células epiteliales de la cultura organoide primario después de 4 días. Linajes se identifican mediante tinción con anticuerpos a K14 (rojo) y K19 (verde); núcleos se tiñeron con DAPI (azul). Luminal (K14-/K19 +, verde), mioepiteliales (K14 + /-K19, rojo), y progenitor (K14 + / K19 +, amarillo), las células son visibles. Células no teñidas se observan en el núcleo organoide debido a la penetración anticuerpo incompleto.
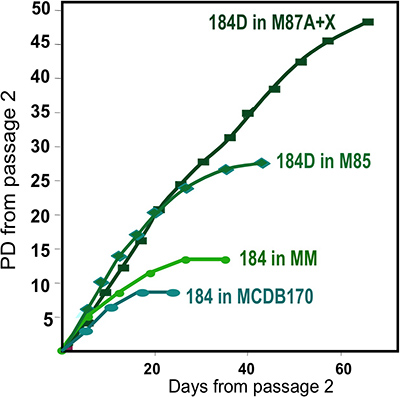
Figura 2. Organoides crecimiento de cultivos HMEC en formulaciones diferentes medios de comunicación. Obtenidas de un individuo, la muestra de 184, se iniciaron en cultivo primario utilizando formulaciones diferentes medios de comunicación. Mejor crecimiento a largo plazo se obtiene utilizando nuestra formulación más reciente, M87A + oxitocina (X) 4. Este medio también soportael crecimiento de múltiples linajes HMEC (véase la fig. 1E). Un anterior formulación de medios, MM 3 proporcionado crecimiento menos robusto, mientras que un medio libre de suero, MCDB170 (comercial MEGM) 17 conduce a la inducción rápida de la ciclina quinasa inhibidor de p16 INK4a y la selección de células aberrantes 7,11,13.
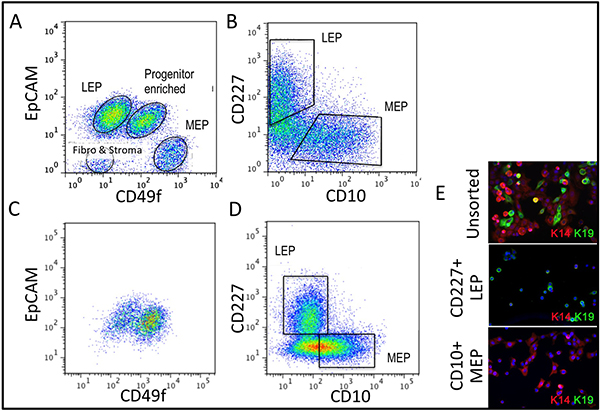
Figura 3. Comparación de la diversidad linaje en organoides uncultured y HMEC cultivaron a 4 º paso. (A, B) análisis FACS de un organoide uncultured, disociado enzimáticamente para (A) expresión de EpCAM y CD49f/alpha 6 integrina, y CD227/Muc1 (B) y CD10/CALLA. (C, D) Análisis FACS de 4 º paso pre-estasis HMEC para la expresión de (C) y la integrina EpCAM CD49f/alpha 6, y (D) y CD227/Muc1 CD10/CALLA. P identificableopulations se etiquetan como LEP (luminal expresar EpCAM o marcadores CD227), MEP (que expresan marcadores mioepiteliales CD49f o CD10) o PROG (enriquecido en el CD49f + / EpCAM población +). Tenga en cuenta que durante la adaptación a la regulación de los cambios de cultura EpCAM y CD49f comparación con organoides uncultured. (E) Unsorted HMEC FACS y enriquecida con LEP y diputado en el paso 4 ª tiñeron para análisis de inmunofluorescencia de la queratina K14 (MEP marcador) y K19 (LEP marcador) para verificar la identificación de linaje. Núcleos teñidos con DAPI aparecen de color azul.
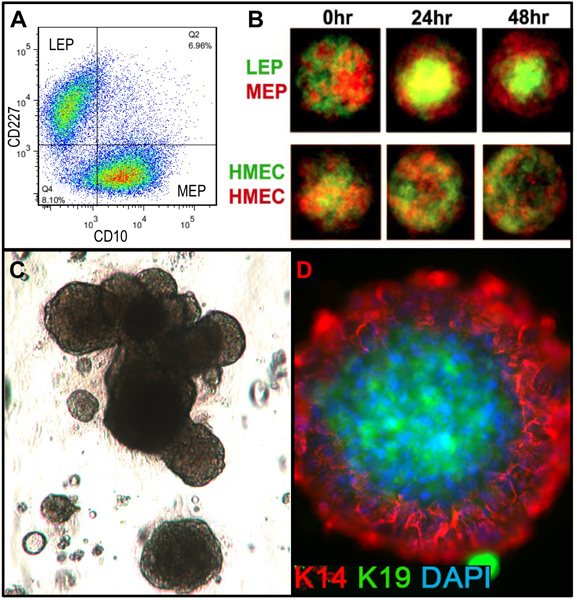
Figura 4. HMEC cultivadas son capaces de formar estructuras organizadas con relaciones de linaje en vivo-como cuando se colocan en microentornos adecuados. (A) Pre-estasis 4 º paso HMEC fueron FACS enriquecido into luminal LEP y linajes MEP utilizando marcadores mioepiteliales para CD227 y CD10, con estos linajes verificados por la expresión de K14 y K19 (no se muestra). (B) Cuando se mezclan en micropatterned pocillos, las células cultivadas fueron capaces de auto-organización en bicapas con MEP en el exterior e interior LEP [Adaptado de Chanson et al. 5]. Marcada con fluorescencia LEP (verde) y MEP (rojo) se obtuvieron imágenes con un microscopio confocal a 0 h, 24 h, y 48 h después de la adición a los micropocillos (superior). Control de HMEC fueron etiquetados arbitrariamente con marcadores fluorescentes de color rojo o verde (inferior). (C) Imagen de campo brillante de las células progenitoras enriquecidas con FACS (cKit +) sembraron en 3D (Matrigel) cultivo y se cultivaron durante 18 días. Estructuras resultantes pueden exhibir morfogénesis alveolar. (D) Las estructuras fueron extraídos de Matrigel y se tiñeron para detectar K14 y K19; núcleos se contratiñeron con DAPI. Análisis de inmunofluorescencia muestra las estructuras organizadas con pola correcta luminal y basaldad.
Discusión
La humana método de procesado de tejido mamario que aquí se presenta permite la obtención de células epiteliales mamarias puros de la mezcla heterogénea de tipos de células en el pecho humano. La filtración a través de poros de tamaño fijo permite la separación de las diferentes fracciones de la glándula mamaria (por ejemplo, ductal y alveolar ductal-vs alveolar) de la matriz estromal digerido. Isogénicas fibroblastos mamarias se puede obtener para que coincida con las células epiteliales. El material congelado digerido ha conservado buena viabilidad durante más de 30 años. Este método ha funcionado con éxito en todos los tejidos mamarios pero muy fibrosas, y es simple de realizar. Otras variaciones de procesamiento de tejido mamario que existen no proporcionan fracciones epiteliales que son tan viables, limpio, o separados. La colocación de organoides procesados en cultivo con bajos estresantes medios como M87A permite crecimiento a largo plazo de HMEC con marcadores de linaje múltiple. HMEC que han sido cultivadas en plástico todavía conservan la capacidad de génerosdel te 3D estructuras con normalidad en las relaciones de linaje vivo-como. Estos cultivos HMEC son adecuados para una amplia investigación experimental, incluyendo un alto rendimiento, de comportamiento normal HMEC y factores que pueden impulsar o inhibir senescencia y transformación.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
MAL, JCG, y MRS son apoyados por el NIA (R00AG033176 y R01AG040081) y por el Laboratorio de Investigación y Desarrollo Dirigido, EE.UU. Departamento de Energía # contrato DE-AC02-05CH11231.
Materiales
| Name | Company | Catalog Number | Comments |
| Vidrio plato Petri 15 cm | VWR | 89000-308 | |
| Tijeras 6.5 " | VWR | 82027-594 | |
| Pinzas 8 " | VWR | 82027-436 | |
| Escalpelos desechables | Miltex | 4-411 | |
| La colagenasa | SIGMA | C0130 | |
| Hialuronidasa | SIGMA | H3506 | |
| Insulina | SIGMA | I5500 | |
| DMSO | SIGMA | D8418 | |
| Pennicillin / estreptomicina | Life Technologies | 15140-122 | |
| Fungizone | Life Technologies | 15290-018 | |
| Polimixina B sulfato | Life Technologies | 21850-029 | |
| Suero Bovino Fetal | Life Technologies | 26140-087 | |
| La tripsina 0,05% 100 ml | Life Technologies | 25300-054 | |
| DMEM/F12 | Life Technologies | 11039-021 | |
| HulaMixer | Life Technologies | 159-20D | |
| Filtro de células 100 micras | BD Falcon | 352360 | |
| Filtro de células 40 micras | BD Falcon | 352340 | |
| Tubos de 15 ml | Greiner Bio-One | 188-261 | |
| Tubos de 50 ml | Greiner Bio-One | 227-261 | |
| TC platos de 10 cm | Greiner Bio-One | 664-160 | |
| TC platos 6 cm | Greiner Bio-One | 628-160 | |
| Viales criogénicos | Nalgene | 5000-1020 | |
| Heamocytometer | Hauser Científico | 1490 | |
| Centrífugo | Eppendorf modelo | 5702 |
Referencias
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados