Method Article
Traitement des mammoplastie de réduction et de tissus humains mastectomie pour Culture Cellulaire
Dans cet article
Résumé
Une méthode pour traiter humaine matériau mammaire chirurgicale est décrite de défausse. Tissu traité, sous la forme d'organites, peuvent être conservés congelés indéfiniment ou mis en culture pour la croissance à long terme. Cette méthode permet d'examiner expérimentale de biologie cellulaire normale épithéliale humaine, et les effets des perturbations exogènes.
Résumé
Examen expérimental des cellules mammaires humaines normales (HMEC) épithélial comportement, et comment les cellules normales acquérir des propriétés anormales, peut être facilitée par des systèmes de culture in vitro de façon plus précise le modèle en biologie in vivo. L'utilisation de matières provenant de l'homme pour l'étude de la différenciation cellulaire, le vieillissement, la sénescence et l'immortalisation est particulièrement avantageux étant donné les nombreuses et importantes différences moléculaires dans ces propriétés entre les cellules de rongeurs et de l'homme couramment utilisé 1-2. Les cellules mammaires présentent un système modèle très pratique car de grandes quantités de tissus normaux et anormaux sont disponibles en raison de la fréquence de réduction mammaire et la chirurgie mastectomie.
La glande mammaire est constituée d'un mélange complexe de nombreux types cellulaires distincts, par exemple, l'épithélium, tissu adipeux, mésenchymateuses, endothéliales. Les cellules épithéliales sont responsables de la fonction différenciée mammaire de la lactation,et sont aussi à l'origine de la grande majorité des cancers du sein. Nous avons développé des méthodes pour traiter les tissus mammaires glande rejets chirurgicales en pures composants épithéliaux ainsi que des cellules mésenchymateuses 3. La matière traitée peuvent être conservés congelés indéfiniment, ou initié à la culture primaire. Matière de défausse chirurgicale est transporté au laboratoire et manuellement disséqué pour enrichir le tissu épithélial contenant. Digestion ultérieure du tissu découpé à l'aide de la collagénase et la hyaluronidase matériau des bandes de stroma de l'épithélium à la membrane basale. Les pièces résultant de petits épithélial de l'arbre (organites) peut être séparé du stroma digéré par filtration séquentielle sur des membranes de porosité fixe. Selon la taille des pores, les fractions peuvent être obtenues composé de grandes canalaires / alvéolaire pièces, des grappes plus petites alvéoles ou cellules stromales. Nous avons observé une croissance supérieure lorsque les cultures sont initiées comme organites plutôt que comme dissociated cellules individuelles. Placement des organites dans la culture en utilisant les médias induisant peu de stress en charge à long terme la croissance des HMEC normale avec des marqueurs de la lignée types multiples (myoépithéliales, luminal, l'ancêtre) 4-5. Un nombre suffisant de cellules peuvent être obtenues à partir de tissus d'un individu pour permettre vaste examen expérimental utilisant des lots de cellules standardisées, ainsi que d'interrogatoire selon des modalités à haut débit.
HMEC culture ont été utilisés dans une grande variété d'études sur les processus normaux qui régissent la croissance, la différenciation, le vieillissement et la sénescence, et comment ces processus normaux sont modifiés au cours de la transformation maligne immortelle et 4-15,16. Les effets de la croissance en présence d'un matériau de matrice extracellulaire, d'autres types cellulaires et / ou la culture 3D peuvent être comparées avec la croissance sur 5,15 plastique. HMEC culture, à commencer par les cellules normales, apporter à un système expérimental maniable pour examiner les facteurs quipeut propulser ou prévenir le vieillissement humain et la cancérogenèse.
Protocole
1. Traitement des tissus et la digestion
- Obtenir le tissu mammaire humain en tant que matériau de défausse de procédures chirurgicales. Mammoplasties de réduction peuvent fournir des cellules normales ou bénignes; fibroadénomes et gynecomastias fournir des cellules bénignes; tissus non tumoraux mastectomie (périphérique ou controlatéral à la tumeur, ou sous-cutanée) fournir des cellules qui peuvent aller de bénigne à la normale à microtumeurs contenant. Assurez-vous approbation de l'IRB bon existe avant l'obtention du matériel de défausse. Tout le matériel doit être traité selon la réglementation des agents pathogènes transmissibles par le sang.
- Placer le produit dans des récipients stériles contenant un tampon ou un support (par exemple 1:1 Medium Eagle modifié par Dulbecco et de Ham F-12), supplémenté avec 100 U / ml de pénicilline, 100 pg / ml de streptomycine, 5 pg / ml Fungizone, 50U/ml polymyxine B, et 10% de sérum foetal bovin, et le transport de laboratoire à 4 ° C. La mammoplastie de réduction des tissus peuvent être conservés ou expédiés à 4 ° C pendant 72 heures sans affecter significativement sula viabilité des cellules bsequent. De petits morceaux de tissu mammaire non-réduction peut nécessiter un traitement plus rapide.
- Séparer les zones épithéliales de la matrice stromale du tissu adipeux, le tissu conjonctif et les vaisseaux sanguins en utilisant une combinaison de scalpel stérile, pinces et de ciseaux. Couper des morceaux de tissu avec des ciseaux et les placer dans un grand plat en verre stérile (par exemple, 150 mm). Disséquer délicatement sur les zones épithéliales, qui apparaissent comme des fils blancs noyées dans la matrice stromale plus jaune, à l'aide des pinces pour maintenir le matériau et le scalpel pour gratter le matériau grossièrement gras. Pour faciliter la digestion, couper le tissu épithélial en petits morceaux de ~ 3-4 mm en utilisant des scalpels opposés et les placer dans un tube à essai de 50 ml. Si de grandes quantités de tissu sont en cours de traitement, frais lames de scalpel peut être nécessaire. Enlever la matière grasse du plat pour l'élimination conformément aux réglementations institutionnelles.
- Dans les tissus fortement fibreux (par exemple, sous-cutanée mastectomies atteints de la maladie fibrokystique grave), il y aura plus solide blanc, non épithéliaux matériel. Il peut être difficile de disséquer les cellules épithéliales de matrices fibreuses telles. De gros morceaux de matériau fibreux peut être coupé en petits morceaux qui sont carrés ~ 1-3 mm dans la zone et digéré séparément.
- Placer le tissu épithélial disséqué dans un tube à centrifuger conique (50 ml ou 15 ml) avec le tissu comprenant pas supérieure à un tiers du volume du tube. Mettre en place le tube à son volume maximum, laissant seulement un espace d'air faible pour permettre le mélange, pendant la rotation, en utilisant un mélange de digestion de tissu (ou l'équivalent DME/F-12, 10 ug / ml d'insuline, antibiotiques comme ci-dessus, et la concentration finale de 10 % de FCS, 200 collagénase brute U / ml et 100 U / ml de hyaluronidase.
- Placer les tubes sur un rotateur de tubes HulaMixer et tourner sur 360 ° à 8 tours par minute pendant la nuit à 37 ° C.
- Tubes à centrifuger à 600 xg pendant 5 min. Jeter le gras surnageant et moyen terme pour l'élimination accordtion de règles institutionnelles.
- Vérifiez l'achèvement de la digestion par dilution d'une petite aliquote de la pastille dans le milieu. La digestion est terminée lorsque l'examen microscopique montre des amas de cellules (organites) avec des structures canalaires lisse d'apparence, alvéolaire, ou canalaire-alvéolaire libres de joint stroma (figure 1A). Tissus réduction mammaire est généralement montrent encore stroma joint après une digestion du jour au lendemain et il faudra du temps digestion supplémentaire.
- Remettre en suspension le culot partiellement digéré en mélange tissu digestion fraîche et ré-incuber avec la rotation à 37 ° C pendant une autre heure 4-12. Répéter les étapes 1,6 et 1,7. Si la digestion est encore incomplète, encore une fois ajouter le mélange de digestion au culot et ré-incuber avec une rotation à 37 ° C pendant la nuit. La concentration d'enzymes peut être réduite pour éviter une sur-digestion pendant une nuit.
- Lorsque la digestion est terminée, centrifuger les tubes à 600 xg pendant 5 min, aspirer le résuméion mélange, resuspendre le culot dans le milieu avec antibiotiques à environ 15 ml/50 ml tube, 5 ml/15 ml tube.
2. Filtration et congélation des matières digérées
- Transfert des aliquotes de l'extrait concentré sur un tamis de 100 um stérile sur un tube stérile de 50 ml. Laissez le drain milieu dans le tube, puis relaver les organites sur le dessus 1-2x fois avec 2-3 ml de milieu. Répétez jusqu'à ce que le culot remis en suspension a été transférée. S'il existe des organites trop sur le filtre et le milieu n'a plus facilement les drains, utiliser un nouveau filtre (s) de la matière restante. Soigneusement retournez le filtre (s) sur le dessus d'un autre tube stérile et laver les organites dans le tube avec plus de support. Il s'agit de la piscine de 100 um organoïde.
- Prenez le matériau qui s'écoule dans l'original tube de 50 ml et répéter le processus de 2,1 en utilisant un tamis 40 um, pour obtenir la piscine de 40 um organoïde, qui contient la plupart des structures alvéolaires. Le matériau qui a drainé dans eTube électronique constitue la piscine filtrat, qui contient des touffes individuelles / petits groupes de cellules mésenchymateuses et épithéliales et des petits morceaux de la vascularisation.
- Pellets de 100 um, 40 um, et les piscines filtrat à 600 xg pendant 5 min.
- Aspirer le surnageant, reconstituer chaque tube en CPM II (DME/F-12 ou équivalent avec 44% de FCS et 6% de DMSO) en utilisant environ 1 ml de CPMII par 0,1 ml de granulés emballés. Conserver à 4 ° C.
- Un plat de graines de test pour les 2 piscines organoïdes en plaçant 0,1 ml de matériel remis en suspension dans une goutte de culture de tissu plat 35 mm en plastique à goutte comme dans 3.2 ci-dessous. La piscine filtrat peut être directement ensemencées sur des cultures de tissus en plastique avec support des fibroblastes (DME/F-12 ou équivalent avec 10 ug / ml d'insuline et 10% de FBS).
- Aliquoter le reste du matériel remis en suspension dans Nunc ampoules de type gel (1 ml / 2 ml en ampoule). Geler pendant une nuit à -80 ° C, puis transférer rapidement vers le stockage dans l'azote liquide. Nous n'avons pas observé de perte significative de viabilitédans nos ampoules d'origine conservé congelé depuis la fin des années 1970.
3. L'ensemencement organites congelés et Subculture des cultures primaires
- Décongeler rapidement l'ampoule congelée contenant les organites dans un bain d'eau à 37 ° C. Les semences organoïdes en 2 à 10 (habituellement ~ 6) 60 mm, des plats ou des boîtes de 100 mm 3.1, en fonction de l'estimation visuelle du nombre de organoïdes dans l'ampoule. Organites environ 20-40 ensemencées par antenne parabolique de 60 mm est optimal.
- Organites décongelés sont placés avec soin, goutte à goutte, sur la surface de plat avec une pipette de 1 ml ou une pipette Pasteur pour une répartition uniforme de la organites. Organoïdes placés ensemble aura pour conséquence un espace limité, ce qui donne lieu à moins de cellules de la sous-culture ou de congélation. Évitez de vous gratter la surface plat (cellules ont tendance à ne pas se développer dernières surfaces rayées). Attendre 1-2 minutes pour permettre aux organites joindre, puis ajouter lentement milieu de croissance pour ne pas déloger les organites (par exemple 2-3 ml/60 plat mm). Jencubate à 37 ° C dans le CO 2 incubateur humidifié. Ce sont les cultures primaires. Nous utilisons actuellement M87A + ocytocine (X) moyen pour la croissance la plus vigoureuse HMEC (Figure 2).
- Après 1 jour, vérifiez que les organites sont attachés. Ajouter à moyen supplémentaire (par exemple 2-3 ml/60 plat mm). La migration cellulaire des organites doit être visible par les 24-48 heures, et l'excroissance mitotique par 48-72 h après le semis (figure 1B, C). Parfois, l'attachement est pauvre bout de 24 heures, surtout si le placage organites overdigested ou organites de femmes plus âgées, mais la plupart des préparations joindre dans les 72 h. De petits morceaux de la vascularisation peut fixer et donner lieu à excroissance de cellules de fibroblastes (figure 1D).
- Nourrir les cultures au moins 3 fois par semaine. Les cellules cultivées dans M87A-type de support croître jusqu'à confluence près dans les 5-8 jours, en fonction de la densité de semis.
- S'il existe de croissance des fibroblastes important, la trypsine différentielle (DT), sur la base de l'détachement rapide des fibroblastes provenant de la surface en plastique, est nécessaire pour éliminer les fibroblastes. Lorsque les plaques épithéliales deviennent grands médias aspirés, plat de lavage (par exemple, 1-2 ml/60 plat mm) avec STE (solution saline, la trypsine 0,05%, 0,02% d'EDTA), aspiration, ajouter de l'0,5 ml STE et laisser à température ambiante pendant environ 1 min avec l'observation microscopique continue. Lorsque les fibroblastes se détacher, mais les cellules épithéliales sont encore adhérent, doucement mais fortement frapper le côté du plat contre une surface dure pour déloger les fibroblastes, puis rapidement aspirer. Laver une fois avec du PBS, et aspirer à nouveau. Cultures fortement contaminés par des fibroblastes peut-être besoin d'une DT supplémentaire.
- Repiquer des cultures primaires lors de grandes plaques épithéliales sont présentes, mais avant la confluence. La densité de semis organoïde et l'attachement va influencer le temps nécessaire. Pour conserver la culture primaire et de générer de multiples cultures secondaires, réparties dans le temps, nous effectuons Trypsinizations partielles (PT).
- Aspirer les médias, laver un plat de 60 mm avec 1-2 STE ml, ajouter 0,5 ml STE frais à plat. Observez le détachement des cellules sous le microscope à température ambiante pendant 1-5 min, avec coups doux du plat de promouvoir le détachement des cellules. Trypsinisation doit être arrêtée lorsque ~ 50% des cellules sont détachées. Au début des TP ont généralement détachement cellulaire rapide. Pour plus tard, physiothérapeutes, les cellules peuvent être placés à 37 ° C pour accélérer le détachement, avec une surveillance attentive, comme toutes les cellules peuvent se détacher rapidement.
- Ajouter 2 ml de sérum contenant des médias pour le plat, repipette pour se laver, et transférer dans un tube de 15 ml stérile. Répéter 2 fois avec un autre support de ~ 1-2 ml, en ajoutant le lavage dans le tube. Réalimenter le plat principal et le retour de l'incubateur. Compter le nombre de cellules dans le tube avec l'hémocytomètre. TP peut être répété environ 4 à 8 fois avec la repousse des cellules bien dans les plats principaux et les équivalents croissance à long terme des repiquées secondaires ou congelés (cellules second passage sont appelés secondaires, une fois repiquées, les cellules ne sont longer primaires). Une fois le matériau organoïde n'est plus présente dans les cultures primaires, secondaires repiquées montrent un déclin à long terme du potentiel de doublement de population.
- Pour repiquer secondaires, les cellules de semence directement du tube dans des boîtes. Les semis de 1-2 x 10 5 mm cellules/100 plat dans un milieu solide tel que M87A + X conduira à la confluence dans les 4-7 jours. Nous ajoutons la toxine du choléra dans le milieu au second passage d'accroître le potentiel prolifératif; la toxine du choléra est omis dans la culture primaire car elle conduit à excroissance cellulaire multicouche des organites.
- Pour la congélation comme secondaires, tube de granulés à 600 xg pendant 5 min, et remettre en suspension dans CPMII avec une densité finale de 10 6 cellules / ml. Aliquoter remis en suspension les cellules dans Nunc ampoules de type gel, geler toute la nuit à -80 ° C, puis transférer sans tarder au stockage dans l'azote liquide.
- Il est recommandé de congeler les cellules de la PT première garde, etutiliser des cellules de la PT deuxième sous-culture. TP supplémentaires peuvent être conservés congelés pour une utilisation future.
Résultats
Des chiffres représentatifs pour les tissus digérés correctement à organites et mis en culture sont présentés dans la figure 1. Tissus incomplètement digérés montrera matériau encore attaché à l'extérieur de ces structures, et aura probablement une certaine croissance des cellules fibroblastiques en culture primaire, nécessitant DT pour le retirer. Tissus Overdigested montrera moins lisses frontières extérieures, et peut prendre plus de temps pour fixer en culture primaire. Excroissance épithéliale doit débuter dans les 48-72 heures (1B, C). De petits morceaux de vascularisation (1D) peut être une source d'excroissance des cellules mésenchymateuses. Excroissances épithéliales montrent que les populations morphologiquement hétérogènes, avec des populations proliférantes qui contiennent des mélanges de cellules avec des marqueurs associés à myoépithéliales, l'ancêtre, et les lignées luminales (1E, 3C-E). Croissance dans des milieux de faible contrainte comme M87A complétés avec la toxine cholérique et l'ocytocine soutiendra à long terme supérieurela croissance de la normale pré-stase HMEC par rapport aux précédentes formulations de milieux (figure 2). M87A-type de support soutiendra également la croissance des cellules luminales et progénitrices à travers des passages 4-8 (figures 3C-E, 4); par la suite, la plupart des cellules montrer les marqueurs de lignage ne myoépithéliales. HMEC cultivés sur plastique peuvent conserver leur capacité à former 3D correcte auto-organisation à micro micropuits 3D, avec des cellules luminales intérieur des cellules myoépithéliales (figure 4A, B), et pour former des structures organisées moment de l'étalement dans le Matrigel (4C, D).
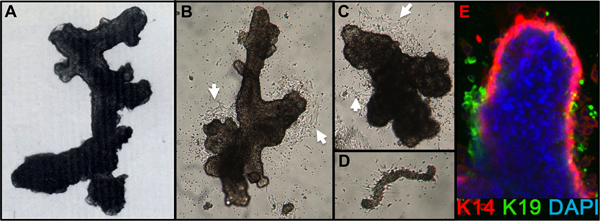
Figure 1. HMEC organites et de la culture primaire. (A) organoïde montrant la structure canalaire-alvéolaire après digestion et la filtration. (B, C) montrant la structure organites canalaire et alvéolaire 2 jours après le placement en culture primaire; noter la cellule de début outgroissance (flèches blanches). (D) des vaisseaux sanguins Petit attachée et avec des fibroblastes de départ excroissance de mêmes cultures que B, C. (E) excroissance des cellules épithéliales de la culture organoïde primaire au bout de 4 jours. Lignées sont identifiées par coloration avec des anticorps contre K14 (rouge) et K19 (vert); noyaux ont été colorées avec du DAPI (bleu). Luminal (K14-/K19 +, vert), myoépithéliales (K14 + /-K19, rouge), et les cellules progénitrices (K14 + / K19 +, cellules jaunes) sont visibles. Cellules non colorées sont observées dans le noyau organoïde due à la pénétration d'anticorps incomplet.
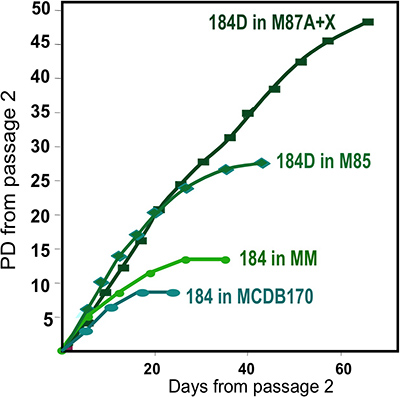
Figure 2. Organites de croissance des cultures HMEC dans les formulations de différents médias. Obtenus à partir d'un individu, un spécimen 184, ont été lancés dans la culture primaire en utilisant différentes formulations de milieux. Meilleure croissance à long terme est obtenue en utilisant notre formulation la plus récente, M87A + ocytocine (X) 4. Ce milieu prend également en chargecroissance de plusieurs lignées HMEC (voir Fig. 1E). Une formulation antérieure médias, MM 3 procuré une croissance moins robuste, tandis qu'un milieu sans sérum, MCDB170 (commercial MEGM) 17 conduit à une induction rapide de l'inhibiteur de la kinase cycline p16 INK4a et de sélection des cellules aberrantes 7,11,13.
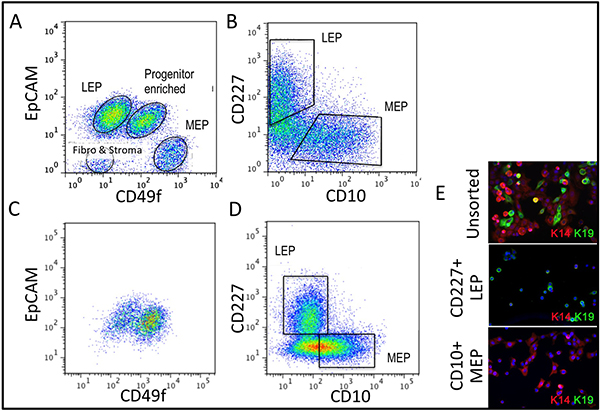
Figure 3. Comparaison de la diversité dans la lignée organites incultes et HMEC culture à 4 analyse FACS ème passage. (A, B) d'un inculte, organoïde enzymatique dissocié de (A) l'expression de EpCAM et CD49f/alpha 6 intégrine, et (B) CD227/Muc1 et CD10/CALLA. (C, D) analyse FACS des 4 ème passage pré-stase HMEC pour l'expression de (C) et de l'intégrine EpCAM CD49f/alpha 6, et (D) et CD227/Muc1 CD10/CALLA. P identifiablesopulations sont étiquetés comme LEP (exprimant EpCAM luminale des marqueurs ou CD227), député européen (exprimant myoépithéliales marqueurs CD49f ou CD10), ou PROG (enrichi en CD49f + / + EpCAM population). Notez que lors de l'adaptation à la réglementation culture de modifications EpCAM et CD49f par rapport aux organites incultes. (E) Unsorted HMEC et FACS enrichi LEP et député à 4 ème passage colorées pour une analyse par immunofluorescence de la kératine K14 (MEP marqueur) et K19 (LEP marqueur) pour vérifier l'identité lignée. Noyaux colorés au DAPI apparaissent en bleu.
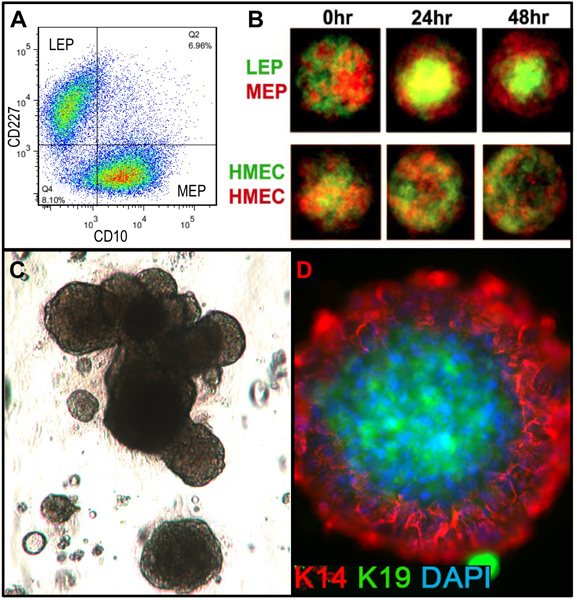
Figure 4. HMEC culture sont capables de former des structures organisées en relation avec la lignée de type in vivo quand ils sont placés dans des micro-environnements appropriés. (A) pré-stase 4 ième passage HMEC étaient FACS enrichi into luminale LEP et les lignages MEP myoépithéliales l'aide de marqueurs pour CD227 et CD10, avec ces lignées vérifiées par l'expression de K14 et K19 (non représentée). (B) Une fois mélangés dans des micropuits à micro, les cellules cultivées étaient capables d'auto-organisation dans des bicouches avec des MEP à l'extérieur et le LEP interne [adapté de Chanson et al. 5]. Marqué par fluorescence LEP (vert) et député européen (rouge) ont été imagées avec un microscope confocal à 0 h, 24 h et 48 h après l'addition de la micropuits (supérieure). Contrôle HMEC ont été arbitrairement étiqueté avec le rouge ou le vert des marqueurs fluorescents (inférieur). (C) image Fond clair FACS des cellules souches enrichies (CKIT +) plaqué en 3D (Matrigel) la culture et cultivées pendant 18 jours. Structures qui en résultent peuvent présenter morphogenèse alvéolaire. (D) Les structures ont été extraites de Matrigel et colorées pour détecter K14 et K19; noyaux ont été DAPI. L'analyse par immunofluorescence montre des structures organisées avec pola luminal et basal correcterité.
Discussion
La méthode humaine de traitement des tissus mammaires présentée ici permet d'obtenir pures cellules épithéliales mammaires à partir du mélange hétérogène de types de cellules dans le sein humain. Filtration au travers des pores de taille fixe permet la séparation des différentes fractions de la glande mammaire (par exemple, des canaux et canalaire contre-alvéolaire alvéolaire) de la matrice digéré stroma. Isogéniques fibroblastes mammaires peuvent être obtenues pour correspondre aux cellules épithéliales. Frozen matière digérée a conservé une bonne viabilité pendant plus de 30 ans. Cette méthode a fonctionné avec succès sur tous, mais très fibreuses tissus mammaires, et est simple à réaliser. D'autres variantes de traitement des tissus mammaires existent qui ne fournissent pas de fractions épithéliales qui sont aussi viables, propres ou séparés. Placement des organites transformés en culture avec de faibles inducteurs de stress médias tels que M87A permet croissance à long terme du HMEC avec des marqueurs de la lignée multiples. HMEC qui ont été cultivées sur plastique tout en conservant la capacité de générationte des structures 3D avec la normale dans les relations lignagères vivo similaires. Ces cultures HMEC conviennent pour une étude expérimentale approfondie, y compris à haut débit, d'un comportement normal et HMEC facteurs qui peuvent propulser ou inhiber la sénescence et de la transformation.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
MAL, JCG, et MRS sont pris en charge par la NIA (R00AG033176 et R01AG040081) et par le Laboratoire Directed Research and Development, US Department of Energy contrat # DE-AC02-05CH11231.
matériels
| Name | Company | Catalog Number | Comments |
| Une boîte de Pétri en verre 15 cm | VWR | 89000-308 | |
| Ciseaux 6.5 " | VWR | 82027-594 | |
| Pince à 8 " | VWR | 82027-436 | |
| Scalpels jetables | Miltex | 4-411 | |
| Collagénase | SIGMA | C0130 | |
| Hyaluronidase | SIGMA | H3506 | |
| Insuline | SIGMA | I5500 | |
| DMSO | SIGMA | D8418 | |
| Pennicillin / streptomycine | Life Technologies | 15140-122 | |
| Fungizone | Life Technologies | 15290-018 | |
| Sulfate de polymyxine B | Life Technologies | 21850-029 | |
| Fetal Bovine Serum | Life Technologies | 26140-087 | |
| Trypsine 0,05% 100 ml | Life Technologies | 25300-054 | |
| DMEM/F12 | Life Technologies | 11039-021 | |
| HulaMixer | Life Technologies | 159-20D | |
| Tamis cellulaire 100 um | BD Falcon | 352360 | |
| Tamis cellulaire 40 pm | BD Falcon | 352340 | |
| Tubes 15 ml | Greiner Bio-One | 188-261 | |
| Tubes de 50 ml | Greiner Bio-One | 227-261 | |
| Plats TC 10 cm | Greiner Bio-One | 664-160 | |
| Plats TC 6 cm | Greiner Bio-One | 628-160 | |
| Flacons cryogéniques | Nalgene | 5000-1020 | |
| Heamocytometer | Hauser scientifique | 1490 | |
| Centrifuger | Eppendorf modèle | 5702 |
Références
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon