Method Article
細胞培養のための人間の削減乳房形成や乳房切除組織の処理
要約
ヒト乳腺外科廃棄材料を処理する方法が記載されている。オルガノイドの形で処理された組織は、無期限に凍結したり、長期的な成長のための文化に入れ保存することができます。この方法は、実験的な正常なヒト上皮細胞生物学の検査、および外因性の摂動の効果を可能にします。
要約
正常ヒト乳腺上皮細胞(HMEC)の動作方法と、正常な細胞が異常な性質を獲得の実験的検討では、in vivoで生物学のそれより正確にモデルのin vitro培養系によって促進することができる。細胞分化を研究するためのヒト由来の材料を使用することは、加齢、老化、および不死化は1-2人間と一般的に利用さげっ歯類の細胞間で、これらのプロパティの多くの重要な分子の違いが与えられたが特に有利で ある。正常と異常組織が大量に削減乳房形成や乳房切除手術の周波数による使用可能であるため、乳腺細胞が便利なモデルシステムを提示する。
乳腺は、多くの異なる細胞型、 例えば 、上皮細胞、脂肪、間葉、内皮の複雑な混合で構成されています。上皮細胞は、泌乳期乳腺の分化機能を担当しているまた、ヒト乳癌の大部分の起源である。私たちは純粋な上皮成分にだけでなく、間葉系細胞を3乳腺外科廃棄組織を処理する方法を開発した。処理された材料は、無期限に凍結保存、または初代培養に開始することができます。外科廃棄材料が実験室に輸送して、手動で上皮含有組織を濃縮するために解剖されています。基底膜における上皮からコラゲナーゼ、ヒアルロニダーゼストリップ間質材料を用いた解剖組織のその後の消化。上皮ツリーの結果小片(オルガノイド)は、固定孔径のメンブレン上の順次濾過により消化ストロマから分離することができる。細孔の大きさに応じて、画分を大きく肺胞/腺管部分、小さい歯槽クラスタ、または間質細胞から成る得ることができます。培養はオルガノイドとしてではなく、DISとして開始されたときに我々は優れた成長を観察しているsociated単一細胞。低応力誘導培地を用いて培養におけるオルガノイドの配置では、複数の系統型(筋上皮、管腔、前駆)4-5のマーカーを用いて正常なHMECの長期的な成長をサポートしています。細胞が十分な数は、広範な実験的な標準化された細胞のバッチを使用して検査だけでなく、高スループットのモダリティを用いた尋問を許可するために1個の組織から得ることができる。
培養HMECは正常な成長、分化、老化、老化を支配するプロセス、およびどのようにこれらの通常のプロセスは不滅と悪性形質転換4-15,16時に変更されているを調べる研究のさまざまな分野で用いられてきた。細胞外マトリックス物質の存在下で成長、他の細胞型、および/ または3D文化の影響は、プラスチック5,15上での成長と比較することができます。培養HMECは、正常細胞から始まり、その要因を調べるために実験的に扱いやすいシステムを提供人間の老化と発癌を推進または防ぐかもしれません。
プロトコル
1。組織の処理と消化
- 外科的処置から廃棄材料として人間の乳腺組織を取得します。削減mammoplastiesは正常または良性細胞を提供することができます。線維腺腫とgynecomastiasは良性細胞を提供する、非腫瘍乳房切除組織(末梢または腫瘍と反対、または皮下)ノーマルからmicrotumorsを含有することに良性の範囲とすることができる細胞を提供する。適切なIRBの承認が廃棄材料を取得する前に存在していることを確認します。すべての材料は、血液媒介病原体の規制の下で扱われるべきである。
- 100 U / mlペニシリン、100μg/ mlのストレプトマイシン、5μg/ mlのファンギゾン、50U/mlポリミキシンBを補充バッファまたはメディア( 例えば 1時01ダルベッコ改変イーグル培地とハムF-12)を含有する滅菌容器に入れ材料および10%ウシ胎児血清、および4の実験室への輸送℃まで削減乳房形成組織を大幅にsuコマンドに影響を与えることなく、72時間、4℃で保存したり、出荷することができますbsequent細胞の生存。非縮小乳房形成組織の小片は、より迅速な処理を必要とするかもしれません。
- 滅菌メス、鉗子、はさみの組み合わせを使用して脂肪組織、結合組織と血管の間質マトリックスから上皮領域を分離する。大きなガラス滅菌シャーレ( 例えば 、150ミリメートル)でハサミと場所との組織片を切り取ります。優しくひどく脂肪物質を削り取るための材料とメスを保持するために鉗子を使用して、黄色く間質マトリックス中に埋め込まれた白いストランドとして表示上皮領域を、ばらばらにする。消化を促進するために、50mlの試験管に反対メスや場所を使用して3〜4ミリの小さな部分に上皮組織を切った。組織は大量の処理されている場合は、新鮮なメス刃が必要になることがあります。制度上の規制に従って処分に皿から脂肪物質を取り除きます。
- 重く線維性組織( 例えば 、皮下MAS重度の線維嚢胞性疾患を持つtectomies)、よりソリッド白、非上皮性物質が存在します。それはそのような繊維状マトリックスからの上皮細胞をばらばらにするのは難しいかもしれません。繊維状物質の大部分は、エリア1〜3 mm角の〜とは別に消化される小さな断片に切断することができる。
- チューブの体積の3分の1よりも大きいを含まない組織とコニカル遠心チューブ(50 mlまたは15ミリリットル)に解剖上皮組織を置きます。組織消化混合物(DME/F-12または同等、10μg/ mlのインスリン、上記のような抗生物質、および10の最終濃度を用いて、回転中に混合を可能にするためにわずかな空気のスペースを残して、フルボリュームにチューブを持ち出す%FCS、200 U / mlの粗製コラゲナーゼおよび100 U / mlのヒアルロニダーゼ。
- プレースHulaMixerチューブローテーター上管および37℃で一晩8 rpmで360°回転℃に
- 5分間、600×gで遠心する。処分協定のための上澄みの脂肪と媒体を捨てる制度的な規制にING。
- 培地中のペレットの小アリコートを希釈することにより、消化が完了するのを確認してください。顕微鏡検査がスムーズに見える、歯槽管、または接続された間質( 図1A)から無料で膵管肺胞構造を持つ細胞(オルガノイド)の塊を示すとき消化は完了です。削減乳房形成組織は通常まだ一晩消化した後に添付された間質が表示され、追加の消化時間が必要になります。
- 別の4から12時間37℃で回転と新鮮な組織消化混合物と再インキュベートで不完全消化ペレットを再懸濁します。手順1.6と1.7を繰り返します。消化がまだ不完全である場合には、再度37℃で一晩回転でペレットと再インキュベートする消化混合物を追加します。酵素の濃度は一晩過消化を防ぐために減少させることができる。
- 消化が完了すると、5分間600×gで遠心する、ダイジェストを吸引約15 ml/50 mlチューブ、5 ml/15 mlチューブで媒体プラス抗生物質のイオン混合、ペレットを再懸濁します。
2。消化された物質の濾過及び凍結
- 滅菌した50mlチューブオーバー滅菌100μmのストレーナーに再懸濁ペレットのアリコートを転送します。チューブに培地ドレインせてから、培地の2-3 mlの上位1-2X倍にオルガノイドを洗い直す。再懸濁ペレットのすべてが転送されるまで繰り返します。フィルタおよび媒体上にあまりにも多くのオルガノイドがある場合は、もはや簡単に排水せず、残りの材料のための新しいフィルタ(複数可)を使用しています。慎重に別の滅菌チューブの上にフィルタ(複数可)を反転させると、より培地をチューブにオルガノイドを洗う。これは、100μmのオルガノイドプールです。
- 元の50mlチューブに排出物質を取るとほとんど胞構造が含まれている40μmのオルガノイドプールを得るために、40μmのストレーナーを使用して2.1のプロセスを繰り返します。番目に排出物質電子管は、間葉と上皮細胞と血管系の小片のシングル/小さな塊が含まれているろプールを構成している。
- 5分間、600×gでペレットは、100μm、40μmとし、濾液プール。
- パックされたペレットを0.1mlあたりCPMII約1mlを使用して、CPM II(44%FCS、および6%DMSOによるDME/F-12または同等品)で上清を、再構成するそれぞれのチューブを吸引します。 4℃に保つ
- 下記の3.2のようにドロップすることによって35mmの組織培養プラスチック皿のドロップに再懸濁した材料の0.1ミリリットルを配置することによって、シード2オルガノイドプール用のテスト皿を。濾液プールは直接線維芽細胞培地(10μg/ mlのインスリンおよび10%FBSを含むDME/F-12または同等品)を用いて組織培養プラスチック上に播種することができる。
- アリコートヌンク型凍結アンプル(1ミリリットル/ 2ミリリットルのアンプル)に再懸濁し、残りの材料。 -80℃で一晩凍結し、液体窒素中でストレージに速やかに転送します。私たちは、生存率の有意な損失が確認されていません当社独自のアンプルに、1970年代後半以来、凍結保存。
3。冷凍オルガノイドと初代培養の継代培養を播種
- 素早く37℃の水浴中でオルガノイドを含む凍結アンプルを解凍します。アンプルでオルガノイド数の目測に応じシード2から10にオルガノイド(通常〜6)60ミリメートル皿、または1-3の100mm皿、。約60 mmディッシュに播種当たり20から40オルガノイドは最適です。
- 解凍しオルガノイドを慎重に配置され、オルガノイドを均等に分配するために1ミリリットルピペットやパスツールピペットを用いて皿の表面に、一滴ずつ。一緒に近くに配置オルガノイドは、継代培養や凍結のための少数の細胞を生じさせる、伸長のための限られたスペースを持つことになります。 (細胞が過去の傷の表面を成長させない傾向がある)皿の表面を傷つけないように注意してください。オルガノイド添付し、その後徐々にオルガノイド( 例えば、2月3日ml/60 mmディッシュ)外れを避けるために増殖培地を追加できるようにするために1〜2分待ちます。私37℃で加湿CO 2インキュベーター内でncubate。これらは初代培養されています。我々は現在、最も堅牢なHMEC成長( 図2)M87A +オキシトシン(X)の培地を使用しています。
- 1日後、オルガノイドが取り付けられていることを確認します。追加の媒体( 例えば、2月3日ml/60 mmディッシュ)を追加します。オルガノイドから細胞遊走は、播種後48〜72時間( 図1B、C)で24〜48時間、および細胞分裂伸長によって表示されるはずです。ときどき添付ファイルは、特に年配の女性からoverdigestedオルガノイドまたはオルガノイドをめっきした場合、24時間後に貧しいですが、ほとんどの準備は72時間以内にアタッチされます。血管系の小片は、添付して、線維芽細胞の増殖( 図1D)を生じさせることができる。
- 文化を少なくとも週3回を養う。 M87A型媒体で培養した細胞は、播種密度に応じ、5-8日以内に近く合流に成長。
- に基づいて、重要な線維芽細胞成長、微分トリプシン(DT)は、存在する場合表面のプラスチックからの繊維芽細胞の急速な離脱は、線維芽細胞を除去するために必要とされる。上皮パッチはSTE(生理食塩水、0.05%トリプシン、0.02%EDTA)、吸引と大きく、吸引メディア、洗浄皿( 例えば 、1〜ml/60 mmディッシュ)になると、室温で新しい0.5 mlのSTEを追加して残す連続的な顕微鏡観察で1分程度のため。線維芽細胞は切り離すが、上皮細胞が優しく、まだ付着しているが、急激に線維芽細胞を取り除くために、ハード面に対して皿の側面をノックしてからすぐに吸引した場合。 PBSで1回洗浄し、再度吸引します。ひどく汚染された線維芽細胞と文化が追加DTが必要な場合があります。
- 大型上皮パッチが存在している初代培養を継代培養が、合流する前に。オルガノイド播種および添付ファイルの密度が必要な時間に影響を及ぼすであろう。初代培養を維持するには、時間をかけて等間隔に複数の二次培養液を生成するためには、部分Trypsinizations(PT)を実行します。
- 吸引メディアは、皿に0.5ミリリットル新鮮STEを追加し、1〜2 mlのSTEと60ミリメートル皿を洗う。細胞の剥離を促進するための皿の穏やかなノッキングで、1から5分間室温で顕微鏡下で細胞の剥離を観察します。細胞の約50%が外れたときにトリプシン処理を停止する必要があります。初期のPTは通常、迅速な細胞剥離があります。すべての細胞はすぐにオフに来るかもしれないように、後のPTのために、細胞を、注意深く監視して、より速く剥離のために37℃で配置することができます。
- 皿に血清含有培地の2 mlを加え、repipetteは洗浄し、滅菌した15mlチューブに転送します。チューブに洗浄を追加し、別の〜1-2 mlの培地で2回繰り返します。主要な皿を再供給するとインキュベーターに戻ります。血球計付きチューブに細胞をカウントする。一度継代培養し、細胞がLOません; PTをプライマリー料理や継代培養や凍結セカンダリ(第二通路細胞がセカンダリと呼ばれるから同等の長期的な成長の良好な細胞成長により4から8回程度繰り返すことができますnger原色)。一度オルガノイド物質はもはや初代培養に存在していない、継代培養セカンダリーは、長期的な集団倍加電位の低下を示す。
- 皿にチューブから直接セカンダリー、種細胞に継代培養した。そのようなM87A + Xなどの堅牢な培地中で1〜2×10 5 cells/100 mmディッシュの播種と4-7日で合流につながる。私たちは、増殖能を高めるために第二通路で培地にコレラ毒素を追加し、それがオルガノイドから重層化細胞の増殖につながるため、コレラ毒素は、初代培養では省略されている。
- 5分間600 xgでセカンダリー、ペレット管として凍結のため、10 6細胞/ mlの最終濃度とCPMIIに再懸濁する。アリコートは、ヌンク型凍結アンプルに細胞を再懸濁し、-80℃で一晩凍結℃、その後液体窒素でストレージに速やかに転送します。
- これは、保管のための最初のPTから細胞を凍結することをお勧めします、と継代培養のための第二PTからの細胞を使用しています。追加のPTは、将来の使用のために凍結保存することができます。
結果
適切オルガノイドに消化し 、培養物中に置かれた組織のための代表的な数値は、 図1に示します。不完全に消化された組織は、まだこれらの構造体の外側に取り付けられた材料が表示され、可能性が高いDTは削除する必要が、初代培養におけるいくつかの線維芽細胞増殖を持つことになります。 Overdigested組織が少なく滑らかな外部の境界線を表示され、初代培養でアタッチに時間がかかる場合があります。上皮性増殖は48〜72時間(1B、C)内で開始する必要があります。血管系(1D)の小片は、間葉系細胞の増殖の原因となることができます。上皮の増生は筋上皮、先祖に関連するマーカーを持つ細胞、および管腔系統(1E、3C-E)の混合物を含む増殖集団で、形態学的に不均一な集団を示しています。コレラ毒素およびオキシトシンを補充などM87Aとして低応力メディアの成長は長期的に優れたサポートしています前のメディア製剤( 図2)と比較して、通常のプレうっHMECの成長。 M87A型メディアも通路4-8( 図3C-E 4)を介して管腔側細胞と前駆細胞の増殖をサポートする、その後はほとんどの細胞は筋上皮のみ系統マーカーが表示されます。プラスチック上で培養HMECは筋上皮細胞( 図4A、B)への内部管腔の細胞を用いて、マイクロパターン3Dマイクロウェル内自己組織化適切な3Dを形成する能力を保持することができ、マトリゲル(4C、D)に播種したときに組織化された構造を形成する。
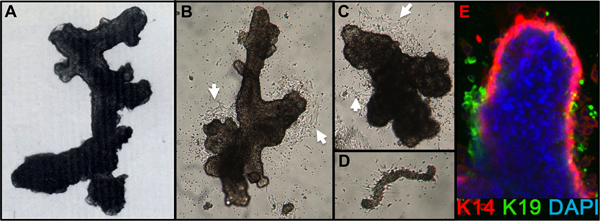
図1。 HMECオルガノイドと初代培養(A)オルガノイドは消化管、濾過後、肺胞の構造を示す。 (B、C)が2日、初代培養で配置した後に乳管および肺胞構造を示すオルガノイドは、先頭セルoutgrの点に注意してください。owth(白矢印)。 (D)は小血管は、AとB、Cと同じ培養から線維芽細胞の増殖を開始すると接続されている4日後にプライマリオルガノイド培養から(E)の上皮細胞の増殖。系統はK14(赤)とK19(緑)に対する抗体で染色することにより識別され、核はDAPI(青)で染色した。腔側(K14-/K19 +緑)、筋上皮(K14 + /-K19、赤)、および前駆(K14 + / K19 +黄)細胞が見えます。染色されていない細胞は不完全抗体の浸透に起因オルガノイドコアで観察されています。
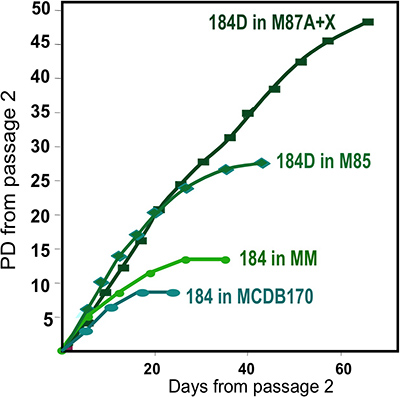
図2。 1個、184検体から得られた様々なメディア製剤におけるHMEC培養物の増殖。オルガノイドは異なるメディア製剤を用いて初代培養に開始された。最良の長期的な成長は、私たちの最新の製剤、M87A +オキシトシン(X)は4を使用して得られる。この媒体はまた、サポートしています複数HMEC系統の成長(図1E参照)。以前のメディア製剤は、MM 3は少なく力強い成長を提供し、一方、無血清培地、MCDB170(商用MEGM)ラピッドサイクリンキナーゼ阻害剤p16 INK4aの誘導および7,11,13異常細胞の選択〜17リード。
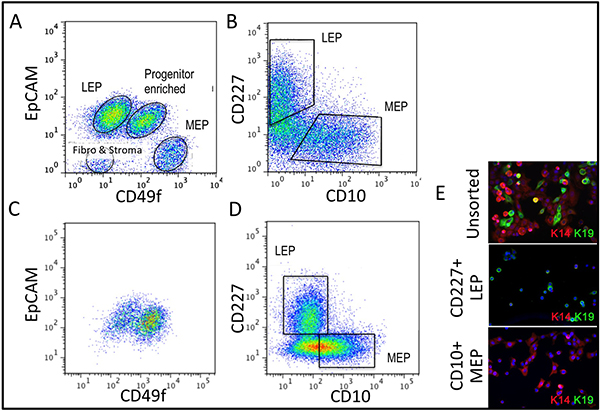
図3。 4 回目の継代培養されていないオルガノイドおよび培養HMECにおける系統の多様性の比較 (A、B)EpCAMとCD49f/alpha 6インテグリンの(A)の発現のための教養のない、酵素的に解離オルガノイドのFACS分析、および(B)CD227/Muc1とCD10/CALLA。 (C)EpCAMとCD49f/alpha 6インテグリンを発現させるための(C、D)の4 番目の通路プレうっHMECのFACS分析、および(D)CD227/Muc1とCD10/CALLA。識別可能な電話opulationsはLEP(腔側マーカーEPCAMまたはCD227を発現する)、MEP(筋上皮マーカーCD49fまたはCD10を発現する)、またはPROG(CD49f + / EPCAM +集団に富む)として分類されます。 EpCAMとCD49f変化の文化の規制への適応時に教養のないオルガノイドに比較することに注意してください。 (E)はソートされていないHMECと4 番目の通路でFACS富むLEPとMEPは、系統の識別を検証するためにケラチンK14のMEP(マーカー)とK19(LEPマーカー)の免疫蛍光分析のために染色。 DAPIで染色された核は青色で表示されます。
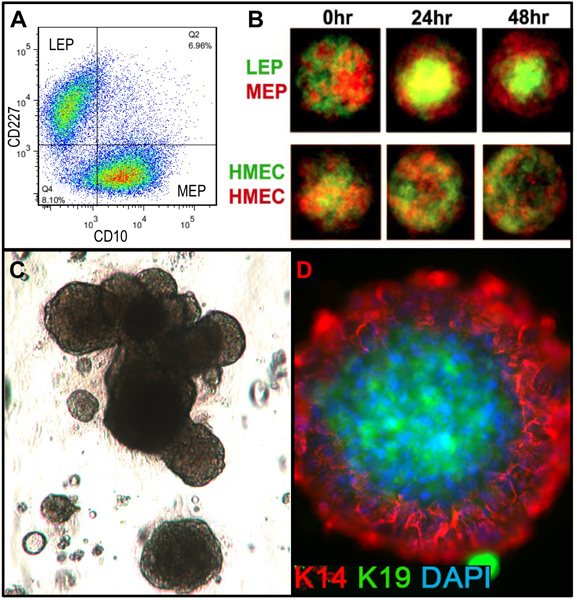
図4。培養HMECは適切な微小環境に置かれたときに生体のような系統関係にあると組織化された構造を形成することが可能である。()プリうっ血4 番目の通路HMECはFACSに富んだ私でしたNTO腔側LEPと筋上皮のMEP系統(図示せず)は、K14とK19の発現によって検証されたこれらの系統で、CD227およびCD10のマーカーを使用しています。 (B)は、マイクロウェルマイクロパターンで一緒に混合すると、培養した細胞は、外部と内部のLEPのMEPとの二重層に自己組織化することが可能であった[シャンソンらから適応。5]。蛍光標識されたLEP(緑)とMEP(赤)は共焦点0時間、24時間で顕微鏡、およびマイクロウェル(上側)に加えて48時間後に撮像した。制御HMECは任意に赤または緑の蛍光標識(下)で標識した。 (C)は、FACSに富む前駆細胞の明視野像(CKIT +)3D(マトリゲル)培養に播種し、18日間生育させた。得られた構造は、肺胞の形態形成を示すことができる。 (D)の構造は、マトリゲルから抽出およびK14とK19を検出するために染色した、核をDAPIで対比染色した。免疫蛍光分析は正しかっ腔側と基底ポーラで組織構造を示しているrity。
ディスカッション
ここに提示され、人間の乳房組織の処理方法は、人間の乳房の細胞型の異種混合物から純粋な乳腺上皮細胞を得ることができます。固定サイズの孔を通って濾過が消化された間質マトリックスから乳腺の異なる画分( 例えば 、乳管や膵管-歯槽対肺胞)を分離することができます。同質乳腺線維芽細胞は、上皮細胞に一致するように求めることができる。凍結消化された物質は、30年以上に渡って良好な生存能力を保持しています。このメソッドは、すべてが、非常に繊維質の乳腺組織で正常に働いて、実行するのは簡単ですしています。乳腺組織の処理の他のバリエーションは、現実的な、きれいな、または分離されている上皮画分を提供していませんが存在しています。そのようなM87Aなどの低応力誘発メディアと文化の中で処理さオルガノイドの配置は複数系統マーカーでHMECの長期的な成長を可能にします。まだ属する能力を保持しているプラスチック上で培養されたHMEC生体のような系統関係における法線とteの3D構造。これらHMEC培養は通常HMEC行動や老化およびトランスフォーメーションを推進するまたは阻害する可能性のある要因についての高スループットなど、豊富な実験調査に適している。
開示事項
特別な利害関係は宣言されません。
謝辞
MALは、JCG、およびMRSはエネルギー契約の米国務省は、#DE-AC02-05CH11231、監督研究開発NIA(R00AG033176とR01AG040081)および研究所によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| ガラスシャーレ15センチメートル | VWR | 89000-308 | |
| はさみ6.5 " | VWR | 82027-594 | |
| 鉗子8 " | VWR | 82027-436 | |
| 使い捨て外科用メス | Miltex | 4から411 | |
| コラゲナーゼ | SIGMA | C0130 | |
| ヒアルロニダーゼ | SIGMA | H3506 | |
| インスリン | SIGMA | I5500 | |
| DMSO | SIGMA | D8418 | |
| Pennicillin /ストレプトマイシン | ライフテクノロジーズ | 15140-122 | |
| ファンギゾン | ライフテクノロジーズ | 15290-018 | |
| ポリミキシンB硫酸塩 | ライフテクノロジーズ | 21850-029 | |
| ウシ胎仔血清 | ライフテクノロジーズ | 26140-087 | |
| トリプシン0.05パーセント100ミリリットル | ライフテクノロジーズ | 25300-054 | |
| DMEM/F12 | ライフテクノロジーズ | 11039-021 | |
| HulaMixer | ライフテクノロジーズ | 159-20D | |
| セルストレーナーは100μm | BDファルコン | 352360 | |
| セルストレーナー40μmの | BDファルコン | 352340 | |
| チューブ15ミリリットル | グライナーバイオ1 | 188から261 | |
| チューブ50ミリリットル | グライナーバイオ1 | 227から261 | |
| TC皿10センチメートル | グライナーバイオ1 | 664から160 | |
| TC皿6センチメートル | グライナーバイオ1 | 628から160 | |
| 極低温バイアル | ナルゲン | 5000-1020 | |
| Heamocytometer | ハウザー·サイエンティフィック | 1490 | |
| 遠心 | エッペンドルフモデル | 5702 |
参考文献
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved