Method Article
Обработка по правам Маммопластика сокращении и Мастэктомия тканей для культуры клеток
В этой статье
Резюме
Метод для обработки молочной железы человека хирургический материал выбросить описано. Обработанная ткань, в виде органоиды, можно хранить замороженными на неопределенный срок или помещали в культуру для долгосрочного роста. Этот метод позволяет экспериментальное исследование нормальных человеческих эпителиальных клеточной биологии, и последствия экзогенных возмущений.
Аннотация
Experimental examination of normal human mammary epithelial cell (HMEC) behavior, and how normal cells acquire abnormal properties, can be facilitated by in vitro culture systems that more accurately model in vivo biology. The use of human derived material for studying cellular differentiation, aging, senescence, and immortalization is particularly advantageous given the many significant molecular differences in these properties between human and commonly utilized rodent cells1-2. Mammary cells present a convenient model system because large quantities of normal and abnormal tissues are available due to the frequency of reduction mammoplasty and mastectomy surgeries.
The mammary gland consists of a complex admixture of many distinct cell types, e.g., epithelial, adipose, mesenchymal, endothelial. The epithelial cells are responsible for the differentiated mammary function of lactation, and are also the origin of the vast majority of human breast cancers. We have developed methods to process mammary gland surgical discard tissues into pure epithelial components as well as mesenchymal cells3. The processed material can be stored frozen indefinitely, or initiated into primary culture. Surgical discard material is transported to the laboratory and manually dissected to enrich for epithelial containing tissue. Subsequent digestion of the dissected tissue using collagenase and hyaluronidase strips stromal material from the epithelia at the basement membrane. The resulting small pieces of the epithelial tree (organoids) can be separated from the digested stroma by sequential filtration on membranes of fixed pore size. Depending upon pore size, fractions can be obtained consisting of larger ductal/alveolar pieces, smaller alveolar clusters, or stromal cells. We have observed superior growth when cultures are initiated as organoids rather than as dissociated single cells. Placement of organoids in culture using low-stress inducing media supports long-term growth of normal HMEC with markers of multiple lineage types (myoepithelial, luminal, progenitor)4-5. Sufficient numbers of cells can be obtained from one individual's tissue to allow extensive experimental examination using standardized cell batches, as well as interrogation using high throughput modalities.
Cultured HMEC have been employed in a wide variety of studies examining the normal processes governing growth, differentiation, aging, and senescence, and how these normal processes are altered during immortal and malignant transformation4-15,16. The effects of growth in the presence of extracellular matrix material, other cell types, and/or 3D culture can be compared with growth on plastic5,15. Cultured HMEC, starting with normal cells, provide an experimentally tractable system to examine factors that may propel or prevent human aging and carcinogenesis.
протокол
1. Обработка тканей и пищеварения
- Получить молочной железы человека ткани, как выбросить материал из хирургических процедур. Сокращение mammoplasties может обеспечить нормальное или доброкачественных клеток; фиброаденомы и gynecomastias обеспечить доброкачественной клеток, неопухолевых мастэктомии ткани (периферическая или контралатеральной опухоли или подкожного) обеспечивают клетки, которые могут варьироваться от нормали к доброкачественным, чтобы содержащих microtumors. Обеспечить надлежащее одобрение IRB существует до получения выброса материала. Все материалы должны рассматриваться в соответствии с кровью патогенов правил.
- Место материал в стерильные контейнеры, содержащие буфер или средствах массовой информации (Medium например, 1:1 Дульбекко изменения Орла и Хэма F-12) дополнить 100 ЕД / мл пенициллина, 100 мкг / мл стрептомицина, 5 мкг / мл Fungizone, 50U/ml полимиксин B, и 10% эмбриональной телячьей сыворотки, и транспорта в лаборатории при 4 ° C. Ткани редукционная маммопластика можно хранить и транспортировать при температуре 4 ° C в течение 72 ч без существенного влияния на суbsequent жизнеспособность клеток. Небольшие кусочки, не редукционная маммопластика ткани может потребоваться более быструю обработку.
- Отделить эпителиальных области из стромальных матрицы жировой ткани, соединительной ткани и кровеносных сосудов, используя комбинацию стерильного скальпеля, пинцета и ножниц. Вырезать куски ткани с помощью ножниц и место в большой стакан стерильную чашку (например, 150 мм). Осторожно рассекают из эпителиальных области, которые выглядят как белые нити в матрицу желтее стромы, используя щипцы для хранения материалов и скальпель, чтобы очистить от грубой жирной материала. Для облегчения пищеварения, сократить эпителиальной ткани на более мелкие куски ~ 3-4 мм с помощью скальпеля и противоположные места в 50 мл пробирку. Если большое количество ткани обрабатываются, свежих лезвий скальпеля могут быть необходимы. Удалите жирные материалы с блюдом для захоронения в соответствии с институциональными нормами.
- В сильно волокнистых тканей (например, подкожные Рождествоtectomies с тяжелыми фиброзно-кистозная болезнь), будет более твердой белой, неэпителиальных материала. Это может быть трудно вскрыть из эпителиальных клеток из таких матриц волокнистые. Большие куски волокнистого материала можно разрезать на более мелкие куски, которые ~ 1-3 мм квадратной площади и переваривается отдельно.
- Поместите расчлененный эпителиальной ткани в конической трубе центрифуги (50 мл или 15 мл) с тканью содержащие не более одной трети объема трубки. Принесите трубу до полного объема, оставляя лишь небольшое воздушное пространство, чтобы для смешивания во время вращения, используя смесь тканей пищеварения (DME/F-12 или эквивалент, 10 мкг / мл инсулина, антибиотиков и выше, а конечной концентрации 10 % FCS, 200 Ед / мл коллагеназы сырой и 100 ЕД / мл гиалуронидазы.
- Место трубки на трубку ротатор HulaMixer и вращаются на 360 ° в 8 оборотов в минуту в течение ночи при 37 ° C.
- Центрифужные пробирки при 600 мкг в течение 5 мин. Удалите супернатант жира и средних по утилизации соглашениеING институциональных правил.
- Дата завершения пищеварения путем разбавления небольших аликвоты осадок в среду. Пищеварение является завершенным, когда микроскопическое исследование показывает, скопления клеток (органоиды) с гладкой появляться протоков, альвеолярный, или протоковой-альвеолярной структуры свободного от прилагаемых стромы (рис. 1А). Ткани редукционная маммопластика, как правило, до сих пор показывают прилагается стромы после ночного пищеварения и потребуется дополнительное время пищеварения.
- Ресуспендируют полностью переваривается гранул в свежей смеси пищеварения ткани и повторно инкубируют с поворотом на 37 ° C в течение еще 4-12 часов. Повторите шаги 1,6 и 1,7. Если пищеварение еще не завершен, снова добавить пищеварения смесь гранул и повторно инкубируют с поворотом на 37 ° C в течение ночи. Концентрация ферментов может быть уменьшена для предотвращения чрезмерного пищеварения ночь.
- При пищеварении завершено, пробирок при 600 мкг в течение 5 мин, аспирации дайджестионной смеси, ресуспендируют осадок в среде плюс антибиотики примерно 15 мл на 50 мл трубки, 5 ml/15 мл трубки.
2. Фильтрация и замораживание дайджестом материал
- Передача аликвоты Ресуспендированный осадок на стерильные 100 мкм сито над стерильные 50 мл трубки. Пусть среда стекает в трубу, то rewash органоидов на вершине 1-2х раз в 2-3 мл среды. Повторяйте, пока все Ресуспендированный осадок был перенесен. Если есть слишком много органоидов на фильтре и среднего стоки не легко, использовать новый фильтр (ы) для остальных материалов. Осторожно переверните фильтр (ы) на другую стерильную пробирку и промойте органоидов в трубу с более среду. Это 100 мкм органоид бассейн.
- Возьмите материал, который сливается в оригинальных 50 мл трубки и повторить процесс на 2,1 использовании 40 мкм сито, чтобы получить 40 мкм органоид бассейн, который содержит в основном альвеолярные структуры. Материал, который сливается в гоэлектронной трубки представляет собой бассейн фильтрата, который содержит одно / маленькие сгустки мезенхимальные и эпителиальные клетки и небольшие кусочки сосудов.
- Гранул 100 мкм, 40 мкм, и фильтрат бассейнов при 600 мкг в течение 5 мин.
- Аспирируйте супернатанта, восстановить каждую трубку в CPM II (DME/F-12 или эквивалент с 44% FCS и 6% ДМСО), используя около 1 мл CPMII в 0,1 мл упакованных гранул. Хранить при температуре 4 ° C.
- Семенной тест блюдо для 2 органоид бассейны, создав 0,1 мл ресуспендированных материала в 35 мм падение культуры тканей блюдо пластиковой по капле, как в 3.2 ниже. Бассейн фильтрат может быть непосредственно высевали на ткани пластической культуры с фибробластов среды (DME/F-12 или эквивалент с 10 мкг / мл инсулина и 10% FBS).
- Алиготе оставшиеся ресуспендированных материала в Nunc типа замораживания ампулах (1 мл / 2 мл ампулы). Заморозить в течение ночи при -80 ° C, а затем передать оперативно хранения в жидком азоте. Мы не наблюдается значительная потеря жизнеспособностиВ наших оригинальных ампулы хранят в замороженном, начиная с конца 1970-х годов.
3. Посев Frozen органоидов и субкультуры первичных культур
- Быстро оттаивать замороженные ампулах, содержащих органоидов в 37 ° С водяной бане. Семенной органоидов на 2 до 10 (обычно ~ 6) 60 мм блюд, или 1-3 мм 100 блюд, в зависимости от визуальной оценки количества органоидов в ампулах. Примерно 20-40 органоидов посеяны на 60 мм блюдом является оптимальным.
- Талая органоидов тщательно размещены, по капле, на поверхности посуды с 1 мл пипетки или пипетки Пастера для равномерного распределения органоидов. Органоидов размещены близко друг к другу будет иметь ограниченное пространство для вырост, что приводит к меньшим клеток для субкультуры или замораживания. Избегайте царапин поверхностью посуды (клетки, как правило, не растут дальше поцарапать поверхность). Подождите 1-2 минуты, чтобы органоидов прикрепить, а затем медленно добавляют питательную среду, чтобы избежать выбить органоидов (например, 2-3 мм ml/60 блюдо). Яncubate при 37 ° С в увлажненной CO 2 инкубаторе. Они являются основным культурам. Мы в настоящее время используют M87A + окситоцин (X) средой для самых надежных HMEC роста (рис. 2).
- Через 1 день, убедитесь, что органоидов прилагаются. Добавить дополнительные среде (например, 2-3 мм ml/60 блюдо). Сотовые миграции из органоидов должна быть видна по 24-48 часов, и митотической вырост на 48-72 ч после посева (рис. 1б, C). Иногда привязанность плохо после 24 часов, особенно, если нанесение покрытий overdigested органоидов или органоидов из пожилых женщин, но большинство препаратов будет приложить в течение 72 часов. Небольшие кусочки сосудистую может приложить и привести к фибробластов вырост (рис. 1D).
- Поток культур по крайней мере 3 раза в неделю. Клетки, выращенные в M87A-тип носителя расти почти до слияния в течение 5-8 дней, в зависимости от плотности посева.
- Если есть значительного роста фибробластов, дифференциальные трипсинизации (DT), основанный наОтряд быстрого фибробластов с поверхности пластика, необходима, чтобы удалить фибробластов. Когда эпителиальные патчи становятся большими, аспирата СМИ, стирка блюдо (например, 1-2 мм ml/60 блюдо) с STE (физиологический раствор, 0,05% трипсина, 0,02% ЭДТА), аспират, добавить свежий 0,5 мл STE и оставить при комнатной температуре приблизительно за 1 мин с непрерывным микроскопических наблюдений. Когда фибробласты отделить но эпителиальные клетки по-прежнему сторонник, мягко, но резко сбить стороны блюдо по твердой поверхности, чтобы выбить фибробластов, а затем быстро аспирации. Мыть один раз PBS, и аспирации снова. Культуры сильно загрязнена фибробластов, возможно, потребуется дополнительное DT.
- Субкультура первичных культур при больших эпителиальных патчей присутствуют, но до слияния. Плотность органоид посева и привязанность будет влиять на время, необходимое. Чтобы сохранить первичную культуру и создавать несколько вторичных культур, расположенными в течение долгого времени, мы выполняем частичное Trypsinizations (PT).
- Аспирата СМИ, мытье 60 мм блюдо с 1-2 STE мл, добавляют 0,5 мл свежей STE блюдо. Соблюдайте клетки отряд под микроскопом при комнатной температуре в течение 1-5 мин, с нежным стуком в блюдо, чтобы способствовать ячейки отряда. Трипсинизации должна быть прекращена, когда ~ 50% клеток были отключены. Рано СТ, как правило, быстрое отряд клетки. Для дальнейшего СТ, клетки могут быть размещены при 37 ° С для более быстрого отряда, с тщательным контролем, как и все клетки могут отрываться быстро.
- Добавить 2 мл сыворотки, содержащей СМИ к блюду, repipette мыть, и перенести в стерильные 15 мл трубки. Повторить 2 раза с другой ~ 1-2 мл СМИ, добавив, мытье к трубе. Подпиточный первичной блюдо и вернуться в инкубаторе. Подсчет клеток в пробирке с гемоцитометра. СТ может быть повторен от 4 до 8 раз с хорошим отрастания клетки в первичном блюд и эквивалентные долгосрочного роста от пересевают или замороженные вторичной (второй проход клетки называются вторичными, однажды пересевают, клетки не лоnger праймериз). После органоид материал уже не присутствует в первичных культур, пересевают вторичных показывают снижение долгосрочного потенциала удвоения популяции.
- Для субкультуры к вторичным, семена клеток непосредственно из трубки в блюдах. Посев в 1-2 х 10 5 клеток/100 мм блюдо в прочном среды, таких как M87A + X приведет к слиянию через 4-7 дней. Добавим, холерный токсин в среду во второй проход увеличить пролиферативный потенциал; холерного токсина опущен в первичной культуре, потому что это приводит к многослойным вырост клетки из органоидов.
- Для замораживания как вторичные, пеллет трубки при 600 мкг в течение 5 мин, и ресуспендируют в CPMII с конечной плотностью 10 6 клеток / мл. Алиготе ресуспендировали клетки в ампулах Nunc замораживания типа, замораживание в течение ночи при температуре -80 ° С, а затем передать оперативно хранения в жидком азоте.
- Рекомендуется, чтобы заморозить клетки от первого PT для хранения ииспользовать клетки от второго PT для субкультуры. Дополнительная СТ можно хранить в замороженном для использования в будущем.
Результаты
Представитель цифры для тканей надлежащим переваривается в органоидов и помещали в культуру показано на рисунке 1. Не полностью переваривается ткани покажет материала все еще привязаны к внешним этих структур, и, вероятно, есть некоторые фибробластов рост клеток в первичной культуре, требующей DT удалить. Overdigested ткани покажет менее гладкой внешних границ, и может занять больше времени, чтобы прикрепить в первичной культуре. Эпителиальные результатом должно начаться в течение 48-72 ч (1B, C). Небольшие кусочки сосудистую (1D) может быть источником мезенхимальные клетки вырост. Эпителиальные выросты показать морфологически гетерогенных популяций, с пролиферативной населения, которые содержат смеси клеток с маркерами, связанные с миоэпителиальных, прародитель, и просвета линий (1E, 3C-E). Рост в странах с низким СМИ стресса, такие как M87A дополнить холерного токсина и окситоцина будет поддерживать превосходную долгосрочнуюрост нормальной предварительно застой HMEC по сравнению с предыдущим составах средств массовой информации (рис. 2). M87A-типа носителя будет также поддерживать рост просвета и клеток-предшественников через каналы 4-8 (цифры 3C-E, 4); после этого, большинство клеток показывают только миоэпителиальных маркерами линии. HMEC культивировали на пластиковых можете сохранить их способность образовывать правильный 3D самоорганизации в micropatterned 3D лунок, с просвета клеток внутри миоэпителиальные клетки (рис. 4а, б), а также для формирования организованных структур при посеве в Matrigel (4C, D).
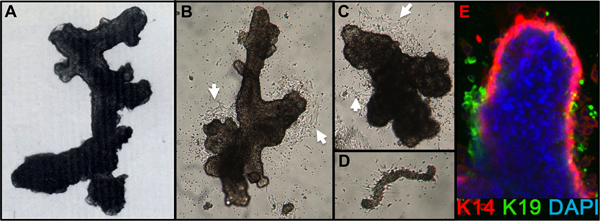
Рисунок 1. HMEC органоидов и первичной культуре. (A) органоид показывает протоковой-альвеолярной структуры после варки и фильтрации. (B, C) органоиды показывает протоков и альвеолярной структуры через 2 дня после размещения в первичной культуре; отметить outgr начале ячейкиowth (белые стрелки). (D) Небольшой сосуд прилагается и с началом фибробластов продукт из той же культуры, как B, C. (E) эпителиальные клетки нарост из первичной культуры органоид через 4 дня. Линии передачи определяются путем окрашивания с антителами к K14 (красный) и K19 (зеленый); ядра окрашивали DAPI (синий). Люминал (K14-/K19 +, зеленый), миоэпителиальных (K14 + /-K19, красный), и предшественников (K14 + / K19 +, желтый) клетки видны. Неокрашенные клетки наблюдаются в основной органоид в связи с неполным проникновением антитела.
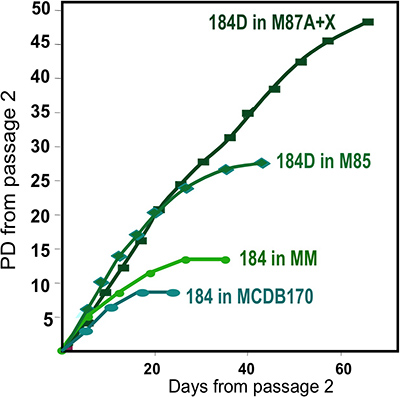
Рисунок 2. Рост HMEC культур в различных составах средств массовой информации. Органоидов получил от одного человека, образец 184, были начаты в первичной культуре с использованием различных составах средств массовой информации. Лучший долгосрочный рост получен с помощью наших последних формулировка, M87A + окситоцин (X) 4. Эта среда поддерживает такжеРост HMEC несколько линий (см. рис. 1E). Ранее разработке средств массовой информации, MM 3 при условии, менее высокие темпы роста, в то время как сыворотки среде, MCDB170 (коммерческий MEGM) 17 приводит к быстрой индукции циклин ингибитор киназы p16 INK4a и отбора аберрантных клеток 7,11,13.
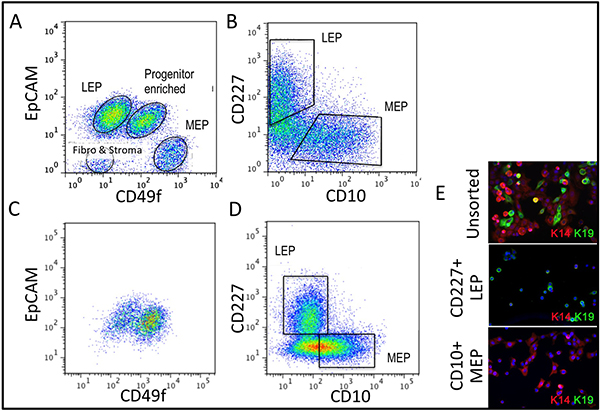
Рисунок 3. Сравнение линии разнообразия в некультурной органоидов и культурной HMEC на 4-й проезд. (A, B) FACS анализ некультурный, ферментативно диссоциированных органоид для (A) выражение EpCAM и CD49f/alpha 6 интегрина, и (Б) CD227/Muc1 и CD10/CALLA. (C, D) FACS анализ 4-й проезд предварительно застой HMEC для выражения (C) EpCAM и CD49f/alpha 6 интегрин, и (D) CD227/Muc1 и CD10/CALLA. Идентифицируемые рopulations помечены как LEP (выражение просвета маркеров EpCAM или CD227), MEP (выражение миоэпителиальных маркеров CD49f или CD10), или PROG (обогащенный CD49f + / + EpCAM населения). Обратите внимание, что во время адаптации к культуре регулирования EpCAM и CD49f изменений по сравнению с некультурным органоидов. (E) Unsorted HMEC и FACS обогащенного ЛЭП и инженерных сетей на 4-й проезд окрашивали для иммунофлуоресценции анализ кератина K14 (MEP маркер) и K19 (LEP маркером) для проверки линии идентификации. Ядрами окрашенных DAPI голубого цвета.
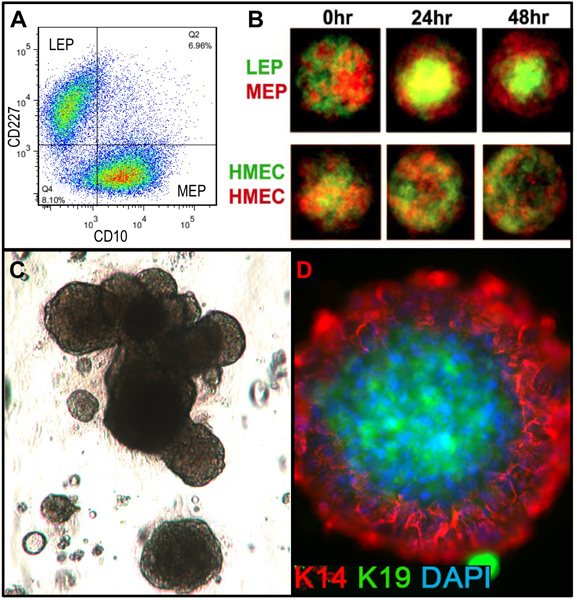
Рисунок 4. Искусственный HMEC способны образовывать организованные структуры с в естественных условиях подобные линии связи при нахождении в соответствующей микросреды. () Pre-стаза 4-й проезд HMEC были FACS обогащенный яNto просвета ЛЭП и линий миоэпителиальных MEP с помощью маркеров для CD227 и CD10, с этих линий проверяется выражение K14 и K19 (не показано). (B) Когда смешиваются в micropatterned лунок, культивируемые клетки были способны к самоорганизации в бислоев с MEP на внешней и внутренней LEP [адаптировано из шансона и соавт. 5]. Флуоресцентно меченые LEP (зеленый) и MEP (красный) были обследованы с помощью конфокальной микроскопии в 0 часов, 24 часов и 48 часа после добавления в лунки (верхний). Управление HMEC произвольно делятся на красные или зеленые флуоресцентные метки (нижний). (C) Яркое изображение области FACS обогащенного клеток-предшественников (cKit +) помещали в 3D (Matrigel) культуры и выращивали в течение 18 дней. Полученные структуры могут проявлять альвеолярной морфогенеза. (D) Структуры были извлечены из Matrigel и окрашивали для выявления K14 и K19; ядер контрастно DAPI. Иммунофлуоресцентного анализ показывает, организованные структуры с правильной просвета и базальных Polaпасности.
Обсуждение
Молочной железы человека способ обработки ткани, представленные здесь дает возможность получения чистых эпителиальные клетки молочной железы из гетерогенной смеси типов клеток в груди человека. Фильтрация через поры фиксированный размер позволяет разделение различных фракций молочной железы (например, протоков и протоков и альвеол по сравнению с альвеолярным) из переваривается стромальных матрицы. Изогенных молочной фибробласты могут быть получены в соответствии с эпителиальные клетки. Замороженные усваивается материал сохранил хорошую жизнеспособность в течение более 30 лет. Этот метод успешно работал на всех, но очень волокнистых тканей молочной, а просто выполнять. Другие изменения молочной обработки ткани существуют, которые не обеспечивают эпителиальных фракции, которые являются жизнеспособными, чистые, или разделены. Размещение обработаны органоидов в культуре с низким стрессовых средах, таких как M87A позволяет долгосрочного роста HMEC с несколькими маркерами линии. HMEC, которые культивировались на пластиковые по-прежнему сохраняют способность к родамТе 3D-структур с нормальными в естественных условиях подобные отношения происхождение. Эти HMEC культур подходит для обширных экспериментальных исследований, в том числе высокой пропускной способности, нормальной HMEC поведения и факторов, которые могут стимулировать или тормозить старение и преобразования.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
MAL, СКГ, и MRS поддерживаются NIA (R00AG033176 и R01AG040081) и лаборатории, руководимой исследований и развития, Министерство энергетики США контракту № DE-AC02-05CH11231.
Материалы
| Name | Company | Catalog Number | Comments |
| Стеклянные чашки Петри 15 см | VWR | 89000-308 | |
| Ножницы 6,5 " | VWR | 82027-594 | |
| Пинцет 8 " | VWR | 82027-436 | |
| Скальпели одноразовые | Miltex | 4-411 | |
| Коллагеноз | SIGMA | C0130 | |
| Гиалуронидаза | SIGMA | H3506 | |
| Инсулин | SIGMA | I5500 | |
| ДМСО | SIGMA | D8418 | |
| Pennicillin / Стрептомицин | Life Technologies | 15140-122 | |
| Fungizone | Life Technologies | 15290-018 | |
| Полимиксина B сульфат | Life Technologies | 21850-029 | |
| Плод бычьего сывороточного | Life Technologies | 26140-087 | |
| Трипсин 0,05% 100 мл | Life Technologies | 25300-054 | |
| DMEM/F12 | Life Technologies | 11039-021 | |
| HulaMixer | Life Technologies | 159-20D | |
| Сотовый фильтр 100 мкм | BD Falcon | 352360 | |
| Сотовый фильтр 40 мкм | BD Falcon | 352340 | |
| Трубы 15 мл | Greiner Bio-One | 188-261 | |
| Трубы 50 мл | Greiner Bio-One | 227-261 | |
| TC блюд 10 см | Greiner Bio-One | 664-160 | |
| TC блюда 6 см | Greiner Bio-One | 628-160 | |
| Криогенная флаконах | Nalgene | 5000-1020 | |
| Heamocytometer | Hauser Научные | 1490 | |
| Центрифугировать | Eppendorf модели | 5702 |
Ссылки
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены