Method Article
Verarbeitung von Human Reduction Mammoplastik und Mastektomie Gewebe für die Zellkultur
In diesem Artikel
Zusammenfassung
Ein Verfahren für die menschliche Brust OP discard Material verarbeiten beschrieben. Verarbeiteten Gewebe, in Form von Organoiden kann unbegrenzt gelagert oder eingefroren platziert in Kultur für langfristige Wachstum werden. Dieses Verfahren ermöglicht die experimentelle Überprüfung der normalen humanen epithelialen Zellbiologie, und die Wirkungen von exogen Störungen.
Zusammenfassung
Experimentelle Untersuchung der normalen humanen Mamma Epithelzelle (HMEC) Verhalten und wie normale Zellen zu erwerben abnormale Eigenschaften können durch in-vitro-Kultur-Systemen erleichtert werden, die genauer in vivo Modell Biologie. Verwendung von menschlichem gewonnenes Material zur Untersuchung zellulärer Differenzierung ist Alterung, Seneszenz, und Immortalisierung besonders vorteilhaft angesichts der vielen signifikanten Unterschiede in diesen molekularen Eigenschaften zwischen menschlichen und üblicherweise verwendet Nagerzellen 1-2. Mammazellen stellen eine bequeme Modellsystem, da große Mengen von normalen und abnormalen Geweben verfügbar sind aufgrund der Häufigkeit der Reduktion mammoplasty und Mastektomie Operationen.
Die Brustdrüse besteht aus einer komplexen Mischung von vielen verschiedenen Zelltypen, z. B. Epithel, adipöses, mesenchymalen, Endothelzellen. Die Epithelzellen sind verantwortlich für die differenzierte Mamma Funktion der Laktationund auch der Ursprung der überwiegenden Mehrheit der menschlichen Brustkrebs. Wir haben Methoden entwickelt, um Brustdrüse chirurgischen discard Gewebe in reinen epithelialen Komponenten sowie mesenchymale Zellen 3 verarbeiten. Das verarbeitete Material kann eingefroren unbegrenzt, oder initiiert in Primärkultur. Chirurgische discard Material ins Labor transportiert und manuell seziert, um für epitheliale enthaltendem Gewebe anzureichern. Nachfolgende Verdauung des sezierten Gewebes mit Kollagenase und Hyaluronidase Streifen Stromatumoren Material aus den Epithelien an der Basalmembran. Die erhaltenen kleinen Stücke der epithelialen Baum (Organoiden) kann aus dem aufgeschlossenen Stroma durch sequentielle Filtration an Membranen von festen Porengröße abgetrennt werden. Je nach Porengröße kann erhaltenen Fraktionen aus größeren duktalen / alveoläre Stücke, kleinere alveolaren Cluster oder Stromazellen werden. Wir haben überdurchschnittliches Wachstum beobachten, wenn Kulturen Organoide sind nicht als dis initiiertsociated Einzelzellen. Platzierung von Organoide in Kultur mit Low-Stress induzierenden Medien unterstützt das langfristige Wachstum von normalen HMEC mit Markern der Multiple Lineage Typen (myoepithelialen, luminale, Vorläuferzellen) 4-5. Eine ausreichende Anzahl von Zellen von einem individuellen Gewebe erhalten werden umfangreiche experimentelle Untersuchungen über standardisierte Zellansätzen sowie Abfragesignals unter Verwendung von Hochdurchsatz Modalitäten ermöglichen.
Cultured HMEC haben in einer Vielzahl von Studien, die die normalen Vorgänge, die Wachstum, Differenzierung, Altern und Seneszenz, und wie diese normalen Prozesse während unsterblich und malignen Transformation 4-15,16 verändert eingesetzt. Die Wirkungen von Wachstum in Gegenwart von extrazellulärem Matrixmaterial anderen Zelltypen und / oder 3D-Kultur kann mit Wachstums auf Kunststoff 5,15 verglichen werden. Cultured HMEC, beginnend mit normalen Zellen, bieten eine experimentell handhabbar System Faktoren, die zu untersuchenkann zu treiben oder zu verhindern menschlichen Alterung und Krebsentstehung.
Protokoll
Ein. Tissue Processing und Verdauung
- Erhalten menschlichen Brustgewebe als discard Material von chirurgischen Eingriffen. Reduktion mammoplasties bieten kann normal oder gutartigen Zellen; Fibroadenome und gynecomastias bereitzustellen gutartigen Zellen; Nicht-Tumor-Gewebe Mastektomie (periphere oder kontralateralen zu einem Tumor, oder subkutanen) bereitzustellen, die Zellen von normal bis zu gutartigen enthaltenden Mikrotumoren reichen kann. Ordnungsgemäße IRB Zulassung vorliegt vor dem Erhalten der discard Material. Alle Materialien sollten unter bloodborne Erregers Vorschriften behandelt werden.
- Das Material in sterilen Behältern mit Puffer oder Medien (zB 1:1 Dulbecco modifiziertem Eagle-Medium und Ham F-12) mit 100 U / ml Penicillin, 100 ug / ml Streptomycin, 5 pg / ml Fungizone, 50U/ml Polymyxin B ergänzt, und 10% fötalem Rinderserum und Transport zu Labor bei 4 ° C. Reduction mammoplasty Gewebe gelagert oder bei 4 ° C versandt werden für 72 Stunden ohne nennenswerte Beeinträchtigung subsequent Lebensfähigkeit der Zellen. Kleine Stücke von Nicht-Reduktion mammoplasty Gewebe kann mehr zeitnahe Bearbeitung.
- Trennen Sie die epithelialen Bereiche aus dem Stroma-Matrix von Fettgewebe, Bindegewebe und Blutgefäße mit einer Kombination aus sterilen Skalpell, Zangen und Scheren. Schneiden Sie Stücke von Gewebe mit einer Schere und in einem großen Glas sterile Schale (z. B. 150 mm). Sanft sezieren Sie die epithelialen Bereichen, die als weiße Fäden im yellower Stroma eingebettet erscheinen, mit der Pinzette das Material und das Skalpell zu kratzen die grob Fettmaterial halten. Zur Verdauung zu erleichtern, schneiden Sie das Epithelgewebe in kleinere Stücke von ~ 3-4 mm mit gegnerischen Skalpellen und in einen 50 ml Reagenzglas. Wenn große Mengen von Gewebe verarbeitet werden kann frischer Skalpellklingen benötigt. Entfernen Fettmaterial aus der Schüssel zur Entsorgung nach den institutionellen Regelungen.
- In stark Bindegewebe (zB subkutan mastectomies mit schweren fibrocystic Krankheit), wird es mehr feste, weiße, nicht-epithelialen Material sein. Es kann schwierig sein, sich zu zerlegen die Epithelzellen aus solchen faserigen Matrizen. Große Stücke aus Fasermaterial kann in kleinere Stücke, ~ 1-3 mm Platz im Bereich sind verdaut und separat geschnitten werden.
- Platzieren Sie die seziert Epithelgewebe in einen konischen Zentrifugenröhrchen (50 ml oder 15 ml) mit dem Gewebe, umfassend nicht mehr als ein Drittel des Volumens der Röhre. Bringen der Röhre bis zum vollen Volumen, so dass nur ein kleiner Luftraum, um zum Mischen während der Rotation zu ermöglichen, unter Verwendung eines gewebespezifischen Verdauungsansatz (DME/F-12 oder gleichwertig, 10 ug / ml Insulin, Antibiotika wie oben und Endkonzentration von 10 % FCS, 200 U / ml Kollagenase und rohe 100 U / ml Hyaluronidase.
- Die Röhrchen auf einem HulaMixer Röhrchenrotator und Drehen um 360 ° bei 8 rpm über Nacht bei 37 ° C.
- Zentrifugenröhrchen bei 600 × g für 5 min. Überstand verwerfen Fett und Medium für Entsorgung gemäßING institutionelle Regelungen.
- Überprüfen für die Fertigstellung der Verdauung durch Verdünnen eines kleines Aliquot der Pellet in Medium. Die Verdauung ist abgeschlossen, wenn die mikroskopische Untersuchung Klumpen von Zellen (Organoide) mit glatten erscheinenden duktalen, alveoläre oder duktale-alveolären Strukturen frei von angeschlossenen Stroma (Abbildung 1A) zeigt. Reduction mammoplasty Gewebe wird in der Regel noch zeigen angeschlossenen Stroma nach einer nächtlichen Verdauung und zusätzliche Verdauung Zeit erfordern.
- Resuspendieren des Pellets in unvollständig verdaut frischem Gewebe Verdauungsansatz und Wiederverwendung inkubieren unter Rotation bei 37 ° C für eine weitere Stunde 4-12. Wiederholen Sie die Schritte 1,6 und 1,7. Wenn Verdauung noch unvollständigem erneut hinzuzufügen Verdauungsansatz dem Pellet und Wiederverwendung inkubieren unter Rotation bei 37 ° C über Nacht. Die Konzentration der Enzyme kann reduziert over-Verdau über Nacht zu verhindern.
- Wenn die Verdauung abgeschlossen ist, Zentrifugenröhrchen bei 600 xg für 5 min absaugen DigestIonen-Mix, Pellet erneut in Medium plus Antibiotika bei etwa 15 ml/50 ml Tube, 5 ml/15 ml Tube.
2. Filtration und Einfrieren von verdaute Material
- Übertragen Aliquots des resuspendierten Pellets auf eine sterile 100 um Sieb über einer sterilen 50-ml-Tube. Lassen des Mediums Drain in das Rohr, so Rewash die Organoiden auf 1-2x mal mit 2-3 ml Medium. Wiederholen, bis alle der resuspendierten Pellets übertragen wurde. Wenn es zu viele Organoide auf dem Filter und das Medium verbraucht nicht mehr einfach sind, verwenden Sie einen neuen Filter (s) für die restliche Material. Drehen Sie das Filter (s) auf einem anderen sterilen Röhrchen und waschen Sie die Organoide in das Rohr mit Medium. Dies ist der 100 um organoide Pool.
- Nehmen Sie das Material, das in den ursprünglichen 50 ml Tube abgelassen und wiederholen Sie den Vorgang von 2,1 mit einem 40 um Sieb, um die 40 um organoide Pool, die meist alveolären Strukturen enthält erhalten. Das Material, das in th abgelassene Rohr bildet den Filtrat Pool, der einzelne / kleinen Klumpen von mesenchymalen und Epithelzellen und kleine Stücke von dem Gefäßsystem enthält.
- Pellet die 100 um, 40 um und Filtrat Pools bei 600 xg für 5 min.
- Überstand rekonstituieren jedes Röhrchen in CPM II (DME/F-12 oder gleichwertig mit 44% FCS und 6% DMSO) mit etwa 1 ml CPMII pro 0,1 ml verpackt Pellet. Halten bei 4 ° C.
- Samen einer Testschale für die 2 organoiden Pools indem 0,1 ml der resuspendierten Materials in eine 35 mm-Gewebekulturschalen Plastikschale tropfenweise wie in 3.2. Das Filtrat Pool kann direkt auf Gewebekulturkunststoff werden mit Fibroblasten-Medium (DME/F-12 oder gleichwertig mit 10 ug / ml Insulin und 10% FBS) ausgesät.
- Aliquot der verbleibende resuspendierten Materials in Nunc Typ Einfrieren Ampullen (1 ml / 2 ml Ampulle). Einfrieren über Nacht bei -80 ° C und dann übertragen umgehend Lagerung in flüssigem Stickstoff. Wir haben keine signifikanten Verlust der Lebensfähigkeit beobachtetin unserem ursprünglichen Ampullen gelagert seit den späten 1970er Jahren eingefroren.
3. Seeding Gefrorene Organoide und Subculture of Primary Kulturen
- Schnell auftauen das gefrorene Ampulle enthält die Organoiden in einem 37 ° C warmen Wasserbad. Saatgut den Organoiden in 2 bis 10 (in der Regel ~ 6) 60 mm-Schalen, oder 1-3 100 mm-Schalen in Abhängigkeit von visuellen Schätzung der Anzahl der in der Ampulle Organoiden. Etwa 20-40 Organoide pro 60 mm-Schale ausgesät ist optimal.
- Aufgetaut Organoiden sorgfältig platziert, tropfenweise auf die Schale Oberfläche mit einer 1 ml Pipette oder Pasteurpipette für eine gleichmäßige Verteilung der Organoiden. Organoiden angeordnet dicht beieinander wird wenig Platz für Auswachsen haben, was zu weniger Zellen für die Subkultur oder Einfrieren. Vermeiden Sie ein Verkratzen der Schale Oberfläche (Zellen neigen nicht zu vergangenen verkratzte Oberflächen wachsen). Warten 1-2 min, damit die Organoide zu befestigen und dann langsam Wachstumsmedium zu vermeiden verdrängen die Organoide (zB 2-3 ml/60 mm-Schale). Ichncubate bei 37 ° C in CO 2 befeuchteten Inkubator. Dies sind die primären Kulturen. Wir verwenden derzeit M87A + Oxytocin (X) Medium für die robustesten HMEC Wachstum (Abbildung 2).
- Nach 1 Tag überprüfen, ob die Organoide angebracht sind. Fügen Sie zusätzliche Medium (zB 2-3 ml/60 mm-Schale). Zellmigration aus den Organellen sichtbar sein soll, indem 24-48 h und mitotischen Auswachsen von 48-72 Stunden nach der Aussaat (Abbildung 1B, C). Manchmal Anlage ist nach 24 Stunden schlecht, besonders wenn Ausplattieren overdigested Organoide oder Organoide von älteren Frauen, aber die meisten Präparate werden innerhalb von 72 Stunden zu befestigen. Kleine Stücke von dem Gefäßsystem kann befestigen und verursachen Fibroblastenzelle Auswuchs (1D).
- Führen Kulturen mindestens 3 mal pro Woche. Zellen in M87A-type Medien gezüchtet wachsen in der Nähe Zusammenfluss innerhalb von 5-8 Tagen, je nach Dichte der Aussaat.
- Wenn eine erhebliche Fibroblastenwachstumsfaktor, Differential Trypsinisierung (DT), bezogen auf dierasche Ablösung von Fibroblasten von der Oberfläche aus Kunststoff, benötigt wird, um die Fibroblasten zu entfernen. Wenn die epithelialen Patches groß, absaugen Medien, waschen Teller (zB 1-2 ml/60 mm-Schale) sich mit STE (Kochsalzlösung, 0,05% Trypsin, 0,02% EDTA), absaugen, mit frischem 0,5 ml STE und bei Raumtemperatur zu verlassen für ca. 1 min mit kontinuierlicher mikroskopischer Beobachtung. Wenn die Fibroblasten, sondern lösen die Epithelzellen sind noch anhaftenden, sanft, aber stark klopfen die Seite der Schale gegen eine harte Oberfläche, um die Fibroblasten zu vertreiben und dann schnell anzusaugen. Waschen Sie einmal mit PBS und saugen wieder. Kulturen stark mit Fibroblasten kontaminiert sein benötigen Sie einen zusätzlichen DT.
- Subculture primären Kulturen, wenn große epitheliale Patches vorhanden sind, aber bevor Zusammenfluss. Die Dichte von organoiden Aussaat und Anlage beeinflussen die erforderliche Zeit. Um die primäre Kultur zu erhalten und mehrere sekundäre Kulturen, zeitlich beabstandet zu erzeugen, führen wir Partielle Trypsinizations (PT).
- Aspirate Medien, waschen ein 60 mm-Schale mit 1-2 ml STE, 0,5 ml frische STE austeilen. Beobachten Zellablösung unter dem Mikroskop bei Raumtemperatur 1-5 min, unter leichtem Klopfen der Schale zu Zellablösung fördern. Trypsinisierung sollte gestoppt, wenn ~ 50% der Zellen wurden abgenommen werden. Frühe PTs haben in der Regel eine schnelle Zellablösung. Für spätere PTs können Zellen bei 37 ° C für eine schnellere Ablösung platziert werden, unter sorgfältiger Überwachung, wie alle Zellen kommen können schnell ab.
- 2 ml Serum-haltigen Medien in die Schale, um repipette waschen, und übertragen in ein steriles 15 ml-Tube. Wiederholen 2x mit weiteren ~ 1-2 ml Medium, Zugabe der Wäsche, um das Rohr. Refeed die primäre Gericht und zum Inkubator. Zählen der Zellen, die in dem Rohr mit der Hämozytometer. Einmal subkultiviert, sind Zellen, no lo; PTs kann um 4 bis 8 mal mit guten Zellerneuerung in den primären Gerichte und eine entsprechende langfristige Wachstum aus den subkultiviert oder gefroren Secondaries (zweiten Durchgang Zellen werden als Secondaries wiederholt werdennger Vorwahlen). Sobald organoide Material nicht mehr in den primären Kulturen zeigen subkultiviert secondaries einen Rückgang der langfristigen Verdopplung der Population Potenzial.
- Für eine Subkultur auf Secondaries, Samenzellen direkt aus der Tube in die Gerichte. Impfen von 1-2 x 10 5 Zellen/100 mm Schale in einem robusten Medium wie M87A + X wird zur Konfluenz von 4-7 Tagen führen. Fügen wir Choleratoxin zu dem Medium in zweiter Durchgang zur proliferative Potenzial zu erhöhen; Choleratoxin in Primärkultur weggelassen, weil sie zu mehrlagigen Zelle Auswachsen führt von den Organoiden.
- Zum Einfrieren als Secondaries, Pellet Rohr bei 600 xg für 5 min, und resuspendieren in CPMII mit einer Enddichte von 10 6 Zellen / ml. Aliquot resuspendiert Zellen in Nunc Typ Gefrierpunkt Ampullen, frieren über Nacht bei -80 ° C und dann zeitnah zu übertragen Lagerung in flüssigem Stickstoff.
- Es wird empfohlen, um Zellen von der ersten zur Aufbewahrung PT einzufrieren, undVerwenden von Zellen aus der zweiten PT für Subkultur. Zusätzliche Terminals können eingefroren gelagert für den zukünftigen Gebrauch werden.
Ergebnisse
Repräsentative Zahlen für Gewebe angemessen zu Organoide verdaut und in Kultur sind in Abbildung 1 dargestellt. Unvollständig verdaute Gewebe zeigen Material noch an der Außenseite des diesen Strukturen befestigt, und wird wahrscheinlich eine gewisse fibroblastische Zellwachstum in Primärkultur, erfordern DT zu entfernen. Overdigested Gewebe wird weniger glatte Außengrenzen und kann länger dauern, bis in Primärkultur befestigen. Epithelialen Auswachsen sollte innerhalb von 48-72 h (1B, C) zu beginnen. Kleine Stücke von Gefäßsystem (1D) eine Quelle von Mesenchymzelle Auswachsen sein. Epithelial Auswüchse zeigen morphologisch heterogene Populationen mit proliferative Populationen, die Mischungen von Zellen enthalten, mit Marker mit myoepithelialen, Vorläuferzellen und luminalen Linien (1E, 3C-E) verbunden. Das Wachstum im niedrigen Spannungen Medien wie M87A mit Cholera-Toxin und Oxytocin ergänzt wird unterstützt langfristig überdurchschnittlicheWachstum von normalen pre-Stasis HMEC zur vorherigen Medien Formulierungen (Abbildung 2). M87A-Typ Medien wird auch das Wachstum von luminalen und Vorläuferzellen durch Durchgänge 4-8 (3C-E, 4), danach zeigen die meisten Zellen nur Myoepithelzellen Abstammungslinie Marker. HMEC auf Kunststoff kultiviert werden, behalten ihre Fähigkeit zur korrekten 3D Selbstorganisation in mikrostrukturierten 3D Mikrowells bilden, mit luminalen Zellen Innenraum zu Myoepithelzellen (4A, B), und um organisierte Strukturen bilden, wenn in Matrigel (4C, D) ausplattiert.
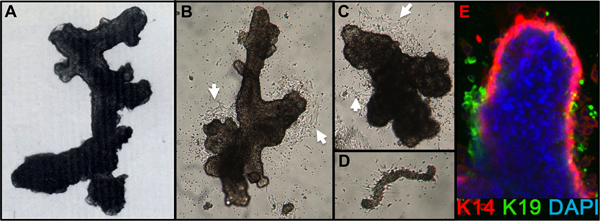
Abbildung 1. HMEC Organoide und Primärkultur. (A) Organoide zeigt duktalen-Wabenstruktur nach der Verdauung und Filtration. (B, C) Organoide zeigt duktalen und Wabenstruktur 2 Tage nach der Platzierung in der primären Kultur; beachten Sie den Beginn Zelle outgrowth (weiße Pfeile). (D) kleine Blutgefäß und mit Start-Fibroblasten Auswachsen von gleichen Kulturen wie B, C. befestigt (E) Epithelzellen Auswuchs aus primären organoiden Kultur nach 4 Tagen. Abstammungslinien sind durch Färbung mit Antikörpern gegen K14 (rot) und K19 (grün) identifiziert; Zellkerne wurden mit DAPI (blau) gefärbt. Luminal (K14-/K19 +, grün), myoepithelialen (K14 + / K19-, rot), und Vorläuferzellen (K14 + / K19 +, gelb) sind Zellen sichtbar. Ungefärbten Zellen in organoiden Kern aufgrund unvollständiger Antikörpers Eindringen beobachtet.
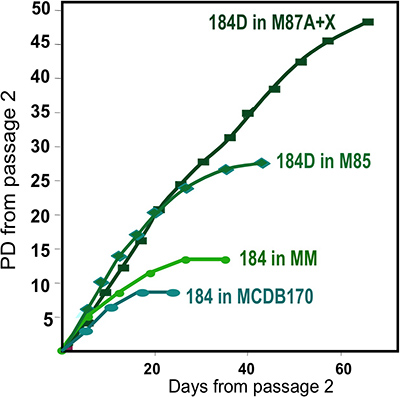
Abbildung 2. Wachstum von HMEC Kulturen in verschiedenen Medien Formulierungen. Organoide von einem Individuum, Probe 184, gewonnen wurden in Primärkultur mit verschiedenen Medien Formulierungen eingeleitet. Beste langfristiges Wachstum wird unter Verwendung unserer jüngsten Formulierung, M87A + Oxytocin (X) 4. Dieses Medium unterstützt auchWachstum von mehreren HMEC Linien (siehe Abb. 1E). Eine frühere Medienformulierung, MM 3 vorgesehen weniger robustes Wachstum, während ein Serum-freie Medien, MCDB170 (Handelsprodukt MEGM) 17 führt eine schnelle Induktion des Cyclin-Kinase-Inhibitor p16 INK4a und Selektion für aberrante Zellen 7,11,13.
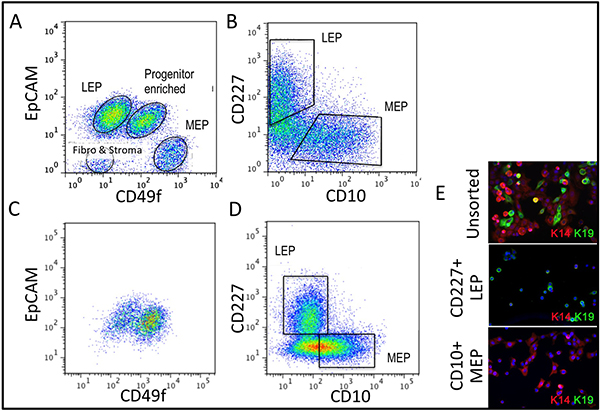
Abbildung 3. Vergleich der Erblinie Vielfalt in uncultured Organoide und kultivierten HMEC bei 4 th Passage. (A, B) FACS-Analyse von einem ungebildeten, enzymatisch gespalten organoide für (A) Expression von EpCAM und CD49f/alpha 6-Integrin, und (B) CD227/Muc1 und CD10/CALLA. (C, D) FACS-Analyse von 4 th Durchgang pre-Stasis HMEC zur Expression von (C) und EpCAM CD49f/alpha 6 Integrin, und (D) und CD227/Muc1 CD10/CALLA. Erkennbare populations als LEP (Ausdruck luminalen Marker EPCAM oder CD227), MdEP (Ausdruck myoepithelialen Marker CD49f oder CD10) oder PROG (angereichert in der CD49f + / EPCAM + Bevölkerung) beschriftet. Beachten Sie, dass während der Anpassung an Kultur Regulierung von EpCAM und CD49f Änderungen uncultured Organoide verglichen. (E) Unsorted HMEC und FACS-angereicherten LEP und MEP bei 4 th Durchgang für Immunfluoreszenzanalyse von Keratin K14 (MEP Marker) und K19 (LEP Marker) zur Linie Identifizierung überprüfen gefärbt. Zellkerne mit DAPI blau erscheinen.
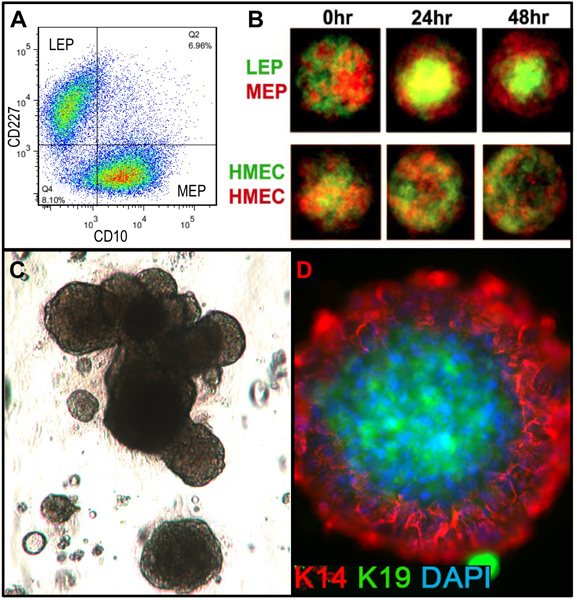
Abbildung 4. Cultured HMEC der Lage sind, organisierte Strukturen mit in vivo-ähnlichen Linie Beziehungen, wenn in geeigneten Mikroumgebungen gelegt. (A) Pre-Stasis 4 th Durchgang HMEC wurden FACS-angereicherten into luminalen LEP und Myoepithelzellen MEP Abstammungslinien unter Verwendung von Markern für CD227 und CD10, mit diesen Linien durch Expression von K14 und K19 verifiziert (nicht dargestellt). (B) Wenn sie zusammen in mikrostrukturierten Vertiefungen gemischt wurden die kultivierten Zellen in der Lage Selbstorganisation zu Doppelschichten mit MEP auf der Außenseite und LEP internen [aus Chanson et al angepasst. 5]. Fluoreszenzmarkierten LEP (grün) und MEP (rot) wurden mit einem konfokalen Mikroskop bei 0 h, 24 h und 48 h nach Zugabe der Kavitäten (oben) abgebildet. Steuerung HMEC wurden willkürlich mit roten oder grünen fluoreszierenden Markierungen (unten) bezeichnet. (C) Hellfeld Bild von FACS-angereicherte Progenitorzellen (cKit +) ausplattiert in 3D (Matrigel) Kultur gewachsen und für 18 Tage. Resultierenden Strukturen aufweisen können alveolären Morphogenese. (D) Die Strukturen wurden von Matrigel extrahiert und gefärbt, um K14 und K19 zu erkennen; Zellkerne wurden mit DAPI gegengefärbt. Immunfluoreszenz Analyse zeigt, organisierte Strukturen mit der richtigen luminalen und basalen polaheit.
Diskussion
Der menschliche Brustgewebe Verarbeitung hier vorgestellte Verfahren ermöglicht Gewinnung reiner Brustepithelzellen aus dem heterogenen Gemisch von Zelltypen in der menschlichen Brust. Filtration durch Poren von fester Größe ermöglicht eine Trennung von verschiedenen Fraktionen der Brustdrüse (zB duktale und duktalen-alveolären vs alveolären) aus dem aufgeschlossenen Stromazellen Matrix. Isogenen Mamma Fibroblasten erhalten, um die Epithelzellen angepasst werden. Gefrorene verdaute Material hat gute Lebensfähigkeit seit über 30 Jahren beibehalten. Diese Methode wurde erfolgreich auf alle, aber sehr faserig Mamma Gewebe gearbeitet und ist einfach durchzuführen. Andere Varianten des Brustgewebes Verarbeitung existieren, bieten keinen epithelialen Fraktionen, die als lebensfähig, sauber, oder getrennt sind. Platzierung verarbeitet Organoide in Kultur mit geringer Beanspruchung induzierenden Medien wie M87A ermöglicht langfristiges Wachstum des HMEC mit mehreren Linie Marker. HMEC die auf Kunststoff kultiviert wurden noch die Fähigkeit beibehalten Gattungente 3D-Strukturen mit normalen in vivo-ähnlichen Linie Beziehungen. Diese HMEC Kulturen eignen sich für umfangreiche experimentelle Untersuchung, einschließlich hoher Durchsatz, der normalen HMEC Verhalten und Faktoren, die zu treiben oder zu hemmen Seneszenz und Transformation kann.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
MAL, JCG und MRS werden von der NIA (R00AG033176 und R01AG040081) und Laboratory Directed Forschung und Entwicklung, US Department of Energy contract # DE-AC02-05CH11231 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Glass Petrischale 15 cm | VWR | 89000-308 | |
| Schere 6,5 " | VWR | 82027-594 | |
| Pinzetten 8 " | VWR | 82027-436 | |
| Skalpelle Einweg | Miltex | 4-411 | |
| Collagenase | SIGMA | C0130 | |
| Hyaluronidase | SIGMA | H3506 | |
| Insulin | SIGMA | I5500 | |
| DMSO | SIGMA | D8418 | |
| Pennicillin / Streptomycin | Life Technologies | 15140-122 | |
| Fungizone | Life Technologies | 15290-018 | |
| Polymyxin B-Sulfat | Life Technologies | 21850-029 | |
| Fötales Rinderserum | Life Technologies | 26140-087 | |
| 0,05% Trypsin 100 ml | Life Technologies | 25300-054 | |
| DMEM/F12 | Life Technologies | 11039-021 | |
| HulaMixer | Life Technologies | 159-20D | |
| Zellsieb 100 um | BD Falcon | 352360 | |
| Zellsieb 40 um | BD Falcon | 352340 | |
| Tubes 15 ml | Greiner bio-one | 188-261 | |
| Tubes 50 ml | Greiner bio-one | 227-261 | |
| TC Gerichte 10 cm | Greiner bio-one | 664-160 | |
| TC Gerichten 6 cm | Greiner bio-one | 628-160 | |
| Kryoröhrchen | Nalgene | 5000-1020 | |
| Heamocytometer | Hauser Scientific | 1490 | |
| Zentrifugieren | Eppendorf Modell | 5702 |
Referenzen
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten