Method Article
Gradiente de densidad multicapa polimerización (DGMP): una técnica novedosa para la creación de multi-compartimiento, Andamios personalizables para Ingeniería de Tejidos
En este artículo
Resumen
Aquí se describe una estrategia única para la creación de matrices biocompatibles, capas continuas con interfaces entre capas distintas para la ingeniería de tejidos. Tal andamio podría proporcionar un entorno adaptable ideal para modular el comportamiento celular por varias señales biológico, químico o mecánico
Resumen
Complejas matrices de cultivo de tejidos, en el que los tipos y concentraciones de los estímulos biológicos (por ejemplo, factores de crecimiento, inhibidores, o pequeñas moléculas) o la estructura de la matriz (por ejemplo, composición, concentración, o la rigidez de la matriz) varían en el espacio, que permiten una amplia gama de investigaciones sobre cómo estas variables afectan la diferenciación celular, la migración y otros fenómenos. El principal reto en la creación de matrices de capas es el mantenimiento de la integridad estructural de las interfaces de capa sin difusión de los componentes individuales de cada capa 1. Las metodologías actuales para ello es photopatterning 2-3, litografía 4, functionalization5 secuencial, liofilización 6 de microfluidos 7, 8 o centrifugación, muchos de los cuales requieren instrumentos sofisticados y habilidades técnicas. Otros confían en unión secuencial de las capas individuales, que pueden llevar a la deslaminación de las capas 9 DGMP supera estos problemas mediante el uso de un modificador de la densidad inerte tal como iodixanol para crear capas de densidades variables 10. Dado que el modificador de la densidad se puede mezclar con cualquier prepolímero o molécula bioactiva, DGMP permite que cada capa andamio para personalizar. Simplemente variando la concentración del modificador de la densidad evita que se mezclen las capas adyacentes mientras permanecen acuosa. Polimerización subsiguiente solo paso da lugar a una estructura de andamio continuo de múltiples capas, en la que cada capa tiene química distinta y propiedades mecánicas. El modificador de la densidad se puede quitar fácilmente con suficiente lavado sin perturbación de las capas individuales o sus componentes. Esta técnica es por lo tanto muy adecuado para la creación de hidrogeles de diversos tamaños, formas y materiales.
Un protocolo para la fabricación de un 2D-polietilenglicol (PEG) gel, en el que las capas alternantes incorporar RGDS-350, se describe a continuación. Utilizamos PEG bomo es biocompatible e inerte. RGDS, una adhesión celular péptido 11, se utiliza para demostrar restricción espacial de una señal biológica, y la conjugación de un fluoróforo (Alexa Fluor 350) nos permite distinguir visualmente distintas capas. Este procedimiento se puede adaptar para otros materiales (por ejemplo, colágeno, ácido hialurónico, etc) y se puede ampliar para fabricar geles 3D con algunas modificaciones 10.
Protocolo
1. Síntesis de la etiqueta fluorescente acriloil-PEG-RGDS
- Reaccionar el péptido RGDS con acriloil-PEG-succinimidil éster de carboximetil (APEG-SCM, PEG MW: 3400 g / mol) y diisopropiletilamina NN (DIPEA) en 1.2:1:2 relaciones molares en sulfóxido de dimetilo (DMSO) en atmósfera de argón a temperatura ambiente durante la noche.
- Confirmar conjugación por láser asistida por matriz de desorción / ionización tiempo de vuelo (MALDI-TOF) espectrometría de masas. Añadir 1 ml de solución de reacción APEG-RGDS a un punto de la muestra sobre la diana MALDI y seco. Preparar una solución saturada de Universal MALDI Matrix en tetrahidrofurano (THF) y agitar durante 1 min. Añadir ~ 1 l de esta solución para el punto de la muestra misma. Repita el procedimiento para APEG-SCM para la comparación. Cargar y analizar. El peso molecular de APEG-RGDS debe ser mayor que APEG-SCM (Figura 2).
- Para conjugar el fluoróforo, añadir una cantidad equimolar de Alexa Fluor 350 de ácido carboxílico (succinimydyl éster), disueltoen un volumen mínimo de DMSO, a la solución de reacción APEG-RGDS de 1,1 y reaccionar en atmósfera de argón a temperatura ambiente durante la noche.
- Purificar APEG-350-RGDS por diálisis (PM 3500 Da) contra DI-H 2 O a 4 º C durante 48 hr en relación volumétrica 1,000:1, el intercambio de dializado al menos dos veces por día.
- Se liofiliza la purifica-RGDS APEG-350 en un Labconco Freezone Plus o el sistema de congelación en seco equivalente y se almacena a -20 ° C.
2. La preparación de un molde 2D y fabricación de un gel 2D con PEG-350 Rgds alterna capas
- Preparar portaobjetos de vidrio hidrófobos. Coloque portaobjetos de vidrio limpias en un plato de vidrio en un horno de vacío. Calentar a 80 ° C durante 30 min para secar completamente las superficies. Lugar plato con diapositivas en una campana de extracción y añadir 250 l Sigmacote para cada diapositiva, agitando suavemente durante 30 segundos a la superficie de capa entera. Enjuague bien los portaobjetos recubiertos con 100% de metanol, seguido de lavado en agua destilada, empapando dos veces durante 5 min en al LEAt 10 ml.
- Cortar separadores de silicona (0,8 mm de espesor) con 10 mm sacabocados.
- Autoclave los separadores de silicona y Sigmacote tratados con portaobjetos de vidrio.
- Formular soluciones para cada capa respectiva en tubos de microcentrífuga individuales mediante la mezcla de diacrilato de PEG (PEGDA) precursor (concentración final 15% w / v) con diferentes cantidades de iodixanol (60% solución madre en agua) para dar concentraciones finales que varían (por ejemplo, 40%, 30%, 20% y% 10), se completa el volumen restante con tampón fosfato salino (PBS) para obtener soluciones de densidades graduadas. De una manera similar, para capas alternas, mezcla APEG-RGDS-350 (concentración final 8 mM) con iodixanol y PBS para dar concentraciones diferentes (por ejemplo, 35%, 25%, y% 15).
- Añadir fotoiniciador (2-hidroxi-4'-(2-hidroxietoxi)-2-metilpropiofenona, stock 333mg/ml en N-vinil pirrolidona) a cada solución para las diversas capas (10 l de solución madre por ml de cada solución de la capa). Fotoiniciador is añadió el pasado para prevenir la polimerización antes de la estratificación de los geles en el molde, ya que es sensible a la luz.
- Los pasos posteriores de este protocolo se realiza en una cabina de bioseguridad para asegurar la esterilidad.
- Filtrar a esterilizar cada solución utilizando una jeringa estéril de 1 ml y 0,2 micras de filtro. Montar la configuración de molde intercalando el espaciador entre dos portaobjetos de vidrio tratados con Sigmacore y asegurar con abrazaderas de colocación como se representa en la figura 1.
- Reparto de los geles de capas mediante la adición de la solución más densa (por ejemplo PEGDA con 40% iodixanol) primero, seguido por una solución menos denso (por ejemplo APEG-RGDS-350 con 35% iodixanol). Repita la estratificación alternativo para lograr varias capas de composición deseada y densidades, como se muestra en la figura 1.
- Irradiar el molde con luz de 365 nm durante 3 min usando un portátil UVR-9000 lámpara. Permitir que los geles polimerizados curar durante 5 min. Retire las abrazaderas, y luego levante suavemente la tapa de cristaldiapositiva y el molde, los geles dGMP estratificados se mantendrá en las diapositivas. Usando una espátula estéril, se coloca cuidadosamente los geles en un tubo de 50 ml que contenía PBS estéril o medio de cultivo para el lavado.
- Lavar los geles polimerizados en PBS a 1,000:1 relación volumétrica, el intercambio de tampón por lo menos dos veces al día para eliminar el modificador de la densidad, fotoiniciador, y polímero sin reaccionar. Alternativamente, el PBS se puede intercambiar con medio de crecimiento celular. La tienda de los geles dGMP en PBS o medio de crecimiento para el experimento de cultivo de células se describe en el paso 3.
- Para visualizar capas alternas, organizar gel DGMP (estos geles no se podrá utilizar para el cultivo celular) a lo largo de una regla en la bandeja de muestras de una unidad documental VersaDoc gel. Exponer los geles en 350 nm, el tiempo de exposición variará dependiendo de la concentración del fluoróforo. Alternancia de bandas oscuras y azul en el hidrogel DGMP demostrar la formación de capas discretas de composición química distinta (Figura 3).
3. Cultivo de células en geles 2D dGMP
- Para geles incorporan péptido RGDS, utiliza células de adhesión dependientes, como C2C12 mioblastos.
- Suavemente inserte geles dGMP (almacenados en PBS) en los pocillos de placas de 48 pocillos de cultivo de células utilizando un raspador de células estéril en una cabina de bioseguridad.
- Pre-caliente crecimiento medio (medio Eagle modificado de Dulbecco o medio DMEM suplementado con v / v 10% de suero fetal bovino y 1% v / v solución 100x penicilina-estreptomicina) y PBS en un baño de agua a 37 ° C.
- Lavar una placa de 60% confluentes (10 mm) de C2C12 células tres veces con PBS. Aspirar fuera de PBS y las células de la cosecha mediante la adición de 1 ml de 0,25% de tripsina-EDTA y se incubaron a 37 ° C durante 2 min. Resuspender las células en medio de crecimiento y células de recuento. Semilla del DGMP gel que contiene el cultivo de células con mioblastos C2C12 bien (20.000 células / cm 2). Se incuban las células a 37 ° C en 5% de CO 2/95% de humedad relativa. Suavemente cambio medio después de 4 horas, cuidando de no volver amover ligeramente las células adheridas.
- Después de 24 h, la unión de mioblastos C2C12 sobre las capas que contienen RGDS de geles dGMP puede ser confirmada por epifluorescencia y la microscopía de contraste de fase (Zeiss Axiovert 200).
Resultados
MALDI-TOF análisis confirma la conjugación del péptido RGDS para acriloil-PEG (Figura 2). Gel imagen revela alterna RGDS-350 (azul) capas después de la fotopolimerización (Figura 3A). Como se muestra en la Figura 3A, tamaño del gel 2D DGMP se puede variar en función del diámetro de los moldes de silicona (10 mm, izquierdo; 8 mm, derecha), y por lo tanto son fácilmente adaptables para su uso en múltiples ensayos - en este caso para adaptarse a una 48 así placa de cultivo de células (Figura 3B). Epifluorescencia y la microscopía de contraste de fase de C2C12 mioblastos cultivados en un gel de DGMP muestra unión selectiva en RGDS-350-que contiene capas de PEG (Figura 4), lo que demuestra la compartimentación de la adhesión celular péptido (RGDS).
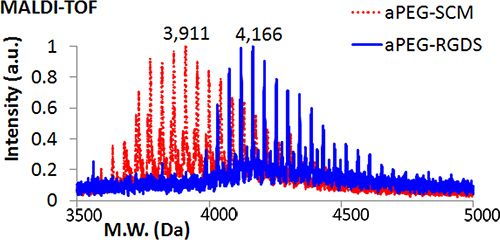
Figura 1. Molecular Weight análisis por MALDI-TOF comparar APEG-SCM para APEG-RGDS obtenidos después de la conjugación del péptido RGDS.
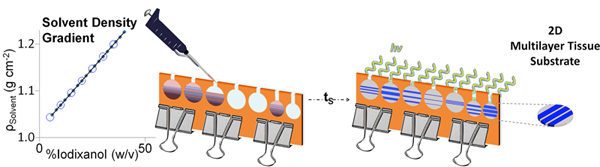
Figura 2. Representación esquemática de DGMP fabricación de gel. Después de los gradientes se disponen en capas, pueden dejarse en reposo durante períodos variables de tiempo (t s) para crear interfaces graduadas, seguido por fotopolimerización. Estratificados geles dGMP puede ser fácilmente extraído del molde para su posterior utilización. Haga clic aquí para ampliar la cifra .

Figura 3. A) geles 2D multicapa obtenidos después de la fotopolimerización imágenes utilizando 350 nm y blancas canales de luz de VersaDoc. gel unidad documental. La escala de grises de la imagen revela alternando capas que contienen RGDS en blanco. B) Inserción de gel DGMP en 48 pocillos de cultivo celular.

Figura 4. Contraste de fase y de la imagen fusionada de epifluorescencia C2C12 mioblastos cultivados en DGMP geles (barra de escala 50 mm).
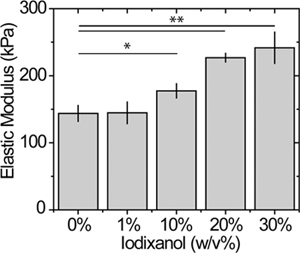
Figura 5. Efecto de la elasticidad del gel iodixanol en superficie. Atómica mediciones de fuerza de microscopía de muestras estáticas de sustratos PEG reticulados utilizando métodos previamente establecidos con un activador 2 nN fuerza 12. * P <0,05 y ** p <0,01.
Discusión
DGMP es una estrategia sencilla para la preparación de geles de capas múltiples que no se basan en instrumentos costosos. Este protocolo se puede adaptar para crear andamios utilizando otros materiales biocompatibles, tales como colágeno y ácido hialurónico. Pequeñas moléculas bioactivas, por ejemplo de células que promueve la adhesión péptido RGDS, puede estar amarrado a la matriz de polímero para evitar la mezcla de las señales entre las capas. Las proteínas se pueden encapsular en capas distintas, sin necesidad de conjugación química, ya que, dependiendo del tamaño de la malla de la matriz, son menos propensos a difundirse a través de hidrogeles 10. Aquí hemos utilizado iodixanol (Nycoprep), un modificador de la densidad inerte, que se ha utilizado anteriormente para las aplicaciones de células viables. Otros modificadores de la densidad tales como sacarosa y dextrosa también se puede utilizar. Al variar el tiempo de establecimiento (t s), se puede ajustar con precisión las interfaces entre las dos capas para producir una transición suave o fuerte, según sea necesario (tiempo de asentamiento más aporta mayor suavidad a las transiciones) 10. Por ejemplo, transiciones más suaves entre las capas de gel dGMP podría ser utilizado para generar un gradiente continuo de una señal biológica para estudiar procesos celulares, tales como la quimiotaxis.
El efecto modificador de la densidad sobre la rigidez de gel se muestra en la Figura 5 para un 15% de gel de aPEGda; una caracterización más completa de la rigidez y de la porosidad como una función de las concentraciones de iodixanol PEGDA y se está evaluando actualmente. Mientras que la concentración de PEGDA en este ejemplo es relativamente alta, se observó un módulo de 60% mayor elástica en geles con 30% iodixanol comparación con los geles sin. El cambio en la rigidez del gel se puede ajustar mediante la modulación de la concentración de macrómero o la densidad de reticulación.
También hemos aplicado la técnica DGMP para crear 3D geles de poliacrilamida utilizando múltiples capas y los precursores de PEG 10. La variación de la concentración o el grado de reticulación del prepolímero permite variación estructural en elandamios, que pueden ser utilizados para explorar el comportamiento celular tales como el crecimiento y la migración polarizada en 3D.
En resumen, DGMP es una técnica adaptable que se puede aplicar para fabricar andamios 2D y 3D a partir de una variedad de materiales biocompatibles para una amplia gama de aplicaciones de investigación biomédica y de base.
Divulgaciones
Los autores no tienen conflictos de intereses a revelar.
Agradecimientos
Los autores agradecen el apoyo de los Premios Innovadores Nuevos NIH Director (1DP2 OD006499-01 a AA y 1DP2 OD006460-01 a AJE) y la Ciudad Rey Abdulaziz para la Ciencia y la Tecnología (Universidad de California en San Diego Centro de Excelencia en Nanomedicina). Nos gustaría dar las gracias a la Sra. Jessica Moore por sus comentarios críticos sobre el manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo o Instrumento | Empresa | Número de catálogo | |
| Polietilenglicol succinimydyl carboximetil (a-PEG-SCM) | Laysan | 120-64 | |
| Polyethelyene glicol diacrilato (PEGDA) | Dajac Labs | 9359 | |
| Arginina-glicina-ácido aspártico-serina (RGDS) | American Peptide | 49-01-4 | |
| N, N - diisopropiletilamina (DIPEA) | Sigma | D125806 | |
| Sulfóxido de dimetilo (DMSO) | Sigma | D2438 | |
| N, N-dimetilformamida (DMF) | Pescador | D119-4 | |
| El tetrahidrofurano (THF) | Pescador | T397 | |
| Casete de diálisis (3500Da) | Thermo Scientific | 66330 | |
| Alexa Fluor 350 carboxílico succinimydyl | Life Technologies | A-10168 | |
| Sigmacote | Sigma | SL2 | |
| Separadores de silicona | Grainger | 1MWA4 | |
| Biopsia golpes | Acuderm | P1025 (10 mm) P850 (8 mm) | |
| Fosfato de Dulbecco tamponada con solución salina (DPBS) | Hyclone | SH30028 | |
| Iodixanol (NycoPrep) | Pescador | NC9388846 | |
| 2-hidroxi-4'-(2-hidroxietoxi)-2-metilpropiofenona | Sigma | 410896 | |
| Dulbecco modificado a medio Eagle (DMEM) | Life Technologies | 11054 | |
| El suero fetal bovino | Life Technologies | 10082 | |
| Penicilina-estreptomicina | Life Technologies | 15140 | |
| C2C12 mioblastos | ATCC | CRL-1772 | |
| MALDI | Bruker | N / A | |
| UVR-9000 | Bayco | UVR-9000 | |
| VersaDoc | Bio-Rad | N / A |
Referencias
- Place, E. S., Evans, N. D., Stevens, M. M. Complexity in biomaterials for tissue engineering. Nat. Mater. 8, 457-470 (2009).
- Liu, V. A., Jastromb, W. E., Bhatia, S. N. Engineering protein and cell adhesivity using PEO-terminated triblock polymers. J. Biomed. Mater. Res. 60, 126-134 (2002).
- Sharma, B., et al. Designing zonal organization into tissue-engineered cartilage. Tissue Eng. 13, 405-414 (2007).
- Hahn, M. S., et al. Photolithographic patterning of polyethylene glycol hydrogels. Biomaterials. 27, 2519-2524 (2006).
- Kizilel, S., Sawardecker, E., Teymour, F., Perez-Luna, V. H. Sequential formation of covalently bonded hydrogel multilayers through surface initiated photopolymerization. Biomaterials. 27, 1209-1215 (2006).
- Harley, B. A., et al. Design of a multiphase osteochondral scaffold. II. Fabrication of a mineralized collagen-glycosaminoglycan scaffold. J. Biomed. Mater. Res. A. 92, 1066-1077 (2010).
- Cuchiara, M. P., Allen, A. C., Chen, T. M., Miller, J. S., West, J. L. Multilayer microfluidic PEGDA hydrogels. Biomaterials. 31, 5491-5497 (2010).
- Roam, J. L., Xu, H., Nguyen, P. K., Elbert, D. L. The formation of protein concentration gradients mediated by density differences of poly(ethylene glycol) microspheres. Biomaterials. 31, 8642-8650 (2010).
- Gleghorn, J. P., Lee, C. S., Cabodi, M., Stroock, A. D., Bonassar, L. J. Adhesive properties of laminated alginate gels for tissue engineering of layered structures. J. Biomed. Mater. Res. A. 85, 611-618 (2008).
- Karpiak, J. V., Ner, Y., Almutairi, A. Density gradient multilayer polymerization for creating complex tissue. Adv. Mater. 24, 1466-1470 (2012).
- Pierschbacher, M. D., Ruoslahti, E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature. 309, 30-33 (1984).
- Kaushik, G., Fuhrmann, A., Cammarato, A., Engler, A. J. In Situ Mechanical Analysis of Myofibrillar Perturbation and Aging on Soft, Bilayered Drosophila Myocardium. Biophysical Journal. 101, 2629-2637 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados