Method Article
Gradiente de densidade de várias camadas de polimerização (DGMP): uma nova técnica para a criação de multi-compartimento, Andaimes customizáveis para Engenharia de Tecidos
Neste Artigo
Resumo
Aqui descrevemos uma estratégia única para a criação de biocompatíveis, matrizes em camadas com interfaces contínuas entre camadas distintas para engenharia de tecidos. Tal um andaime poderia proporcionar um ambiente ideal para modular o comportamento personalizável célula por vários estímulos químicos, biológicos ou mecânicos
Resumo
Matrizes de tecido complexos de cultura, em que os tipos e concentrações de estímulos biológicos (por exemplo, factores de crescimento, inibidores, ou moléculas pequenas) ou a estrutura de matriz (por exemplo, composição, concentração, ou rigidez da matriz) variar ao longo do espaço, de permitir uma vasta gama de investigações sobre a forma como estas variáveis afetam a diferenciação celular, migração e outros fenômenos. O desafio importante na criação de matrizes de camadas é a manutenção da integridade estrutural de interfaces de camada sem difusão dos componentes individuais a partir de cada uma das camadas 1. Metodologias atuais para alcançar este incluem photopatterning 2-3, litografia 4, functionalization5 seqüencial, liofilização 6, microfluídica 7, 8 ou centrifugação, muitos dos quais exigem instrumentação sofisticada e habilidades técnicas. Outros dependem de ligação sequencial de camadas individuais, que podem levar à delaminação das camadas 9 DGMP supera estes problemas por meio de um modificador de densidade inerte tal como o iodixanol para criar camadas de diferentes densidades de 10. Uma vez que o modificador de densidade pode ser misturado com o pré-polímero ou qualquer molécula bioactiva, DGMP permite que cada camada de andaime para ser personalizado. Simplesmente variando a concentração do modificador de densidade impede a mistura das camadas adjacentes, enquanto eles permanecem aquosa. Polimerização único passo subsequente dá origem a uma estruturalmente contínuo multicamada de andaime, em que cada camada tem química distinta e propriedades mecânicas. O modificador de densidade pode ser facilmente removido com a lavagem suficiente sem perturbação das camadas individuais ou os seus componentes. Esta técnica é, portanto, bem adequado para a criação de hidrogéis de várias dimensões, formas e materiais.
Um protocolo para a fabricação de um polietileno glicol 2D-gel (PEG), em que as camadas alternadas incorporar RGDS-350, está descrito a seguir. Usamos PEG bomo é biocompatível e inerte. RGDS, a adesão de células de péptido 11, é utilizado para demonstrar a restrição espacial de um sinal biológico, e a conjugação de um fluoróforo (Alexa Fluor 350) permite-nos distinguir visualmente as diversas camadas. Este procedimento pode ser adaptado para outros materiais (por exemplo, colagénio, ácido hialurónico, etc) e pode ser estendido para o fabrico de geles de 3D 10 com algumas modificações.
Protocolo
1. Síntese de acriloílo marcado por fluorescência-PEG-RGDS
- Reagir o péptido RGDS com éster carboximetil acriloil-PEG-succinimidil (APEG-SCM, PEG MW: 3400 g / mol) e di-isopropiletilamina NN (DIPEA) em razões molares 1.2:1:2 em sulfóxido de dimetilo (DMSO) sob atmosfera de árgon à temperatura ambiente durante a noite.
- Confirmar conjugação por laser assistida por matriz tempo de dessorção / ionização de voo (MALDI-TOF) espectrometria de massa. Adicionar 1 ml de APEG-RGDS solução de reacção a uma mancha de amostra no alvo MALDI e seco. Prepara-se uma solução saturada de Universal MALDI Matrix em tetra-hidrofurano (THF) e agitar em vortex durante 1 min. Adicionar ~ pi 1 desta solução à mancha mesma amostra. Repita o procedimento para APEG-SCM para comparação. Carregar e analisar. O peso molecular de APEG-RGDS deve ser superior a APEG-SCM (Figura 2).
- Para conjugar o fluoróforo, adicionar uma quantidade equimolar de Alexa Fluor 350 carboxílico (éster succinimydyl), dissolvidosnum volume mínimo de DMSO, a solução de reacção APEG-RGDS de 1,1 e reagir sob atmosfera de árgon à temperatura ambiente durante a noite.
- Purificar APEG-RGDS-350 por diálise (PM 3500 Da) contra DI O 2-H, a 4 ° C, durante 48 horas à razão volumétrica 1.000:1, trocando dialisado pelo menos duas vezes por dia.
- Congelar a secar purificado APEG-350-RGDS em um Labconco Freezone Plus ou sistema equivalente congelamento seco e armazenar a -20 ° C.
2. Preparação de um Molde de 2D e fabricação de um gel 2D com PEG-350 RGDS alternada Camadas
- Preparar lâminas de vidro hidrofóbicas. Colocar as lâminas de vidro limpas em um prato de vidro num forno de vácuo. Aquecer a 80 ° C durante 30 minutos para secar completamente as superfícies. Lugar prato com lâminas em um exaustor e adicionar 250 ul Sigmacote a cada slide, balançando suavemente por 30 segundos para a superfície revestimento inteiro. Enxaguar bem as lâminas revestidas com 100% de metanol, seguido de lavagem em água destilada, duas vezes por imersão durante 5 minutos em em least de 10 ml.
- Cortar espaçadores de silicone (0,8 mm de espessura), com 10 milímetros de biópsia perfuradores.
- Autoclavar os espaçadores de silicone e slides Sigmacote tratados com vidro.
- Formular soluções para cada respectiva camada, em tubos de microcentrífuga individuais, de mistura de PEG diacrilato (PEGda) precursor (concentração final de 15% w / v) com quantidades diferentes de iodixanol (solução-mãe a 60% em água), para se obterem diferentes concentrações finais (por exemplo, 40%, 30%, 20% e 10%), completando o volume restante com tampão fosfato salino (PBS) para obter soluções de densidades calibradas. De uma maneira semelhante, por camadas alternadas, mistura APEG-RGDS-350 (concentração final de 8 mM) com PBS e iodixanol, para se obter várias concentrações (por exemplo, 35%, 25% e 15%).
- Adicionar fotoiniciador (2-hidroxi-4'-(2-hidroxietoxi)-2-metilpropiofenona, estoque 333mg/ml em N-vinil-pirrolidona) a cada solução por várias camadas (10 ul de solução de reserva por ml de cada solução de camada). Fotoiniciador is adicionados no final para evitar a polimerização antes estratificação dos géis no molde, uma vez que é sensível à luz.
- Etapas subseqüentes deste protocolo será realizado em uma cabine de segurança biológica para assegurar a esterilidade.
- Filtra-esterilizar cada solução utilizando uma seringa estéril ml e um filtro de 0,2 um. Montar a configuração do molde por ensanduichando o espaçador entre duas lâminas de vidro tratadas com Sigmacore e seguras com grampos colocação, conforme ilustrado na Figura 1.
- Converter os géis em camadas, adicionando a solução mais denso (por exemplo PEGda com iodixanol 40%) em primeiro lugar, seguido por uma solução de menor densidade (por exemplo, APEG-RGDS-350 com iodixanol 35%). Repita as camadas alternadas de atingir várias camadas de composição desejada e densidades, como mostrado na Figura 1.
- Irradiar o molde com luz de 365 nm, durante 3 min usando um portátil UVR-9000 da lâmpada. Permitir que os géis polimerizados curar durante 5 min. Remova os grampos, em seguida, levantar delicadamente a parte superior de vidroslides e do molde, os géis dGMP estratificadas permanecerá nos slides. Usando uma espátula estéril, colocar cuidadosamente os géis em tubo de 50 ml de PBS estéril contendo meio de cultura ou para a lavagem.
- Lavar os géis polimerizados em PBS a 1.000:1 razão volumétrica, a troca de tampão de pelo menos duas vezes por dia, para remover o modificador de densidade, fotoiniciador, e um polímero que não reagiu. Alternativamente, PBS pode ser trocado com meio de crescimento celular. Armazenar os géis dGMP em PBS ou meio de crescimento para a cultura de células de ensaio descrito no Passo 3.
- Para visualizar camadas alternadas, organizar DGMP gel (esses géis não poderá ser usado para cultura de células) ao longo de uma régua na bandeja de amostra de uma unidade de documentação de gel VersaDoc. Expor o gel em 350 nm, o tempo de exposição pode variar, dependendo da concentração do fluoróforo. Alternando bandas escuras e azul no hidrogel DGMP demonstrar a formação de camadas discretas da composição química diferente (Figura 3).
3. Cultura de Células 2D sobre geles dGMP
- Para geles incorporando péptido RGDS, utilização de células dependentes da aderência, tais como mioblastos C2C12.
- Insira cuidadosamente géis dGMP (armazenadas em PBS) nas cavidades de placas de 48 poços de cultura de células, utilizando um raspador de células estéril numa câmara de biossegurança.
- Pré-aquecer o meio de crescimento (meio de Dulbecco modificado por Eagle ou DMEM suplementado com 10% v / v de soro fetal de bovino e de v / v de 1% 100x solução de penicilina-estreptomicina) e PBS num banho de água regulado a 37 ° C.
- Lavar a placa de 60% confluentes (10 mm) de células C2C12 três vezes com PBS. Aspirar PBS e as células de colheita por adição de 1 ml de 0,25% de tripsina-EDTA e incubado a 37 ° C durante 2 min. Ressuspender as células em meio de crescimento e células de contagem. Semente da DGMP gel contendo a cultura de células bem com mioblastos C2C12 (20.000 células / cm 2). Incubar as células a 37 ° C em 5% CO2 / 95% de humidade relativa. Gentilmente meio de troca, após 4 horas, cuidado para não voltarmover levemente células aderidas.
- Após 24 h, a fixação de mioblastos C2C12 sobre as camadas que contêm RGDS de géis dGMP pode ser confirmado por epifluorescência e microscopia de contraste de fase (Zeiss Axiovert 200).
Resultados
MALDI-TOF análise confirma a conjugação do péptido RGDS de acriloil-PEG (Figura 2). Gel de imagem revela alternada RGDS-350 (azul) as camadas após a fotopolimerização (Figura 3A). Como mostrado na Figura 3A, 2D tamanho DGMP gel pode ser variada em função do diâmetro dos moldes de silicone (10 mm, esquerda, 8 mm, para a direita), e, portanto, são facilmente adaptável para utilização em ensaios múltiplos - neste caso, para se ajustar um 48 placas de cultura de células bem (Figura 3B). Epifluorescência e microscopia de contraste de fase de mioblastos C2C12 cultivados sobre um gel DGMP mostra ligação selectiva em RGDS-350-camadas contendo PEG (Figura 4), demonstrando a compartimentalização do peptídeo de adesão celular (RGDS).
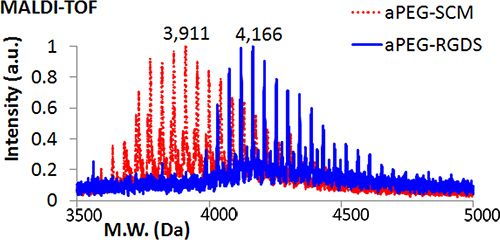
Figura 1. Molecular Weight análise por MALDI-TOF comparando APEG-SCM de APEG-RGDS obtidos após a conjugação do péptido RGDS.
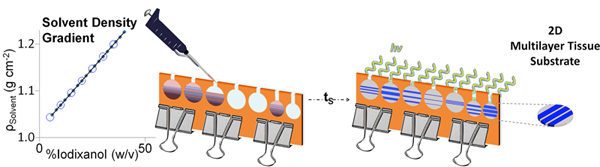
Figura 2. Representação esquemática da fabricação DGMP gel. Após os gradientes são em camadas, que pode ser deixado em repouso por períodos de tempo variáveis (t s) para criar interfaces graduados, seguidos por fotopolimerização. Géis estratificadas dGMP pode ser facilmente extraído do molde para uso posterior. Clique aqui para ver maior figura .

Figura 3 a.) 2D géis de multicamadas obtidas após fotopolimerização fotografada usando 350 nm e brancas canais de luz de VersaDoc unidade de documentação de gel. Escala cinza revela camadas alternadas contendo RGDS em branco. B) Inserção de gel DGMP em 48 pratos de cultura de células bem.

Figura 4. Contraste de fase Incorporada e imagem epifluorescência de mioblastos C2C12 cultivados em DGMP géis (barra de escala 50 mm).
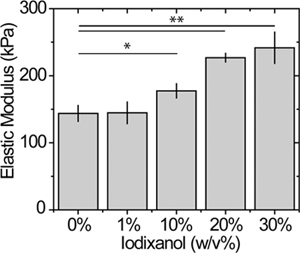
Figura 5. Efeito de iodixanol na superfície do gel. Elasticidade medições de força atômica microscopia de amostras de substratos estáticos PEG reticuladas utilizando métodos previamente estabelecidos com uma força de disparo 2 nN 12. * P <0,05 e ** p <0,01.
Discussão
DGMP é uma estratégia simples para a preparação de geles de várias camadas que não contam com a instrumentação dispendiosa. Este protocolo pode ser adaptado para a criação de andaimes que utilizam outros materiais biocompatíveis, como o colagénio e ácido hialurónico. Pequenas moléculas bioactivas, por exemplo a promoção de adesão celular de péptidos RGDS, pode ser amarrado à matriz polimérica para impedir a mistura de sinais entre as camadas. As proteínas podem ser encapsuladas em camadas distintas, sem a necessidade de conjugação química à medida que, dependendo do tamanho da malha da matriz, são menos propensas a se difundir através hidrogéis 10. Aqui foi utilizado iodixanol (Nycoprep), um modificador de densidade inerte, que tenha sido previamente utilizado para aplicações de células viáveis. Outros modificadores da densidade tais como a sacarose e dextrose pode também ser usado. Ao variar o tempo de sedimentação (t s), pode-se ajustar as interfaces entre duas camadas para produzir transições suaves ou afiado como necessário (tempo de sedimentação dá transições mais suaves) 10. Por exemplo, as transições suaves entre as camadas de gel dGMP poderia ser usado para gerar um gradiente contínuo de um sinal biológico para estudar processos celulares, tais como a quimiotaxia.
O efeito do modificador de densidade na rigidez do gel é apresentado na Figura 5 para um 15% aPEGda gel; uma caracterização mais completa de rigidez e porosidade como uma função da concentração de iodixanol PEGda e está actualmente a ser avaliada. Embora a concentração PEGda neste exemplo é relativamente alta, observou-se um módulo de elasticidade de 60% maior do elástico em géis com iodixanol 30% em relação aos géis sem. A alteração na rigidez de gel pode ser ajustada para a concentração por modulação de macrómero a densidade de reticulação ou.
Temos também aplicada a técnica de criar DGMP 3D utilizando géis de poliacrilamida de multicamadas e de precursores de PEG 10. Variando a concentração ou do grau de reticulação do polímero permite a variação estrutural noandaimes, os quais podem ser usados para investigar o comportamento de células, tais como o crescimento e migração polarizada em 3D.
Em resumo, DGMP é uma técnica flexível que pode ser aplicado para o fabrico de andaimes de 2D e 3D a partir de uma variedade de materiais biocompatíveis para uma ampla gama de aplicações de pesquisa biomédica e básica.
Divulgações
Os autores não têm conflitos de interesses para divulgar.
Agradecimentos
Os autores agradecem o apoio de novos prêmios NIH Director Innovator (1DP2 OD006499-01 a AA e 1DP2 OD006460-01 a AJE), e Abdulaziz King City para a Ciência e Tecnologia (UC San Diego Centro de Excelência em Nanomedicina). Gostaríamos de agradecer a Sra. Jessica Moore por seus comentários críticos sobre o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente ou Instrumento | Companhia | Número de catálogo | |
| Polietileno glicol succinimydyl carboximetilcelulose (a-PEG-SCM) | Laysan | 120-64 | |
| Polyethelyene glicol diacrilato (PEGda) | Dajac Labs | 9359 | |
| Arginina-glicina-ácido aspártico-serina (RGDS) | American Peptide | 49-01-4 | |
| N, N - diisopropiletilamina (DIPEA) | Sigma | D125806 | |
| Dimetil-sulfóxido (DMSO) | Sigma | D2438 | |
| N, N-dimetilformamida (DMF) | Pescador | D119-4 | |
| Tetrahidrofurano (THF) | Pescador | T397 | |
| Cassete de diálise (3500Da) | Thermo Scientific | 66330 | |
| Alexa Fluor 350 carboxílico succinimydyl | Life Technologies | A-10168 | |
| Sigmacote | Sigma | SL2 | |
| Espaçadores de silicone | Grainger | 1MWA4 | |
| Biópsia socos | Acuderm | P1025 (10 mm) P850 (8 mm) | |
| Fosfato de Dulbecco tamponado salino (DPBS) | Hyclone | SH30028 | |
| Iodixanol (NycoPrep) | Pescador | NC9388846 | |
| Ácido 2-hidroxi-4'-(2-hidroxietoxi)-2-metilpropiofenona | Sigma | 410896 | |
| Meio Dulbecco modificado por Eagle (DMEM) | Life Technologies | 11054 | |
| De soro fetal bovino | Life Technologies | 10082 | |
| Penicilina-estreptomicina | Life Technologies | 15140 | |
| Mioblastos C2C12 | ATCC | CRL-1772 | |
| MALDI | Bruker | N / A | |
| RUV-9000 | Bayco | RUV-9000 | |
| VersaDoc | Bio-Rad | N / A |
Referências
- Place, E. S., Evans, N. D., Stevens, M. M. Complexity in biomaterials for tissue engineering. Nat. Mater. 8, 457-470 (2009).
- Liu, V. A., Jastromb, W. E., Bhatia, S. N. Engineering protein and cell adhesivity using PEO-terminated triblock polymers. J. Biomed. Mater. Res. 60, 126-134 (2002).
- Sharma, B., et al. Designing zonal organization into tissue-engineered cartilage. Tissue Eng. 13, 405-414 (2007).
- Hahn, M. S., et al. Photolithographic patterning of polyethylene glycol hydrogels. Biomaterials. 27, 2519-2524 (2006).
- Kizilel, S., Sawardecker, E., Teymour, F., Perez-Luna, V. H. Sequential formation of covalently bonded hydrogel multilayers through surface initiated photopolymerization. Biomaterials. 27, 1209-1215 (2006).
- Harley, B. A., et al. Design of a multiphase osteochondral scaffold. II. Fabrication of a mineralized collagen-glycosaminoglycan scaffold. J. Biomed. Mater. Res. A. 92, 1066-1077 (2010).
- Cuchiara, M. P., Allen, A. C., Chen, T. M., Miller, J. S., West, J. L. Multilayer microfluidic PEGDA hydrogels. Biomaterials. 31, 5491-5497 (2010).
- Roam, J. L., Xu, H., Nguyen, P. K., Elbert, D. L. The formation of protein concentration gradients mediated by density differences of poly(ethylene glycol) microspheres. Biomaterials. 31, 8642-8650 (2010).
- Gleghorn, J. P., Lee, C. S., Cabodi, M., Stroock, A. D., Bonassar, L. J. Adhesive properties of laminated alginate gels for tissue engineering of layered structures. J. Biomed. Mater. Res. A. 85, 611-618 (2008).
- Karpiak, J. V., Ner, Y., Almutairi, A. Density gradient multilayer polymerization for creating complex tissue. Adv. Mater. 24, 1466-1470 (2012).
- Pierschbacher, M. D., Ruoslahti, E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature. 309, 30-33 (1984).
- Kaushik, G., Fuhrmann, A., Cammarato, A., Engler, A. J. In Situ Mechanical Analysis of Myofibrillar Perturbation and Aging on Soft, Bilayered Drosophila Myocardium. Biophysical Journal. 101, 2629-2637 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados