Method Article
Density Gradient Multilayered Polymerisation (DGMP): A Novel Technique für das Erstellen von Multi-Fach, Anpassbare Scaffolds für das Tissue Engineering
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein einzigartiges Strategie zur Erzeugung biokompatiblen, schichtförmige Matrices mit kontinuierlicher Schnittstellen zwischen unterschiedlichen Schichten für das Tissue Engineering. Ein solches Gerüst könnte eine ideale anpassbare Umgebung zu modulieren Zellverhalten durch verschiedene biologische, chemische oder mechanische Signale
Zusammenfassung
Komplex Gewebekultur Matrizen, in denen Arten und Konzentrationen der biologische Reize (zB Wachstumsfaktoren, Inhibitoren, oder kleinen Molekülen) oder Matrix-Struktur (zB Zusammensetzung, Konzentration oder Steifigkeit der Matrix) variieren über Raum, würde es ermöglichen, eine Vielzahl von Untersuchungen darüber, wie diese Variablen Zelldifferenzierung, Migration und andere Phänomene beeinflussen. Die größte Herausforderung beim Erstellen geschichteten Matrices ist die Aufrechterhaltung der strukturellen Integrität der Schicht Schnittstellen ohne Diffusion einzelner Komponenten aus jeder Schicht ein. Aktuelle Methoden, dies zu erreichen, zählen Photostrukturierung 2-3, Lithographie 4, sequentielle functionalization5, Gefriertrocknung 6, Mikrofluidik 7 oder Zentrifugation 8, von denen viele erfordern anspruchsvolle Mess-und technischen Fähigkeiten. Andere verlassen sich auf sequentielle Befestigung der einzelnen Schichten, die kann dazu führen, Schichten 9 Delamination DGMP überwindet diese Probleme durch die Verwendung eines inerten Dichtemodifikationsmittel wie Iodixanol, um Schichten unterschiedlicher Dichte 10 zu erzeugen. Da das Dichtemodifikationsmittel mit jeder Prepolymer oder bioaktive Molekül vermischt werden können, ermöglicht DGMP jedes Gerüst Schicht angefertigt werden. Einfache Variation der Konzentration des Dichtemodifikationsmittel verhindert eine Vermischung benachbarter Schichten während sie wässrigen bleiben. Anschließende Polymerisation einzigen Schritt führt zu einer strukturell kontinuierlichen mehrschichtigen Gerüst, in der jede Schicht unterschiedlichen chemischen und mechanischen Eigenschaften. Die Dichtemodifizierer können leicht mit ausreichend Spülen ohne Störung der einzelnen Lagen oder deren Bestandteile entfernt werden. Diese Technik ist daher gut für die Erstellung von Hydrogelen in verschiedenen Größen, Formen und Materialien.
Ein Protokoll für die Herstellung eines 2D-Polyethylenglykol (PEG)-Gel, in dem alternierende Schichten aufzunehmen RGDS-350, wird im Folgenden erläutert. Wir verwenden PEG beil es ist biokompatibel und inert. RGDS, eine Zelladhäsion Peptid 11 wird verwendet, um räumliche Beschränkung einer biologischen Cue demonstrieren, und die Konjugation von einem Fluorophor (Alexa Fluor 350) ermöglicht es, visuell zu unterscheiden verschiedenen Schichten. Dieses Verfahren kann auch für andere Materialien angepasst werden (z. B. Kollagen, Hyaluronsäure, etc.) und kann um 3D Gele mit einigen Modifikationen 10 herzustellen.
Protokoll
Ein. Synthese von fluoreszenzmarkierten Acryloyl-PEG-RGDS
- Reagieren des RGDS-Peptids mit Acryloyl-PEG-Succinimidyl carboxymethylester (APEG-SCM, PEG MG: 3400 g / mol) und NN Diisopropylethylamin (DIPEA) in 1.2:1:2 Molverhältnisse in Dimethylsulfoxid (DMSO) unter Argon bei Raumtemperatur Übernachtung.
- Bestätigen Konjugation durch Matrix-Assisted Laser Desorption / Ionisation Time of Flight (MALDI-TOF) Massenspektrometrie. Hinzufügen 1 ul APEG-RGDS Reaktionslösung zu einer Probe Fleck auf das MALDI-Target und trocken. Bereiten Sie eine gesättigte Lösung von Universal MALDI Matrix in Tetrahydrofuran (THF) und Vortex für 1 min. Fügen Sie ~ 1 ul dieser Lösung auf die gleiche Probe vor Ort. Wiederholen Sie den Vorgang für APEG-SCM für den Vergleich. Laden und zu analysieren. Das Molekulargewicht APEG-RGDS sollte größer sein als APEG-SCM (Abbildung 2).
- Um das Fluorophor konjugiert, fügen eine äquimolare Menge von Alexa Fluor 350 carbonsäure (succinimydyl Ester), gelöstin einem minimalen Volumen von DMSO, die RGDS-APEG Reaktionslösung von 1,1 und reagieren unter Argon bei Raumtemperatur über Nacht.
- Läutern APEG-RGDS-350 durch Dialysieren (MW 3500 Da) gegen DI-H 2 O bei 4 ° C für 48 h bei 1.000:1 Volumenverhältnis, Austauschen Dialysat wenigstens zweimal pro Tag.
- Freeze Dry das gereinigte APEG-RGDS-350 in einer Labconco Freezone Plus oder gleichwertige Freeze Dry-System und bei -20 ° C.
2. Herstellung eines 2D-Mold und Anfertigung einer 2D PEG Gel mit alternierenden Schichten RGDS-350
- Bereiten hydrophoben Glasträger. Zeigen sauberes Glas gleitet in einer Glasschale in einem Vakuumofen. Wärme auf 80 ° C für 30 min vollständig trocknen die Flächen. Platz Teller mit Folien in einer Abzugshaube und 250 ul Sigmacote zu jeder Folie, sanft schaukelnden für 30 sec zu beschichten gesamte Fläche. Gründlich die beschichteten Objektträger mit 100% Methanol, gefolgt von Waschen in destilliertem Wasser, Einweichen zweimal für 5 min in bei Leasingt 10 ml.
- Cut Silikon-Abstandshalter (0,8 mm dick) mit 10 mm Biopsieausstanzungen.
- Autoklaven werden die Silikon-Abstandshalter und Sigmacote behandelten Objektträger.
- Formulierung von Lösungen für jedes jeweilige Schicht in einzelnen Mikrozentrifugenröhrchen durch Mischen PEG-diacrylat (PEGDA) Vorstufe (Endkonzentration 15% w / v) mit unterschiedlichen Mengen von Iodixanol (60% ige Stammlösung in Wasser) in unterschiedlichem Endkonzentrationen (zB 40% zu ergeben, 30%, 20% und 10%) zur Ergänzung der restliche Volumen mit Phosphat-gepufferter Salzlösung (PBS), um Lösungen von abgestuften Dichten zu erhalten. In einer ähnlichen Weise, zum alternierenden Schichten, um Mischung APEG-RGDS-350 (8 mM Endkonzentration) mit Iodixanol und PBS zu ergeben verschiedenen Konzentrationen (z. B. 35%, 25% und 15%).
- Hinzufügen Fotoinitiator (2-Hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenon, 333mg/ml stock in N-vinylpyrrolidon) zu jeder Lösung für verschiedene Schichten (10 ul Stammlösung pro ml jeder Schicht Lösung). Photoinitiator is zuletzt zugegeben, um die Polymerisation vor Schichtung der Gele in der Form zu verhindern, da sie lichtempfindlich ist.
- Nachfolgende Schritte dieses Protokoll wird in einer biologischen Sicherheitswerkbank durchgeführt werden, um die Sterilität zu gewährleisten.
- Filtern sterilisieren jede Lösung mit einer sterilen 1-ml-Spritze und 0,2 um Filter. Montieren Sie den Werkzeug-Setups durch Anordnen der Abstandhalter zwischen zwei Sigmacore behandelten Glasplatten und mit Zwingen befestigen Platzierung wie in Abbildung 1 dargestellt.
- Warf die geschichteten Gele, indem das dichteste Lösung (zB PEGDA mit 40% Iodixanol) zunächst durch eine weniger dichte Lösung (zB APEG-RGDS-350 mit 35% Iodixanol) gefolgt. Wiederholen des alternativen Schichtung mehrere Schichten von gewünschten Zusammensetzung und Dichten zu erzielen, wie in Abbildung 1 gezeigt.
- Bestrahlen der Form mit 365 nm Licht für 3 min unter Verwendung eines tragbaren UVR-9000 Lampe. Lassen Sie die polymerisierte Gele für 5 min zu heilen. Entfernen Sie die Klammern, dann heben Sie die obere GlasRutsche und die Form, die geschichtete DGMP Gele werden auf den Folien bleiben. Mit einem sterilen Spatel, vorsichtig die Gele in einem 50 ml Röhrchen mit sterilem PBS oder Kulturmedium für Wäsche.
- Waschen der polymerisierten Gele in PBS bei 1.000:1 Volumenverhältnis, Austauschen Puffer mindestens zweimal pro Tag das Dichtemodifikationsmittel, Photoinitiator und nicht umgesetztem Polymer zu entfernen. Alternativ kann PBS mit Zellwachstumsmedium ausgetauscht werden. Speichern der DGMP Gele in PBS oder Wachstumsmedium für die Zellkultur Experiment in Schritt 3 beschrieben.
- Um abwechselnden Schichten visualisieren, zu veranlassen DGMP Gel (diese Gele nicht verwendbar für die Zellkultur) entlang einer Lineal auf der Probenschale eines VersaDoc Geldokumentation Einheit. Setzen der Gele in 350 nm; die Belichtungszeit variiert in Abhängigkeit von der Konzentration des Fluorophors. Abwechselnd dunklen und blauen Streifen im DGMP Hydrogel demonstrieren Bildung von diskreten Schichten aus verschiedenen chemischen Zusammensetzung (Abbildung 3).
3. 2D Cell Culture auf DGMP Gels
- Für Gele Einbeziehung RGDS-Peptid, verwenden Adhäsion abhängigen Zellen, wie C2C12 Myoblasten.
- Schieben Sie DGMP Gele (gespeichert in PBS) in die Vertiefungen der 48-Well-Zellkultur-Platten mit einer sterilen Zellschaber in einer biologischen Sicherheitswerkbank.
- Vorwärmen Wachstumsmedium (Dulbeccos modifiziertes Eagle-Medium oder DMEM, ergänzt mit 10% v / v fötalem Rinderserum und 1% v / v 100x Penicillin-Streptomycin-Lösung) und PBS in ein Wasserbad gesetzt bei 37 ° C
- Waschen mit 60% konfluenten Platte (10 mm) von C2C12 Zellen dreimal mit PBS. Absaugen PBS und Ernte Zellen durch Zugabe von 1 ml 0,25% Trypsin-EDTA und Inkubation bei 37 ° C für 2 min. Die Zellen in Wachstumsmedium und Anzahl Zellen. Samen der DGMP Gel enthaltenden Zellkultur gut mit C2C12 Myoblasten (20.000 Zellen / cm 2). Inkubieren der Zellen bei 37 ° C in 5% CO 2/95% relative Luftfeuchtigkeit. Gently Tauschmittel nach 4 h, aufpassen, nicht wiederBewegen leicht anhaftenden Zellen.
- Nach 24 Stunden kann die Anbringung von C2C12 Myoblasten auf den RGDS-haltigen Schichten DGMP Gele durch Epifluoreszenz und Phasenkontrast-Mikroskopie (Zeiss Axiovert 200) bestätigt werden.
Ergebnisse
MALDI-TOF-Analyse bestätigt die Konjugation von RGDS-Peptid um Acryloyl-PEG (Abbildung 2). Gel Imaging offenbart alternierenden RGDS-350 (blau) Schichten nach Photopolymerisation (Abbildung 3A). Wie in 3A gezeigt, können 2D DGMP Gelgröße basierend auf dem Durchmesser der Silikonformen (10 mm, links; 8 mm, rechts) variiert werden, und sind daher leicht anpassbar für die Verwendung in mehreren Assays - in diesem Fall um einen passenden 48 well Zellkulturplatte (3B). Epifluoreszenz und Phasenkontrast-Mikroskopie von C2C12 Myoblasten auf einem DGMP Gel kultiviert zeigt selektiver Anbringung auf RGDS-350-enthaltenden PEG Schichten (Abbildung 4), was zeigt, Kompartimentierung der Zelladhäsion Peptid (RGDS).
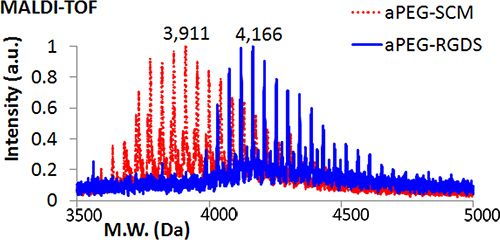
Abbildung 1. Molecular Weight Analyse durch MALDI-TOF Vergleich APEG-SCM APEG-RGDS nach Konjugation RGDS Peptid erhalten.
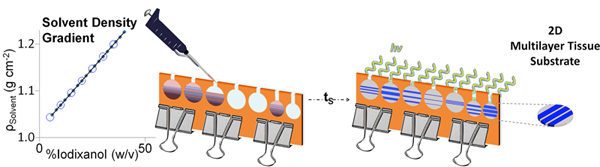
Abbildung 2. Schematische Darstellung DGMP Gelherstellung. Nachdem die Gradienten geschichtet sind, können sie gestattet, um die verschiedenen Zeiträume (t s) zur abgestuften Schnittstellen, durch Photopolymerisation gefolgt erstellen begleichen. Geschichtete DGMP Gele können leicht aus der Form zur weiteren Verwendung entnommen werden. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 3. A) 2D vielschichtigen Gelen nach Photopolymerisation erhalten abgebildet mit 350 nm und weißes Licht Kanäle VersaDoc Gel-Dokumentation Einheit. Das Graustufenbild zeigt abwechselnden Schichten mit RGDS in weiß. B) Insertion von DGMP Gel in 48-Well-Zellkulturschalen.

Abbildung 4. Merged Phasenkontrast und Epifluoreszenz Bild von C2C12 Myoblasten auf DGMP Gele (Maßstab 50 um) gewachsen.
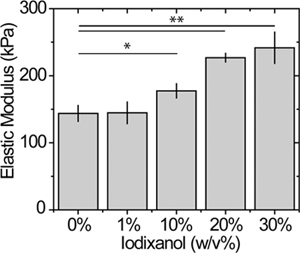
Abbildung 5. Wirkung von Iodixanol auf Geloberfläche Elastizität. Atomic force microscopy Messungen von statischen Proben von vernetzten PEG Substraten unter Verwendung von bereits etablierten Methoden mit einem 2 nN Kraft Trigger 12. * P <0,05 und ** p <0,01.
Diskussion
DGMP ist eine einfache Strategie zur Vorbereitung vielschichtigen Gele, die nicht auf teure Instrumente angewiesen ist. Dieses Protokoll kann zum Erstellen von Gerüsten mit anderen biokompatiblen Materialien, wie beispielsweise Collagen und Hyaluronsäure angepasst werden. Bioaktiven kleinen Molekülen, zum Beispiel Zell haftvermittelnde RGDS-Peptid, können an die Polymermatrix angebunden werden zur Verhinderung der Vermischung von Stimmungen zwischen den Schichten. Proteine können in getrennten Schichten ohne chemische Konjugation eingekapselt werden, da sie je nach Matrix Maschengröße, weniger anfällig für durch Hydrogele 10 diffundieren können. Hier verwendet Iodixanol (Nycoprep), eine inerte Dichtemodifikationsmittel, die zuvor für lebensfähige Zelle Anwendungen verwendet worden. Andere Dichtemodifizierer wie Saccharose und Dextrose können ebenfalls verwendet werden. Durch Variation der Einschwingzeit (t s), kann man die Feinabstimmung der Schnittstellen zwischen zwei Schichten auf glatten oder scharfe Übergänge zu erzeugen, wie erforderlich ist (längere Einschwingzeit gibt weichere Übergänge) 10. Zum Beispiel könnte weichere Übergänge zwischen DGMP Gelschichten verwendet, um einen kontinuierlichen Gradienten eines biologischen Cue zu Zelle Prozesse wie Chemotaxis studieren zu erzeugen.
Die Wirkung des Gels auf Dichtemodifikationsmittel Steifigkeit ist in 5 für einen 15%-Gel aPEGda gezeigt; eine vollständige Charakterisierung der Steifigkeit und Porosität als Funktion der PEGDA und Iodixanol Konzentrationen wird derzeit untersucht. Während die PEGDA Konzentration in diesem Beispiel ist relativ hoch, beobachteten wir eine 60% größer Elastizitätsmodul in Gelen mit 30% im Vergleich zu Iodixanol Gelen ohne. Die Veränderung der Steifigkeit Gel kann durch Modulation der Konzentration oder Makromer Vernetzungsdichte einstellbar.
Wir haben auch die DGMP Technik 3D vielschichtigen Gele mit Polyacrylamid und PEG-Vorstufen 10 zu schaffen angewendet. Variieren der Konzentration oder der Grad der Vernetzung des Prepolymers ermöglicht strukturellen Variation in derGerüste, die zur Zell-Verhalten wie polarisierten Wachstum und Migration in 3D erforschen kann.
Zusammenfassend ist DGMP eine anpassungsfähige Technik, die angewendet 2D-und 3D-Gerüste aus einer Vielzahl von biokompatiblen Werkstoffen für eine Vielzahl von biomedizinischen Anwendungen und Grundlagenforschung fabrizieren lassen.
Offenlegungen
Die Autoren haben keine widerstreitenden Interessen offen zu legen.
Danksagungen
Die Autoren bedanken sich für die Unterstützung aus New Innovator NIH Director Awards (1DP2 OD006499-01 bis AA und 1DP2 OD006460-01 bis AJE) und King Abdulaziz City for Science and Technology (UC San Diego Center of Excellence in Nanomedizin). Wir möchten Ms. Jessica Moore für ihre kritischen Anmerkungen zum Manuskript danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenz oder Instrument | Firma | Katalog-Nummer | |
| Polyethylenglykol succinimydyl carboxymethyl (a-PEG-SCM) | Laysan | 120-64 | |
| Polyethelyene Glykoldiacrylat (PEGDA) | Dajac Labs | 9359 | |
| Arginin-Glycin-Asparaginsäure-Serin (RGDS) | American Peptide | 49-01-4 | |
| N, N - Diisopropylethylamin (DIPEA) | Sigma | D125806 | |
| Dimethylsulfoxid (DMSO) | Sigma | D2438 | |
| N, N-Dimethylformamid (DMF) | Fischer | D119-4 | |
| Tetrahydrofuran (THF) | Fischer | T397 | |
| Dialysekassette (3500Da) | Thermo Scientific | 66330 | |
| Alexa Fluor 350 Carbonsäure succinimydyl Ester | Life Technologies | A-10168 | |
| Sigmacote | Sigma | SL2 | |
| Silikon Abstandshalter | Grainger | 1MWA4 | |
| Biopsieausstanzungen | Acuderm | P1025 (10 mm) P850 (8 mm) | |
| Dulbeccos phosphatgepufferter Salzlösung (DPBS) | Hyclone | SH30028 | |
| Iodixanol (NycoPrep) | Fischer | NC9388846 | |
| 2-Hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenon | Sigma | 410896 | |
| Dulbecco modifiziertem Eagle-Medium (DMEM) | Life Technologies | 11054 | |
| Fötales Rinderserum | Life Technologies | 10082 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| C2C12 Myoblasten | ATCC | CRL-1772 | |
| MALDI | Bruker | N / A | |
| UVR-9000 | Bayco | UVR-9000 | |
| VersaDoc | Bio-Rad | N / A |
Referenzen
- Place, E. S., Evans, N. D., Stevens, M. M. Complexity in biomaterials for tissue engineering. Nat. Mater. 8, 457-470 (2009).
- Liu, V. A., Jastromb, W. E., Bhatia, S. N. Engineering protein and cell adhesivity using PEO-terminated triblock polymers. J. Biomed. Mater. Res. 60, 126-134 (2002).
- Sharma, B., et al. Designing zonal organization into tissue-engineered cartilage. Tissue Eng. 13, 405-414 (2007).
- Hahn, M. S., et al. Photolithographic patterning of polyethylene glycol hydrogels. Biomaterials. 27, 2519-2524 (2006).
- Kizilel, S., Sawardecker, E., Teymour, F., Perez-Luna, V. H. Sequential formation of covalently bonded hydrogel multilayers through surface initiated photopolymerization. Biomaterials. 27, 1209-1215 (2006).
- Harley, B. A., et al. Design of a multiphase osteochondral scaffold. II. Fabrication of a mineralized collagen-glycosaminoglycan scaffold. J. Biomed. Mater. Res. A. 92, 1066-1077 (2010).
- Cuchiara, M. P., Allen, A. C., Chen, T. M., Miller, J. S., West, J. L. Multilayer microfluidic PEGDA hydrogels. Biomaterials. 31, 5491-5497 (2010).
- Roam, J. L., Xu, H., Nguyen, P. K., Elbert, D. L. The formation of protein concentration gradients mediated by density differences of poly(ethylene glycol) microspheres. Biomaterials. 31, 8642-8650 (2010).
- Gleghorn, J. P., Lee, C. S., Cabodi, M., Stroock, A. D., Bonassar, L. J. Adhesive properties of laminated alginate gels for tissue engineering of layered structures. J. Biomed. Mater. Res. A. 85, 611-618 (2008).
- Karpiak, J. V., Ner, Y., Almutairi, A. Density gradient multilayer polymerization for creating complex tissue. Adv. Mater. 24, 1466-1470 (2012).
- Pierschbacher, M. D., Ruoslahti, E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature. 309, 30-33 (1984).
- Kaushik, G., Fuhrmann, A., Cammarato, A., Engler, A. J. In Situ Mechanical Analysis of Myofibrillar Perturbation and Aging on Soft, Bilayered Drosophila Myocardium. Biophysical Journal. 101, 2629-2637 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten