Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de Ca intracelular
En este artículo
Resumen
Intracelular de Ca 2 + Dinámicas son muy importantes en la fisiología de esperma y Ca 2 + Delicados tintes fluorescentes constituyen una herramienta versátil para su estudio. Experimentos Población (fluorometría y dejó de fluorometría de flujo) y los experimentos de células individuales (citometría de flujo y la imagen única célula) se utilizan para realizar un seguimiento espacio-temporal [Ca 2 +] Los cambios en los espermatozoides humanos.
Resumen
Los espermatozoides son las células reproductoras masculinas, especialmente diseñados para alcanzar, reconocer y fusionarse con el óvulo. Para realizar estas tareas, los espermatozoides deben estar preparados para enfrentarse a un entorno en constante cambio y superar varias barreras físicas. Siendo en esencia transcripcional y traduccional en silencio, estas células móviles dependen profundamente de diversos mecanismos de señalización para orientarse y nadar de una manera dirigida, y para lidiar con las difíciles condiciones ambientales durante su viaje para encontrar el huevo. En particular, Ca 2 +-señalización mediada es fundamental para varias funciones espermáticas: la activación de la motilidad, la capacitación (un proceso complejo que se prepara esperma para la reacción del acrosoma) y la reacción acrosómica (un evento de exocitosis que permite la fusión esperma-óvulo). El uso de colorantes fluorescentes para rastrear las fluctuaciones intracelulares de este ión es de notable importancia debido a su facilidad de aplicación, la sensibilidad, y la versatilidad de detexión. Utilizando un protocolo de tinte de carga solo utilizamos cuatro técnicas diferentes para controlar fluorométricas espermatozoides Ca 2 + dinámica. Cada técnica proporciona información distinta que permite la resolución espacial y / o temporal, la generación de datos tanto en una sola célula y los niveles de población de células.
Introducción
Ca 2 + es un segundo mensajero universal de las vías de transducción de señales en las células eucariotas. Intracelular de Ca 2 + (Ca 2 + i) participa en la regulación de muchos procesos fisiológicos fundamentales tanto en células excitables y no excitables. La importancia y la universalidad de la Ca 2 + como segundo mensajero en la transducción de señales se deriva de su versatilidad espacio-temporal en la transmisión de información dentro de la célula. Mientras Ca 2 + no puede ser sintetizado de novo o degradada dentro de la célula, su concentración intracelular ([Ca2 +] i) se mantiene dentro de límites muy estrictos a través de diferentes mecanismos celulares que continuamente tampón, secuestrar, compartimentar, y / o acumular Ca 2 +. Los cambios en la concentración de este ión se producen en áreas muy localizadas dentro de la célula 1, y descifrar dichas fluctuaciones es esencial para la obtención de uncomprensión eper de (1) su papel en el mecanismo de señalización, (2) su importancia fisiológica, y (3) los mecanismos generales de la señalización celular. Ca 2 +-señalización mediada es de particular importancia en la fisiología de esperma 2. La motilidad del esperma es una de las funciones más importantes para el éxito de la fertilización, y de hecho, varios defectos de la motilidad del esperma puede causar esterilidad 3-5. La importancia de Ca 2 + en el movimiento flagelar se ha reconocido desde hace tiempo 6, sin embargo, el mecanismo de cómo Ca 2 + controla la forma específica de flagelar flexión no se entiende completamente.
Antes de fusionarse con el óvulo, los espermatozoides deben someterse a la capacitación, un proceso complejo que depende de la residencia de los espermatozoides dentro del tracto femenino. Durante la capacitación, la arquitectura lipídica de la membrana de los espermatozoides y la organización se modifican, principalmente como resultado de la eliminación del colesterol de la membrana plasmática. Además, varias proteínas son tirosina-fósforoylated 7. Es importante destacar que, durante la capacitación hay un aumento en el pH intracelular (pH i) y de la [Ca2 +] i, y el potencial de membrana hiperpolariza en algunas especies 2. La capacitación se lleva a cabo sólo en una subpoblación de espermatozoides (20-40%), y los mecanismos implicados en estos cambios celulares están lejos de ser clara. Se acepta generalmente que sólo una subpoblación de espermatozoides capacitados se someten a la reacción acrosómica (AR) cuando se expone a los inductores fisiológicos. La AR es también un evento de 2 +-Ca regulada necesaria para la fertilización en todas las especies poseen un acrosoma (orgánulo especializado con membranas externa e interna). Durante este proceso los fusibles de membrana acrosomal exteriores con la membrana plasmática del espermatozoide, la liberación de enzimas hidrolíticas que permiten que la célula de esperma para penetrar la matriz de glico-proteico que rodea el huevo (zona pelúcida, o ZP). La AR también expone una nueva superficie de la célula de esperma fusogénico que interactúa conla membrana plasmática de huevo para la fusión final de los dos gametos. Hay varios ligandos celulares que inducen la AR, la progesterona es uno de los más estudiados entre ellos.
En este trabajo se presentan cuatro técnicas diferentes que implican el uso de un colorante fluorescente sensible a Ca + 2 para medir la [Ca 2 +] i los cambios en el esperma humano provocado por la progesterona (a excepción de la citometría de flujo, en el que se midió la [Ca 2 + ] i inducida por aumento durante el proceso de capacitación in vitro). En este caso particular, se utilizó Fluo-3 AM (Life Technologies, Grand Island, NY), un colorante de la membrana permeable a los con una Kd = 325 nM. In vitro que supervisó cambios de fluorescencia como una función del tiempo con tres de las metodologías, y con la cuarta técnica que mide los valores de fluorescencia en un punto dado en el tiempo. Estos diferentes enfoques se complementan entre sí, ya que en conjunto proporcionan resolución espacial y temporallución en tanto la célula individual y los niveles de población de células.
Población celular o experimentos a granel
Técnicas granel se utilizan ampliamente no sólo porque los instrumentos que requieren están fácilmente disponibles, sino también porque son simples, bien establecida, y permiten el cálculo del promedio de la información a partir de mediciones realizadas en millones de células en un solo experimento.
Técnica # 1. Fluorometría convencional
Esta técnica monitorea los cambios en la fluorescencia como una función de tiempo; los experimentos se llevan a cabo en cubetas de vidrio con volúmenes de muestra que van de 200 a 1000 l. Mezcla adecuada de los reactivos añadidos requiere agitación magnética, y por lo tanto, la resolución temporal obtenida es del orden de segundos. El intervalo de concentración celular típica de las muestras analizadas es 10 5 -10 8 células / ml.
Técnica # 2. Detenido Fluorometría Flow
Tsu técnica también monitorea los cambios en la fluorescencia como una función de tiempo, pero los reactivos se mezclan juntos rápidamente (utilizando la presión) en una cubeta de grabación que contiene un volumen muy pequeño de la muestra (que van de 25-100 l). Por lo tanto, la homogeneización de los reactivos es instantánea, lo que permite una alta resolución temporal en el orden de milisegundos. El análisis de la fluorescencia frente al tiempo huellas resultantes son adecuados para la determinación de las velocidades de reacción, la aclaración de la complejidad del mecanismo de reacción, la obtención de información sobre los intermedios de reacción de vida corta, etc El intervalo de concentración celular común de las muestras analizadas es 10 5 -10 7 células / ml.
Experimentos sola célula
Experimentos granel informan el comportamiento medio de un gran número de células, sin embargo, una población puede con frecuencia exhiben propiedades heterogéneas que se pasan por alto durante tal tipo de mediciones. Técnicas de células individuales por lo tanto se utilizan para complementar ªinformación de correo obtiene con experimentos población de células.
Técnica # 3. Citometría de Flujo
A pesar de la importancia de la información que surge a partir de mediciones de células individuales, es importante analizar un gran número de células con el fin de evitar que la extrapolación errónea de las propiedades de células específicas para una población entera. Por esta razón, las técnicas de alto rendimiento se ven favorecidos y el método más popular es la citometría de flujo, en la que 10.000 células por condición se analizan de forma convencional. Este método permite el análisis de múltiples paramétrica de poblaciones heterogéneas, ya que clasifica las células en función de su tamaño (dispersión hacia adelante (FSC)), granularidad (dispersión lateral (SSC)) y la intensidad de fluorescencia (etiquetado específico con un anticuerpo, marcador de viabilidad, etc) , lo que proporciona información sobre la distribución de los parámetros "de un grupo de células. La citometría de flujo proporciona información instantánea en lugar de en función del tiempo 8. Adelante y lateral valores de dispersión are también es útil para la selección de una puerta que incluye células, pero discrimina los restos celulares, el polvo, etc Para las mediciones de fluorescencia, fluorescencia controles negativos y positivos también deben ser incluidos. Si se utiliza más de un canal de fluorescencia, se debe realizar un proceso conocido como compensación (para detalles ver http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Compensación permite la superposición espectral de la discriminación entre los fluoróforos. La citometría de flujo también permite la discriminación de las células muertas, generalmente por medio de tinción con yoduro de propidio.
Técnica # 4. Soltero imágenes de células
Microscopía es otro método común para estudiar el comportamiento de células individuales, sino que es muy adecuado para estudios dependientes del tiempo y también proporciona resolución espacial. Un gran inconveniente es que el análisis de alto rendimiento es sólo en su infancia en la actualidad 9.
Protocolo
En este trabajo se reporta el uso de las cuatro técnicas antes mencionadas para medir la [Ca 2 +] i los cambios en los espermatozoides humanos. Se utilizó progesterona para desencadenar una respuesta de Ca 2 +, ya que está bien establecido que este esteroide produce un transitorio [Ca2 +] i aumentar en los espermatozoides. Particularmente, en el esperma humano, la progesterona activa directamente un canal de Ca2 + (es decir, CatSper) expresado exclusivamente en la membrana plasmática de las células de esperma 10,11. También se midió en reposo [Ca 2 +] i antes y después de la capacitación, dado que también es ampliamente aceptado que un aumento de la [Ca 2 +] i se produce durante la capacitación. Para las técnicas que requieren un control positivo se utilizó un ionóforo de Ca 2 +-ionomicina para inducir la máxima absorción de Ca2 + en la célula, y por lo tanto, la respuesta de fluorescencia máxima; para el valor de fluorescencia mínima, se utilizó Mn 2 + para apagar la fluorescencia.
1. Sperm preparación de muestras por el método de Swim-up (Ver Figura 1)
Utilice sólo eyaculado muestras (obtenidas por masturbación), cuyas características cumplen los parámetros establecidos por la última edición del manual de laboratorio de la OMS (disponible en http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) para el examen y el procesamiento de semen humano.
- Obtener la muestra de semen en un recipiente estéril y colóquelo (con tapa suelta) en una incubadora a 37 º C y CO2 al 5% / 95% de aire durante 30 min. Este paso es para la licuefacción de la muestra.
- Colocar 500 ml de alícuotas de la muestra de semen licuado en la parte inferior de los tubos de ensayo de vidrio limpia (1,0 x 7,5 cm). Se necesitan aproximadamente ocho tubos de ensayo para una muestra de tamaño medio (4 ml).
- Con cuidado, la capa 1 ml de medio F-10 de Ham (su. pplemented con 2 mM CaCl 2 y 5 mg / ml de albúmina de suero bovino para promover la capacitación in vitro) en la parte superior de cada alícuota de semen (Ver Figura 1) SUGERENCIA: toque la pared del tubo con la punta de la micropipeta, y dispensar cuidado el medio por encima de la muestra. Es muy importante hacerlo lentamente la mezcla de las dos capas (muestra y media) se debe evitar.
- Cuidadosamente incline los tubos a un ángulo de 30 ° aproximadamente. Esto aumentará el área de superficie entre los dos líquidos, mejorando así el desplazamiento (en la piscina) de las células humanas de la muestra al medio durante la incubación.
- Coloque el grupo de tubos de ensayo se inclina hacia dentro una incubadora a 37 ° C y CO2 al 5% / aire 95% durante 1 hora.
- Usando una micropipeta retire con cuidado el l 700 superior de medio F-10 de Ham (que ahora contiene los espermatozoides móviles) de cada tubo y la piscina todas las muestras recogidas en un tubo de vidrio limpio única (1,0 x 7,5 cm, para volúmenes mayores utilizan a 15 mlTubo Falcon), evitando la formación de burbujas. Lugar 10 l de muestra agrupada en el cristal plano óptico de una base de cámara de recuento Makler, y luego colocar la cubierta de vidrio (una vez que la cubierta está en su lugar, evitar levantar o cubrir de nuevo para mantener la propagación uniforme de muestra de esperma). Asegúrese de evitar la formación de burbujas en el interior de la cámara ya que esto daría lugar a un recuento incorrecto.
- Observe bajo un microscopio compuesto (se recomienda el uso de un objetivo 20X). El vidrio de cubierta de la cámara de recuento Makler tiene un gran cuadrada compuesta de 100 cuadrados más pequeños (es decir, un 10 por 10 la red). Contar las células en cualquier franja de 10 plazas. Este número representa su concentración en millones de células / ml. Repetir el recuento en dos tiras de 10-cuadrados adicionales, y calcular el promedio de los tres recuentos NOTA:. Si una cámara de recuento Makler (que está especialmente diseñado para contar las células de esperma) no está disponible, cualquier cámara de hemocitómetro se puede utilizar.
- Ajuste fina de la muestral de concentración de 1x10 7 células / ml en suplementado medio F-10 de Ham. Cuando sea necesario, se incuba la muestra a 37 ° C y CO2 al 5% / aire 95% durante 5 horas para promover la capacitación.
2. Fluorescente colorante de carga de Ca 2 + mediciones
Hay varios colorantes fluorescentes disponibles para medir la concentración intracelular de Ca 2 +; el apropiado debe ser seleccionado de acuerdo a su Kd, y sus longitudes de onda de emisión y excitación (para mediciones cualitativas y cuantitativas, de emisión y excitación de longitudes de onda individuales y dobles, respectivamente, debe ser utilizado) más información). Para la aplicación cualitativa presente utilizamos Fluo-3 AM, un tinte celular permeable con una K d = 325 nM, y la única emisión y excitación de longitud de onda de 506/526 nm, respectivamente 12.
- Preparar 50 l de un 1 mM de Fluo-3 a.m. solución madre disolviendo el contenido de un vial de 50 mg de colorante (PM = 1.130 g / mol) en 44 l de DMSO anhidro.
- El uso de un tubo de microcentrífuga de 1,5 ml mezclar el volumen requerido de suspensión de esperma (ver cantidad requerida para cada técnica específica a continuación) con suficiente 1 mM de Fluo-3 a.m. solución madre para obtener una concentración final de 2 mM de Fluo-3 AM (es decir, 1 l de Stock Fluo-3 AM se agrega por cada 500 l de suspensión de espermatozoides).
- Incubar durante 30 min a 37 ° C y protegido de la luz.
- Centrifugar el tubo a 750 xg durante 5 min utilizando una microcentrífuga, aspirar y descartar el sobrenadante, y resuspender el sedimento en el volumen apropiado (véase la concentración requerida para cada técnica específica por debajo) de esperma humano medio (HSM; mM: 120 NaCl, 15 NaHCO3 , 4 KCl, CaCl2 1,8, MgCl2 1, HEPES 10, 10 Na lactato, 5 D-glucosa, 1 piruvato de Na, pH = 7,4) NOTA: La formación de una nube en lugar de una pastilla indica que las células están en buenas condiciones.
- Las células se cargan ahora con el colorante, sino que siguen siendo viables (mantenido a 37 ° C y protegido de la luz) durante aproximadamente dos horas, y se pueden utilizar en cualquiera de las siguientes técnicas.
3. Técnica # 1. Fluorometría convencional (Información Promedio de una gran población de células)
Equipos: para nuestra población de espermatozoides [Ca 2 +] i mediciones que utilizamos un espectrofluorómetro Aminco SLM operado por el software Olis (Bogart, GA, EE.UU.) con control de agitador magnético (SIM Aminco) y acoplado a un LED azul (LED Star LXHL- LB3C, desde LUMILEDS) y un filtro de 465 a 505 nm de paso de banda (Chroma Technology Corp.) para Fluo-03 a.m. excitación. El LED es controlado por una fuente de alimentación a la medida (700 mA). Emisión de luz se mide mediante el establecimiento de la longitud de onda de emisión (λ Em) a 525 nm en el monocromador de espectrofluorómetro.
- Lugar 570 l de HSM y 30 l de suspensión de células de esperma (previamente cargada con Fluo-3 AM y se resuspendieron en HSM para obtener 1x10 8 células / ml) en un tubo de vidrio de fondo plano (ID 8 x 50 mm). Coloque una barra de agitación magnética en el interior del tubo e insertar el tubo en la cámara de la lectura de la espectrofluorómetro (precalentado a 37 ° C), agitar la muestra durante todo el tiempo de la adquisición.
- Iniciar el experimento usando el software del equipo (software de Olis en este caso) y proceder a la adquisición de los valores de fluorescencia a una frecuencia de 0,5 Hz durante 300 seg. Aplicar los compuestos de ensayo deseados por inyección del volumen apropiado de una solución stock (generalmente 100X más concentrada que la concentración final deseada) utilizando una jeringa Hamilton de micro-de la siguiente manera:
- Adquirir fluorescencia basal de 30 seg.
- Agregar 4 mM progesterona (Pg).
- En 100 seg añadir ionomicina 20 mM (como un control positivo, para obtener el valor máximo de fluorescencia).
- Ejecutar un control negativo mediante la repetición de los pasos 3.1 a 3.2.3, pero en lugar de la adición de Pg sólo el disolvente utilizado para disolverlo (HSM con 0,01% de DMSO anhidro).
- Exportación de valores de intensidad de fluorescencia de crudo a Microsoft Excel y normalizar utilizando la siguiente ecuación: (f/f0) - 1. Donde F es la intensidad de fluorescencia medido en un momento dado (t), y F0 es la fluorescencia basal media tomada durante la inicial de 30 seg. Trazar la serie total de (f/f0) - 1 valores en función del tiempo (Figura 2A). Medir la diferencia entre los valores de intensidad de fluorescencia antes y después de la adición de los compuestos de ensayo (Df), colócalas en un gráfico de barras y procesar los datos que aplican los métodos de análisis estadísticos apropiados (Figura 2B).
4. Técnica # 2. Detenido Flow Fluorometría (Información con alta resolución temporal de una gran población de células)
Equipamiento: intracelular [Ca 2 +] cambios se miden con alta resolución temporal con un SFM-20-mezclador de flujo detenido junto a un rápido sistema óptico MOS-200 cinética, tanto de instrumentos científicos biológicos (Grenoble, Francia). Todos los datos se analizaron con el software de Bio-Kine32 de la misma compañía.
- Establecer las condiciones apropiadas en el equipo; la fuente de iluminación debe estar encendido por lo menos 15 min antes de iniciar el experimento; ajustar filtros de excitación y emisión, ajustar el fotomultiplicador a un valor de voltaje dentro del rango establecido por el fabricante de flujo detenido, y establecer la temperatura del baño a 37 ° C.
- Llenar una de las jeringas del instrumento con 1 ml de Fluo-3 AM células de esperma-cargados (1X10 7 células / ml) y la segunda jeringa con 1 ml del compuesto a ensayar, ya sea de HSM (control negativo),10 ionomicina mu M (control positivo) o 10 Pg mM disuelto en HSM Nota:. En este paso es crucial para evitar la formación de burbujas mientras que la elaboración de los líquidos en las jeringas.
- Levante ambos pistones instrumento hasta que toquen la punta de los émbolos de la jeringa.
- Ajuste el caudal al valor mínimo que proporcionará una respuesta medible con el fin de minimizar el daño celular. La velocidad de flujo se utiliza en el sistema de SFM-20 es de 1 ml / seg 13.
- Ajuste la frecuencia (en este caso 10 ms) y el tiempo total de muestreo (en este caso 50 seg).
- Desencadenar la mezcla de reactivos NOTA:. Si bien un solo gatillo a la vez se puede hacer de forma manual, un conjunto de disparadores automáticos consecutivos puede ser pre-programado así.
- La traza de la fluorescencia prima (unidades arbitrarias) frente al tiempo se muestra en la pantalla del ordenador.
- La mezcla de reactivos per se va a generar una traza que no es una línea recta. Por lo tanto, con el fin de obtener el real [Ca2 +] cambio derivado de un estímulo, la traza de control obtenido a partir de células de mezcla con medio (control negativo) se debe restar de cada una de las huellas experimentales. Analizar los datos según sea necesario; algunos parámetros de la cinética también se pueden obtener con el software de adquisición de Bio-Kine32. Rastros primas sin sustracción se muestran en la Figura 1 complementario para la comparación.
- Para cambiar el reactivo en la jeringa compuesto de ensayo, limpiarlo a fondo con agua destilada. A continuación, llenar la jeringa a su volumen máximo con agua destilada, colocarlo en el pistón correspondiente del fluorómetro de flujo detenido y empujar el agua a través del mecanismo interno (el agua de enjuague debe ser dirigida al recipiente de desechos). Repita este paso dos veces más.
- Repetir los pasos 4.2 a 4.9, llenando la segunda jeringa con el siguiente compuesto de ensayo deseada.
- Al final del experimento, enjuagar todo el equipo con agua destilada, drenar completamente el agua de lamangueras internas.
5. Técnica # 3. Citometría de Flujo (Individual Información de células obtenidas a partir de un gran número de células)
Equipo: Esta técnica permite la medición simultánea de varios parámetros en un único momento en el tiempo, pero a diferencia de las técnicas anteriores, no mide los cambios en el tiempo, sino que proporciona los valores de los parámetros en el momento de la medición. Por lo tanto, en lugar de la adición de Pg para activar la respuesta, en este caso se midió intracelular de Ca 2 + niveles en células de esperma antes y después de la inducción de capacitación. Se utilizó un citómetro FACSCanto (Becton Dickinson) y los datos fueron analizados con el software FlowJo (árbol de la estrella 9.3.3).
- Preparar las muestras experimentales en tubos citómetro mediante la colocación de 500 l de suspensión de células (4x10 6 células / ml) por tubo bajo cada condición a ser probado (en este caso, diez condiciones; véase la Tabla 1). Recopilar datos de fluorescencia from 10.000 eventos por muestra.
- Para configurar un experimento que utiliza el software del equipo a:
- Crear una nueva: carpeta, experimento, la muestra y el número de tubos.
- Seleccione los ajustes adecuados para el citómetro de Fluo-3 AM (utilizar FITC-fluoresceína isotiocianato de filtro) y PI (uso PI-yoduro de propidio-filtro).
- Ejecutar los tubos de control sin teñir 1 y 2 en el citómetro. Recoger FSC y SSC de datos para verificar que los valores de umbral son apropiados y para crear la puerta correspondiente con el fin de discriminar los desechos de las células.
- Para crear controles de compensación, ejecute las siguientes muestras de control, la recogida automática de datos y la fluorescencia máxima (PI y los canales FITC) (NOTA: esta tarea se realiza generalmente por el técnico del equipo):
- Células sin teñir (tubos 1 y 2).
- Las células cargadas con Fluo-3 AM (2 M) (tubos 3 y 4).
- Las células muertas (espermatozoides en suspensión en 0,1% de Triton X-100 en HSM durante 10 min a temperatura ambiente)teñidas con PI (1,2 mM PI, es decir, 0,25 l de 2,4 mM de PI se añadió a 500 l de suspensión de esperma) durante 30 min a 37 ° C, protegido de la luz (tubos 5 y 6).- Ver datos registrados y seleccione la entrada de las poblaciones deseadas.
- Ajuste la puerta y seleccione "Aplicar" para todos los controles de compensación.
- Seleccione experimento> Configuración de compensación> calcular la indemnización.
- Cambiar el nombre de la configuración de la compensación y el enlace y guardar.
- Ejecutar todos los tubos experimentales (en este caso, los tubos de 7-10). Al final, la exportación de todos los datos en el software disponible para el análisis (véase el paso 5.6).
- Analizar los resultados de cada experimento utilizando el software del equipo, el software FlowJo disponible en el mercado o el software libre Cytobank ( http://www.cytobank.org/ ).
6. Técnica # 4. Soltero imágenes de células (Individual Información de celular con alta resolución espacial)
Equipamiento:. Imágenes a la medida puesta a Nuestra imagen de configuración se compone de un invertido Nikon Diaphot 300 microscopio equipado con un controlador de temperatura (Medical System Corp., Greenvale, NY), una Nikon PlanApo 60X (1,4 NA inmersión en aceite) objetivo. Iluminación fluorescente es proporcionada por una Luxeon V Estrella Lambertian Cian LED part # LXHL-LE5C (Lumileds Lighting LLC, San Jose, CA) unido a una caja de control estroboscópico medida. El LED se monta en un conjunto FlashCube40 con espejo dicroico M40-DC400 (Rapp Opto Electrónica, Hamburgo, Alemania) (anchos de banda: 450 a 490 nm de excitación, espejo dicroico 505 nm y de emisión de 520 a 560 nm). La producción de luz se sincroniza con la señal de salida de exposición de una cámara CCD Snap fresco a través de la caja de control para producir un solo destello de duración 2 ms por la exposición individual. El tiempo de exposición de la cámara se fijó equivalente a la duración del flash (2 mseg). Las imágenes se recogieron cada 250 mseg (o pueden ser ajustados de acuerdo conla resolución temporal deseada) utilizando el software IQ (Andor Bioimagen, Wilmington, NC).
- Preparar cubreobjetos redondos (diámetro = 25 mm) mediante la aplicación de una gota 5-l de solución de poli-L-lisina (0,01% w / v) en el centro. Deje reposar por lo menos 1 hora (puede secar). Utilizando una botella con atomizador enjuague zona tratada con agua antes de su uso. Este procedimiento permitirá que las células de esperma a que se adhieran a la hoja de la cubierta de su cabeza, mientras que su flagelo todavía puede moverse.
- Preparar los compuestos a ensayar por disolución en HSM acuerdo con la Tabla 2. Los compuestos se añaden secuencialmente en la misma cámara de registro, asegurándose de añadir siempre el mismo volumen, y para ajustar la concentración de la solución madre teniendo en cuenta la dilución que tendrá cuando se mezcla con el volumen ya presente en la cámara (como se indica en Tabla 2). Mantenga todas las soluciones de ensayo en un baño a 37 ° C hasta su utilización.
- Montar la hoja de la cubierta interior de la recording cámara y el lugar 10 l de Fluo-3 AM células cargadas (1 x 10 7 células / ml) en el centro. Cubra las células con 200 l de pre-calentado HSM.
- Coloque la cámara sobre la platina del microscopio previamente calentado a 37 ° C, ver las células (usando contraste de fase) y seleccionar un área para la formación de imágenes. Es importante seleccionar un área en la densidad celular es adecuado (vea la Figura 5), demasiadas células hacen análisis difícil debido a las señales superpuestas NOTA: Las celdas deben estar firmemente unidos a la hoja de la cubierta de la cabeza sino que exhibe el movimiento flagelar, lo que confirma. viabilidad.
- Adquirir imágenes de fluorescencia en modo directo para ajustar el enfoque y el brillo.
- Iniciar el experimento mediante la activación del software de adquisición de imágenes de series de tiempo (IQ en este caso). Típicamente cuatro imágenes se adquieren por segundo con la iluminación de 2 mseg por imagen.
- Utilice una micropipeta para añadir cuidadosamente (gota a gota) el compuesto de ensayo (Pg en este caso), continuar imagadquisición e como se requiere y llevar a cabo dos adiciones secuenciales de control en la misma cámara de: (1) ionomicina 20 mM para obtener la fluorescencia máxima y (2) 5 mM de MnCl2 para obtener la fluorescencia mínima. Alternativamente, los compuestos se pueden añadir usando una cámara de perfusión que ofrece las ventajas de que permite la eliminación de estímulo, y la capacidad para bañarse uniformemente las células con el compuesto. Al mismo tiempo, tiene las desventajas de requerir grandes cantidades de solución, y de toma de control de la temperatura más problemática.
- Repita la adquisición de una nueva cámara con cada compuesto de ensayo deseada.
- Realizar análisis de imágenes en línea utilizando el software del equipo, o fuera de línea usando software IQ o imagen J freeware. Dibuje las regiones de interés (ROIs) alrededor de cada celda (o parte de la célula) y también seleccionar una zona libre de células (para el fondo automático de la resta por el software). Una serie intensidad-tiempo de la fluorescencia se obtiene entonces para cada ROI y estos datos may puede exportar a Microsoft Excel para su posterior análisis. Se normalizan los valores de intensidad de fluorescencia utilizando la siguiente ecuación: (f/f0) - 1. Donde F es la intensidad de fluorescencia medido en un momento dado (t) y F0 es la fluorescencia media tomada durante la inicial de 30 seg. Trazar la serie total de (f/f0) - 1 en función del tiempo (Figura 5B). Los valores también se pueden normalizar usando el valor de fluorescencia obtenido después de la adición de ionomicina como 100%.
- Análisis de imágenes puede alternativamente llevarse a cabo utilizando Image J software libre.
Técnica # 1. Fluorometría convencional
La progesterona es uno de los inductores conocido AR y, como se esperaba, lo hace provocar un transitorio [Ca2 +] i aumento en el esperma humano (que se muestra en la Figura 2). La adición de un ionóforo de calcio (ionomicina) hace que el máximo [Ca 2 +] i aumento, que no vuelve a los niveles basales.
Técnica # 2. SFluorometría Flow rematada
La progesterona inducida por [Ca2 +] i aumento se midió como antes (fluorometría convencional), pero esta vez con una mayor resolución temporal, en este caso la frecuencia de adquisición fue de 0,1 Hz. Como se muestra en la Figura 3, tanto la progesterona (transitoria línea, rojo) y ionomicina (línea sostenida, azul) causaron una muy rápida [Ca2 +] i aumento. La ausencia de un retraso en el aumento de la progesterona inducida [Ca 2 +] i es consistente con informes anteriores que sugieren que la progesterona activa directamente la Ca 2 + canales CatSper, sin señalización intermedio 10,14.
Técnica # 3. Citometría de Flujo
[Ca 2 +] i se midió capacitados y no capacitados esperma humano. Como se informó anteriormente en el ratón 15, el esperma bovino 16 y esperma humano 17, también se observó un aumento [Ca 2 +] i en el capacitado en comparación con el esperma humano no capacitado. Baldi, et al. (1991) 17 informó superior basal [Ca 2 +] i en capacitada que en el esperma humano no capacitado usando fluorometría convencional. En este trabajo se utilizó la citometría de flujo para medir la [Ca 2 +] i antes y después de la capacitación in vitro. La citometría de flujo nos permite ver que la distribución de los valores de fluorescencia para espermatozoides capacitados (Figura 4D, traza azul) se desplaza a valores más altos en comparación con los espermatozoides no capacitados (Figura 4D, trazo rojo). Los valores de fluorescencia para cada célula individual se pueden observar en los gráficos de puntos de dos dimensiones que se muestran en la Figura 4G; importante, la señal que surge de las células muertas (15% aproximadamente) puede ser eliminado (Figura 4G, cuadrantes superiores).
Técnica # 4. Soltero imágenes de células
La progesterona-inducird [Ca 2 +] i el cambio se mide en células individuales de esperma. Además progesterona provoca un aumento de [Ca 2 +] i, tanto en la cabeza del espermatozoide y en el flagelo. Como se observa en experimentos de población, el análisis de células individuales reveló un transitorio y un aumento sostenido de la progesterona y ionomicina, respectivamente.
Resultados
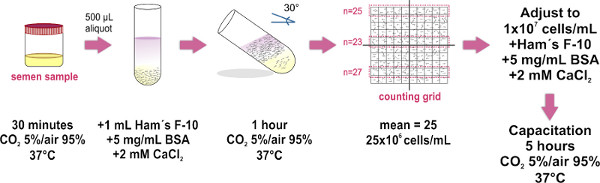
Figura 1. Diagrama esquemático del protocolo experimental para la preparación de la muestra de esperma por el método de la piscina. Los pasos principales para la separación de espermatozoides móviles y para el ajuste de su concentración se ilustran. La última etapa de incubación sólo se realiza cuando se requie...
Discusión
Señalización intracelular es vital para la mayoría de las actividades celulares; Ca 2 + es un mensajero ubicuo que acompaña a las células de mamíferos a lo largo de toda su vida útil, desde su origen en la fecundación, hasta el final de su ciclo de vida. En respuesta a diferentes estímulos, [Ca 2 +] i, oscila aumenta y disminuye con codificación espacio-temporal, en consecuencia, se activan diversos procesos, moduladas o terminado por Ca 2 + mensajes codificados. Intracelular d...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Los autores agradecen a José Luis De la Vega, Erika Melchy y Dr. Takuya Nishigaki de asistencia técnica. Este trabajo fue apoyado por el Consejo Nacional de Ciencia y Tecnología (CONACyT-México) (99.333 y 128.566 para CT), Dirección General de Asuntos del Personal Académico / Universidad Nacional Autónoma de México (IN202212-3 de CT).
Materiales
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Referencias
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados