このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞内Ca測定
要約
細胞内Ca 2 +ダイナミクスは、精子生理学およびCaで非常に重要である 2 +感受性蛍光色素は、それらを研究するための多彩なツールを構成する。集団実験(蛍光法およびフロー蛍光停止)し、単一細胞実験(フローサイトメトリーおよび単一細胞イメージング)は、時空間の[Caを追跡するために使用され 2 +]変化。
要約
精子は、特に、到達認識し、卵と融合するように設計された男性の生殖細胞である。これらのタスクを実行するには、精子細胞は、絶えず変化する環境に直面して、いくつかの物理的な障壁を克服するために準備しなければなりません。転写と翻訳サイレント本質にある、これらの運動性の細胞は自分自身の向きに多様なシグナル伝達機構に深く依存しており、監督のファッションで泳ぎ、そして卵を見つけるために彼らの旅の間に環境条件に挑戦すると競合する。具体的には、Ca 2 +の媒介シグナル伝達は、いくつかの精子の機能のための極めて重要です:運動の活性化能(先体反応のために精子を準備する複雑なプロセス)と、先体反応(精子卵の融合を可能にしますエキソサイトーシスイベント)。このイオンの細胞内変動を追跡するための蛍光色素の使用は、アプリケーション、感度の容易さのために顕著に重要である、とDETの汎用性ECTION。一つの染料ローディングプロトコルを用いて、我々は、精子のCa 2 +動態を監視するために4つの異なる蛍光技術を利用。各手法は、シングルセル及び細胞集団レベルでデータを生成し、空間的および/または時間分解能を可能にする明確な情報を提供する。
概要
のCa 2 +は、真核細胞内シグナル伝達経路の普遍的な二次メッセンジャーである。細胞内Ca 2 +(Ca 2 +のi)は興奮性と非興奮性細胞の両方で多くの基本的な生理的過程の調節に関与する。シグナル伝達事象中のセカンドメッセンジャーとしてのCa 2の重要性と普遍+は、セル内の情報の伝送における時空間汎用性に由来する。のCa 2 + のde novo又は細胞内で分解さ合成することはできないが、その細胞内濃度([Ca 2 +] i)が連続的にバッファ、封鎖、区分化、および/ またはカルシウム2を蓄積するさまざまな細胞機構を介して非常に厳格な限度内に維持される+。このイオンの濃度の変化は、セル1内に高度にローカライズされた地域で発生し、このような変動を解読すると、デを得るために不可欠であることができますEPERのシグナル伝達機構(1)の役割を理解すること、(2)それらの生理的重要性、および細胞シグナル伝達の(3)一般的なメカニズム。のCa 2 +を介するシグナル伝達は、精子生理学2において特に重要である。精子の運動性は、受精の成功のための最も重要な機能の一つであり、実際には、いくつかの精子の運動性の欠陥は不妊3-5を引き起こす可能性があります。のCa 2の重要性+鞭毛運動には長い間、6を認識されてきたが、どのようにのCa 2メカニズムは+鞭毛曲げ特定の形が完全に理解されていない制御します。
卵と融合する前に、精子は能、雌の管の内部の精子の住居に依存する複雑なプロセスを経る必要があります。能中、精子膜の脂質アーキテクチャおよび組織は、主に形質膜からコレステロール除去の結果として、変更される。さらに、いくつかのタンパク質はチロシン蛍光体であるylated 7。重要なことは、受精能の間に細胞内のpHの上昇液(i)との[Ca 2 +] iの 、膜電位はいくつかの種に含ま過分極でもある。能では、精子の集団(20〜40%)で行われのみ、そして、これらすべての細胞の変化に関与するメカニズムは、はるかに明確にしています。これは、一般的に生理的なインダクタにさらされたときに受精能の唯一の集団は先体反応(AR)を受けることが認められている。 ARはまた、(外側と内側の膜と特殊なオルガネラ)先体を所有しているすべての種で受精に必要なCa 2 +の調節イベントです。このプロセス中に精子の形質膜と外側の先体膜ヒューズは、精子細胞は、卵(透明帯、またはZP)を取り囲む糖タンパク質性マトリックスに浸透できるようにする加水分解酵素を放出する。また、ARと相互作用する新規融合精子の細胞表面を露出させる両方の配偶子の最終的な融合のための卵形質膜。 AR、ほとんどのそれらの間研究の一つであるプロゲステロンを誘発するいくつかの細胞リガンドがあります。
本研究で我々は〔Ca 2を測定するフローサイトメトリーを除いてプロゲステロン(によって引き起こされるヒト精子での[Ca 2 +] iの変化を測定するためのCa 2 +感受性蛍光色素の使用を含む四つの異なる手法を提示+ ] i)が 体外受精能プロセスの間に誘導増加。この特定のケースで我々はフルオ-3のAM(ライフテクノロジーズ、グランドアイランド、NY)、K D = 325 nMのと膜透過性染料を使用していましたin vitroでは 、我々は、方法論の3との時間の関数としての蛍光の変化をモニターしたそして第四の技術で我々は時間の単一の特定の時点での蛍光値を測定した。完全にそれらが空間的および時間的解像度を提供するので、これらの異なるアプローチは、互いに補完単一細胞及び細胞集団の両方のレベルでolution。
細胞集団またはバルク実験
彼らは十分に確立され、シンプルであり、単一の実験で細胞の数百万人上で実行される測定からの情報の平均化を可能にするので、彼らが必要とする楽器でも容易に入手可能であるが、あるため、バルクの技術が広範囲にだけ使用されています。
テクニック#1。従来の蛍光測定
この技術は、時間の関数としての蛍光の変化を監視し、実験は、200〜1,000μlに至るまでサンプル量を有するガラスキュベットで行われる。追加された試薬の適切な混合は、磁気攪拌を必要とし、従って、得られた時間分解能は秒のオーダーである。分析されたサンプルの典型的な細胞濃度範囲は、10 5〜10 8細胞/ mlである。
テクニック#2。停止フロー蛍光測定
Tその手法は、時間の関数としての蛍光の変化を監視したが、試薬が急速に非常に少量のサンプルボリューム(25-100μlの範囲)を含有する記録キュベットに(圧力を使用して)一緒に混合する。したがって、試薬の均質化は、ミリ秒のオーダーで高い時間分解能を可能に瞬間的である。得られた蛍光対時間トレースの分析は、分析試料の一般的な細胞濃度の範囲は短命反応中間体等に関する情報を取得し、反応機構の複雑さを解明、反応速度を決定するのに適している10 5〜10 7細胞/ ml。
単一細胞実験
バルク実験は、多数のセルの平均的挙動を報告しているが、人口が頻繁に測定のようなタイプの中に見過ごされている異種の性質を示すことができる。単一セル技術は、このように目を補完するために使用される電子情報は、細胞集団実験で得られた。
テクニック#3。フローサイトメトリー
単一セル測定に起因する情報の重要性にもかかわらず、全人口のセル固有のプロパティの誤外挿を防止するために多数のセルを分析することが重要である。このため、高スループット技術が好まれている、最も一般的な方法は、条件あたり10,000細胞は、従来、分析された、フローサイトメトリーである。それは彼らの大きさ(前方散乱(FSC))、粒度(側方散乱(SSC))と蛍光強度(抗体との特異的標識、生存マーカーなど)に応じて細胞を分類し、この方法では、異種の個体群のマルチパラメトリック分析を可能に、したがって、セルのグループのパラメータ '分布に関する情報を提供する。フローサイトメトリーは、インスタントではなく、時間に依存した情報を提供しています8。前方と側方散乱値AR細胞が含まれていますが、蛍光測定、負と正の蛍光コントロールの細胞破片、ほこりなどを判別ゲートを選択するためにも有用電子も含まれている必要があります。複数の蛍光チャネルが使用される場合、補償として知られている処理(詳細は参照のために実行しなければならないhttp://www.bdbiosciences.com/resources/protocols/setting_compensation.jspを )。補償は、フルオロフォア間のスペクトルの重なり弁別が可能になります。フローサイトメトリーはまた、ヨウ化プロピジウム染色によって一般的に、死細胞の識別を可能にする。
技術#4。単一細胞イメージング
顕微鏡法は、単一の細胞の挙動を研究するための別の一般的な方法であり、それは十分に時間依存性の研究に適しており、それはまた、空間分解能を提供する。主な欠点は、ハイスループット分析は現時点ではまだ揺籃期に唯一であるということですまで。
Access restricted. Please log in or start a trial to view this content.
プロトコル
本稿では、ヒトの精子細胞での[Ca 2 +] iの変化を測定するための4つの前述の技術の使用を報告している。それはよく、このステロイドは、一時の[Ca 2 +] iは精子の増加を生成することを確立されているように我々は、Ca 2 +の反応を誘発するためにプロゲステロンを使用していました。特に、ヒト精子において、プロゲステロンが直接精子細胞10,11の原形質膜においてのみ発現のCa 2 +チャネル(すなわちCatSper)を起動する。また、測定された安静時の[Ca 2 +] iのそれはまた広く増加の[Ca 2 +] iは能間に起こることが認められていることを考えると能前後。を最小限の蛍光値のために、我々は蛍光消光+にMnの2を使って 、正の制御を必要とする技術のために私達は+イオノフォアイオノマイシンするセルに最大限のCa 2 +の取り込みを誘導し、その結果、最大の蛍光応答のCa 2を使用した。
1。スイムアップ法による精子サンプル調製(図1を参照)
(マスターベーションによって得られた)だけ射精サンプルその特性が世界保健機構研究室マニュアル(で入手の最新版によって確立されたパラメータ果たす使用http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf検査のために)人間の精液と処理。
- 37℃インキュベーター内部の滅菌容器と場所、それを(緩めキャップ付き)内側に精液サンプルを入手℃で30分間の間に、Cおよび5%CO 2 /空気の95%に。このステップは、サンプル液化用です。
- 清浄なガラス試験管(1.0×7.5センチ)の底部に液化精液サンプルの代わりに500μlのアリコート。約8試験管平均的なサイズの試料(4 ml)のために必要とされる。
- ハムのF-10培地(SUの慎重層1ミリリットル( 図1を参照)、各精液アリコートの上に)2のCaCl 2および5 in vitroで受精能を促進するためにmg / mlのウシ血清アルブミンとpplemented TIP:マイクロピペットの先端をチューブの壁をタッチして、ゆっくりとスペンスはサンプル上記の培地。 (サンプル及び培地)両方の層の混合は避けなければならないとして、それは徐々にそれを行うことが重要です。
- 慎重に約30°の角度にチューブを傾く。これによりインキュベーション中のサンプルから培地にヒト細胞の変位(スイムアップ)を高め、二液の間の表面積を増加させる。
- 1時間37℃、5%CO 2/95%空気のインキュベーター内部に寄りかかった試験管のグループを配置。
- 大きなボリュームは15ミリリットルを使用するため、マイクロピペットを使用すると、慎重に、単一のきれいなガラス管(1.0×7.5センチに各チューブとプール、収集されたすべてのサンプルからHAMのF-10培地(現運動精子含む)の上限700μLを削除ファルコンチューブ)、バブル形成を回避。場所は10商工会議所の基盤を数えるMaklerの光学平らなガラスの上にプールされた試料を添加した後、(一度カバーが所定の位置にある、持ち上げたり、精子サンプルの均一な広がりを維持するために、再びカバーを避けるため)、カバーガラスを配置。これは不正確な細胞数の結果と同じように室内の気泡の形成を避けるようにしてください。
- 複合顕微鏡(20X目的の使用が推奨される)の下で観察する。 Maklerカウンティングチャンバーのカバーガラスは、100より小さい四角( すなわち 10グリッドで10)で構成される大きな広場があります。 10正方形のいずれかのストリップ内のセルを数える。この数値は、細胞/ mlの何百万の彼らの濃度を表す。二つの追加の10平方ストリップのカウントを繰り返し、三カウントの平均値を計算注:Maklerカウンティングチャンバは(精子細胞をカウントするために特に設計されている)が利用できない場合は、任意の血球チャンバを使用することができる。
- サンプルのFINAを調整補足ハムF-10培地で1×10 7細胞/ mlにlの濃度。必要に応じて、37でサンプルをインキュベート°能を促進するために5時間のためのCおよび5%CO 2 /空気の95%。
2。のCa 2のための蛍光色素の読み込み+測定
細胞内Ca 2 +を測定するために利用可能ないくつかの蛍光色素がありますが、適切なものは、そのK Dに応じて選択する必要があり、その排出量と励起波長は(それぞれ定性的および定量的測定、シングルとダブルの発光と励起波長のため、でなければならない使用される)より多くの情報)。我々はフルオを用いた本質的アプリケーション用-3は、それぞれK D = 325 nMであり、526分の506 nmの単一の放射と励起波長、12細胞透過性染料AM。
- 無水DMSO 44μlの内の1つの50μgの染料バイアル(MW = 1130グラム/モル)の内容を溶解することにより原液AM 1mMのフルオ-350μlのを準備します。
- 1.5 mlのマイクロチューブを使用すると、十分に1 mmの精子懸濁液の必要量(以下、それぞれの特定技術に必要な量を参照)を混ぜるのFluo-3が2μMのFluo-3 AM( すなわち 1μlの最終濃度を得るために、原液AM株式フルオ-3 AM)は、精子懸濁液の各500μlのために添加される。
- 37℃で30分間インキュベートし、光から保護した。
- マイクロを使用して5分間750 xgでチューブを遠心分離、吸引し、上清を捨て、そしてヒト精子の中の適切なボリューム(以下の各特定技術のために必要な濃度を参照してください)(HSMでペレットを再懸濁し、MM:120のNaCl、15 NaHCO 3を 4のKCl、1.8 CaCl 2を、1のMgCl 2、10 HEPES、10のNa、乳酸、D-グルコース5、1ナトリウム、ピルビン酸でpH = 7.4) 注:雲の形成ではなく、ペレット細胞であることを示している良好な状態である。
- 細胞は、現在染料をロードされ、それらは約2時間(37℃で維持し、光から保護)生存したままであり、以下の技術のいずれにも使用することができる。
3。テクニック#1。従来の蛍光測定(大細胞集団からの平均情報)
機器:当社の精子の人口はの[Ca 2 +] iの測定は、我々は磁気攪拌制御(SIM Aminco)でOlisソフトウェアによって運営SLM Amincoの分光(ボガート、ジョージア州、USA)を使用し、青のLED(LuxeonのスターLXHL-に結合LUMILEDSからLB3C、)とのFluo-3のための465から505 nmのバンドパスフィルタ(クロマルネサステクノロジ)が励起AM。 LEDは、特注の電源(7により制御される00ミリアンペア)。放出光は、分光光度計のモノクロメータに525 nmの発光波長(λ エム ) を設定することにより測定される。
- 場所HSMの570μLと平底ガラス管に精子細胞懸濁液(以前のFluo-3 AMにロードされ、1×10 8細胞/ mlを得るために、HSMに再懸濁し)(ID 8×50 mm)の30μlの。チューブ内部の磁気攪拌棒を置き、分光の読書室(37℃に予熱)にチューブを挿入して、すべての収集時間中のサンプルをかき混ぜる。
- 機器のソフトウェア(この場合Olisソフトウェア)を使用して実験を開始し、300秒の間、0.5ヘルツの周波数で蛍光値を取得するために進んでください。次のようにハミルトンマイクロシリンジを用いてストック溶液(所望の最終濃度より一般的には100Xより濃縮)から適切な量の注入により所望の試験化合物を適用する。
- 30秒間基底蛍光を取得する。
- 4μMのプロゲステロン(PG)を追加します。
- 100で秒(陽性対照として、最大蛍光値を得るために)20μMのイオノマイシンを追加します。
- 上記3.2.3に手順3.1を繰り返して、その代わりに、PGの溶媒のみが(0.01%無水DMSOでHSM)それを溶解するために使用される追加することによって負の制御を実行します。
- Microsoft Excelに生の蛍光強度値をエクスポートし、次式使用してそれらを正規化:(F/F0) - 1。ここで、Fは、任意の所与の時間(t)で測定した蛍光強度であり、F0は、初期30秒の間に取られた平均蛍光基底である。 1の値対時間( 図2A) -トータルシリーズ(F/F0)をプロットします。試験化合物(ΔF)を添加する前と後の蛍光強度値の差を測定し、バーグラフ上にプロットし、適切な統計分析方法( 図2B)を適用するデータを処理する。
4。テクニック#2。フローを停止しましたwの蛍光測定(大細胞集団からの高時間分解能での情報)
機器:細胞内の[Ca 2 +]の変更は生物科学器械(グルノーブル、フランス)からMOS-200急速動態光学系に結合SFM-20ストップトフローミキサー、両方を使用して、高い時間分解能で測定されています。すべてのデータは、同じ会社からバイオKine32ソフトウェアを用いて分析されています。
- 機器の適切な条件を設定し、照明光源、実験を開始する前に、少なくとも15分にオンされるべきである、励起および発光フィルタを調整して停止したフローメーカーによって確立範囲内の電圧値に光電子増倍管を調整し、セット37℃浴温℃、
- 、HSMのいずれか(陰性対照)、1フルオ3 AM-ロードされた精子細胞(1×10 7細胞/ ml)の溶液および試験される化合物を1mlと第2のシリンジと、測定器の注射器のいずれかを満たす10μMのイオノマイシン(ポジティブコントロール)またはHSMに溶解した10μMPgの注:このステップでは、それがシリンジに液体を描きながら気泡形成を避けることが重要です。
- 彼らは、シリンジプランジャーの先端に触れるまで両方の計器ピストンを持ち上げます。
- 細胞の損傷を最小限にするために、測定可能な応答を提供する最小値に流量を設定する。我々はSFM-20システムで使用流速は1ml /秒で13である。
- 周波数(この場合は10ミリ秒)と総サンプリング時間(この場合50秒)を設定します。
- 試薬の混 合をトリガ注:一度に単一のトリガが手動で変更することができるが、連続的な自動トリガーのセットは、同様に事前にプログラムされてもよい。
- 生の蛍光(任意単位)対時間のトレースは、コンピュータの画面上に表示される。
- 自体の試薬 の混 合は直線ではないトレースを生成します。そこで、実際の[Caを得た2 +刺激由来]変化、培地(ネガティブコントロール)を混合した細胞から得られた制御トレースは実験トレースの各1から減算する必要があります。必要に応じてデータを分析し、いくつか動態パラメータは、バイオKine32入手ソフトウェアを用いて得てもよい。減算せずに生のトレースは、比較のための補足図1に示されている。
- 試験化合物の注射器に試薬を変更するには、蒸留水で徹底的にそれを一掃する。その後、蒸留水で、その最大のボリュームに注射器を埋めるストップトフロー蛍光光度計の対応するピストンに入れて(水は廃棄物容器に向けられなければならないすすぎ)内部機構を通して水を押してください。さらに2回、この手順を繰り返します。
- 次の所望の試験化合物と第2のシリンジに充填する、手順4.2から4.9を繰り返します。
- 実験の最後に、完全に水を排水から、蒸留水で装置全体をすすぎ内部ホース。
5。テクニック#3。フローサイトメトリー(多数の細胞から得られた単セル情報)
装置:この手法は、時間内の単一の瞬間に複数のパラメータを同時に測定することができますが、以前の手法とは異なり、それは時間をかけて変化を測定するのではなく、それは測定時のパラメータ値を提供します。したがって、代わりに反応を誘発するにPgを追加するので、この場合、我々は、精子の細胞内レベル+前と能を誘導した後、細胞内Ca 2を測定した。我々はFACSCantoサイトメーター(ベクトン·ディッキンソン)とデータがFlowJoソフトウェア(ツリースター9.3.3)を用いて分析した使用。
- 試験される各条件の下で管ごとに細胞懸濁液500μl(4×10 6細胞/ ml)を配置することによって、サイトメーターチューブ内の実験試料を調製し(ここでは、10条件を、表1を参照)。あちこち蛍光データを収集Mサンプルあたり10,000イベント。
- 実験への機器のソフトウェアを使用して設定するには:
- チューブのフォルダ、実験、標本と番号:新しいを作成します。
- フルオ-3 AM(FITC-フルオレセインイソチオシアネートフィルタを使用)とPI(PI-プロピジウムヨウフィルタを使用してください)に適切なサイトメーターの設定を選択します。
- メーター内染色コントロールチューブ1と2を実行します。しきい値の設定が適切であることを確認するために、細胞から残骸を識別するために、対応するゲートを作成するためにFSCとSSCデータを収集します。
- 補償コントロールを作成するには、次のコントロールサンプルを実行し、自動および最大蛍光データ(PIとFITCチャンネル)( 注:このタスクは通常、機器の技術者によって行われて)収集:
- 非染色細胞(試験管1及び2)。
- 細胞はフルオ-3 AM(2μM)(管3および4)でロード。
- 死細胞(精子は、室温で10分間、HSMでトリトンX-100、0.1%懸濁)光(管5および6)から保護℃で、37℃で30分間、PI(2.4 mMのPI すなわち 0.255μlを精子懸濁液500μlに添加される1.2μMPI)で染色した。- 記録されたデータを表示し、目的の集団のためのゲートを選択します。
- ゲートを調整し、すべての補償コントロールへの "適用"を選択します。
- 実験>補償セットアップ>補償を計算]を選択します。
- 補償のセットアップとリンクの名前を変更&保存。
- 全ての実験管を(この場合は、チューブ7-10)を実行します。最後に、(ステップ5.6を参照)分析のために利用可能なソフトウェアにすべてのデータをエクスポートします。
- 機器のソフトウェアは、市販FlowJoソフトウェアまたはCytobank無料ソフトを(使用して、各実験の結果を分析しhttp://www.cytobank.org/ )。
6。技術#4。単一細胞イメージング(高空間分解能を備えた単一のセル情報)
機器:特注イメージングセットアップ当社イメージングセットアップがニコンPlanApo 60X(1.4 NA油浸)、温度調節器(医療システム(株)、グリーンベイル、NY)を搭載した倒立ニコンDiaphot 300顕微鏡で構成されています。客観。蛍光照明はLuxeonのVスターランバートシアンLEDパーツ特注ストロボコントロールボックスに接続されている#LXHL-LE5C(ルミレッズ照明LLCは、サンノゼ、カリフォルニア州)によって提供されます。 LEDは、ダイクロイックミラーM40-DC400(ラップオプトエレクトロニック、ハンブルク、ドイツ():励起450から490 nmで、ダイクロイックミラー505 nmで、発光520から560 nmの帯域幅)でFlashCube40アセンブリに取り付けた。 LEDの出力は、個々のエクスポージャーごとに2ミリ秒期間のシングルフラッシュを生成するコントロールボックスを経由してクールスナップCCDカメラの信号アウト露出に同期されました。カメラの露光時間は、フラッシュ持続時間(2ミリ秒)に相当するとした。画像は、すべての250ミリ秒(収集されまたはに従って調整することができるIQソフトウェア(アンドールバイオイメージング、ウィルミントン、ノースカロライナ州)を用いて、所望の時間分解能)。
- 中央にポリ-L-リジン溶液に5 - 液滴(0.01%w / vの)を印加してラウンドカバースリップ(直径= 25 mm)を準備する。それは、少なくとも1時間(それが乾くことがあります)放置しましょう。噴出ボトルを使用すると、使用前に水で処理面積をすすいでください。彼らの鞭毛はまだ移動できますが、この手順では、精子細胞が自分の頭からカバースリップに固執することができます。
- 表2に従ってHSMでそれらを溶解することによってテストされる化合物を製造する。化合物は、(ように示されているチャンバー内に既に存在するボリュームと混合したときに、それはあります常に同じボリュームを追加するために、と考慮し希釈を考慮原液の濃度を調整することを確認し、同じ記録室に順次追加されます表2)。それらが使用されている°Cまで、37℃でお風呂のすべてのテスト·ソリューションを保つ。
- REC内部カバースリップを組み立てのディング室と場所を10μlのFluo-3の中央にあるAM-ロードされた細胞(1×10 7細胞/ ml)。予め温めておいたHSMを200μlで細胞をカバーしています。
- 37に予熱顕微鏡のステージ上室を置き°C、細胞(位相コントラストを使用して)表示し、イメージングのための領域を選択します。これは、細胞密度が( 図5A参照 )が適切である領域を選択することが重要であり、あまりにも多くの細胞が原因で重複信号を解析を困難にする注:細胞をしっかりヘッドによってカバースリップに取り付けなく確認する鞭毛の動きを示すべきである。生存能力。
- ピントや明るさを調整するためにライブモードで蛍光画像を取得します。
- 時系列画像取得ソフトウェア(ここではIQ)を活性化することにより、実験を開始する。一般的に4つの画像は、画像ごとに2ミリ秒の照射で毎秒取得されています。
- (滴下)慎重に追加するには、マイクロピペットを使用して、試験化合物(この場合PG)、IMAG続ける必要と同じチャンバー内に2つの連続したコントロールの追加を行うなどの電子の買収:最小蛍光を得るために、最大蛍光及び(2)の5mMのMnCl 2を取得するために(1)20μMのイオノマイシン。あるいは、化合物は、刺激の除去、均一化合物で細胞を浴びるすることを可能にするという利点を提供する灌流チャンバーを用いて添加してもよい。同時に、それは溶液の、温度制御がより問題作るより多くの数量を必要とするという欠点を持っている。
- すべての希望する試験化合物と新しいチャンバー内の買収を繰り返します。
- IQソフトウェアまたは画像Jフリーウェアのいずれかを使用して機器のソフトウェア、またはオフラインを使用して画像解析をオンラインで行う。各セルの周囲に関心(ROIを)の領域を描く(またはセルの一部)も無細胞領域(ソフトウェアによる自動バックグラウンド減算)を選択します。時間の蛍光強度シリーズは、各ROIこれらのデータミリアンペアに対して得られるYは、さらなる分析のためにMicrosoft Excelにエクスポートする。 1 - (F/F0):我々は、以下の式を用いて蛍光強度値を正規化する。ここで、fは、任意の時間(t)で測定された蛍光強度であり、F0は、初期の30秒間に取られた平均蛍光です。 1対時間( 図5B) -トータルシリーズ(F/F0)をプロットします。値は、100%とイオノマイシンの添加後に得られた蛍光値を用いて正規化することができる。
- 画像解析は、代替イメージJフリーソフトウェアを用いて行うことができる。
テクニック#1。従来の蛍光測定
プロゲステロンは、予想通り、それは一過性を誘発しない、既知のARデューサーの一つであり、〔Ca 2 +] iは ( 図2に示す)は、ヒトの精子の増加。カルシウムイオノフォアの添加(イオノマイシン)は基底レベルに戻らない最大の[Ca 2 +] iの増加を引き起こす。
テクニック#2。 S突破フロー蛍光測定
プロゲステロン誘発性の[Ca 2 +] iの増加は、(従来の蛍光)以前のように測定されたが、より時間分解能でこの時間でしたが、この場合には、買収の周波数は0.1 Hzであった。 図3に示すように、両方のプロゲステロン(一時、赤線)とイオノマイシンは(持続、青線)は、非常に高速の[Ca 2 +] iの増加を引き起こした。プロゲステロン誘発性の[Ca 2 +] iの増加の遅れがないことは、プロゲステロンが直接中間シグナリング10,14せず、のCa 2 +チャネルCatSperを活性化することを示唆している以前の報告と一致している。
テクニック#3。フローサイトメトリー
〔Ca 2 +] iの能力付与および非ヒト精子受精能を測定した。以前にマウス15、ウシ精子16とヒト精子17に報告されているように、我々はまた、増加した[Cを観察した2 +] iは 、非ヒト精子受精能に比べて能力付与。バルディら (1991)17は、より高い基礎を報告した[Ca 2 +] iの従来の蛍光を使用して非能力付与ヒト精子に比べて能力付与。本研究では[のCa 2 +] iの in vitroでの能で前後に測定するために、フローサイトメトリーを使用していました。フローサイトメトリーは受精能( 図4D、青のトレース)のための蛍光値の分布が非受精能( 図4D、赤のトレース)に比べて高い値にシフトされていることを確認することを可能にします。個々のセルのための蛍光値は、 図4Gに示すように二次元のドットプロットで観察することができ、重要なのは、死んだ細胞(約15%)から生じる信号は( 図4G、上部象限)を排除することができる。
技術#4。単一細胞イメージング
プロゲステロン誘発dは〔Ca 2 +] iの変化は、単一の精子細胞で測定した。プロゲステロンの添加はの増加原因の[Ca 2 +]精子頭部および鞭毛の両方でI。人口実験、単一細胞分析で観察されたように、それぞれ、過渡とプロゲステロンとイオノマイシンための持続的な増加を明らかにした。
Access restricted. Please log in or start a trial to view this content.
結果
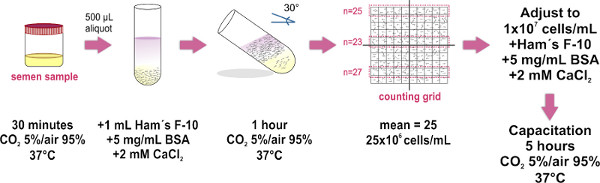
図1。スイムアップ法による精子サンプル調製のための実験プロトコールの概略図。精子の分離およびそれらの濃度を調整するための主要なステップが示されている。能が必要とされるときに最後インキュベーション工程にのみ実行される。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
細胞内シグナル伝達は、ほとんどの細胞の活動のために不可欠であり、Ca 2 +の受精で、その起源から、そのライフサイクルの終わりに、彼らの全体の寿命を通して、哺乳動物細胞に伴うユビキタスメッセンジャーです。別の刺激に応答して、[のCa 2 +] iの増加、発振と時空成文とともに減少、それに応じて、多様なプロセスが起動され、変調された又はCa 2 +でエンコー...
Access restricted. Please log in or start a trial to view this content.
開示事項
我々は、開示することは何もありません。
謝辞
著者は、技術支援のためにホセ·ルイス·デ·ラ·ベガ、エリカMelchy博士拓也西垣に感謝します。 Dirección一般デAsuntosデルパーソナルAcadémico/国立大学自治デ·メヒコ(CTへIN202212-3);この作品はConsejoナシオナルデCiencia YTecnología(CONACyT·メキシコ)(CTに99333と128566)によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
参考文献
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844(2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119(2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved