Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mess-intrazellulären Ca
In diesem Artikel
Zusammenfassung
Intrazelluläre Ca 2 + Dynamik sind sehr wichtig in Spermien Physiologie und Ca 2 + Fluoreszenzfarbstoffe bilden ein vielseitiges Werkzeug, um sie zu studieren. Bevölkerung Experimente (Fluorometrie und gestoppt Flußfluorometrie) und einzelne Zelle Experimente (Durchflusszytometrie und Single-Cell-Imaging) verwendet werden, um räumlich-zeitliche [Ca verfolgen 2 +] Veränderungen im menschlichen Spermien.
Zusammenfassung
Spermien sind männliche Keimzellen speziell entwickelt, um zu erreichen, zu erkennen und verschmelzen mit dem Ei. Um diese Aufgaben zu erfüllen, müssen Spermien bereit, eine sich ständig wandelnden Umfeld zu stellen und mehrere physische Barrieren überwunden werden. Sein Wesen in transkriptionell und translational still, verlassen sich diese bewegliche Zellen zutiefst auf verschiedenen Signal-Mechanismen, sich zu orientieren und schwimmen in einer gerichteten Weise und mit schwierigen Umgebungsbedingungen während ihrer Reise, um das Ei zu finden kämpfen. Insbesondere ist Ca 2 +-vermittelten Signale entscheidend für mehrere Spermien Funktionen: Aktivierung der Motilität, capacitation (ein komplexer Prozess, die Spermien für die Akrosomreaktion bereitet) und der Akrosomreaktion (ein Ereignis, das exozytotische Spermien-Ei-Fusion ermöglicht). Der Einsatz von Fluoreszenzfarbstoffen, um intrazelluläre Schwankungen dieses Ions zu verfolgen ist von bemerkenswerter Bedeutung aufgrund ihrer einfachen Anwendung, Empfindlichkeit und Vielseitigkeit detection. Mit einem einzigen Farbstoff-loading-Protokoll nutzen wir vier verschiedene Techniken, um Spermien fluorometrische Ca 2 + Dynamik überwachen. Jede Technik liefert verschiedene Informationen, die räumliche und / oder zeitliche Auflösung ermöglicht, die Erzeugung von Daten sowohl auf einzelne Zelle und Zellpopulation Ebenen.
Einleitung
Ca 2 + ist ein universelles second messenger von Signaltransduktionswegen in eukaryotischen Zellen. Intrazelluläre Ca 2 + (Ca 2 + i) ist an der Regulation vieler grundlegenden physiologischen Prozesse in beide erregbaren und nicht erregbaren Zellen. Die Bedeutung und die Universalität der Ca 2 + als second messenger während Signaltransduktion von seiner räumlich-zeitlichen Vielseitigkeit bei der Übertragung von Informationen in der Zelle ab. Während Ca 2 + nicht de novo oder abgebaut innerhalb der Zelle, dessen intrazelluläre Konzentration ([Ca2 +] i) synthetisiert werden soll, in sehr engen Grenzen durch unterschiedliche zelluläre Mechanismen, die kontinuierlich Puffer, absondern, zu unterteilen, und / beibehalten oder akkumulieren Ca 2 +. Änderungen in der Konzentration dieses Ions in stark lokalisierten Bereichen innerhalb der Zelle 1 auf, und die Entschlüsselung solcher Schwankungen ist wichtig für die Gewinnung eines deeper Verständnis von (1) ihre Rolle in der Signal-Mechanismus, (2) ihre physiologische Bedeutung, und (3) allgemeine Mechanismen der Zell-Signalisierung. Ca 2 +-vermittelte Signalisierung von besonderer Bedeutung ist in Spermien Physiologie 2. Beweglichkeit der Spermien ist eine der wichtigsten Funktionen für die Befruchtung erfolgreich, und in der Tat, mehrere Spermien-Motilität Defekte können Sterilität 3-5 führen. Die Bedeutung von Ca 2 + in Flagella Bewegung ist seit langem anerkannt 6, jedoch ist der Mechanismus, wie Ca 2 + steuert die spezifische Form Flagella Biegung ist nicht vollständig verstanden.
Vor der Fusion mit dem Ei, müssen Spermien durchlaufen capacitation, ein komplexer Prozess, abhängig von Spermien Wohnsitz innerhalb der weiblichen Trakt. Während capacitation werden die Spermien Membran Lipid Architektur und Organisation geändert, vor allem als Folge von Cholesterin Entnahme aus der Plasmamembran. Darüber hinaus sind mehrere Proteine Tyrosin-Phosphorlierte 7. Wichtig ist, dass während capacitation gibt es eine Zunahme des intrazellulären pH (pH i) und von [Ca 2 +] i, und das Membranpotential hyperpolarisiert in einigen Arten 2. Kapazitation erfolgt nur in einer Subpopulation von Spermien (20-40%), und die Mechanismen in all diesen zellulären Veränderungen beteiligt sind alles andere als klar. Es ist allgemein anerkannt, dass nur eine Subpopulation von kapazitierten Spermien die Akrosomreaktion (AR) zu unterziehen, wenn sie physiologische Induktoren ausgesetzt. Die AR ist auch ein Ca 2 +-regulierten Ereignis für die Befruchtung in allen Arten besitzen ein Akrosom (spezialisierte Organellen mit äußeren und inneren Membranen) erforderlich. Dabei werden die äußeren akrosomalen Membran verschmilzt mit der Spermien Plasmamembran, Freisetzung hydrolytischer Enzyme, die die Samenzelle, die Glyco-Protein-Matrix um das Ei (zona pellucida oder ZP) eindringen können. Die AR macht auch eine neue fusogene Samenzelle Oberfläche, die mit interagiertdas Ei Plasmamembran für die endgültige Verschmelzung beider Keimzellen. Es gibt mehrere zelluläre Liganden darstellt, die AR, Progesteron eine der darunter untersucht induzieren.
In dieser Arbeit haben wir vier verschiedene Techniken, bei denen die Verwendung eines Ca 2 +-sensitiven Fluoreszenzfarbstoff zu messen präsentieren [Ca 2 +] i Veränderungen in menschlichen Spermien durch Progesteron ausgelöst (außer für die Durchflusszytometrie, in denen wir messen die [Ca 2 + ] i erhöhen induziert während der in vitro Kapazitation-Prozess). In diesem speziellen Fall haben wir Fluo-3 AM (Life Technologies, Grand Island, NY), ein membranpermeablen Farbstoff mit einem K d = 325 nM. In vitro wir überwacht Fluoreszenz ändert sich als Funktion der Zeit mit drei der Methoden, und die vierte Technik wir gemessenen Fluoreszenz-Werte bei einem gegebenen Zeitpunkt. Diese unterschiedlichen Ansätze einander ergänzen, da sie insgesamt räumlicher und zeitlicher Auflösung liefernolution sowohl an der einzelnen Zelle und Zell-Population Ebenen.
Handy Bevölkerung oder Bulk-Experimente
Masse Techniken werden ausführlich nicht nur, weil die Instrumente, die sie benötigen leicht verfügbar sind, sondern auch, weil sie einfach, gut etabliert sind und damit für die Mittelung der Daten aus Messungen an Millionen von Zellen in einem einzigen Experiment durchgeführt werden.
Technik # 1. Konventionelle Fluorometrie
Diese Technik überwacht Änderungen in der Fluoreszenz als Funktion der Zeit; die Experimente in Glasküvetten mit Probenvolumina im Bereich von 200 bis 1000 ul durchgeführt. Das Mischen des zugegebenen Reagenzien erfordert Magnetrührstab und damit die zeitliche Auflösung erhalten wird, in der Größenordnung von Sekunden. Die typische Zelle Konzentrationsbereich der untersuchten Proben 10 5 bis 10 8 Zellen / ml.
Technik # 2. Gestoppt Flußfluorometrie
Tseine Technik überwacht auch Veränderungen in der Fluoreszenz als eine Funktion der Zeit, aber die Reagenzien schnell zusammen (durch Druck) in eine Aufnahme Küvette mit einem sehr kleinen Probenvolumen (im Bereich von 25 bis 100 ul) gemischt. Daher ist Homogenisierung Reagenzien unmittelbar, so dass eine hohe zeitliche Auflösung in der Größenordnung von Millisekunden. Analyse der resultierenden Fluoreszenz-Zeit-Spuren sind geeignet für die Bestimmung Reaktionsgeschwindigkeiten, die Aufklärung der Komplexität des Reaktionsmechanismus, Beschaffung von Informationen über kurzlebige Zwischenprodukte der Reaktion usw. Die gemeinsame Zelle Konzentrationsbereich der analysierten Proben ist 10 5 -10 7 Zellen / ml.
Single Cell Experimente
Masse Experimente den Durchschnittswert Verhalten einer großen Anzahl von Zellen, aber eine Population kann häufig eine heterogene einzustellen, die bei dieser Art von Messungen übersehen werden. Einzel-Zell-Techniken werden verwendet, um damit th ergänzene Informationen mit Zellpopulation Experimenten erhalten.
Technik # 3. Durchflusszytometrie
Trotz der Bedeutung der Informationen, die aus einzelnen Zellen Messungen ist es wichtig, eine große Anzahl von Zellen zu analysieren, um die fehlerhafte Extrapolation von Zell-spezifischen Eigenschaften auf eine gesamte Bevölkerung zu verhindern. Aus diesem Grund sind High-Throughput-Techniken begünstigt und die beliebteste Methode ist die Durchflusszytometrie, in denen 10.000 Zellen pro Zustand konventionell analysiert. Dieses Verfahren ermöglicht die multi-parametrische Analyse heterogener Bevölkerungen, wie es Zellen kategorisiert nach ihrer Größe (Vorwärtsstreuung (FSC)), Granularität (side scatter (SSC)) und die Fluoreszenzintensität (spezifische Markierung mit einem Antikörper, der Lebensfähigkeit Marker, etc.) , damit die Informationen über die Parameter 'verteilung für eine Gruppe von Zellen. Durchflusszytometrie bietet sofortigen anstatt zeitabhängige Informationen 8. Vorwärts-und Seitwärts-Streulicht Werte are auch hilfreich bei der Auswahl ein Tor, das Zellen enthält, aber unterscheidet Zelltrümmer, Staub usw. für Fluoreszenzmessungen, negative und positive Kontrollen Fluoreszenz ebenfalls aufzunehmen. Wenn mehr als ein Fluoreszenz-Kanal verwendet wird, muss ein Prozess als Entschädigung bekannt sind, durchgeführt (Details siehe werden http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Compensation ermöglicht spektrale Überlappung Diskriminierung unter Fluorophore. Durchflusszytometrie ermöglicht Diskriminierung von toten Zellen, im allgemeinen mittels Propidiumiodid-Färbung.
Technik # 4. Single Cell Imaging
Mikroskopie ist eine weitere häufige Methode, um einzelne Zelle Verhalten zu studieren, es ist gut für zeitabhängige Studien geeignet und es bietet auch die räumliche Auflösung. Ein großer Nachteil ist, dass High-Throughput-Analyse nur in den Kinderschuhen steckt in der heutigen Zeit 9.
Protokoll
In diesem Beitrag berichten wir über die Verwendung der vier oben genannten Techniken zu messen [Ca 2 +] i Veränderungen im menschlichen Spermien. Wir verwendeten Progesteron einen Ca 2 +-Antwort auslösen, wie es üblich ist, dass dieses Steroid einen transienten [Ca 2 +] i in Spermien erhöhen produziert. Insbesondere in menschlichen Spermien, Progesteron direkt aktiviert einen Ca 2 +-Kanals (nämlich CatSper) ausgedrückt ausschließlich in der Plasmamembran von Samenzellen 10,11. Wir haben auch gemessen Ruhestätte [Ca 2 +] i vor und nach capacitation gegeben, dass es auch allgemein anerkannt, dass eine Erhöhung der [Ca 2 +] i während capacitation auftritt. Für Verfahren, die eine positive Kontrolle verwendeten wir eine Ca 2 +-Ionophor-Ionomycin auf maximale Ca 2 +-Aufnahme in die Zelle zu induzieren, und somit maximale Fluoreszenz Reaktion, für die minimale Fluoreszenz Wert haben wir Mn 2 + zu löschen Fluoreszenz.
1. Sperma Probenvorbereitung von der Swim-up-Methode (siehe Abbildung 1)
Verwenden Sie nur ejakuliert Proben (durch Masturbation gewonnen), deren Merkmale erfüllen die Parameter, die von der neuesten Ausgabe der World Health Organization Laborhandbuch (verfügbar unter etabliert http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) für die Prüfung und Verarbeitung von menschlichen Samen.
- Beziehen Sie das Ejakulat in einem sterilen Behälter und platziere sie (mit gelockerten cap) in einem Brutschrank bei 37 ° C und 5% CO 2/95% Luft während 30 min. Dieser Schritt ist für die Probe Verflüssigung.
- Ort 500 ul Aliquots des verflüssigten Samenprobe auf der Unterseite des sauberen Glasröhrchen (1,0 x 7,5 cm). Etwa acht Reagenzgläser werden für eine durchschnittliche Größe Probe (4 ml) erforderlich.
- Vorsichtig 1 ml Hams F-10 Medium (su. pplemented mit 2 mM CaCl 2 und 5 mg / ml Rinderserumalbumin zu Kapazitation in vitro) auf der jeweils Samen Aliquot fördern (siehe Abbildung 1) TIPP: Tippen Sie auf die Wand des Rohres mit der Spitze der Mikropipette und sanft verzichten das Medium über der Probe. Es ist wichtig, sich langsam zu tun, wie das Mischen der beiden Schichten (Probe und Medium) zu vermeiden.
- Sorgfältig lehnen die Rohre zu einem Winkel von 30 ° etwa. Dies Oberfläche zwischen den beiden Flüssigkeiten zu erhöhen, wodurch die Verschiebung (Bad-up) von menschlichen Zellen aus der Probe zu dem Medium während der Inkubation.
- Legen Sie die Gruppe lehnte Reagenzgläsern innen einem Brutschrank bei 37 ° C und 5% CO 2/95% Luft für 1 Stunde.
- Mit einer Mikropipette vorsichtig die oberen 700 ul HAM F-10-Medium (jetzt mit beweglichen Spermien) aus jedem Röhrchen und Pool alle gesammelten Proben in einem einzigen sauberes Glasröhrchen (1,0 x 7,5 cm, bei größeren Volumina mit einem 15 mlFalcon-Röhrchen), Vermeidung von Blasenbildung. Platz 10 ul Mischprobe auf der optischen Flachglas eines Makler Zählkammer Basis, und legen Sie dann das Deckglas (einmal die Abdeckung in Platz, vermeiden Heben oder Abdeckung erneut, um die gleichmäßige Verteilung der Spermaprobe aufrecht zu erhalten). Achten Sie darauf, um eine Blasenbildung in der Kammer zu vermeiden, da dies zu einer ungenauen Zellzahl führen.
- Beachten Sie bei einem zusammengesetzten Mikroskop (die Verwendung eines 20X Ziel wird empfohlen). Das Deckglas der Makler Zählkammer hat einen großen Platz von 100 kleinere Quadrate (dh 10 bis 10 Raster) zusammen. Zählen Sie die Zellen in einem Streifen von 10 Plätzen. Diese Zahl stellt ihre Konzentration in Millionen von Zellen / ml. Wiederholen Sie die Zählung in zwei weitere 10-Quadratmeter-Streifen, und berechnen Sie den Durchschnitt der drei zählt. HINWEIS: Wenn ein Makler Zählkammer (das ist speziell entwickelt, um Spermien zu zählen) nicht verfügbar ist, jede Hämozytometer Kammer verwendet werden.
- Stellen der Probe final Konzentration bis 1x10 7 Zellen / ml in ergänzt Hams F-10 Medium. Wenn erforderlich, bebrüten die Probe bei 37 ° C und CO 2 5% / 95% für Air 5 h bis capacitation fördern.
2. Fluoreszenzfarbstoffbeladung für Ca 2 + Messungen
Es gibt mehrere Fluoreszenzfarbstoffe für intrazelluläres Ca 2 + zu messen, die geeigneten sind entsprechend ihrer K d ausgewählt werden, und die Emissions-und Anregungswellenlängen (für die qualitative und quantitative Messungen einfach und doppelt Emissions-und Anregungswellenlängen bzw. müssen verwendet) Weitere Informationen). Für die vorliegende qualitative Anwendung, die wir verwendet Fluo-3 Uhr, eine Zelle durchdringenden Farbstoff mit einem K d = 325 nm, und einzelne Emissions-und Anregungswellenlängen 506/526 nm, bzw. 12.
- Bereiten Sie 50 ul einer 1 mM Fluo-03.00 Stammlösung durch Lösen Sie den Inhalt einer Ampulle 50 ug Farbstoff (MW = 1130 g / mol) in 44 ul wasserfreiem DMSO.
- Mit einem 1,5 ml Mikrozentrifugenröhrchen mischen das erforderliche Volumen der Spermien Suspension (siehe benötigte Menge für jede spezifische Technik unten) mit genügend 1 mM Fluo-03.00 Stammlösung zu einer Endkonzentration von 2 uM Fluo-3 AM (dh 1 ul erhalten stock Fluo-3 AM wird für jede 500 ul Spermiensuspension) aufgenommen.
- Inkubation für 30 min bei 37 ° C und vor Licht geschützt.
- Das Röhrchen bei 750 xg für 5 min mit einem Mikrozentrifugengefäß absaugen und den Überstand verwerfen und das Pellet in dem entsprechenden Volumen (siehe erforderliche Konzentration für jede spezifische Technik unten) von menschlichen Spermien Medium (HSM; mM: 120 NaCl, 15 NaHCO 3 , 4 KCl, 1,8 CaCl 2, 1 MgCl 2, 10 HEPES, 10 Na-Lactat, 5 D-Glucose, 1 Na-Pyruvat, pH = 7.4) HINWEIS: Die Bildung einer Wolke anstatt ein Pellet zeigt an, dass die Zellen in gutem Zustand.
- Die Zellen werden nun mit dem Farbstoff beladen, sie lebensfähig bleiben (gehalten bei 37 ° C und vor Licht geschützt) für etwa zwei Stunden, und kann in einer der folgenden Techniken verwendet werden.
3. Technik # 1. Konventionelle Fluorometrie (Durchschnitt von Informationen aus einer Großzellig Bevölkerung)
Ausstattung: Für unsere Spermien Bevölkerung [Ca 2 +] i-Messungen verwenden wir einen SLM Aminco Spektrofluorometer von Olis Software (Bogart, GA, USA) mit Magnetrührer Kontrolle (SIM Aminco) betrieben und mit einem blauen LED (Luxeon Star LXHL- LB3C von LUMILEDS) und 465 bis 505 nm-Bandpassfilter (Chroma Technology Corp) für Fluo-3.00 Anregung. Die LED wird durch einen speziell angefertigten Stromversorgung (7 gesteuert00 mA). Emission Licht wird durch die Einstellung der Emissionswellenlänge (λ Em) bis 525 nm auf der Spektrofluorometer der Monochromator gemessen.
- Platz 570 ul HSM und 30 ul der Spermien Zellsuspension (vorher mit Fluo-3.00 geladen und erneut in HSM bis 1x10 8 Zellen / ml zu erhalten) in einem flachen Boden Glasrohr (ID 8 x 50 mm). Legen Sie einen magnetischen Rührstab im Inneren des Rohres und stecken Sie den Schlauch in die Messkammer des Spektrofluorometer (vorgewärmt auf 37 ° C), rühren die Probe während der ganzen Messzeit.
- Starten Sie das Experiment mit der Ausrüstung der Software (Olis Software in diesem Fall) und fahren Sie mit Fluoreszenz-Werte bei einer Frequenz von 0,5 Hz erwerben während 300 Sekunden. Übernehmen Sie die gewünschten Test-Verbindungen durch Injektion der geeigneten Volumen aus einer Stammlösung (in der Regel 100X stärker konzentriert als die gewünschte Endkonzentration) unter Verwendung eines Mikro-Hamilton Spritze wie folgt:
- Erwerben basale Fluoreszenz für 30 sek.
- In 4 uM Progesteron (Pg).
- Bei 100 sec 20 uM Ionomycin (als positive Kontrolle, um die maximale Fluoreszenz-Wert zu erhalten).
- Führen Sie eine negative Kontrolle durch Wiederholen der Schritte 3.1 bis 3.2.3, aber das Hinzufügen statt Pg nur das Lösungsmittel, um es (HSM mit 0,01% wasserfreien DMSO) auflösen verwendet.
- Exportieren roh Fluoreszenzintensitätswerte zu Microsoft Excel und normalisieren sie mit der folgenden Gleichung: (F/F0) - 1. Wobei F die Fluoreszenz-Intensität zu einem bestimmten Zeitpunkt (t) gemessen und F0 ist die mittlere basale Fluoreszenz während der ersten 30 sec aufgenommen. Zeichnen Sie die gesamte Serie von (F/F0) - 1 Werte gegen die Zeit (Abbildung 2A). Messen der Differenz zwischen der Fluoreszenzintensität Werte vor und nach der Zugabe der Testverbindungen (AF), zeichnen sie auf einem Balkendiagramm und Verarbeitung der Daten der Anwendung der geeigneten statistischen Analysemethoden (2B).
4. Technik # 2. Gestoppt Flow Fluorometrie (Information mit hoher zeitlicher Auflösung von einem Großzellig Bevölkerung)
Ausstattung: Die intrazelluläre [Ca 2 +] Änderungen werden mit hoher zeitlicher Auflösung unter Verwendung eines SFM-20 Stopped-Flow-Mischer, der mit einem MOS-200 schnelle Kinetik optisches System, sowohl von BioLogic wissenschaftliche Instrumente (Grenoble, Frankreich) gemessen. Alle Daten werden mit Bio-Kine32 Software von der gleichen Firma analysiert.
- Legen Sie die entsprechenden Bedingungen in der Anlage, die Lichtquelle sollte auf mindestens 15 Minuten vor Beginn des Experiments eingeschaltet werden; einstellen Anregungs-und Emissions-Filter, Einstellung der Photomultiplier auf eine Spannung innerhalb des Bereichs von der Stopped-Flow-Hersteller gegründet, und setzen die Badtemperatur bei 37 ° C.
- Füllen eines das Instrument Spritzen mit 1 ml von Fluo-3 AM-beladenen Spermien (1x10 7 Zellen / ml) und der zweiten Spritze mit 1 ml der zu testenden Verbindung, entweder HSM (negative Kontrolle),10 uM Ionomycin (positive Kontrolle) oder 10 uM Pg in HSM gelöst. Hinweis: In diesem Schritt ist es von entscheidender Bedeutung, um eine Blasenbildung zu vermeiden während des Zeichnens die Flüssigkeiten in den Spritzen.
- Heben Sie beide Instrument Kolben, bis sie die Spitze der Spritze Kolben berühren.
- Stellen Sie den Durchfluss auf den minimalen Wert, die eine messbare Reaktion zur Verfügung stellt, um Zellschäden zu minimieren. Der Durchfluss verwenden wir in der SFM-20 System ist 1 ml / sec 13.
- Stellen Sie die Frequenz (in diesem Fall 10 ms) und die gesamte Abtastzeit (in diesem Fall 50 sec).
- Auslösen der Vermischung der Reagentien. Hinweis: Während einer einzigen Auslöser zu einer Zeit manuell vorgenommen werden können, eine Reihe von aufeinanderfolgenden automatischen Auslöser können vorprogrammiert werden auch.
- Die Spur der Roh-Fluoreszenz (willkürliche Einheiten) gegen die Zeit wird auf dem Bildschirm angezeigt.
- Das Mischen der Reagenzien an sich erzeugt eine Spur, die nicht eine gerade Linie ist. So, um zu erhalten, die tatsächliche [Ca2 +] Wechsel von einem Stimulus abgeleitet, muss die Steuerung Spur von Mischen Zellen mit Medium (Negativkontrolle), die aus jedem der experimentellen Spuren subtrahiert werden. Analysieren Sie die erforderlichen Daten ein, einige Kinetik Parameter können auch mit dem Bio-Kine32 Erwerb Software erzielt werden. Raw Spuren ohne Subtraktion in Ergänzende Abbildung 1 zum Vergleich gezeigt.
- Um das Reagenz in der Testverbindung Spritze wechseln, reinigen Sie es gründlich mit destilliertem Wasser. Dann füllen Sie die Spritze auf sein maximales Volumen mit destilliertem Wasser, legen Sie sie in den entsprechenden Kolben der Stopped-Flow-Fluorometer und drücken das Wasser durch den internen Mechanismus (das Spülwasser in den Abfallbehälter muss gerichtet werden). Wiederholen Sie diesen Schritt noch zweimal.
- Wiederholen Sie die Schritte 4,2-4,9, Füllen der zweiten Spritze mit dem nächsten gewünschten Testverbindung.
- Am Ende des Experiments, spült das gesamte Gerät mit destilliertem Wasser komplett Ablassen des Wassers aus deminterne Schläuche.
5. Technik # 3. Durchflusszytometrie (Single Cell Informationen aus einer großen Anzahl von Zellen erhalten)
Ausstattung: Diese Technik ermöglicht die gleichzeitige Messung verschiedener Parameter in einem einzigen Augenblick in der Zeit, aber im Gegensatz zu den bisherigen Verfahren, es nicht über die Zeit zu messen, sondern sie stellt die Parameterwerte zum Zeitpunkt der Messung. Daher anstelle der Zugabe Pg, um die Antwort auslösen, in diesem Fall werden wir gemessen intrazellulären Ca 2 +-Spiegel in Spermien vor und nach Induktion capacitation. Wir verwendeten einen FACSCanto Cytometer (Becton Dickinson) und die Daten wurden mit FlowJo Software (Baum Stern 9.3.3) analysiert.
- Bereiten Sie die experimentellen Proben in cytometer Rohre, indem 500 ul Zellsuspension (4x10 6 Zellen / ml) pro Röhrchen unter jeder Bedingung zu prüfen (in diesem Fall zehn Bedingungen, siehe Tabelle 1). Sammle Fluoreszenzdaten from 10.000 Ereignisse pro Probe.
- So richten Sie ein Experiment verwenden die Geräte-Software an:
- Erstellen Sie eine neue: Ordner, experiment, Probe und Anzahl der Rohre.
- Wählen Sie den entsprechenden cytometer Einstellungen für Fluo-3 AM (verwenden FITC-Fluoresceinisothiocyanat-Filter) und PI (PI verwenden-Propidiumiodid-Filter).
- Führen Sie die ungefärbte Kontrolle Rohre 1 und 2 im Durchflusszytometer. Sammle FSC und SSC Daten zu verifizieren, dass Schwellwerteinstellungen angemessen sind und die entsprechenden Gate zu schaffen, um Schmutz aus den Zellen zu unterscheiden.
- Um Entschädigung Steuerelemente erstellen, führen Sie die folgenden Kontrollproben, sammeln auto und maximale Fluoreszenz Daten (PI und FITC Kanäle) (Hinweis: Diese Aufgabe wird in der Regel durch die Ausrüstung der Techniker durchgeführt):
- Ungefärbte Zellen (Röhrchen 1 und 2).
- Zellen mit Fluo-3 AM (2 uM) (Röhrchen 3 und 4) geladen.
- Dead Zellen (Spermien in 0,1% Triton X-100 in HSM ausgesetzt für 10 min bei Raumtemperatur)gefärbt mit PI (1,2 uM PI, dh 0,25 ul 2,4 mM PI ist auf 500 ul der Spermien Suspension) während 30 min bei 37 ° C, vor Licht (Rohre 5 und 6) geschützt.- Aufgezeichneten Daten anzeigen und wählen Sie das Tor für den gewünschten Populationen.
- Passen Sie das Tor und wählen Sie "Apply", um alle Entschädigungsansprüche Steuerelemente.
- Wählen Sie Experiment> Entschädigung Setup> Berechnen Entschädigung.
- Benennen Sie die Entschädigung Setup und Link und sparen.
- Führen Sie alle experimentellen Röhren (in diesem Fall, Rohre 7-10). Am Ende, exportieren Sie alle Daten an die Software zur Analyse zur Verfügung (siehe Schritt 5.6).
- Analysieren Sie die Ergebnisse der einzelnen Experiment mit der Ausrüstung der Software, die im Handel erhältlich FlowJo Software oder Cytobank freie Software ( http://www.cytobank.org/ ).
6. Technik # 4. Single Cell Imaging (Single Cell Informationen mit hoher räumlicher Auflösung)
Ausstattung:. Mass Imaging Set-up Unsere Imaging Set-up ist eines umgekehrten Nikon Diaphot 300 Mikroskop mit einem Temperaturregler (Medical System Corp, Greenvale, NY), ein Nikon PlanApo 60X (1.4 NA Öl-Immersion) ausgestattet zusammengesetzt Ziel. Fluoreszenz Beleuchtung wird durch eine Luxeon V Star Lambertian Cyan LED part # LXHL-LE5C (Lumileds Lighting LLC, San Jose, CA), die an einem speziell angefertigten Stroboskop Schaltkasten zur Verfügung gestellt. Die LED wurde in eine FlashCube40 Montage mit dichroitischen Spiegel M40-DC400 (Rapp Opto Electronic, Hamburg, Deutschland) (: Anregung 450-490 nm, dichroitische Spiegel 505 nm und Emission 520-560 nm Bandbreiten) montiert. LED-Ausgang wurde die Belichtung Signal von einem Cool-Snap-CCD-Kamera über den Regler an einen einzigen Blitz von 2 ms Dauer pro einzelnen Exposition hervorrufen synchronisiert. Die Belichtungszeit der Kamera eingestellt wurde gleichbedeutend mit der Blitzdauer (2 ms). Bilder werden alle 250 ms (gesammelt oder können nach eingestellt werdendie gewünschte zeitliche Auflösung) mit IQ-Software (Andor Bioimaging, Wilmington, NC).
- Bereiten Runde Deckgläser (Durchmesser = 25 mm) durch Anlegen einer 5-ul Tropfen von Poly-L-Lysin-Lösung (0,01% w / v) in der Mitte. Lassen Sie es für mindestens 1 Stunde (es kann trocken) stehen. Mit einer Spritzflasche spülen behandelte Fläche vor Gebrauch mit Wasser. Dieses Verfahren ermöglicht es Spermien zu dem Deckglas aus ihrem Kopf halten, während ihre Geißel noch bewegen kann.
- Herstellung der Verbindungen durch Lösen in HSM gemäß Tabelle 2 geprüft werden. Die Verbindungen werden nacheinander in der gleichen Aufnahme Kammer aufgenommen, achten Sie darauf, immer das gleiche Volumen hinzuzufügen, und die Konzentration der Stammlösung unter Berücksichtigung der Verdünnung einstellen müssen, wenn sie mit dem Volumen der bereits in der Kammer (wie in angegeben gemischt Tabelle 2). Bewahren Sie alle Testlösungen in einem Bad bei 37 ° C, bis sie verwendet werden.
- Montieren Sie das Deckglas in der recOrding Kammer und Platz 10 ul Fluo-3 AM-beladenen Zellen (1 x10 7 Zellen / ml) in der Mitte. Decken Sie die Zellen mit 200 ul vorgewärmte HSM.
- Legen Sie die Kammer auf der Bühne des Mikroskops vorgewärmt auf 37 ° C, zeigen Sie die Zellen (mit Phasenkontrast) und wählen Sie einen Bereich für die Bildgebung. Es ist wichtig, einen Bereich, in dem die Zelldichte werden (siehe 5A) auszuwählen, zu viele Zellen zu Analyse schwierig durch überlappende Signale Hinweis: Die Zellen sind fest mit dem Deckglas durch den Kopf befestigt, sondern aufweist Flagella Bewegung, die bestätigt. Lebensfähigkeit.
- Erwerben Fluoreszenz-Aufnahmen im Live-Modus, um den Fokus und die Helligkeit anpassen.
- Beginn des Experiments durch die Aktivierung der Zeitreihen-Bildaufnahme-Software (IQ in diesem Fall). Typischerweise werden vier Bilder pro Sekunde mit Beleuchtung von 2 ms pro Bild erworben.
- Verwenden Sie eine Mikropipette zu vorsichtig (tropfenweise) die Testverbindung (Pg in diesem Fall), weiterhin image Akquisition erforderlich und erfüllen zwei Ablaufsteuerung Zusätze in der gleichen Kammer (1) 20 uM Ionomycin maximale Fluoreszenz zu erhalten, und (2) 5 mM MnCl 2 bis mindestens Fluoreszenz zu erhalten. Alternativ können Verbindungen zugesetzt Verwendung einer Perfusionskammer, die die Vorteile ermöglicht Stimulus Entfernung, und die Fähigkeit, gleichmäßig tauchen die Zellen mit der Verbindung bietet werden. Zur gleichen Zeit, ist es die Nachteile, die größere Mengen von Lösung und machen Temperaturregelung problematischer.
- Wiederholen Übernahme in eine neue Kammer mit jeder gewünschten Testverbindung.
- Führen Bildanalyse online über die Geräte-Software, oder offline entweder IQ Software oder Bild J Freeware. Zeichnen Sie die Regionen von Interesse (ROI) um jede Zelle (oder Teil-Zelle) und auch einen zellfreien Bereich (für automatische Hintergrund-Subtraktion von der Software). Eine Zeit-Fluoreszenzintensität Serie wird dann für jede ROI und diese Daten ma erhalteny nach Microsoft Excel zur weiteren Analyse exportiert werden. Wir normalisieren Fluoreszenzintensitätswerte unter Verwendung der folgenden Gleichung: (F/F0) - 1. Wobei F die Fluoreszenz-Intensität zu einem bestimmten Zeitpunkt (t) gemessen und F0 ist die mittlere Fluoreszenz während der ersten 30 sec aufgenommen. Zeichnen Sie die gesamte Serie von (F/F0) - 1 gegen die Zeit (Abbildung 5B). Die Werte können auch unter Verwendung der normalisierten Fluoreszenz-Wert nach Zugabe Ionomycin als 100% erhalten werden.
- Bildanalyse kann alternativ unter Verwendung von Bild J kostenlose Software werden.
Technik # 1. Konventionelle Fluorometrie
Progesteron ist einer der bekannten AR-Induktoren und, wie erwartet, es macht eine vorübergehende provozieren [Ca 2 +] i in menschlichen Spermien (siehe Abbildung 2) zu erhöhen. Die Zugabe einer Calcium-Ionophor (Ionomycin) bewirkt, dass die maximale [Ca 2 +] i zu erhöhen, die sich nicht auf Basalniveaus zurückkehrt.
Technik # 2. SSpitze Flußfluorometrie
Die Progesteron-induzierten [Ca 2 +] i Anstieg wurde wie zuvor (konventionelle Fluorometrie) gemessen, aber dieses Mal mit größerer zeitlicher Auflösung, in diesem Fall die Frequenz des Erwerbs betrug 0,1 Hz. Wie in Abbildung 3 dargestellt, verursacht sowohl Progesteron (transient, rote Linie) und Ionomycin (sustained, blaue Linie) eine sehr schnelle [Ca 2 +] i zu erhöhen. Das Fehlen einer Verzögerung in der Progesteron-induzierten [Ca 2 +] i Anstieg steht im Einklang mit früheren Berichten darauf hindeutet, dass Progesteron aktiviert direkt die Ca 2 +-Kanal CatSper, ohne Zwischenschritte Signalisierung 10,14.
Technik # 3. Durchflusszytometrie
[Ca 2 +] i wurde in kapazitierten und nicht-menschlichen Spermien kapazitierten gemessen. Wie bereits in der Maus 15, 16 und Rinder Spermien menschlichen Spermien 17 berichtet, haben wir auch beobachtet erhöht [Ca 2 +] i in kapazitierten Vergleich zu Nicht-kapazitierten menschlichen Spermien. Baldi, et al. (1991) 17 berichtet höhere basale [Ca 2 +] i in kapazitierten als bei Nicht-kapazitierten menschlichen Spermien mit herkömmlichen Fluorometrie. In dieser Arbeit, die wir verwendet Durchflusszytometrie auf [Ca 2 +] i vor und nach in vitro Kapazitation messen. Durchflusszytometrie ermöglicht es uns zu sehen, dass die Verteilung der Werte für Fluoreszenz kapazitierten Spermien (4D, blaue Kurve) zu höheren Werten im Vergleich zu nicht-kapazitierten Spermien (4D, rote Kurve) verschoben wird. Die Fluoreszenz-Werte für jede einzelne Zelle in den zweidimensionalen Dot-Plots in 4G gezeigt, beobachtet werden, wichtig, das Signal aus toten Zellen (ca. 15%) kann entfallen (Fig. 4G, oberen Quadranten) werden.
Technik # 4. Single Cell Imaging
Die Progesteron-induzierend [Ca 2 +] i Änderung wurde in einzelne Samenzellen gemessen. Progesteron hinaus bewirkt eine Zunahme von [Ca 2 +] i sowohl Sperma im Kopf und in der Geißel. Wie in Experimenten beobachtet Bevölkerung zeigte einzelne Zelle Analyse eine vorübergehende und eine nachhaltige Steigerung für Progesteron und Ionomycin, beziehungsweise.
Ergebnisse
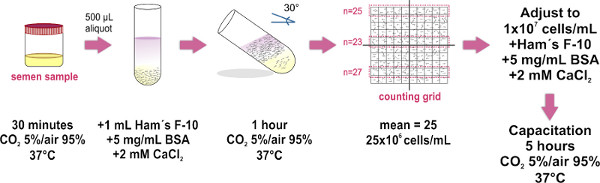
Abbildung 1. Schematische Darstellung des experimentellen Protokolls für die Spermien Probenvorbereitung von der Swim-up-Methode. Die wichtigsten Schritte für die Trennung der beweglichen Spermien und zur Anpassung ihrer Konzentration dargestellt. Der letzte Schritt der Inkubation wird nur durchgeführt, wenn capac...
Diskussion
Intrazelluläre Signalwege ist von entscheidender Bedeutung für die meisten zellulären Aktivitäten; Ca 2 + ist ein allgegenwärtiges Bote, Säugerzellen begleitet während ihrer gesamten Lebensdauer, von ihrem Ursprung bei der Befruchtung, bis zum Ende ihres Lebenszyklus. In Reaktion auf verschiedene Stimuli, [Ca 2 +] i zunimmt, schwingt und nimmt mit raumzeitliche Codierung, dementsprechend, diverse Prozesse aktiviert, moduliert oder terminiert durch Ca 2 +-codierten Nachrichten. Int...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Jose Luis De la Vega, Erika Melchy und Dr. Takuya Nishigaki für technische Unterstützung. Dirección General de Asuntos del Persönliche Académico / Universidad Nacional Autónoma de México (IN202212-3 CT); Diese Arbeit wurde vom Consejo Nacional de Ciencia y Tecnología (CONACyT-Mexiko) (99333 und 128566 zu CT) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Referenzen
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten