JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 내 칼슘 측정
요약
세포 내 칼슘 2 + 역학 정자 생리학 및 캘리포니아에 매우 중요하다 2 + 민감한 형광 염료를 연구하는 다양한 도구를 구성합니다. 인구 실험 (fluorometry 및 흐름 fluorometry 중지) 및 단일 세포 실험 (유동 세포 계측법 및 단일 세포 이미징) 시공간적 [CA를 추적하는 데 사용됩니다 2 +] 변경됩니다.
초록
정자, 특히 도달 인식하고 계란 융합 디자인 남성의 생식 세포 수 있습니다. 이 작업을 수행하려면, 정자 세포는 끊임없이 변화하는 환경에 직면하고 여러 개의 물리적 장벽을 극복 할 준비를해야합니다. transcriptionally 및 translationally 침묵하는 본질이기 때문에, 이러한 운동성이있는 세포는 방향 자체에 다양한 신호 전달 메커니즘에 깊이 의존하고 지시 패션에서 수영을하고, 계란을 찾기 위해 자신의 여행을하는 동안 환경 조건을 도전에 맞설 수 있습니다. 특히 칼슘 2 + - 매개 신호는 여러 정자 기능에 필수적이다 : 운동, capacitation (첨 반응 정자를 준비하는 복잡한 과정)과 첨 반응 (정자 - 난자의 융합을 할 수 exocytotic 이벤트)의 활성화. 이 이온의 세포 내 변화를 추적 할 수있는 형광 염료를 사용하는 응용 프로그램, 감도의 용이성으로 인해 현저한 중요성과 DET의 다양성ection. 하나의 염료 로딩 프로토콜을 사용하여 우리는 정자의 칼슘 2 + 역학을 모니터링하는 네 가지 형광 기술을 사용합니다. 각 기술은 모두 하나의 세포와 세포 인구 수준에서 데이터를 생성, 공간 및 / 또는 시간적 해상도를 가능하게 독특한 정보를 제공합니다.
서문
칼슘 2 + 진핵 세포의 신호 전달 경로의 보편적 인 두 번째 메신저이다. 내 Ca 2 +은 (칼슘 2 + I) 흥분과 비 흥분성 세포 모두에서 많은 근본적인 생리적 인 과정의 조절에 참여하고 있습니다. 칼슘의 중요성과 보편성 + 두번째 메신저와 같은 신호 전달 이벤트 기간 동안은 세포 내에서 정보의 전송에있는 그것의 시공간적 다양성에서 파생됩니다. 칼슘 2 + 드 노보 또는 세포의 세포 내 농도 ([칼슘 2 +] i) 내에서 분해 합성 할 수없는 서로 다른 세포 지속적으로 버퍼, 격리한다는 구획화하는 메커니즘 및 /를 통해 매우 엄격한 한계 내에서 유지되거나 칼슘을 축적하는 동안 +. 이 이온의 농도의 변화는 세포 1 ~ 매우 지역화 된 지역에서 발생하고 그러한 변동을 해독하는 데 확보를 위해 필수적입니다 수 있습니다신호 메커니즘 (1) 자신의 역할, (2) 자신의 생리적 중요성 및 세포 신호 (3) 일반 기계 장치의 EPER 이해. 칼슘 2 + - 매개 신호 정자 생리학이 특히 중요하다. 정자의 운동성은 수정의 성공을 위해 가장 중요한 기능 중 하나이며, 실제로 여러 정자 운동성 결함 불임 3-5가 발생할 수 있습니다. + 편모 운동에 칼슘의 중요성은 긴 6 인식되고 있지만, 칼슘 2 + 편모 굴곡의 특정한 모양을 제어하는 방법의 메커니즘은 완전히 이해되지 않습니다.
계란 융합하기 전에 정자가 capacitation, 여성의 요로 안에 정자 거주지에 따라 복잡한 과정을 거쳐야합니다. capacitation 동안 정자 세포막의 지질 구조와 조직은 주로 세포막에서 콜레스테롤 제거의 결과로 수정됩니다. 또한, 여러 가지 단백질 티로신 형광체 있습니다7 ylated. 중요한 것은, capacitation 동안이 세포 내 pH가 증가 (산도 I)과의 [칼슘 2 +] i를하고 막 잠재력은 어떤 종 2 hyperpolarizes. Capacitation는 정자 (20-40%)의 모집단에서 발생하고, 이러한 모든 세포 변화에 관여하는 메커니즘은 명확 멀리 있습니다. 그것은 일반적으로 생리 인덕터에 노출되었을 때 capacitated 정자 만 모집단이 첨 반응 (AR)을 받아야하는 허용됩니다. AR은 (외부 및 내부 점막과 전문 소기관) 첨을 가진 모든 종에서 수정에 필요한 칼슘 2 + 조절 이벤트입니다. 이 과정에서 정자의 세포막과 외부 acrosomal 막 퓨즈, 정자 세포 달걀 (투명대 또는 ZP)를 둘러싼 글리코 단백질 성 매트릭스에 침투 할 수 있도록 가수 분해 효소를 방출. AR은 또한 상호 작용하는 새로운 fusogenic 정자 세포 표면에 노출두 배우자의 최종 융합 계란 원형질막. AR, 프로게스테론은 가장 그들 가운데 연구 중 하나 인 유도 여러 세포 리간드가 있습니다.
이 작품에서 우리는 측정하는 칼슘 2 +에 민감한 형광 염료의 사용과 관련된 네 가지 기술을 제시 [칼슘 2 +] 나는 황체 호르몬에 의해 트리거 인간의 정자의 변화 (우리는 [칼슘 2 측정하는 유동 세포 계측법을 제외 + ] 내가) 체외 capacitation 프로세스 중에 유도 증가한다. 이 특정한 경우에 우리가 사용하는 플루오을 오전 3시 (생활 기술, 그랜드 아일랜드, NY)와 막 투과성 염료 K D = 325 nm의. 체외에서 우리는 방법 세 가지와 시간의 함수로 형광 변화를 감시, 그리고 네 번째 기술로 우리는 시간에 하나의 주어진 시점에서 형광 값을 측정 하였다. 모두 그들은 공간과 시간적 해상도를 제공 이후 서로 다른 접근 방법은 서로를 보완단일 세포와 세포 인구 수준 모두에서 olution.
세포 인구 또는 대량 실험
그들은 잘 설립, 간단하고, 하나의 실험에서 세포의 수백만에서 수행되는 측정에서 정보의 평균화 수 있기 때문에 그들이 필요로하는 악기도 쉽게 사용할 수 있지만, 때문에 대량 기술이 광범위하게뿐만 아니라 사용됩니다.
기술 # 1. 기존 Fluorometry
이 기술은 시간의 함수로 형광의 변화를 모니터링, 실험은 200 ~ 1,000 μL에 이르기까지 샘플 볼륨이 유리 큐벳에서 수행됩니다. 추가 시약의 적절한 혼합은 자기 교반이 필요하며, 얻어진하므로 시간적 해상도 (초)의 순서입니다. 분석 시료의 전형적인 세포 농도 범위는 10 5 -10 8 세포 / ㎖이다.
기술 # 2. 정지 흐름 Fluorometry
티그의 기술은 또한 시간의 함수로 형광의 변화를 감시하지만, 시약을 매우 작은 샘플 볼륨 (25-100 μL에 이르기까지)를 포함하는 기록 베트로 (사용 압력) 함께 혼합된다. 따라서 시약의 균질화 (밀리 초)의 순서에서 높은 시간적 해상도를 가능하게 순간이다. 결과 형광 대 시간 트레이스의 분석은 분석 시료의 일반적인 세포 농도 범위는 짧은 반응 중간체 등에 대한 정보를 얻는 반응 메커니즘의 복잡성을 해명, 반응 속도를 결정하기에 적합한 10 5 -10 7 세포 / ML.
단일 세포 실험
대량 실험은 세포의 큰 숫자의 평균 행동을보고 있지만, 인구는 자주 측정과 같은 유형의 동안 간과 이종 특성을 보일 수 있습니다. 단일 세포 기술은 따라서 일을 보완하는 데 사용됩니다전자 정보는 세포 인구의 실험을 얻었다.
기술 # 3. 유동 세포 계측법
단일 세포 측정에서 발생하는 정보의 중요성에도 불구하고, 그것은 전체 인구 세포 특정 속성의 잘못된 추정을 방지하기 위해 세포의 큰 숫자를 분석하는 것이 중요합니다. 이러한 이유로, 높은 처리량 기법을 선호하고 가장 인기있는 방법은 조건 10,000 세포가 종래 분석하는, 유동 세포 계측법이다. 그것의 크기 (전방 산란 (FSC)), 단위 (사이드 분산 형 (SSC)) 및 형광 강도 (항체 특정 라벨, 생존 마커 등)에 따라 세포를 분류이 방법은 이기종 인구의 다중 매개 변수 분석을 가능하게 따라서 셀 그룹에 대한 매개 변수 '유통에 대한 정보를 제공한다. 유동 세포 계측법 오히려 시간에 따른 정보 8보다 인스턴트를 제공합니다. 앞으로 측면 산란 값 AR세포를 포함하지만, 형광 측정, 부정과 긍정적 인 형광 컨트롤의 세포 파편, 먼지 등을 차별 게이트를 선택하는 유용 E도 포함되어야합니다. 두 개 이상의 형광 채널을 사용하는 경우, 보상으로 알려진 과정 (자세한 내용은 참조를 위해 수행해야 http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp을 ). 보상 형광체 사이에 스펙트럼 중복 차별 할 수 있습니다. 유동 세포 계측법은의 propidium 요오드 염색에 의해 일반적으로 죽은 세포의 차별을 할 수 있습니다.
기술 # 4. 단일 셀 이미징
현미경 단일 세포의 행동을 연구하는 또 다른 일반적인 방법입니다, 그것은 잘 시간에 따른 연구에 적합하고 또한 공간 해상도를 제공합니다. 주요 단점은 높은 처리량 분석은 현 시점에서 초기 단계에 유일한 것입니다 까지.
프로토콜
본 논문에서는 측정하는 네 앞서 언급 한 기술의 사용보고 [칼슘 2 +] 나는 인간의 정자 세포의 변화.에게 그것은 잘이 스테로이드는 일시적 [칼슘 2 +] 나는 정자의 증가를 생산하는 설립으로 우리는 칼슘 2 + 반응을 유발하는 호르몬을 사용했다. 특히, 인간의 정자에 프로게스테론 직접 정자 세포 10,11의 플라즈마 막에 독점적으로 표현 칼슘 2 + 채널 (즉 CatSper)를 활성화합니다. 우리는 또한 측정 휴식 [칼슘 2 +] 나는 그것은 또한 널리 증가 [칼슘 2 +] 나는 capacitation시 발생하는 허용됩니다 주어진 capacitation 전후.에게 최소 형광 값을 위해, 우리는 형광 해소 +하는 망간 2를 사용하여, 양성 대조군을 필요로하는 기술을 위해 우리는 + 이온 운반체-ionomycin -하는 세포로 최대 칼슘 2 + 흡수를 유도하고, 따라서, 최대한의 형광 반응 칼슘 사용.
1. 스 윔업 방법으로 정자 샘플 준비 (그림 1 참조)
사용은 사정 (자위 행위로 얻은) 샘플을 그 특징 세계 보건기구 실험실 설명서 (에서 사용 가능한 최신 버전으로 설치 매개 변수를 충족 http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf 검사를위한) 인간의 정액 및 처리.
- 37 인큐베이터 내부의 멸균 용기와 장소를 (느슨하게 뚜껑) 안에 정액 샘플을 얻을 ° C와 CO 30 분 동안 2 5 % / 공기 95 %. 이 단계에서는 샘플 액화입니다.
- 깨끗한 유리 시험관 (1.0 X 7.5 cm)의 하단에있는 액화 정액 샘플의 장소 500 μL의 aliquots. 약 8 시험관 평균 크기 샘플 (4 ml)에 필요합니다.
- 햄의 F-10 매체의주의 레이어 1 ML (SU2. mm 인 pplemented (그림 1 참조) 각 정액 나누어지는의 상단에 체외에서 capacitation)을 촉진하기 위해 알부민 염화칼슘 2, 5 MG / ML 혈청 TIP : 마이크로 피펫의 팁 관의 벽을 터치하고 부드럽게 분배 샘플 위의 매체. 그것은 (샘플과 중간) 두 레이어의 혼합으로 피해야한다 천천히 할 중요하다.
- 조심스럽게 약 30 ° 각도로 튜브를 숙이고. 이 때문에 배양시 시료의 중간에 인간 세포의 변위 (윔업)를 강화, 두 액체 사이의 표면적을 증가 할 것이다.
- 1 시간 동안 37 ° C와 5 % CO 2 / 공기 95 %에서 인큐베이터 안에 기댈 테스트 튜브의 그룹을 놓습니다.
- 큰 볼륨은 15 ML을 사용하기 위해, 마이크로 피펫을 사용하여 조심스럽게 한 깨끗한 유리 튜브 (1.0 × 7.5 cm로 각 튜브, 수영장 수집 된 모든 샘플에서 HAM의 F-10 배지 (지금은 운동성이있는 정자 포함)의 상위 700 μl를 제거팔콘 튜브), 거품 형성을 방지. 다음 장소 10 Makler 계산 회의소 자료의 광학 평면 유리에 풀 샘플 μL, 그리고 커버 유리 (한 번 덮개가 제자리에 있고, 올리거나 정자 샘플의 균일 한 확산을 유지하기 위해 다시 덮고 방지)를 배치합니다. 이 부정확 한 세포 수에 될 것 같은 챔버 내부의 거품 형성을 방지해야합니다.
- 복합 현미경 (20X 목적의 사용을 권장합니다)에서 관찰합니다. Makler 카운팅 챔버의 커버 유리 100 작은 사각형 (즉, 10 그리드로 10)으로 구성된 큰 광장이있다. 10 사각형의 스트립에있는 세포를 계산합니다. 이 숫자는 셀 / ML의 수백만에서 자신의 농도를 나타냅니다. 두 개의 추가 10 평방 스트립 카운트를 반복하고 세 개의 계수의 평균 주를 계산합니다. Makler 카운팅 챔버가 (이 특히 정자 세포를 계산하도록 설계되어 있습니다) 사용할 수없는 경우, 모든 혈구 챔버를 사용할 수 있습니다.
- 샘플의 FINA를 조정에 1X10 6 세포 / ML와 L의 농도는 햄의 F-10 중간을 보충. 필요한 경우, 37 샘플을 품어 ° C와 CO capacitation을 촉진하기 위해 5 시간 동안 2 5 % / 공기 95 %.에게
2. 칼슘 형광 염료 로딩 + 측정
내 Ca 2 +을 측정 할 수있는 여러 가지 형광 염료가있다, 적절한 하나의 K D에 따라 선택해야합니다, 그것의 방출 및 여기 파장 (각각 정성 및 정량 측정, 단일 및 이중 방출 및 여기 파장에 대한이어야합니다 사용) 자세한 내용). 본 질적 응용 프로그램을 위해 우리는 플루오로 사용-3, K D = 325 m로 세포 투과 염료, 각각 하나의 방출 및 여기 526분의 506 ㎚의 파장, 자정.
- 50 1 ㎜ ㎕의 플루오 3 개의 50 μg 염료 유리 병의 내용을 용해하여 원액 AM (MW = 1천1백30g / mol)을 무수 DMSO 44 μL합니다. 준비
- 1.5 ML의의 microfuge 튜브를 사용하면 충분히 1 ㎜로 정자 현탁액의 필요한 볼륨 (아래의 각 특정 기술에 필요한 양을 참조) 혼합 플루오 3 2 μM 플루오 오전 3시 (즉, 1 μL의 최종 농도를 얻기 위해 원액 오전 주식 플루오-3 오전 정자 현탁액의 각 500 μL)에 추가됩니다.
- 37 ° C에서 30 분 동안 배양하고 빛으로부터 보호됩니다.
- 의 microcentrifuge를 이용하여 5 분 750 XG에서 튜브를 원심 분리기, 기음과 상층 액을 버리고, 그리고 인간 정자 매체의 적절한 볼륨 (아래의 각 특정 기술에 필요한 농도 참조) (HSM의 펠렛을 resuspend을, MM : 120 염화나트륨 15 NaHCO3를 4 KCl을, 1.8 염화칼슘 2, 1 MgCl 2, 10 HEPES, 10 나 젖산 5 D-포도당, 1 나상욱 피루 베이트, 산도 = 7.4) 참고 : 구름의 형성보다는 펠렛 세포가 있음을 나타냅니다 좋은 상태를 유지하고있다.
- 세포는 이제 염료로로드됩니다, 그들은 약 2 시간 동안 (37 ° C로 유지하고 빛으로부터 보호) 가능한 남아 있고, 다음 기술 중 하나에 사용할 수 있습니다.
3. 기술 # 1. 기존 Fluorometry (큰 세포 인구에서 평균 정보)
장비 : 우리의 정자 인구 [칼슘 2 +] 우리는 자석 교반기 제어 olis 분 소프트웨어 (보가트, GA, USA) (SIM Aminco)에 의해 운영하고 블루 LED (을 결합 SLM Aminco의 spectrofluorometer를 사용하여 I 측정 Luxeon의 스타 LXHL- LUMILEDS에서 LB3C)과 플루오 3 465-505 nm의 대역 통과 필터 (채도 기술 공사) 여기하십시오. LED는 맞춤형 전원 공급 장치 (7에 의해 제어됩니다00mA). 방출 빛 spectrofluorometer의 단색에 525 nm의 방출 파장 (λ 엠)를 설정하여 측정됩니다.
- 장소 HSM의 570 μL와 평면 바닥 유리 튜브 정자 세포 현탁액의 30 μl를 (이전 플루오 오전 3시에로드 1X10 8 셀 / ML을 얻기 위해 HSM에 재 부유) (ID 8 × 50 ㎜). 튜브 안쪽에 자석 교반 막대를 놓고 spectrofluorometer의 읽기 챔버 (37 ° C로 예열)에 튜브를 삽입, 모든 인수 시간 동안 샘플을 저어.
- 장비의 소프트웨어 (이 경우 olis 분 소프트웨어)를 사용하여 실험을 시작하고 300 초 동안 0.5 Hz의 주파수에서 형광 값을 얻기 위해 계속합니다. 다음과 같이 해밀턴 마이크로 주사기를 사용하여 원액 (원하는 최종 농도보다 일반적으로 100 배 이상 농축)에서 적절한 양을 주입하여 원하는 시험 물질을 적용합니다 :
- 30 초 동안 기초 형광을 획득. 4 μM 프로게스테론 (대학원)를 추가합니다.
- 100 초 (양성 대조군으로, 최대 형광 값을 얻기 위해) 20 μM의 ionomycin을 추가합니다.
- 위의 3.2.3 단계 3.1를 반복하는 대신 대학원 만 용매 (0.01 % 무수 DMSO와 HSM)을 용해하는 데 추가하여 음성 대조군을 실행합니다.
- Microsoft Excel로 원시 형광 강도 값을 내보내기 및 다음 식 사용하여 정규화 : (F/F0) - 1. F는 주어진 시간 (t)에서 측정 된 형광 강도이며, F0는 초기 30 초 동안 찍은 평균 기초 형광입니다. 1 값 대 시간 (그림 2A) - 총 시리즈 (F/F0)을 플롯. 시험 화합물 (ΔF)의 추가 전후의 형광 강도 값 사이의 차이를 측정, 막대 그래프를 플롯하고 적절한 통계 분석 방법 (그림 2B)를 적용하여 데이터를 처리합니다.
4. 기술 # 2. 플로 중지W Fluorometry (큰 세포 인구에서 높은 시간적 해상도를 가진 정보)
장비 : 세포 내 [칼슘 2 +] 변화는 생물 학적 과학 기기 (그르노블, 프랑스)에서 MOS-200 빠른 반응 속도 광학 시스템에 결합 SFM-20 정지 - 흐름 믹서를 모두 사용하여 높은 시간적 해상도로 측정됩니다. 모든 데이터가 같은 회사에서 바이오 Kine32 소프트웨어로 분석됩니다.
- 장비의 적절한 조건을 설정, 조명 소스는 실험을 시작하기 전에 적어도 15 분 켜야한다, 여기 및 방출 필터를 조정 중지 흐름 제조 업체에 의해 설립 된 범위 내의 전압 값으로 광전자 증을 조정하고, 설정 37 목욕 온도 ° C.
- , HSM도 (대조군), 1 플루오-3 AM-로드 정자 세포 (1X10 6 세포 / ML)의 mL를 테스트 할 화합물 1 mL로 두 번째 주사기 기기의 주사기 중 하나를 입력합니다10 μM의 ionomycin (양성 대조군) 또는 HSM에 녹여 10 μM의 대학원. 주 :이 단계는 주사기로 액체를 그리는 동안 거품 형성을 방지하기 위해 매우 중요합니다.
- 그들은 주사기 플런저의 끝 부분에 닿을 때까지 두 악기 피스톤을 들어 올립니다.
- 세포 손상을 최소화하기 위해 측정 응답을 제공합니다 최소값으로 유량을 설정합니다. 우리는 SFM-20 시스템에서 사용하는 유량은 1 ML / 초 13이다.
- 주파수 (이 경우 10 밀리 초 단위) 및 총 샘플링 시간 (이 경우 50 초)에 설정합니다.
- . 시약의 혼합주의를 트리거 : 한 번에 하나의 트리거를 수동으로 할 수도 있지만, 자동 연속 트리거 세트는뿐만 아니라 사전에 프로그래밍 할 수 있습니다.
- 원시 형광 (임의의 단위) 대 시간의 흔적은 컴퓨터 화면에 표시됩니다.
- 자체 시약의 혼합은 직선이 아닌 추적을 생성합니다. 따라서 순서대로 실제 [CA를 얻을 수2 + 자극에서 유래] 변화, 매체 (음성 대조군)과 혼합 세포에서 얻은 제어 추적이 실험 흔적 각에서 차감해야합니다. 필요에 따라 데이터를 분석, 일부 동역학 매개 변수는 바이오 Kine32 수집 소프트웨어를 얻을 수 있습니다. 뺄셈이없는 원시 추적은 비교를위한 보충 그림 1에 표시됩니다.
- 시험 화합물 주사기에 시약을 변경하려면, 증류수로 철저하게 청소. 다음 증류수를 최대 볼륨으로 주사기를 작성하여 중지 흐름 형광의 해당 피스톤에 배치하고 내부 메커니즘 (물이 폐기물 용기로 전달해야 린스)를 통해 물을 밀어 넣습니다. 두 번 더이 단계를 반복합니다.
- 다음 원하는 시험 화합물로 두 번째 주사기를 채우는 단계 4.2-4.9를 반복합니다.
- 실험의 끝에 완전히에서 물을 배수 증류수로 전체 장비를 씻어내부 호스.
5. 기술 # 3. 유동 세포 계측법 (세포의 큰 숫자에서 얻은 단일 셀 정보)
장비 :이 기술은 시간을 한 순간에 여러 매개 변수를 동시에 측정 할 수 있지만, 기존 기술과는 달리, 그것은 시간이 지남에 따라 변화를 측정하지 않고 오히려 그것을 측정시에 매개 변수 값을 제공합니다. 따라서, 대신이 경우에는 응답을 트리거 대학원을 추가하는 우리는 정자 세포에서 + 레벨 전에 capacitation를 유도 한 후 세포 내 칼슘을 측정 하였다. 우리는 FACSCanto cytometer에 (벡톤 디킨슨)를 사용하고 데이터는 FlowJo 소프트웨어 (트리 스타 9.3.3)로 분석 하였다.
- 테스트 할 각 조건에서 튜브 당 세포 현탁액 500 μL (4X10 6 세포 / ㎖)을 배치하여 cytometer의 튜브에 실험 샘플을 준비합니다 (이 경우, 열 조건, 표 1 참조). 이리저리 형광 데이터를 수집샘플 당 m 10,000.
- 실험에 장비 소프트웨어를 사용 설정하려면 :
- 새를 만듭니다 폴더, 실험, 시료 및 튜브의 수입니다.
- 적절한 cytometer에 설정을 선택 플루오 오전 3시 (이소 티오 시아 네이트 필터 FITC-형광 사용) 및 PI (요오드 필터 PI-propidium의 사용).
- cytometer에있는 흠 제어 튜브 1과 2를 실행합니다. 임계 값 설정이 적절한 지 확인하고 세포 파편을 구별하기 위해 해당 게이트를 만들 FSC와 SSC 데이터를 수집합니다.
- 보정 컨트롤을 만들려면 다음 컨트롤 샘플을 실행, 자동 및 최대 형광 데이터 (PI와 FITC 채널) (참고 :이 작업은 일반적으로 장비의 기술자가 수행됩니다) 수집 :
- 흠 세포 (튜브 1과 2).
- 세포 플루오 오전 3시 (2 μM) (관 3, 4)와 함께로드합니다.
- 죽은 세포 (정자는 실온에서 10 분 동안 HSM 0.1 % 트리톤 X-100를 일시 중단)37 라이트 (관 5와 6)에서 보호 ° C, 30 분 동안, PI (즉, 2.4 mM의 PI 0.25 μL가 정자 현탁액 500 μL에 추가됩니다 1.2 μM PI)로 염색.- 기록 된 데이터를 확인하고 원하는 인구의 문을 선택합니다.
- 게이트를 조정하고 모든 보상 컨트롤에 "적용"을 선택합니다.
- 실험> 보정 설정> 보정 계산을 선택합니다.
- 보상 설정 및 링크 및 저장의 이름을 바꿉니다.
- 모든 실험 튜브 (이 경우, 튜브 7-10)를 실행합니다. 끝에서 (단계 5.6 참조) 분석에 사용할 수있는 소프트웨어에 대한 모든 데이터를 내보낼 수 있습니다.
- 장비의 소프트웨어를 상업적으로 이용 가능한 FlowJo 소프트웨어 또는 Cytobank 무료 소프트웨어 (사용하여 각 실험의 결과를 분석 http://www.cytobank.org/ ).
6. 기술 # 4. 단일 셀 이미징 (높은 공간 해상도를 가진 단일 셀 정보)
장비 :. 사용자 정의 내장 된 이미징 셋업 우리의 영상 셋업은 온도 조절기 (의료 시스템 주식 회사, 그린 베일, NY), 니콘 PlanApo 60X (1.4 NA 기름 침지)가 장착 반전 니콘 Diaphot 300 현미경으로 구성되어 있습니다 목적. 형광 조명은 Luxeon의 V 스타 산란 방사 청록색 LED 부품 맞춤형 스트로보 스코프 컨트롤 박스에 연결 # LXHL-LE5C (루 밀레 즈 조명 LLC, 산호세, CA)에 의해 제공됩니다. LED는 이색 성 거울 M40-DC400 (RAPP 옵토 전자, 함부르크, 독일) (: 여기 450-490 nm의 이색 거울 505 nm의 및 배출 520-560 nm의 대역폭)를 FlashCube40 어셈블리에 장착되었다. LED 출력은 개별 노출 당 2 밀리 초 기간의 단일 플래시를 생산하는 컨트롤 박스를 통해 멋진 스냅 CCD 카메라의 출력 신호 노출에 동기화되었습니다. 카메라의 노출 시간은 플래시 지속 시간 (2 밀리 초)에 해당 설정되었습니다. 이미지는 모든 250 밀리 초 (수집하거나에 따라 조정될 수 있습니다IQ 소프트웨어 (도르 바이오 이미징, 윌 밍턴, 노스 캐롤라이나)를 사용하여 원하는 시간 해상도).
- 센터에 폴리-L-라이신 솔루션의 5 μL 드롭 (0.01 % W / V)를 적용하여 라운드 커버 전표 (직경 = 25mm)를 준비합니다. 그것은 적어도 1 시간 (말리기 수 있습니다) 동안 서 보자. 물총 병을 사용하면 사용하기 전에 물 치료 부위를 씻어. 자신의 편모는 여전히 이동할 수 있지만이 절차는 정자 세포가 자신의 머리에서 커버 슬립을 준수 할 수 있습니다.
- 표 2에 따라 HSM에서 그들을 용해하여 테스트 할 화합물을 준비합니다. 화합물 (로 표시된 챔버에 이미 볼륨과 혼합 때해야합니다 항상 동일한 볼륨을 추가하고, 고려 희석 복용 원액의 농도를 조정합니다 확인하고, 동일한 기록 챔버에 순차적으로 추가됩니다 표 2). 그들이 사용하는 ° C까지 37 화장실에서 모든 테스트 솔루션을 유지한다.
- REC 안쪽에 커버 슬립을 조립의 ording 지 챔버와 장소 10 μL 플루오 3 센터 AM-로드 셀 (1 배 7 세포 / ㎖). 미리 예열 HSM의 200 μL와 세포를 포함한다.
- 37 예열 현미경의 무대에 챔버를 놓고 ° C, 세포를 (위상 콘트라스트를 사용하여)보고 이미징 영역을 선택합니다. 그것은 세포 밀도는 (그림 5A 참조) 적절한 영역을 선택하는 것이 중요합니다, 너무 많은 세포로 인해 중복 신호 분석을 어렵게 참고 : 세포는 단단히 머리에 의해 커버 슬립에 연결 만 확인 편모 운동을 전시한다. 생존.
- 초점과 밝기를 조정하는 라이브 모드에서 형광 이미지를 획득.
- 시계열 이미지 수집 소프트웨어 (이 경우 IQ)를 활성화하여 실험을 시작합니다. 일반적으로 네 개의 이미지는 이미지 당 2 밀리의 조명 초당 획득됩니다.
- (드롭 현명한)주의 추가 마이크로 피펫을 사용하여 시험 화합물 (이 경우 대학원), IMAG 계속전자 취득해야하고 같은 방에 두 개의 연속 제어 추가를 수행 할 때 : (1) 20 μM의 ionomycin 최대 형광을 얻기 위해 (2) MnCl 2 5 MM은 최소한의 형광을 얻을 수 있습니다. 또한, 화합물은 자극 제거, 균일 화합물로 세포를 목욕을 할 수있는 능력을 가능하게하는 장점을 제공 재관류 챔버를 사용하여 추가 할 수 있습니다. 동시에, 그것은 솔루션의 큰 수량을 요구하는 단점을 가지고 있고, 온도 제어가 더 문제가 만드는 않습니다.
- 원하는 모든 시험 화합물의 새로운 챔버에 인수를 반복합니다.
- IQ 소프트웨어 또는 이미지 J 프리웨어를 사용하여 장비의 소프트웨어 또는 오프라인을 사용하여 이미지 분석을 온라인으로 수행 할 수 있습니다. 각 셀 (또는 셀의 일부) 주변 관심 (로아)의 영역을 그리기도 셀이없는 영역 (자동 배경 감산을위한 소프트웨어에 의해)을 선택합니다. 시간 형광 강도 시리즈는 다음 각 ROI와 이러한 데이터 mA에 대한 얻을 수있다Y는 추가 분석을 위해 Microsoft Excel로 내보낼 수. - 1 (F/F0) : 우리는 다음 방정식을 사용하여 형광 강도 값을 정상화. F는 주어진 시간 (t)에서 측정 된 형광 강도이며 F0는 초기 30 초 동안 찍은 평균 형광이다. 1 대 시간 (그림 5B) - 총 시리즈 (F/F0)을 플롯. 값은 100 %로 ionomycin 첨가 한 후 얻은 형광 값을 사용하여 정규화 할 수 있습니다.
- 이미지 분석 또는 이미지 J 무료 소프트웨어를 사용하여 수행 할 수 있습니다.
기술 # 1. 기존 Fluorometry
황체 호르몬은 예상대로, 그것은 일시적인을 자극한다, 알려진 AR 유도 중 하나입니다 [칼슘 2 +] 나는 인간의 정자 (그림 2)에서 증가한다. 칼슘 이온 운반체 (ionomycin)의 추가가 최대의 원인 [칼슘 2 +] 기저 수준으로 반환하지 않습니다 나 증가.
기술 # 2. 에스얹어 흐름 Fluorometry
프로게스테론에 의한 [칼슘 2 +] I의 증가는 (기존 fluorometry) 이전으로 측정하지만, 더 큰 시간적 해상도를 가진이 시간이되었다;이 경우 인수의 주파수는 0.1 Hz에서였다. 그림 3에서와 같이, 두 호르몬 (과도, 빨간색 선)와 ionomycin은 (지속, 파란 선) 매우 빠른 [칼슘 2 +] 나는 증가가 발생했습니다. 황체 호르몬에 의한 [칼슘 2 +] 나는 증가 지연의 부재는 황체 호르몬이 직접 중간 신호 10,14없이 칼슘 2 + 채널 CatSper을 활성화 제안 이전의보고와 일치합니다.
기술 # 3. 유동 세포 계측법
[칼슘 2 +] 나는 capacitated 비 capacitated 인간의 정자에서 측정 하였다. 이전 마우스 15, 소 정자 16과 인간의 정자 17 보도 된 바와 같이, 우리는 또한 증가 [C 관찰2 + 비 capacitated 인간의 정자에 비해 capacitated에서] 전. 발디, 외. (1991) 17보고 높은 기저 [칼슘 2 +] 기존 fluorometry를 사용하여 비 capacitated 인간의 정자에 비해 capacitated의 전. 이 작품에서 우리는 내가 전에 체외 capacitation에서 후 [+ 칼슘 2] 측정하기 위해 유동 세포 계측법을 사용했다. 유동 세포 계측법은 capacitated 정자 (그림 4D, 파란 추적)에 대한 형광 값의 분포가 아닌 capacitated 정자 (그림 4D, 레드 트레이스)에 비해 높은 값으로 이동되는 것을보고 우리를 수 있습니다. 각 셀의 형광 값은 그림 4G에 표시된 두 개의 차원 도트 플롯에서 관찰 될 수있다 중요한 것은, 죽은 세포 (약 15 %)에서 발생하는 신호는 (그림 4G의 상단 사분면)을 제거 할 수 있습니다.
기술 # 4. 단일 셀 이미징
황체 호르몬 - 유도D [칼슘 2 +] 나는 변화가 하나의 정자 세포에서 측정 하였다. 황체 호르몬 첨가의 증가 원인 [칼슘 2 +] 정자 머리와 편모의 두 전. 인구 실험에서 관찰로, 단일 세포 분석은 각각 과도과 프로게스테론과 ionomycin에 대한 지속적인 증가를 발표했다.
결과
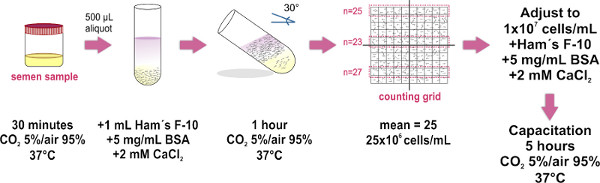
그림 1. 스 윔업 방법으로 정자 샘플 준비를위한 실험 프로토콜입니다. 운동성 정자의 분리와 그 농도 조정을위한 주요 단계의 개략적 인 다이어그램이 설명된다. capacitation이 필요한 경우 마지막 부화 단계는 수행됩니다.
토론
세포 내 신호는 대부분의 세포 활동을 위해 매우 중요합니다, 칼슘 2 + 수명주기의 끝에, 수정의 기원에서 자신의 전체 수명에 걸쳐 포유 동물 세포와 함께 유비쿼터스 메신저이다. 다른 자극에 대한 응답으로, [칼슘 2 +] 나는 증가, 발진 및 시공간적 화와 감소, 따라서, 다양한 프로세스가 활성화됩니다, 변조 또는 칼슘 2 + 인코딩 메시지가 종료되었습니다. 내 Ca 2 +이
공개
우리는 공개 아무것도 없어.
감사의 말
저자는 기술 지원 호세 루이스 드 라 베가, 에리카 Melchy 박사 타쿠야 Nishigaki 감사합니다. Dirección 일반 드 Asuntos 델 개인 Académico / 국립 대학교 AUTONOMA 드 멕시코 (CT에 IN202212-3),이 작품은 Consejo 나시 오날 드 Ciencia Y Tecnología (CONACYT-멕시코) (CT에 99333 및 128566)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
참고문헌
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유