A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת תאיים Ca
In This Article
Summary
תאיים Ca 2 + דינמיקה הן חשובה מאוד בפיזיולוגיה של זרע וCa 2 + רגישים צבעי ניאון מהווים כלי תכליתי ללמוד אותם. ניסויי אוכלוסייה (fluorometry ועצר fluorometry זרימה) וניסויים תא בודדים (cytometry זרימה והדמיה תא יחידה) נמצאים בשימוש כדי לעקוב אחר מרחב ובזמן [Ca 2 +] שינויים בתאי זרע אנושיים.
Abstract
תאי זרע הם תאי הרבייה של גבר שתוכננו במיוחד כדי להגיע אליו, להכיר ופתיל עם הביצה. כדי לבצע משימות אלה, חייבים להיות מוכנים להתמודד עם תאי זרע סביבה משתנה כל הזמן ולהתגבר על כמה מחסומים פיסיים. להיות במהות התעתיק וtranslationally השקט, ניעתי התאים הללו מסתמכים עמוקות על מנגנוני איתות מגוונים להתמצא ולשחות באופן מכוון, ולהתמודד עם תנאי סביבה מאתגר במהלך מסעם למצוא את הביצה. בפרט, Ca 2 + איתות בתיווך היא מרכזית עבור מספר פונקציות זרע: הפעלה של תנועתיות, capacitation (תהליך מורכב שמכין את הזרע לתגובת acrosome) ותגובת acrosome (אירוע exocytotic המאפשר היתוך זרע ביצית). השימוש בצבעי ניאון כדי לעקוב אחר תנודות תאיות של יון זה הוא בעל חשיבות יוצאת דופן בשל קלות יישום, רגישותם, ורבגוניות של Detection. שימוש בפרוטוקול לצבוע טעינה אחת בודד אנו מנצלים ארבע טכניקות שונות כדי לעקוב אחר fluorometric זרע Ca 2 + דינמיקה. כל טכניקה מספקת מידע ייחודי המאפשר רזולוציה מרחבית ו / או זמנית, שהניבו נתונים הן בתא בודד ורמות אוכלוסיית תא.
Introduction
Ca 2 + הוא שליח שני אוניברסלי של מסלולי העברת אותות בתאים אוקריוטים. תאיים Ca 2 + (Ca 2 + I) משתתף בוויסות של תהליכים פיסיולוגיים בסיסיים רבים בתאים גם להתרגש ולא להתרגש. את החשיבות ואת האוניברסליות של Ca 2 + כשליח שני במהלך אירועי העברת אותות נגזרת מרבגוניות מרחב ובזמנה בהעברת המידע בתוך התא. בעוד Ca 2 + לא יכול להיות מסונתז דה נובו או מושפל בתוך התא, הריכוז תאי שלו ([Ca 2 +] i) נשמר בגבולות מאוד נוקשים באמצעות מנגנונים שונים הסלולר כי ברציפות חיץ, לעקל, למדר, ו / או לצבור Ca 2 +. שינויים בריכוז של יון זה יכול להתרחש באזורי נקודתי מאוד בתוך התא 1, ופענוח תנודות כאלה הוא חיוני להשגת דההבנה של ePER (1) תפקידם במנגנון האיתות, (2) המשמעות הפיזיולוגית שלהם, וכן (3) מנגנונים כלליים של איתות תא. Ca 2 + איתות בתיווך היא בעלת חשיבות מיוחדת בזרע פיזיולוגיה 2. תנועתיות זרע היא אחד מתפקידיו החשובים ביותר להצלחת הפריה, ולמעשה, כמה פגמי תנועתיות זרע יכולים לגרום לעקרות 3-5. החשיבות של Ca 2 + בתנועת flagellar כבר זמן רב מוכרת 6, עם זאת, המנגנון של כמה Ca 2 + שולט בצורה מסוימת של flagellar כיפוף אינו מובן במלואו.
לפני שהוא נדבק עם הביצה, הזרע חייב לעבור capacitation, תהליך מורכב תלוי בזרע מגורים בתוך הנקבה בדרכי. במהלך capacitation, אדריכלות השומנים של קרום הזרע והארגון משתנים, בעיקר כתוצאה מהסרת כולסטרול מקרום הפלזמה. בנוסף, כמה חלבונים טירוזין זרחןylated 7. חשוב לציין, במהלך capacitation יש עלייה ברמת חומציות תוך תאית (pH ט) וב[ Ca 2 +] אני, ופוטנציאל הממברנה hyperpolarizes בכמה מינים 2. Capacitation לוקח רק מקום בsubpopulation של זרע (20-40%), ואת המנגנונים המעורבים בכל שינויים התאיים אלה הם רחוקים מלהיות ברורים. הדעה מקובלת היא שרק subpopulation של זרע capacitated לעבור תגובת acrosome (AR) בעת חשיפה לסלילים פיסיולוגיים. AR הוא גם 2 + אירוע מוסדר Ca נדרש להפריה בכל המינים בעלי (אברון מיוחד עם קרומים חיצוניים ופנימיים) acrosome. במהלך תהליך זה את נתיכי הקרום החיצוניים acrosomal עם קרום הפלזמה של תאי הזרע, משחררים אנזימי hydrolytic המאפשרים לתא הזרע לחדור למטריצת Glyco-חלבוניים המקיפה את הביצית (מעטפת שקופה, או ZP). א.ר. גם חושף את פני השטח תא זרע fusogenic חדשים שמקיים אינטראקציה עםקרום הפלזמה הביצה להיתוך הסופי של שני תאי המין. ישנן מספר ligands הסלולרי אשר יגרום להיות AR, פרוגסטרון אחד הכי למד מהם.
בעבודה זו אנו מציגים ארבע טכניקות שונות של השימוש בצבע פלואורסצנטי 2 + רגיש Ca למדוד [Ca 2 +] אני שינויים בזרע אנושי מופעל על ידי פרוגסטרון (פרט לcytometry הזרימה, שבו אנו נמדדים [Ca 2 + ] אני מגדיל מושרה במהלך בתהליך capacitation חוץ גופית). במקרה הספציפי הזה היינו Fluo-3 בבוקר (חיים טכנולוגיות, גרנד איילנד, ניו יורק), צבע קרום חדיר עם K D = 325 ננומטר. במבחנתנו לנטר שינויי הקרינה כפונקציה של זמן עם שלוש מהשיטות, ועם הטכניקה הרביעית מדדנו ערכי הקרינה בנקודה מסוימת אחת בזמן. אלו גישות שונות משלימות זה את זה, שכן הם מספקים לגמרי מיל מרחב ובזמןolution בשניהם תא הבודד ורמות אוכלוסיית תא.
אוכלוסיית תא או ניסויים בתפזורת
טכניקות נמצאות בשימוש נרחב בכמות גדולה לא רק בגלל המכשירים שהם דורשים זמינים, אלא גם משום שהם פשוט, מבוססים היטב, ולאפשר למיצוע של מידע ממדידות שבוצעו על מיליוני תאים בניסוי יחיד.
טכניקת המס '1. Fluorometry הקונבנציונלי
טכניקה זו עוקבת אחר שינויים בקרינה כפונקציה של זמן; הניסויים מבוצעים בcuvettes זכוכית עם כרכי מדגם הנעים בין 200 ל -1,000 μl. ערבוב נכון של חומרים כימיים הוסיפו דורש ערבוב מגנטי, ולכן הפתרון הזמני שהושג הוא בסדר גודל של שניות. טווח ריכוז התא האופייני של הדגימות נותחו הוא 10 -10 5 8 תאים / מ"ל.
טכניקת המס '2. Fluorometry הזרימה נעצר
Tהטכניקה שלו גם מפקחת על שינויים בקרינה כפונקציה של זמן, אבל את ריאגנטים מעורבבים יחד במהירות (תוך שימוש בלחץ) לקובט הקלטה המכיל נפח דגימה קטן מאוד (הנע 25-100 μl). לכן, הומוגניזציה של חומרים כימיים היא מיידית, מה שמאפשר רזולוציה גבוהה זמנית בצו של אלפיות שנייה. ניתוח של עקבות הקרינה כפונקציה של זמן כתוצאה מתאים לקביעת שיעורי תגובה, הבהרת המורכבות של מנגנון התגובה, קבלת מידע על תשומות ביניים תגובה קצרות מועד, ועוד מגוון ריכוז התא המשותף של הדגימות נותחו הוא 10 5 -10 7 תאים / מ"ל.
ניסויי תא בודדים
ניסויים בתפזורת לדווח על ההתנהגות הממוצעת של מספר גדול של תאים, עם זאת, ייתכן שלעתים קרובות אוכלוסייה הטרוגנית תערוכת נכסים שהם התעלמו בסוג כזה של מדידות. טכניקות תא יחידות ובכך ישמשו כדי להשלים את המידע המתקבל בדואר עם ניסויי אוכלוסיית תא.
טכניקת המס '3. הזרימה cytometry
למרות חשיבותו של המידע הנובע ממדידות תא בודדות, חשוב לנתח מספר גדול של תאים על מנת למנוע הניפוח השגוי של נכסי תא ספציפיים לאוכלוסייה שלמה. מסיבה זו, טכניקות תפוקה גבוהה והם העדיפו את השיטה הפופולרית ביותר היא cytometry זרימה, שבו 10,000 תאים למצב מנותחים באופן קונבנציונלי. שיטה זו מאפשרת ניתוח רב פרמטרים של אוכלוסיות הטרוגניות כפי שהוא מסווג תאים על פי גודלם (פיזור קדימה (FSC)), גרעיניות (פיזור צד (SSC)) ועוצמת הקרינה (תיוג ספציפי עם נוגדן, סמן כדאיות, וכו ') , ובכך לספק מידע על ההתפלגות של הפרמטרים עבור קבוצה של תאים. cytometry הזרימה מספק מידע מיידי ולא תלוי זמן 8. קדימה וצד פיזור הערכים ARדואר גם שימושי לבחירת שער הכולל תאים אבל מפלה פסולת הסלולר, אבק, וכו 'לקבלת מדידות הקרינה, פקדי הקרינה שליליים וחיוביים גם חייב להיות כלול. אם נעשה שימוש בקרינת ערוץ אחד או יותר, תהליך המכונה פיצוי חייבת להתבצע (לפרטים ראו http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp). פיצוי מאפשר לאפליה חפיפה בין fluorophores רפאים. cytometry הזרימה גם מאפשר אפליה של תאים מתים, בדרך כלל באמצעות מכתים יודיד propidium.
טכניקת המס '4. הדמיה תא בודד
מיקרוסקופית הוא שיטה נפוצה אחרת כדי ללמוד את התנהגות תא בודד, זה מתאים גם ללימודים תלוי זמן והוא גם מספק רזולוציה מרחבית. חסרון עיקרי הוא שניתוח תפוקה גבוהה הוא רק בחיתוליו בעת הנוכחית 9.
Access restricted. Please log in or start a trial to view this content.
Protocol
במאמר זה אנו מדווחים על השימוש בארבע הטכניקות למדידה הנ"ל [Ca 2 +] אני שינויים בתאי זרע אנושיים. אנחנו השתמשנו פרוגסטרון כדי לעורר Ca 2 + תגובה, כפי שהיא מבוססת היטב כי זה מייצר סטרואידים חולפים [Ca 2 +] אני מגדיל בתאי הזרע. במיוחד, בזרע אנושי, פרוגסטרון ישירות מפעיל Ca 2 + ערוץ (כלומר CatSper) הביע באופן בלעדי בקרום הפלזמה של תאי זרע 10,11. כמו כן, אנו נמדדים במנוחה [Ca 2 +] אני לפני ואחרי capacitation בהתחשב בעובדה שהוא גם מקובל כי עלייה ב[ Ca 2 +] אני מתרחש במהלך capacitation. לטכניקות הדורשות שליטה חיובית השתמשנו Ca 2 + ionophore-ionomycin-לגרום Ca 2 + ספיגה מקסימלי לתוך התא, ובכך, תגובת הקרינה מקסימלי; לערך הקרינה מינימאלי, השתמשנו Mn 2 + כדי להרוות את הקרינה.
1. הכנת דגימת זרע בשיטה ניתן לשחות אליו (ראה איור 1)
השתמש פלטתי רק דגימות (המתקבלות על ידי אוננות) שמאפייניו למלא את הפרמטרים שנקבעו על ידי המהדורה האחרונה של ארגון הבריאות העולמי המעבדה הידנית (זמין בhttp://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf) לבדיקה ועיבוד של זרע אנושי.
- השג את דגימת הזרע בתוך מיכל סטרילי ולמקם אותו (עם כובע משוחרר) בתוך חממה ב 37 ° C ו 5% CO 2/95 אוויר% במהלך 30 דקות. צעד זה הוא לעיבוי מדגם.
- מקום 500 aliquots μl של דגימת הזרע הנוזלי בחלק התחתון של מבחנות זכוכית נקיות (1.0 ס"מ X 7.5). כשמונה מבחנות נדרשות למדגם בגודל ממוצע (4 מ"ל).
- זהירות שכבה 1 מ"ל של המדיום של ווסטהאם F-10 (su. Pplemented עם 2 מ"מ CaCl 2 ו -5 בסרום שור מ"ג / מיליליטר אלבומין לקדם capacitation במבחנה) על גבי כל aliquot זרע (ראה איור 1) טיפ: לגעת בקיר של הצינור עם קצה micropipette, ובעדינות לוותר בינונית מעל המדגם. זה חיוני כדי לעשות את זה לאט כמו הערבוב של שתי השכבות (מדגם ובינוני) יש להימנע.
- להישען בזהירות את הצינורות לזווית של ° 30 כ. זה יגביר את שטח פנים בין שני הנוזלים, ובכך לשפר את העקירה (ניתן לשחות אליו) של תאים אנושיים ממדגם למדיום במהלך דגירה.
- הנח את הקבוצה של מבחנות גחנו פנימה חממה ב 37% 95 מעלות צלזיוס, 5% CO 2 / אוויר במשך שעה 1.
- באמצעות micropipette להסיר בזהירות את μl 700 העליונות של המדיום של HAM-F-10 (החברה המכיל תאי זרע ניעתי) מצינור אחד ובריכת כל הדגימות שנאספו לתוך צינור זכוכית נקי יחידה (1.0 x 7.5 ס"מ; לנפחים גדולים יותר משתמשים ב15 מ"לפלקון צינור), הימנעות מהיווצרות בועה. מקום 10 μl של מדגם נקווה על הזכוכית שטוחה האופטית של בסיס ספירת Makler קאמרי, ולאחר מכן למקם את מכסה הזכוכית (פעם אחת את המכסה נמצא במקומו, יש להימנע מההרמה או כיסוי שוב כדי לשמור את ההתפשטות אחידה של דגימת זרע). לוודא כדי למנוע היווצרות בועה בתוך החדר כמו זה יביא על ספירת תאים לא מדויקת.
- שים לב תחת מיקרוסקופ מתחם (השימוש אובייקטיבי 20X מומלץ). יש מכסה הזכוכית של חדר ספירת Makler כיכר גדולה מורכבת מ100 ריבועים קטנים יותר (כלומר 10 על ידי 10 רשת). ספירת התאים בכל רצועה של 10 ריבועים. מספר זה מייצג את הריכוז שלהם במיליוני תאים / מ"ל. חזור על הספירה בשתי רצועות של 10 מ"ר נוספות, ולחשב את הממוצע של שלוש הספירות. הערה: אם חדר ספירת Makler (אשר תוכנן במיוחד כדי לספור תאי זרע) אינו זמין, ניתן להשתמש בכל חדר hemocytometer.
- התאם של מדגם פינהריכוז ליטר ל1x10 7 תאים / מ"ל בתוספת בינונית של ווסטהאם F-10. בעת צורך, דגירה המדגם על 37 מעלות צלזיוס ו-CO 2/5% אוויר 95% במשך 5 שעות כדי לקדם capacitation.
2. פלורסנט טעינת הצבע לCa 2 + מדידות
ישנם מספר צבעי ניאון זמין למדוד תאיים Ca 2 +; אחד המתאים יש לבחור על פי ד K שלה, ואורכי גל הפליטה ועירור שלו (למדידות איכותיות וכמותיים, אורכי גל פליטה ועירור יחידים וכפולים, בהתאמה, חייבים להיות בשימוש) מידע נוסף). ליישום האיכותי הנוכחי השתמשנו Fluo-3 לפנות הבוקר, לצבוע תאי permeant עם K D = 325 ננומטר, ופליטה בודדת ועירור אורכי גל של 506/526 ננומטר, בהתאמה 12.
- הכן 50 μl של 1 מ"מ Fluo-03:00 פתרון מניות על ידי המסת התוכן של בקבוקון צבע 50 מיקרוגרם אחד (MW = 1130 גרם / מול) ב44 μl של DMSO נטול מים.
- שימוש בצינור 1.5 מיליליטר microfuge לערבב את הנפח הנדרש של השעיה זרע (ראה סכום הנדרש עבור כל טכניקה ספציפית בהמשך) עם מספיק 1 מ"מ Fluo-03:00 פתרון מניות כדי להשיג ריכוז סופי של 2 מיקרומטר Fluo-03:00 (כלומר 1 מתוך μl מניית Fluo-03:00 מתווסף לכל 500 μl של השעיה זרע).
- דגירה במשך 30 דקות ב 37 מעלות צלזיוס ומוגנת מפני אור.
- צנטריפוגה את הצינור ב XG 750 במשך 5 דקות באמצעות microcentrifuge, לשאוב וזורקים supernatant, וresuspend גלולה בהיקף המתאים (ראה ריכוז הנדרש עבור כל טכניקה ספציפית בהמשך) של אדם זרע בינוני (HSM; מ"מ: 120 NaCl, 15 NaHCO 3 , 4 KCl, 1.8 CaCl 2, 1 MgCl 2, 10 HEPES, 10 קטט Na, 5 D-גלוקוז, פירובט Na 1, pH = 7.4) הערה: היווצרותו של ענן ולא גלולה מצביעה על כך שהתאים במצב טוב.
- התאים כעת נטענים עם הצבע, הם נשארים קיימא (שמר על 37 מעלות צלזיוס ומוגנת מפני אור) למשך כשתי שעות, וניתן להשתמש בכל אחת מהטכניקות הבאות.
3. טכניקת המס '1. Fluorometry הקונבנציונלי (מידע ממוצע מאוכלוסייה של תאים גדולים)
ציוד: לזרע האוכלוסייה שלנו [Ca 2 +] אני מדידות אנו משתמשים spectrofluorometer Aminco SLM המופעל על ידי תוכנת Olis (בוגרט, ג'ורג'יה, ארה"ב) עם שליטה מגנטית stirrer (SIM Aminco), ומצמיד את LED הכחול (Luxeon כוכב LXHL- LB3C, מLumileds) וננומטר 465-505 להקה לעבור סינון (Chroma הטכנולוגיה קורפ) לFluo-03:00 עירור. LED נשלט על ידי אספקת חשמל שהותקן (700 MA). אור הפליטה נמדד על ידי קביעת אורך גל הפליטה (λ EM) ל 525 ננומטר על monochromator של spectrofluorometer.
- מקום μl 570 של HSM ו -30 μl של השעיה תא זרע (נטען בעבר עם Fluo-03:00 וresuspended בHSM להשיג 1x10 8 תאים / מ"ל) בשפופרת זכוכית תחתית שטוחה (ID 8 X 50 מ"מ). הנח מגנטי מערבבי הבר בתוך הצינור ולהכניס את הצינור לתוך חדר הקריאה של spectrofluorometer (שחומם מראש ל 37 מעלות צלזיוס), מערבבים המדגם במשך כל זמן הרכישה.
- התחל את הניסוי באמצעות התוכנה של הציוד (תוכנת Olis במקרה זה) ולהמשיך לרכוש ערכי הקרינה בתדר של 0.5 הרץ במהלך 300 שניות. להחיל את תרכובות מבחן הרצויות על ידי הזרקה של הנפח המתאים מפתרון מניות (בדרך כלל 100X מרוכז יותר הריכוז הסופי הרצוי) באמצעות מזרק המילטון מיקרו כדלקמן:
- לרכוש הקרינה בסיסית למשך 30 שניות. הוסף 4 פרוגסטרון מיקרומטר (PG).
- ב -100 שניות להוסיף 20 ionomycin מיקרומטר (כביקורת חיובית, כדי לקבל את ערך הקרינה המקסימאלי).
- להפעיל ביקורת שלילית על ידי חזרה על שלבי 3.1 ל 3.2.3 לעיל, אך הוסיף במקום Pg רק הממס משמש להמסתו (HSM עם 0.01% DMSO נטול מים).
- יצוא ערכי עוצמת הקרינה גלם ל-Microsoft Excel ולנרמל אותם באמצעות המשוואה הבאה: (F/F0) - 1. כאשר F הוא את עוצמת הקרינה שנמדדה בכל זמן נתון (t), וF0 הוא הקרינה הבסיס הממוצעת צולמה במהלך 30 שניות הראשונות. עלילה הסדרה בהיקף הכולל של (F/F0) - ערכי 1 כפונקציה של זמן (איור 2 א). למדוד את ההפרש בין ערכי עוצמת הקרינה לפני ואחרי התוספת של תרכובות הבדיקה (ΔF), להציב אותם בגרף עמודות ולעבד את נתוני יישום שיטות הניתוח הסטטיסטיים המתאימות (איור 2).
4. טכניקת המס '2. הפסיק פלוw fluorometry (מידע עם רזולוציה גבוהה זמנית מאוכלוסיית תאים גדולה)
ציוד: תאיים [Ca 2 +] שינויים נמדדים עם רזולוציה גבוהה זמנית בעזרת מערבל SFM-20 הפסיקה זרימה מצמידים את מערכת אופטית קינטיקה מהירה MOS-200, שניהם ממכשירים מדעיים ביולוגיים (גרנובל, צרפת). כל הנתונים מנותחים עם תוכנה ביו Kine32 מאותה החברה.
- הגדר את התנאים המתאימים בציוד; מקור התאורה צריך להיות מופעל על לפחות 15 דקות לפני תחילת הניסוי; להתאים מסנני עירור ופליטה, להתאים את המכפיל לערך מתח בטווח שהוקם על ידי יצרנית הפסיקה הזרימה, ולהגדיר טמפרטורת האמבטיה ב 37 ° C.
- מלא אחד מהמזרקים של המכשיר עם 1 מ"ל של 3 Fluo תאי זרע בבוקר טעון (1x10 7 תאים / מ"ל) ואת המזרק השני עם 1 מ"ל של המתחם להיבדק, או HSM (ביקורת שלילית),ionomycin 10 מיקרומטר (ביקורת חיובית) או Pg מיקרומטר 10 מומס בHSM. הערה: בשלב זה הוא חיוני, כדי למנוע היווצרות בועה והסקת הנוזלים לתוך המזרקים.
- הרם את שתי בוכנות המכשיר עד שהם נוגעים בקצה של בוכנות המזרק.
- הגדר את קצב הזרימה לערך המינימאלי שיספק מענה למדידה כדי למזער את נזק לתאים. קצב הזרימה אנו משתמשים במערכת SFM-20 הוא 1 מ"ל / 13 שניות.
- הגדר את התדר (במקרה זה 10 אלפיות שני) וזמן הדגימה הכולל (במקרה זה 50 שניות).
- תפעיל את הערה הערבוב של חומרים כימיים:. בעוד הדק אחד בכל פעם יכול להתבצע באופן ידני, סט של גורמים רצופים אוטומטיים יכול להיות מתוכנתים מראש גם כן.
- העקבות של הקרינה גלם (יחידות שרירותיות) לעומת זמן שמוצגת על מסך מחשב.
- הערבוב של חומרים כימיים כשלעצמה יפיק עקבות שלא בקו ישר. לפיכך, על מנת לקבל בפועל [Ca2 +] שינוי נובע מגירוי, עקבות השליטה מתקבלות מתאי ערבוב עם מדיום (בקרה שלילית) חייבת להיות מופחתים מכל אחד מהעקבות הניסיוניות. לנתח את הנתונים כנדרש; כמה פרמטרים קינטיקה גם ניתן לקבל עם תוכנת רכישת Bio-Kine32. עקבות גולמיות ללא חיסור מוצגות באיור 1 משלים להשוואה.
- כדי לשנות את המגיב במזרק מתחם הבדיקה, לנקות אותו ביסודיות עם מים מזוקקים. ואז למלא את המזרק לנפח המרבי שלו עם מים מזוקקים, למקם אותו בבוכנה המקבילה fluorometer הפסיקה הזרימה ולדחוף את המים דרך המנגנון הפנימי (שטיפת מים יש להפנות למכל הפסולת). חזור על פעולה זו עוד פעמיים.
- חזור על שלבים 4.2-4.9, ממלא את המזרק השני עם מתחם הבדיקה הרצויה הבא.
- בסופו של הניסוי, יש לשטוף את כל הציוד במים מזוקקים, ניקוז מים מלחלוטיןצינורות פנימיים.
5. טכניקת המס '3. Cytometry הזרימה (מידע תא יחיד המתקבל ממספר גדול של תאים)
ציוד: טכניקה זו מאפשרת מדידה בו זמנית של מספר פרמטרים ברגע אחד בזמן, אבל בניגוד לטכניקות הקודמות, זה לא למדוד את השינויים לאורך זמן, אלא שהוא מספק את ערכי פרמטרים בעת המדידה. לכן, במקום להוסיף Pg כדי לעורר תגובה, במקרה זה אנו נמדדים תאיים Ca 2 + רמות בתאי זרע לפני ואחרי גרימת capacitation. אנחנו השתמשנו Cytometer FACSCanto (הקיטון דיקינסון) ונותחו נתונים עם תוכנת FlowJo (עץ כוכבים 9.3.3).
- הכן את דגימות ניסוי בצינורות cytometer על ידי הצבת 500 μl של השעיה תא (4x10 6 תאים / מ"ל) לכל צינור מתחת לכל מצב להיבדק (במקרה זה, עשרה תנאים, ראה טבלה 1). איסוף נתונים הקרינה הלוך ושוב10,000 אירועים מ 'לדגימה.
- כדי להגדיר ניסוי להשתמש בתוכנה לציוד:
- יצירה חדש: תיקייה, ניסוי, דגימה ומספר הצינורות.
- בחר את ההגדרות מתאימות לcytometer Fluo-3 בבוקר (להשתמש FITC-העמסת isothiocyanate-מסנן) וצרכן (שימוש PI-Propidium יודיד-מסנן).
- הפעל את צינורות בקרה בלא כתם 1 ו -2 בcytometer. לאסוף FSC וSSC נתונים כדי לוודא שהגדרות סף מתאימות וליצור את השער המקביל כדי להפלות פסולת מהתאים.
- כדי ליצור פקדי פיצויים, הפעל את דגימות הבקרה הבאות, איסוף נתונים אוטומטי וקרינה מרביות (PI וערוצי FITC) (הערה: משימה זו מבוצעת בדרך כלל על ידי הטכנאי של הציוד):
- תאים בלא כתם (צינורות 1 ו -2).
- תאים עמוסים Fluo-3 בבוקר (2 מיקרומטר) (צינורות 3 ו -4).
- תאים מתים (תאי זרע תלוי ב0.1% טריטון X-100 בHSM למשך 10 דקות בטמפרטורת חדר)מוכתם בPI (1.2 מיקרומטר PI, כלומר 0.25 μl של 2.4 מ"מ PI מתווסף ל500 μl של השעיה זרע) במהלך 30 דקות ב 37 מעלות צלזיוס, מוגן מפני אור (צינורות 5 ו -6).- הצג את הנתונים שנרשמו ובחר את השער לאוכלוסיות הרצויות.
- התאם את השער ובחר באפשרות "החל" לכל פקדי הפיצויים.
- בחר ניסוי> הגדרת פיצוי> חישוב פיצויים.
- שנה את שם התקנת פיצוי והקישור ולשמור.
- להפעיל את כל הצינורות הניסיוניים (במקרה זה, צינורות 7-10). בסופו של הדבר, לייצא את כל הנתונים לתוכנה זמינה לניתוח (ראה שלב 5.6).
- לנתח את התוצאות של כל ניסוי באמצעות תוכנה של הציוד, תוכנת FlowJo זמינה מסחרי או תוכנה החופשית Cytobank (http://www.cytobank.org/).
6. טכניקת המס '4. הדמיה תא בודד (פרטים בתא אחד עם רזולוציה מרחבית גבוהה)
ציוד:. הותקן הדמיה הגדרת ההדמיה ההגדרה שלנו מורכבת ממיקרוסקופ 300 ההפוך ניקון Diaphot מצויד בבקר טמפרטורה (רפואה מערכת קורפ, Greenvale, ניו יורק), ניקון PlanApo 60x (NA 1.4 טבילת שמן) אובייקטיבי. תאורת הקרינה מסופקת על ידי חלק Luxeon V כוכב Lambertian ציאן LED # LXHL-LE5C (Lumileds התאורה LLC, סן חוזה, קליפורניה) המצורף לקופסא שליטת stroboscopic שהותקן. הנורית הייתה רכוב להרכבת FlashCube40 עם מראה dichroic M40-DC400 (ראפ Opto אלקטרוני, המבורג, גרמניה) (פס: עירור 450-490 ננומטר, 505 ננומטר, ומראה dichroic ננומטר פליטה 520-560). פלט LED היה מסונכרן לחשיפה מתוך אות של מצלמת CCD הצמד מגניב דרך תיבת הבקרה כדי לייצר פלאש יחיד של אלפיות שני 2 לכל משך חשיפת פרט. זמן חשיפת המצלמה נקבע שווה ערך לתקופת הבזק (2 אלפיות השנייה). תמונות נאספות כל 250 אלפיות שנייה (או יכולה להיות מותאם על פיהרזולוציה של זמן הרצוי) באמצעות תוכנת IQ (אנדור bioimaging, ווילמינגטון, צפון קרוליינה).
- הכן את התלושים לכסות עגולים (קוטר 25 מ"מ =) על ידי יישום ירידה של 5 μl של פתרון פולי-L-ליזין (0.01% w / v) במרכז. תן לו לעמוד במשך שעה לפחות 1 (זה עלול לייבש). שימוש בבקבוק להשפריץ לשטוף אזור מטופל במים לפני השימוש. הליך זה יאפשר לתאי זרע לדבוק להחליק את המכסה מהראש שלהם, ואילו השוטון שלהם עדיין יכול לזוז.
- הכן את התרכובות שנבדקו על ידי המסתם בHSM לפי טבלה 2. תרכובות נוספות ברצף באותו חדר הקלטה, והקפד תמיד להוסיף באותו הנפח, ולהתאים את הריכוז של פתרון המניות תוך לקיחה בחשבון את הדילול זה יהיה בשילוב עם הנפח כבר נמצא בתא (כפי שמצוין ב טבלת 2). כל פתרונות הבדיקה לשמור באמבט על 37 מעלות צלזיוס עד שהם משמשים.
- הרכב את הכיסוי להחליק בתוך recציוד הרפואי והמדעי קאמרי והמקום 10 μl של Fluo-3 תאים AM-טעונים (1 תאי 7 / מ"ל x10) במרכז. לכסות את התאים עם 200 μl של HSM המחומם מראש.
- מניחים את החדר על הבמה של מיקרוסקופ שחומם מראש ל -37 מעלות צלזיוס, להציג את התאים (באמצעות לעומת שלב) ובחר אזור להדמיה. חשוב לבחור באזור שבו צפיפות תאים מתאימה (ראה איור 5 א); תאים רבים מדי לבצע ניתוח קשה בשל אותות חופפים הערה: תאים צריכים להיות מחובר ללהחליק את המכסה בחוזקה על ידי הראש שלהם, אבל מפגין תנועת flagellar, אשר מאשרת. כדאיות.
- לרכוש תמונות הקרינה במצב חי להתאים את המיקוד ואת הבהירות.
- התחל את הניסוי על ידי הפעלת תוכנת רכישת תמונה בזמן סדרה (IQ במקרה זה). בדרך כלל ארבע תמונות נרכשות לשנייה עם תאורה של 2 אלפיות שני לכל תמונה.
- השתמש micropipette להוסיף בזהירות (טיפה חכמה) מתחם הבדיקה (Pg במקרה זה), ימשיך מתאר לעצמירכישת דואר כנדרש ולבצע בקרה רציפות שתי תוספות לאותו תא: (1) 20 מיקרומטר ionomycin להשיג הקרינה המרבית ו( 2) 5 מ"מ MnCl 2 להשיג הקרינה מינימאלית. לחלופין, ניתן להוסיף תרכובות באמצעות תא זלוף המציע את היתרונות של מה שמאפשר הסרת גירוי, והיכולת לרחוץ את התאים באופן אחיד עם המתחם. במקביל, יש לזה את החסרונות של דורש כמויות גדולות יותר של פתרון, ומה שהופך את השליטה בטמפרטורה של יותר בעייתית.
- חזור על רכישה בתא חדש עם כל מתחם בדיקה רצויה.
- לבצע ניתוח תמונה באינטרנט באמצעות התוכנה של הציוד, או לא מקוון או באמצעות תוכנת IQ או תוכנה חופשית J תמונה. לצייר את האזורים של עניין (ROIs) מסביב לכל תא (או חלק מהתא) וגם לבחור באזור ללא תא (לאוטומטי רקע חיסור על ידי התוכנה). סדרת עוצמת הקרינה בזמן לאחר מכן קבלה את ההחזר על ההשקעה עבור כל אלה והנתונים MAY ניתן לייצא ל-Microsoft Excel לניתוח נוסף. אנו לנרמל ערך עוצמת הקרינה באמצעות המשוואה הבאה: (F/F0) - 1. כאשר F הוא את עוצמת הקרינה שנמדדה בכל זמן נתון (t) וF0 הוא הקרינה הממוצעת שצולמה במהלך 30 שניות הראשונות. עלילה הסדרה בהיקף הכולל של (F/F0) - 1 לעומת הזמן (איור 5). ערכים יכולים להיות גם מנורמלים באמצעות ערך הקרינה המתקבל לאחר בנוסף ionomycin כמו 100%.
- ניתוח תמונה לחלופין ניתן לבצע באמצעות תוכנה חופשית תמונת ג'יי.
טכניקת המס '1. Fluorometry הקונבנציונלי
פרוגסטרון הוא אחד AR המעוררים ידועים, כצפוי, היא עושה לעורר חולפת [Ca 2 +] אני מגדיל בזרע אנושי (המוצג באיור 2). תוספת של סידן ionophore (ionomycin) גורמת המרבית [Ca 2 +] אני עלייה, שאינו חוזר לרמות בסיס.
טכניקת המס '2. SFluorometry זרימה המצופה
פרוגסטרון-Induced [Ca 2 +] אני עלייה נמדדה כמו קודם (fluorometry הקונבנציונלי), אבל הפעם עם רזולוציה של זמן רב יותר, במקרה זה התדירות של רכישה הייתה 0.1 הרץ. כפי שניתן לראות באיור 3, שניהם פרוגסטרון (קו חולף, אדום) וionomycin (קו מתמשך, כחול) גרם מהר מאוד [Ca 2 +] אני תגדל. היעדר עיכוב בפרוגסטרון-Induced [Ca 2 +] אני העלייה עקבי עם דיווחים קודמים המצביעים על פרוגסטרון שמפעיל ישירות Ca 2 + ערוץ CatSper, ללא איתות ביניים 10,14.
טכניקת המס '3. הזרימה cytometry
[Ca 2 +] אני נמדד בזרע אנושי capacitated ולא capacitated. כפי שדווח בעבר ב 15 עכבר, שור 16 וזרע זרע אנושי 17, אנחנו גם ציינו גדלו [C2 +] אני בcapacitated בהשוואה לזרע אנושי שאינם capacitated. אלדי, et al. (1991) 17 דיווח גבוה יותר בסיסי [Ca 2 +] אני בcapacitated מאשר בזרע אנושי שאינם capacitated באמצעות fluorometry הקונבנציונלי. בעבודה זו אנו משמשים cytometry הזרימה למדוד [Ca 2 +] אני לפני ואחרי בcapacitation המבחנה. cytometry הזרימה מאפשר לנו לראות שהתפלגות ערכי הקרינה לזרע capacitated (איור 4D, כחול זכר) הוא העביר לערכים גבוהים יותר בהשוואה לזרע שלא לcapacitated (איור 4D, אדום זכר). ניתן לראות את ערכי הקרינה עבור כל תא בודד בחלקות dot דו ממדים המוצגות באיור 4G; חשוב מכך, ניתן למנוע את האות הנובעת מהתאים מתים (כ -15%) (איור 4G, רביעים עליונים).
טכניקת המס '4. הדמיה תא בודד
פרוגסטרון-לגרוםד [Ca 2 +] שינוי שנמדד בתאי זרע בודדים. בנוסף פרוגסטרון גורם לתוספת ב[ Ca 2 +] אני הן בראש ובזרע השוטון. כפי שנצפה בניסויים באוכלוסייה, ניתוח תא בודד חשף חולף ועלייה מתמשכת לפרוגסטרון וionomycin, בהתאמה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
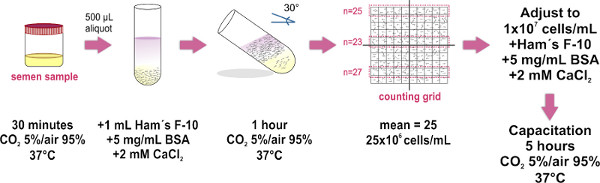
איור 1. תרשים סכמטי של פרוטוקול הניסוי להכנת דגימת זרע בשיטה בברכה. את השלבים העיקריים להפרדת הזרע נעימה ולהתאמה של הריכוז שלהם באים לידי ביטוי. שלב הדגיר?...
Access restricted. Please log in or start a trial to view this content.
Discussion
האיתות תאית חיונית לפעילות הסלולר ביותר, Ca 2 + הוא שליח בכל מקום שמלווה את תאי יונקים לאורך כל תוחלת החיים שלהם, ממוצאם בהפריה, לסוף מחזור החיים שלהם. בתגובה לגירויים שונים, [Ca 2 +] אני מגביר, oscillates וקטן עם הקודיפיקציה מרחב ובזמן, ובהתאם, תהליכים מגוונים מופעלי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
יש לנו מה למסור.
Acknowledgements
המחברים מודים חוזה לואיס דה לה וגה, אריקה Melchy וד"ר טאקויה Nishigaki לקבלת סיוע טכני. עבודה זו נתמכה על ידי Consejo Nacional de Ciencia y Tecnología (CONACyT-מקסיקו) (99,333 128,566 ולCT); Dirección גנרל דה Asuntos דל האישי Académico / האוניברסיטה הלאומית האוטונומית של דה מקסיקו (IN202212-3 לCT).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
References
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844(2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119(2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved