Method Article
Visualización y Análisis de las moléculas de ARNm mediante fluorescencia
En este artículo
Resumen
Este protocolo describe un procedimiento experimental para la realización de fluorescencia In situ La hibridación (FISH) para el recuento de ARNm en células individuales con una resolución de una sola molécula.
Resumen
La hibridación in situ fluorescente (FISH) método permite detectar los ácidos nucleicos en el medio ambiente celular nativo. Aquí se proporciona un protocolo para el uso de FISH para cuantificar el número de ARNm en las células individuales de levadura. Las células pueden ser cultivadas en cualquier condición de interés y después se fijaron y hacen permeables. Posteriormente, múltiples desoxioligonucleótidos monocatenario conjugados con tintes fluorescentes se utilizan para etiquetar y visualizar los ARNm. Fluorescencia de difracción limitada de las moléculas de ARNm individuales se cuantifica usando un algoritmo de punto de detección para identificar y contar el número de ARNm por célula. Mientras que los métodos de cuantificación más estándar de transferencias Northern, RT-PCR y microarrays de expresión génica proporcionan información sobre los ARNm promedio en la población mayor, PEZ, facilita tanto el recuento y localización de estos ARNm en las células individuales a una resolución de una sola molécula.
Introducción
Usando técnicas de medición a granel, no es posible ensayar el número de transcripciones o la actividad transcripcional dentro de las células individuales 1. Uso de proteínas fluorescentes conducidos por promotores de interés como reporteros de la expresión génica puede abordar este problema en cierta medida, pero el tiempo necesario para las proteínas fluorescentes para plegar oscurece la dinámica de los primeros. Proteínas fluorescentes de larga vida tampoco pueden reportar vidas ARNm. El método FISH se puede usar para ensayo de ARNm durante su ciclo de vida completo, desde la iniciación de la transcripción en el núcleo para la posterior maduración y la decadencia en las células individuales, con la resolución de una sola molécula.
El original en experimentos in situ para la visualización de los ácidos nucleicos utilizados sondas de ARN radiomarcadas para sondear elementos de ADN. Estos incluyen la visualización de ADN ribosomal en los ovarios de la rana Xenopus laevis 2 y el ADN satélite en tejidos de ratón 3. La primera fluorescente in situ en experiment utiliza una molécula de ARN marcado con un fluoróforo a la sonda secuencias particulares de ADN 4. La primera aplicación de sondas fluorescentes para la visualización de ARN in situ era la visualización de la expresión del gen de actina de pollo en cultivo de tejido muscular 5. Más recientemente, en la levadura en ciernes, PEZ, se ha utilizado para investigar oscilaciones en la transcripción durante el ciclo metabólico de levadura 6, la descomposición de ARNm durante la progresión del ciclo celular 7, y la localización espacial de los transcritos de ARNm durante la mitosis 8. PECES se ha utilizado en la levadura para mostrar que las fluctuaciones no correlacionadas en forma constitutiva genes transcritos, que constituyen más de la mitad de todos los genes de la levadura, surgen de iniciación de la transcripción no correlacionado 9. En las especies distintas de la levadura, pescado ha sido utilizado para identificar marcadores de células madre en el intestino del ratón 10 y para determinar que la penetrancia incompleta de destinos celulares puede resultar de genes estocásticos fluctuaciones de expresión en C.Elegans embriones 11.
El método descrito aquí PESCADO funciona mediante la hibridación de marcado tinte, sondas de ADN de cadena sencilla a ARNm mensajes. Las células se obtuvieron imágenes y los ARNm se cuentan usando un algoritmo de punto de detección. Sondas de cadena simple pueden ser generados con un sintetizador de ADN y marcaron a continuación (se hace referencia aquí como sondas Singer) o ordenados comercialmente como sondas de pre-marcados (sondas Stellaris) 12,13. Una diferencia importante entre el cantante y Stellaris sondas es que las sondas de Singer son más largas (~ 50 pb) y son multi-etiquetados, mientras que las sondas Stellaris son cortos (~ 20 pb) con sólo una etiqueta por sonda, como se describe por Raj et al 14. Además, el enfoque Stellaris utiliza muchos más sondas de genes que el de Singer (~ 30 frente a 5 sondas por gen, respectivamente). A continuación se proporciona un protocolo que describe el uso de cualquier tipo de sonda. En la sección 2, se proporciona un protocolo para etiquetar amino-alilo sondas timidina que contienen wi-ésimo un colorante Cy elegido. Una visión general de los pasos de cálculo necesarios para identificar los puntos individuales de ARNm se proporciona en la Sección 7.
Protocolo
Las figuras 1 y 2 son diagramas esquemáticos de los procedimientos experimentales FISH y análisis de imagen de tuberías utilizada para la cuantificación FISH imágenes.
1. Soluciones de prepararse
* Las soluciones a continuación son para uso con sondas Singer. Si el uso de sondas de Stellaris, sustitúyase "40% de formamida" por "10% de formamida" tanto en tampón de hibridación y la solución de lavado. Cambios adicionales en tampón de hibridación al utilizar sondas Stellaris son (1) añadir 1 g de sulfato de dextrano y (2) no incluyen 10 mg ssDNA.
Tampón B
8 ml 1 M KH 2 PO 4
41,5 ml 1 M K 2 HPO 4
109,3 g Sorbitol
Buffer spheroplasting
890 l Tampón B
100 l VRC
10 l 25000 U / ml de liticasa
2 l β-mercaptoetanol
tampón de hibridación (10 ml, volumen final)
10 mg E. coli tRNA
10 mg de DNA de cadena simple *
100 l 200 mM de stock VRC
40 l de 50 mg / ml de BSA
1 ml de SSC 20X
4 ml de formamida al 40% *
Nucleasa libre de agua (hasta 10 ml de volumen final)
1 g de sulfato de dextrano *
* Tampón de Hibridación puede mantenerse en alícuotas de 0,5 ml a -20 ° C para la conveniencia.
Tampón de lavado (50 ml, volumen final)
5 ml de SSC 20X
20 ml de formamida al 40% *
Nucleasa libre de agua (50 ml de volumen final)
Etiquetado Buffer
1,06 g de carbonato sódico
100 ml de agua DEPC
pH 9
2. Probe-etiquetado (sondas Singer solamente)
Obtenemos estas sondas mediante síntesis en la casa usando un aparato de síntesis de oligonucleótidos ABI. Typicaliado, 4-5 ~ 50 bp oligonucleótidos son sintetizados que son homólogas al gen de interés, sustituyendo timidina amino-alilo durante varios thymidines espaciadas al menos 8, preferiblemente 10 + pb aparte. Debido a su sensibilidad al ozono, se trabaja en una instalación libre de ozono cuando se utilizan colorantes CY.
- Obtener ~ 5 sondas y resuspender en 100 l de agua - las concentraciones de verificación en Nanodrop.
- Dependiendo del número de sondas / genes, combine total de 10 oligonucleótidos mg / gen (por ejemplo, si se 5 / sondas de genes, entonces quiero 2 mg / sonda).
- Utilice columnas QIAquick para purificar sondas según QIAquick nucleótidos Protocolo kit de retiro.
- Añadir 10 volúmenes de tampón de PN con el total de volumen de sondas combinadas y mezclar.
- Aplicar la muestra a la columna QIAquick - si el volumen total es mayor que 750 l, girar hacia abajo dos veces utilizando la mitad del volumen en cada giro
- Deje reposar durante 1 min.
- Centrifugar 1 min a 6000 rpm.
- Lavar con 750 l PE Buffer.
- Centrifugar1 min a 6000 rpm.
- Eliminar el flujo a través de la columna y re-giro durante 1 min a 13000 rpm para secar.
- Columna QIAquick Place en tubo nuevo de microcentrífuga y el ADN se eluye con 50 l H 2 O - Asegúrese de H 2 O pH está dentro de 7,0 y 8,5 y se coloca directamente sobre la membrana.
- Deje reposar durante 1 min.
- Centrifugar durante 1 min a 13.000 rpm para eluir el ADN.
- Liofilizar ADN a 45 ° C.
- Resuspender el precipitado en 10 l buffer de etiquetado y añadir al tubo de tinte sin tocar el tinte.
- Repita con el otro buffer etiquetado 10 l.
- Vortex y centrifugar tubos de tinte y ADN.
- Cubra los tubos con papel de aluminio y guardar en la oscuridad a RT O / N para etiquetar.
- Repita QIAquick nucleótidos Protocolo kit de retiro. Realizar con dos diferencias:
- Añadir 200 l de tampón PN sondas y poner sondas marcadas a través de columnas de 2x.
- Realizar 3 lavados con tampón PE con el fin de eliminar cualquier tinte no unido antes de la elución. - After elución obtener la concentración a través de nanogota. El etiquetado de eficiencia es típicamente ~ 0,25 pmol / ng de ADN de una sola hebra.
3. Coverslip Preparación
- Coloque los cubreobjetos en los portaobjetos en plasma-acicalarse cámara de vacío ( http://www.plasmapreen.com/ ) (cuanto más cerca del centro de la mejor).
- Coloque la cámara de vacío en el microondas y asegúrese de que está sellado.
- Encienda la bomba primero y luego gire en vacío de una sola vez de la bomba se pone en marcha.
- Encienda el horno de microondas, y dejar 5 segundos después plasma es visible.
- Apague la bomba de vacío a continuación.
- Saque la cámara de vacío y retirar cubreobjetos con unas pinzas (aquellos que han caído necesita ser limpiado de nuevo).
- Lugar cubreobjetos lado limpiado en placas de 12 pocillos.
4. Procedimiento Fijación
- Crecer levadura a un OD 600 de aproximadamente 0,1-0,2 en medio mínimo. 10 ml de células produce suficiente FOr ~ 10 hibridaciones separadas.
- Añada 1/10 del volumen 37% de formaldehído directamente a los medios de cultivo (10 ml de cultivo + 1 ml de formaldehído al 37%) y dejar reposar durante 45 min.
- Lavar 2x con hielo 1 ml de tampón B frío en un tubo de microcentrífuga (puede girar a 13.000 rpm durante 1 min).
- Añadir 1 ml de tampón spheroplasting.
- Incubar a 37 ° C durante 15 min. Compruebe células cada pocos minutos bajo microscopio hasta la mayoría de las células son de color negro (es decir, no la eliminación brillante).
- Lavar 2x con tampón enfriado con hielo B, girando a baja velocidad (~ 3500 rpm).
- Añadir 1 ml de EtOH al 70%, resuspender suavemente y dejar toda la noche a 4 ° C (se puede almacenar indefinidamente a -20 ° C).
5. Procedimiento de hibridación
- Preparar la solución de hibridación: a 100 l de tampón de hibridación, agregue 1-3 l de la sonda, luego vortex y centrifugar. Cantante utilizan sondas 8-10 ng totales por sonda conjunto (es decir, por gen). Hemos fotografiado hasta 3 genes simultáneamente con 3 diferentessonda marcada rente fija.
Asegúrese de calentar la solución de hibridación a temperatura ambiente antes de abrirlo.
Para sondas Stellaris, se recomienda empezar 4 reacciones de hibridación independientes mediante la adición de 1 l cada uno de 1:10, 1:20, 1:50 y 1:100 diluciones de trabajo de las sondas para ver cuál es el óptimo. Diluciones de trabajo de sondas Stellaris se preparan en tampón de hibridación.
- Se centrifuga (para todos los pasos posteriores; 3.500 rpm, 5 min) las células fijadas (por ejemplo, 200 l) y aspirar lejos del etanol.
- Resuspender suavemente en 1 ml de tampón de lavado que contiene el mismo porcentaje de formamida como el tampón de hibridación. Deje reposar durante 2-5 min.
- Centrifugar la muestra y el tampón de lavado aspirado, a continuación, añadir solución de hibridación. Incubar en la oscuridad con agitación suave, O / N a 37 ° C.
Nota: El siguiente procedimiento es para la aplicación de células / imagen en cubreobjetos. Para wincineración / células de formación de imágenes en placas de 96 pocillos, incluyendo el oxígeno solución de eliminador de especies reactivas alternativa ver http://www.biosearchtech.com/stellarisprotocols.
- Al día siguiente, o antes, limpio (ver procedimiento) y tratar cubreobjetos con 150 l 0,01% de poli-L-lisina durante 5 min. Aspirar, dejar secar, lavar 3 veces con H2O destilada y dejar secar.
- En la mañana, añadir 1 ml de tampón de lavado a la muestra, resuspender suavemente, centrífuga y aspirar, a continuación, volver a suspender en otro 1 ml de tampón de lavado y se incuba a 37 ° C durante 30 min.
- Lavar con 2 x SSC + 0,1% de Triton X-100 a TA 15 min en un agitador.
- Tome medio de montaje fuera del congelador para permitir que suba a temperatura ambiente antes de montar.
- Lavar con 1X SSC a TA 15 min en un agitador.
- Diluir DAPI en PBS (0,1 mg / ml final) y volver a suspender las células en 150 l.
- Solución Place a limpiar / poli-lys-treacubre-ted en placa de 12 pocillos, al menos 30 minutos sin ser molestados.
- Retire la solución (es posible colocarlo en una hoja de cubierta de repuesto como copia de seguridad) y se lava 3 veces con 1 ml de 1X PBS.
- Coloque 3 l de prolongar medio de montaje del oro en un portaobjetos (Invitrogen P36934). Para ello, uno a la vez si tiene varias hojas de la cubierta para evitar la desecación del medio de montaje.
- Agregar ~ 0,5 ml de etanol al cubreobjetos en placas de 12 pocillos, retire la hoja de la cubierta y el aire seco, mientras que la celebración de unas pinzas.
- Coloque cubrir deslizamiento celular del lado hacia abajo en medio de montaje y dejar endurecer varias horas o O / N en la oscuridad.
- Selle los bordes con esmalte de uñas y proceder a la creación de imágenes.
6. Obtención de imágenes de células con Olympus IX-81 microscopio invertido general
- Para la adquisición de imágenes utilizamos software Slidebook (inteligente imaging.com) y un 1,45 NA, aceite objetivo TIRFM 100X. Para GFP serie, DAPI, Cy3, Cy5 y Cy3.5 imagen: conjuntos de filtros Chroma (ver reactivos).
- Utilice el filtro de DAPIpara encontrar y centrarse células.
- Establezca este como punto de referencia.
- Tome un z-stack de imágenes alrededor del punto de referencia donde la distancia total es de 5 m con 0,2 mM tamaño (25 aviones). Repita el procedimiento para cada canal de colorante (es decir, cada sonda conjunto).
- Exportar como TIFF de 16 bits para el análisis de imágenes.
7. Resumen Análisis de Imágenes (sondas Singer)
A continuación ofrecemos un resumen de los métodos de cálculo que utilizamos para el análisis de imágenes de peces en MATLAB. Las funciones de MATLAB relevantes utilizadas están entre corchetes a la derecha. Los algoritmos y los umbrales están sintonizados para los datos de las sondas de estilo Singer. Uso de sondas de estilo Stellaris serán necesarios algunos ajustes, en particular a la etapa de filtración final (7,8).
Identificación teléfono 15
- Separar las células del fondo utilizando un umbral global sobre DAPI imágenes 16 [graythresh].
- Identificar núcleos mediante la función maxima extendida [imextendedmax].
- Células segmento utilizando núcleos como semillas para un algoritmo de cuenca [cuenca].
Encuentra puntos de interés en cada canal de fluorescencia
- Lleve a cabo la transformación tophat para normalizar fondo y mejorar la relación señal-ruido [bwmorph].
- Encontrar máximos para identificar la capa de enfoque (en el plano z) para cada punto de [imregionalmax].
- Filtrar lugares potenciales utilizando un modelo de ajuste lineal a un gradiente radial.
Intensidad punto de medición y señales de la sonda mono contra poli filtro
- Ajustar un perfil gaussiano 2D al lugar en la capa de enfoque previamente identificados y la intensidad estimación 17.
- Filtrar los puntos débiles utilizando un umbral (basado en histograma). Para sondas tipo Singer esto es importante, pero lo es menos para las sondas de Stellaris.
- Contar puntos en cada celda.
Resultados
La Figura 3 muestra histogramas típicos calculados a partir de FISH imágenes y se utiliza para determinar el número de los ARNm presentes en las células individuales. Una ventaja importante de la microscopía basado en la cuantificación del ARN es que se puede obtener información sobre la localización de las transcripciones. Por ejemplo, hemos utilizado FISH para identificar ARNm en células individuales con una inducible CBF1 alelo (Figura 4). Debido a que muchas moléculas de ARNm están presentes en el sitio de la transcripción, que son capaces de identificar la presencia y ubicación de los sitios de transcripción dentro del núcleo.
Mediante la utilización de diferentes colorantes para ARNm de etiquetas de diferentes genes, uno puede cuantificar múltiples especies de ARNm en las mismas células. Para demostrar esto, las células de levadura se incubaron en presencia de α-factor de y sorbitol. FUS1 transcripción (Quasar670 colorante, rojo) es inducida por α-factor. Transcripción STL1 (Quasar 570 tinte, verde) es inducido por el aumento de la osmolaridad extracelular ( Figura 5). Figura 4 es un ejemplo de FISH con las sondas Singer. Figura 5 es un ejemplo de FISH con las sondas de Stellaris.
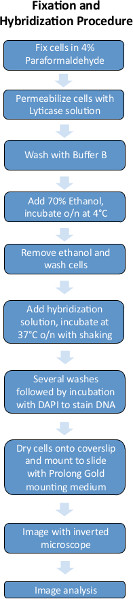
Figura 1. Esquema del procedimiento experimental FISH. Haz clic aquí para ver más grande la figura .

Figura 2. Esquema de la tubería de análisis de imagen. Los puntos finales se determinan en la figura más a la derecha.
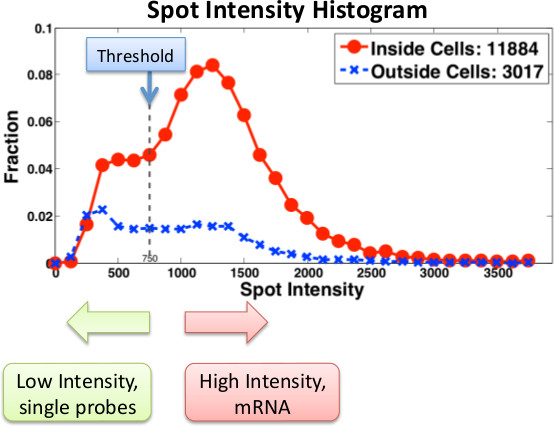
Figura 3. Histograma de las intensidades de terreno para un gen particular, utilizando sondas Singer . Intensidad de la sonda se computan tanto las células externas (azul) en el interior (rojo) y. Puntos de baja intensidad son o ruido o sondas individuales. Mensajes ARNm reales se etiquetan con múltiples sondas. Al utilizar las sondas Stellaris, sondas individuales son menos detectables y por lo tanto los umbrales y los filtros se deben ajustar en consecuencia.
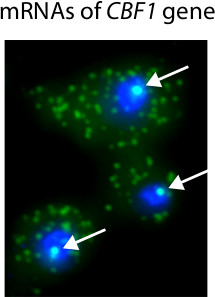
La Figura 4. Los resultados representativos de procedimiento PESCADO cantante. En este experimento, la transcripción CBF1 se activa con un promotor inducible 18. Los núcleos se tiñen de azul con DAPI. MRNAs CBF1 etiquetados con Cy3-etiquetados sondas. Las flechas blancas destacan la presencia de CBF1 sitios de transcripción en el núcleo. Transcripciones de ARNm individuales son visibles en el citoplasma.
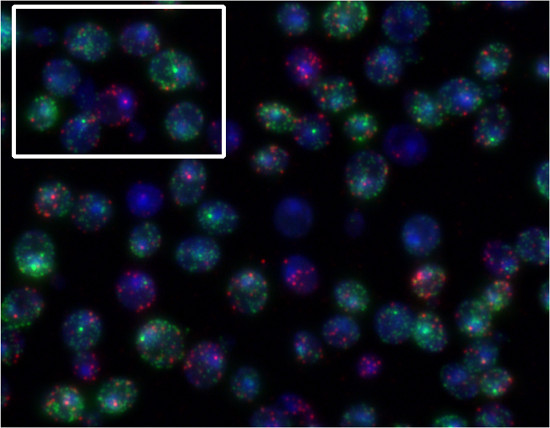
Figura 5. Los resultados representativos de procedimiento PESCADO Stellaris. Células de levadura Mata fueron expuestos simultáneamente a 30 ng / ml de factor de α-y 0,75 M de sorbitol durante 10 min y se probaron simultáneamente para FUS1 (Quasar 670, rojo) y STL1 (Quasar 570, verde) transcripciones. En el cuadro resaltado, podemos ver una célula de responder sólo a la feromona (FUS1 sitio de inicio, rojo) y la otra predominantemente responder al sorbitol (sitio de inicio de STL1, verde).
Discusión
Hasta la fecha, pescado ha sido sobre todo un método de bajo rendimiento. El uso de Cy3, Cy3.5, y Cy5 tintes limita el número de genes se puede investigar en células individuales para tres a la vez. Algunas sondas adicionales se han desarrollado (Stellaris), pero el número de sondas distinguibles se encuentra todavía en más de siete. Para evitar esta limitación, las estrategias de etiquetado combinatorias utilizando múltiples fluoróforos se han utilizado para crear códigos de barras para diferentes especies de ARNm 19,20. Más recientemente, Lubeck y Cai utilizan códigos de barras óptico y espectral para cuantificar 32 especies diferentes al mismo tiempo con los pescados en células de levadura individuales 19. Una limitación de este enfoque combinatorio reciente es que requiere el uso de super-resolución de la microscopía. El análisis necesario para distinguir las sondas de código de barras también es bastante complejo.
Hemos encontrado que Cy3 y Cy3.5 son preferibles a Cy5 para experimentos de FISH. Una de las limitaciones del tinte Cy5 es su sensibilidada photobleaching. Sin embargo, Stellaris ha desarrollado recientemente Cy5 variantes que se anuncian como más resistentes a photobleaching, y puede aliviar este problema técnico. Es también digno de mención que el pescado es un método costoso de implementar y que tanto Singer y Stellaris sondas suelen costar $ 700 - $ 1,000 por sonda conjunto, aunque los precios de las sondas disponibles en el mercado deberían disminuir en el futuro. Ahorradores de reactivos y etiquetado eficientes trae sondas Singer hasta el rango más bajo en precio.
Uno de los principales desafíos técnicos es la separación de los puntos de sonda única o múltiple, que requiere la aplicación de algoritmos de punto a indicar sofisticados. Esto puede tomar una amplia revisión manual para ajustar los parámetros de análisis de imágenes para instalaciones experimentales específicas. Un resumen de nuestra cartera de cálculo con funciones relevantes MATLAB se proporciona en la Sección 7 del protocolo. Este problema es un tanto aliviado por las sondas de Stellaris que sólo tienen una etiqueta por sonda. Por lo tanto, requiere la colocalización de múltiples sondas para ver una señal.
Dado que el pescado requiere la fijación de las células, que no facilita el seguimiento de las células individuales en el tiempo. Anteriormente, se utilizaron los datos de instantánea FISH para reconstruir la dinámica de la expresión de genes en las poblaciones de levadura ciclismo metabólicamente individuales 6. Ciclo metabólico se observa en la pre-hambrientos, cultivos continuos, y se caracteriza por oscilaciones colectivas en toda la población en el consumo de oxígeno. Estas oscilaciones se asocian con el genoma de las transcripciones oscilaciones que se producen por medio de todos los genes de levadura en las diferentes fases de consumo de oxígeno. Hemos tratado de determinar si el ciclismo metabólico estaba presente en cultivos de levaduras continuas sin sincronizar. Si está presente, las transcripciones que son anti-correlacionados en las poblaciones síncronos también deben ser anti-correlación en las células individuales no sincronizadas, y viceversa para transcripciones correlacionados.
ent "> Para reconstruir dinámica de la producción de ARNm en el tiempo, los datos de la instantánea observados debe ser comparado con lo que se espera de un modelo del comportamiento subyacente. Existen limitaciones teóricas a que tales" instantáneas "de los datos de expresión de genes pueden ser utilizados para determinar la dinámica de expresión de genes subyacentes y que tipo de modelos se pueden distinguir 21. Para los datos de los ciclos metabólicos, en lugar de mostrar directamente la presencia de oscilaciones temporales, las mediciones estadísticas se llevaron a cabo para demostrar que efectivamente existe una celda programa oscilatoria autónoma consistente con mayor microarray mediciones.Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Esta investigación fue apoyada por subvenciones GM046406 (de DB) y por el Instituto Nacional de Ciencias Médicas Generales Centro de Biología Cuantitativa (GM071508). RSM reconoce el financiamiento de la Beca de Investigación de Postgrado NSF. MNM con el apoyo de una beca de Lewis-Sigler. Nos gustaría agradecer a los miembros del laboratorio Botstein útil para los debates y los miembros ex Allegra Petti y Nikolai Slavov por sus contribuciones al proyecto de ciclo metabólico. Damos las gracias a Daniel Zenklusen y Robert Singer para conseguir nosotros empezó con el método de FISH.
Materiales
| Name | Company | Catalog Number | Comments |
| Vanadyl Ribonucleoside Complex | NEB | S1402S | |
| Lyticase | Sigma | L5263 | |
| E. coli tRNA | Roche | 1010954001 | |
| BSA (RNase free) | Ambion | ||
| Beta-mercapt–thanol | Fisher | 03446l | |
| DAPI, dilactate | Sigma | D9564 | |
| PBS 10X (RNase free) | Ambion | AM9624 | |
| Triton X-100 | Shelton Scientific | ||
| Dextran sulfate | Sigma | D6001 | Or equivalent |
| Saline-sodium citrate (SSC) 20X | VWR | 82021-484 | |
| Formamide (deionized) | Ambion | AM9342 | |
| Nuclease-free water | Ambion | AM9932 | |
| Alpha-D-glucose | Sigma | 158968 | For GLOX solution |
| 1 M Tris-HCl, pH 8.0 | Ambion | AM9855G | |
| 100% Ethanol | |||
| Glucose oxidase | Sigma | G0543 | For GLOX solution |
| Catalase | Sigma | C3155 | For GLOX solution |
| Concanavalin A | MP Biomedicals | 150710 | |
| Polylysine (0.01%) | Sigma | P8920 | |
| Coverslips | Warner Instruments | Cs-18R15 | |
| Prolong Gold Mounting Medium | Invitrogen | P36934 | |
| QIAquick Nucleotide Removal Kit | QIAGEN | 28304 | |
| FISH Probes | Biosearch Technologies | Custom order for your desired mRNA sequence | |
| Glass bottom 96-well plates | Nunc | 265300 | Alternative to coverslips |
| 12-well plates | BD Falcon | 351143 | |
| Cy3, Cy3.5, Cy5 dyes | GE Healthcare | monofunctional NHS-ester | |
| EQUIPMENT | |||
| Plasma-Preen I Cleaner | Terra Universal | 9505-00 | Controller (Cat #9505-17 optional) |
| Vacuum Pump | Alcatel | 205SDMLAM | For operating Plasma-Preen |
| Widefield Fluorescence Microscope | Olympus | IX81 | Or equivalent |
| 100X objective | Olympus | 1-UB617R | |
| Light Source | X-Cite | XCT 10-A | Or equivalent |
| Filter Sets | Chroma | U-NSP100V2-SPR, U-NSP101V2-SPR, U-NSP102V2-SPR, U-NSP103V2-SPR,U-NSP104V2-SPR. | |
| Cooled CCD or EMCCD Camera | Hamamatsu | C4742-98-24ER | |
Referencias
- Femino, A. M., Fay, F. S., Fogarty, K., Singer, R. H. Visualization of single RNA transcripts in situ. Science. 280, 585-590 (1998).
- Gall, J. G., Pardue, M. L. Formation and Detection of Rna-DNA Hybrid Molecules in Cytological Preparations. Proceedings of the National Academy of Sciences of the United States of America. 63, 378 (1969).
- Jones, K. W. Chromosomal and Nuclear Location of Mouse Satellite DNA in Individual Cells. Nature. 225, 912 (1970).
- Bauman, J. G., Wiegant, J., Borst, P., van Duijn, P. A new method for fluorescence microscopical localization of specific DNA sequences by in situ hybridization of fluorochromelabelled RNA. Exp Cell Res. 128, 485-490 (1980).
- Singer, R. H., Ward, D. C. Actin gene expression visualized in chicken muscle tissue culture by using in situ hybridization with a biotinated nucleotide analog. Proc. Natl. Acad. Sci. U.S.A. 79, 7331-7335 (1982).
- Silverman, S. J., et al. Metabolic cycling in single yeast cells from unsynchronized steady-state populations limited on glucose or phosphate. Proc. Natl. Acad. Sci. U.S.A. 107, 6946-6951 (2010).
- Trcek, T., Larson, D. R., Moldon, A., Query, C. C., Singer, R. H. Single-molecule mRNA decay measurements reveal promoter- regulated mRNA stability in yeast. Cell. 147, 1484-1497 (2011).
- Bertrand, E., et al. Localization of ASH1 mRNA particles in living yeast. Mol Cell. 2, 437-445 (1998).
- Gandhi, S. J., Zenklusen, D., Lionnet, T., Singer, R. H. Transcription of functionally related constitutive genes is not coordinated. Nat. Struct. Mol. Biol. 18, 27-34 (2011).
- Itzkovitz, S., et al. Single-molecule transcript counting of stem-cell markers in the mouse intestine. Nature Cell Biology. 14, 106-U193 (2012).
- Raj, A., Rifkin, S. A., Andersen, E., van Oudenaarden, A. Variability in gene expression underlies incomplete penetrance. Nature. 463, 913-U984 (2010).
- Raj, A., Tyagi, S. Detection of individual endogenous RNA transcripts in situ using multiple singly labeled probes. Methods Enzymol. 472 (10), 365-386 (2010).
- Trcek, T., et al. Single-mRNA counting using fluorescent in situ hybridization in budding yeast. Nature Protocols. 7, 408-419 (2012).
- Raj, A., vanden Bogaard, P., Rifkin, S. A., van Oudenaarden, A., Tyagi, S. Imaging individual mRNA molecules using multiple singly labeled probes. Nature Methods. 5, 877-879 (2008).
- Otsu, N. A Tlreshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man and Cybernetics. 9, 62-66 (1979).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophys J. 82, 2775-2783 (2002).
- McIsaac, R. S., et al. Fast-acting and nearly gratuitous induction of gene expression and protein depletion in Saccharomyces cerevisiae. Molecular biology of the cell. 22, 4447-4459 (2011).
- Lubeck, E., Cai, L. Single-cell systems biology by super-resolution imaging and combinatorial labeling. Nature Methods. 9, 743-U159 (2012).
- Levsky, J. M., Shenoy, S. M., Pezo, R. C., Singer, R. H. Single-cell gene expression profiling. Science. 297, 836-840 (2002).
- Wyart, M., Botstein, D., Wingreen, N. S. Evaluating Gene Expression Dynamics Using Pairwise RNA FISH Data. Plos Computational Biology. 6, (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados