Method Article
Визуализации и анализа молекул мРНК с помощью флуоресцентной
В этой статье
Резюме
Этот протокол описывает экспериментальную процедуру выполнения флуоресценции На месте Гибридизация (FISH) для подсчета мРНК в одиночных камерах в одной молекулы разрешение.
Аннотация
Флуоресценции в гибридизация (FISH) метод позволяет обнаружить нуклеиновых кислот в клеточной среде родного. Здесь мы предлагаем протокол для использования FISH для количественного определения количества мРНК в отдельные клетки дрожжей. Клетки могут быть выращены в любом состоянии интерес, а затем фиксировали и сделаны проницаемыми. Впоследствии несколько одноцепочечной deoxyoligonucleotides конъюгированные с флуоресцентными красителями используются для маркировки и визуализировать мРНК. Ограниченное дифракцией флуоресценции от одиночных молекул мРНК количественно с использованием точечного алгоритма обнаружения для определения и подсчета количества мРНК в клетке. В то время как более стандартные методы количественной оценки северной пятна, RT-PCR и микрочипов экспрессии генов предоставлять информацию о среднем мРНК в объеме населения, FISH облегчает как подсчет и локализации этих мРНК в отдельные клетки при одной молекулы разрешение.
Введение
Использование объемных методов измерения, это не возможно для анализа количества транскриптов или транскрипционную активность в отдельные клетки 1. Использование флуоресцирующих белков обусловлен промоторов интерес в качестве репортеров экспрессии гена может решить эту проблему в некоторой степени, но время, необходимое для флуоресцентного белка сложить скрывает рано динамики. Долгосрочные флуоресцентные белки также не может сообщить мРНК жизней. FISH метод может быть использован для анализа мРНК во время его жизненного цикла, от инициации транскрипции в ядре последующим созреванием и распада в отдельные клетки, с одной молекулы разрешение.
Оригинальный экспериментов на месте для визуализации нуклеиновых кислот использовали радиоактивно РНК-зонды для исследования ДНК элементов. К их числу относятся визуализация рибосомальной ДНК в яичниках лягушки Xenopus Laevis 2 и сателлитной ДНК в ткани мыши 3. Первый флуоресцентный на месте экспериментаiment использовали молекулу РНК отмечены флуорофором чтобы исследовать определенные последовательности ДНК 4. Первым применением флуоресцентных зондов для визуализации РНК на месте была визуализация экспрессии гена актина в мышечных тканях куриных культуры 5. Совсем недавно, в начинающие дрожжи, рыба использовалась для изучения колебаний в транскрипции во время цикла дрожжей метаболических 6, распад мРНК во время клеточного цикла 7 и пространственной локализации транскриптов мРНК во время митоза 8. Рыба была использована в дрожжах, чтобы показать, что некоррелированного колебания конститутивной транскрипции генов, которые составляют более половины всех генов дрожжей, возникают из некоррелированного инициации транскрипции 9. В не-дрожжевых видов, FISH была использована для определения стволовых клеток маркеров в кишечнике мыши 10 и определить, что неполные проницаемость клеточной судьбы могут возникнуть в результате стохастического экспрессии генов колебания C.Элеганс эмбрионов 11.
FISH метод, описанный здесь работает путем гибридизации меченного красителем, одноцепочечной ДНК-зондов мРНК сообщений. Клетки отображаемого мРНК и подсчитывают с помощью точечного обнаружения алгоритма. Одноцепочечных зонды могут быть созданы с помощью синтезатора ДНК и затем метили (называемый здесь Певица зонды) или заказать коммерчески как предварительно меченых зондов (Stellaris зонды) 12,13. Одно из основных различий между певцом и Stellaris зондов, что певец зонды больше (~ 50 б.п.) и мульти-меченных в то время как Stellaris зонды короткие (~ 20 б.п.) только одна метка на зонд, как описано Радж и др. 14. Кроме того, Stellaris подход использует гораздо больше зондов на ген, чем у Singer (~ 30 против 5 зондов на ген, соответственно). Ниже мы приводим протокол, который описывает использование любого типа зонда. В разделе 2, мы предоставляем протокол для маркировки амино-аллил тимидином содержащих зонды Wго выбрали Cy красителя. Обзор вычислительных шагов, необходимых для идентификации одного пятна мРНК приведена в разделе 7.
протокол
На рисунках 1 и 2 представляют собой схематические FISH экспериментальных процедур и анализа изображений трубопровод использовали для количественной FISH изображений.
1. Решения по подготовке
* Решения ниже для использования с певицей зондов. При использовании зондов Stellaris заменить "40% формамидом" на "10% формамидом" в обоих буфера гибридизации и отмывки буфером. Дополнительные изменения в буфере для гибридизации при использовании Stellaris зонды (1) добавить 1 г декстрансульфате и (2) не включают 10 мг одноцепочечной ДНК.
Буфер В
8 мл 1 М KH 2 PO 4
41,5 мл 1 М К 2 НРО 4
109,3 г сорбита
Сферопластов буфера
890 мкл буфера B
100 мкл VRC
10 мкл 25 000 Ед / мл Lyticase
2 мкл β-меркаптоэтанол
<сильный буфера гибридизации> (10 мл, конечный объем)
10 мг E. палочка тРНК
10 мг * одноцепочечной ДНК
100 мкл 200 мМ VRC складе
40 мкл 50 мг / мл BSA
1 мл 20 х SSC
4 мл 40% формамида *
Нуклеазы бесплатно Вода (до 10 мл конечного объема)
1 г декстрансульфате *
* Гибридизации буфер может храниться в 0,5 мл аликвотах при -20 ° C для удобства.
Промывочный буфер (50 мл, конечный объем)
5 мл 20 х SSC
20 мл 40% формамида *
Нуклеазы бесплатно воде (50 мл конечного объема)
Маркировка буфера
1,06 г карбоната натрия
100 мл воды DEPC
рН 9
2. Зонд-маркировки (Singer только для датчиков)
Мы получим эти зонды в доме синтеза с использованием синтеза олигонуклеотидных ABI аппарата. Typicсоюзник, 4-5 ~ 50 п.н. олигонуклеотиды синтезируют, которые гомологичны представляющий интерес ген, заменяя амино-аллил тимидина в течение нескольких тимидина расстоянии не менее 8, предпочтительно от 10 + пар друг от друга. Из-за их чувствительность к озону, мы работаем в безозоновом объекта при использовании CY красителей.
- Получаем ~ 5 зондов и ресуспендируют в 100 мкл воды - проверка концентрации на Nanodrop.
- В зависимости от того, сколько зондов / ген, объединить общей сложности 10 мкг олигонуклеотидов / ген (например, если есть 5 зондов / гена, то хотим 2 мкг / зонд).
- Используйте QIAquick колонки для очистки зондов в соответствии с Протоколом QIAquick нуклеотидные комплект удаления.
- Добавить 10 объемами буфера PN к общему объему комбинированных зондов и перемешать.
- Нанести образец в колонку QIAquick - если общий объем больше 750 мкл, спин вниз дважды, используя половины объема в каждом вращении
- Дайте постоять в течение 1 мин.
- Центрифуга 1 мин при 6000 оборотах в минуту.
- Промыть 750 мкл буфера PE.
- Центрифуга1 мин при 6000 оборотах в минуту.
- Утилизацию потока через и повторно ротационную колонку в течение 1 мин при 13000 оборотов в минуту, чтобы высохнуть.
- Место QIAquick столбца в новую пробирку и микроцентрифужные элюата ДНК с 50 мкл H 2 O - Убедитесь, что H 2 O рН находится в пределах 7,0 и 8,5 и находится непосредственно на мембране.
- Дайте постоять в течение 1 мин.
- Центрифуга течение 1 мин при 13000 оборотов в минуту, чтобы элюировать ДНК.
- Лиофильной сушке ДНК при 45 ° С.
- Ресуспендируют гранул в 10 мкл буфера для маркировки и добавить в трубке красителя, не касаясь красителя.
- Повторите с другой 10 мкл буфера для маркировки.
- Vortex и спином вниз трубку краситель и ДНК.
- Обложка трубы с алюминиевой фольгой и держать в темноте при комнатной температуре O / N на этикетке.
- Повторите QIAquick нуклеотидные протокола Комплект удаления. Выполните с двумя отличиями:
- Добавить 200 мкл буфера PN к зондам и положить меченых зондов через 2x столбцов.
- Выполнить 3 промывок буфером PE для того, чтобы смыть любую одиноких красителя перед элюирования. - Звуковая частотаТер элюирования получить концентрацию через NanoDrop. Маркировки эффективности, как правило, ~ 0,25 пмоль / нг одноцепочечной ДНК.
3. Подготовка Покровное
- Место покровные на слайдах при плазменно-копчиковой вакуумной камере ( http://www.plasmapreen.com/ ) (ближе к центру, тем лучше).
- Положить в вакуумной камере микроволновой печи и убедитесь, что она запечатана.
- Включите насос первого затем включить только один раз вакуум насос.
- Включите микроволновую печь, и остановка 5 сек после плазменной видна.
- Отключите вакуумную затем насосом.
- Вытяните вакуумной камере и удалите покровные щипцами (те, которые упали должны быть очищены снова).
- Место покровные очищены вверх в 12-луночных планшетах.
4. Процедура фиксации
- Расти дрожжей OD 600 около 0,1-0,2 в минимальных средах. 10 мл клеток дает достаточно лR ~ 10 отдельных гибридизации.
- Добавить 1/10 объема 37% формальдегида непосредственно в ростовой среде (10 мл культуры + 1 мл 37% формальдегида) и оставьте на 45 мин.
- Вымойте 2x с 1 мл ледяного буфера B в микроцентрифужных трубку (может вращаться со скоростью 13000 оборотов в минуту в течение 1 мин).
- Добавить 1 мл сферопластов буфера.
- Инкубировать при 37 ° С в течение 15 мин. Проверьте клетки каждые несколько минут под микроскопом, пока большинство клеток не черный (т.е. не-фазы яркий).
- Вымойте 2x ледяной буфера B, спиннинг на низкой скорости (~ 3500 оборотов в минуту).
- Добавить 1 мл 70% этанола, ресуспендируйте мягко и оставить на ночь при 4 ° С (может хранить до бесконечности при -20 ° C).
5. Процедура Гибридизация
- Подготовьте раствор для гибридизации: к 100 мкл буфера для гибридизации, добавьте 1-3 мкл зонда, то вихрем и центрифуги. Певица зондов использовать 8-10 нг Всего за комплект зонда (т.е. на ген). Мы отображаемого до 3 генов одновременно с 3-DIFferent меченого зонда устанавливается.
Будьте уверены, чтобы нагреть гибридизации раствора до комнатной температуры перед его открытием.
Для Stellaris зонды, рекомендуется, чтобы начать 4 отдельных реакций гибридизации путем добавления 1 мкл каждого из 1:10, 1:20, 1:50 и 1:100 рабочего разведения зонды, какой из них является оптимальным. Рабочее разведений Stellaris зонды готовили в буфере для гибридизации.
- Центрифуга (для всех последующих шагов; 3500 оборотов в минуту, 5 мин) фиксированные клетки (например, 200 мкл) и аспирации от этанола.
- Аккуратно ресуспендируйте в 1 мл промывочного буфера, содержащий те же формамидом процентах как буфера для гибридизации. Дайте постоять 2-5 мин.
- Центрифуга образца и аспирация промывочного буфера, а затем добавить раствор для гибридизации. Инкубируют в темноте при осторожном встряхивании, O / N при 37 ° С.
Примечание: Следующая процедура предназначена для применения / изображений на покровных клетках. Для Wозоления / изображений клеток в 96-луночных планшетах, включая альтернативные активных форм кислорода мусорщик решения см. http://www.biosearchtech.com/stellarisprotocols.
- На следующий день, или заранее, в чистоте (см. процедуры) и лечения покровные стекла с 150 мкл 0,01% поли-L-лизин в течение 5 мин. Аспирируйте, дайте высохнуть, промыть 3 раза с ГД 2 O и дайте высохнуть.
- Утром добавляют 1 мл промывочного буфера для образца, осторожно ресуспендируют, центрифуги и аспирации, а затем ресуспендируют в другой 1 мл промывочного буфера и инкубируют при 37 ° С в течение 30 мин.
- Промыть 2Х SSC + 0,1% Тритон Х-100 при комнатной температуре 15 минут на шейкере.
- Возьмите монтажа средних из морозильника, чтобы позволить ему подойти к комнатной температуре до начала монтажа.
- Промыть 1X SSC при комнатной температуре 15 мин на шейкере.
- Развести DAPI в PBS (0,1 мкг / мл окончательный) и ресуспендирования клеток в 150 мкл.
- Место решение на очищенную / поли-лиз-TreaТед покровные стекла в 12-луночный планшет, по крайней мере 30 минут спокойно.
- Удалите раствор (вы можете поместить его на запасной покровного в качестве резервного) и промыть 3 раза с 1 мл 1X PBS.
- Поместите 3 мкл Продли Золотой монтажа среды на слайд (Invitrogen P36934). Делайте это по одному за раз, если у вас есть несколько покровных, чтобы избежать высыхания монтажной среды.
- Добавить ~ 0,5 мл этанола, покровное в 12-луночный планшет, удалите покровные и сухой воздух, удерживая с помощью пинцета.
- Поместите клетки покровного стекла стороной вниз на монтажную среду и пусть затвердевают несколько часов или O / N в темноте.
- Печать края с лаком для ногтей и приступить к визуализации.
6. Изображений клеток с Olympus IX-81 Перевернутый Обзор микроскоп
- Для получения изображения мы используем Slidebook (интеллигентного imaging.com) программного обеспечения и 100X, 1,45 Н.А., TIRFM нефти цели. Для последовательной GFP, DAPI, Cy3, Cy3.5 и Cy5 изображения: Chroma наборы фильтров (см. реагентов).
- Используйте фильтры DAPIнайти и сосредоточиться клеток.
- Установить в качестве точки отсчета.
- Возьмите Z-стек изображений вокруг опорной точки, где общее расстояние составляет 5 мкм с размером 0,2 мкм (25 самолетов). Повторите эти действия для каждого канала красителя (т.е. каждый набор зондов).
- Экспорт в 16-битные TIFF для анализа изображений.
7. Анализ изображения Обзор (Singer зонды)
Ниже мы приводим схему вычислительных методов мы используем для анализа FISH изображения в MATLAB. Соответствующих функций MATLAB использованы в скобки справа. Алгоритмы и пороги сейчас настроены для данных с зондов Певица стиля. Использование зондов Stellaris стиль потребует некоторого регулировки, в частности, к конечной стадии фильтрации (7.8).
Идентификации ячейки 15
- Отдельные клетки от фона, используя глобальный порог на 16 DAPI изображения [graythresh].
- Определить ядер с использованием расширенных функций максимумов [IMextendedmax].
- Сегмент клеток с использованием ядер семян для водоразделе алгоритм [водоразделом].
Найти места в каждом канале флуоресценции
- Выполните TopHat преобразования для нормализации фона и улучшить отношение сигнал-шум [bwmorph].
- Найти максимумы для идентификации в фокусе слой (в плоскости г) для каждого пятна [imregionalmax].
- Фильтр потенциальных мест с использованием линейной модели подходят к радиальным градиентом.
Измерение интенсивности месте и одним фильтром против нескольких сигналов зонда
- Fit 2D гауссовым профилем на место в ранее выявленных в фокусе слоя и оценку интенсивности 17.
- Фильтр из слабых мест с использованием порогового уровня (по гистограмме). Для зондов Зингера это важно, но в меньшей степени для Stellaris зондов.
- Граф пятна в каждой клетке.
Результаты
3 показана типичная гистограмма вычисляется из FISH изображения и используется для определения количества мРНК присутствует в отдельные клетки. Важным преимуществом микроскопии на основе количественного РНК является то, что можно получить информацию о локализации транскриптов. Например, мы использовали FISH для выявления мРНК в одиночных камерах индуцибельного CBF1 аллели (рис. 4). Поскольку многие молекулы мРНК, которые присутствуют на месте транскрипции, мы можем определить наличие и расположение сайтов транскрипции в ядре.
За счет использования различных красителей для маркировки мРНК различных генов, можно количественно нескольких видов мРНК в тех же клетках. Чтобы продемонстрировать это, дрожжевые клетки инкубировали в присутствии α-фактора и сорбит. FUS1 транскрипции (Quasar670 краситель, красный) индуцируется α-фактора. STL1 транскрипции (Квазар 570 красителя, зеленый) индуцируется повышение внеклеточных осмолярности ( Рисунок 5). Рисунок 4 является примером FISH с певицей зондов. Рисунок 5 является примером рыбы с Stellaris зондов.
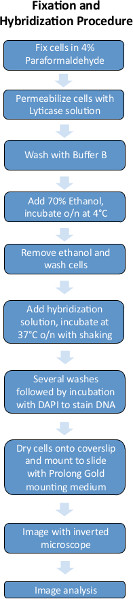
Рисунок 1. Схема экспериментальной процедуры FISH. Нажмите здесь, чтобы увеличить рисунок .

Рисунок 2. Схематическое изображение трубопровода анализа. Конечный пятна определяются в крайнем правом рисунке.
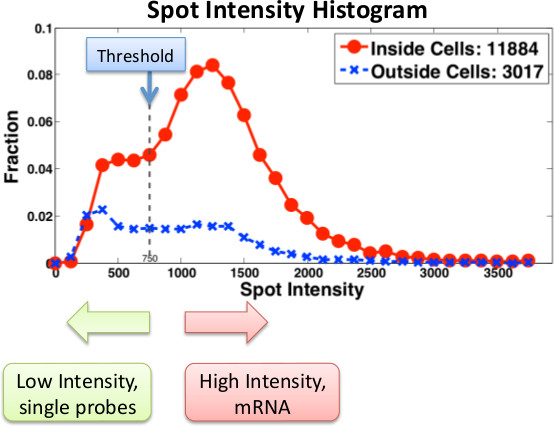
Рисунок 3. Гистограмма интенсивности месте для конкретного гена с использованием Певица зондов . Датчик интенсивности вычисляются как внутри, (красный) и внешним (синий) клеток. Низкая интенсивность пятна либо шумов или одинарных зондов. Настоящее сообщения мРНК помечены с несколькими зондами. При использовании Stellaris зондов, один зонды менее обнаруживаемые и, следовательно, пороги и фильтрации должны быть соответствующим образом скорректированы.
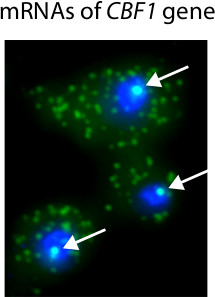
Рисунок 4. Представитель результаты Певица процедуры FISH. В этом эксперименте CBF1 транскрипции активируется с индуцируемым промотором 18. Ядра окрашиваются в синий с DAPI. CBF1 мРНК помечены Cy3-меченых зондов. Белые стрелки обозначения присутствия CBF1 сайтов транскрипции в ядре. Одноместный транскриптов мРНК видны в цитоплазме.
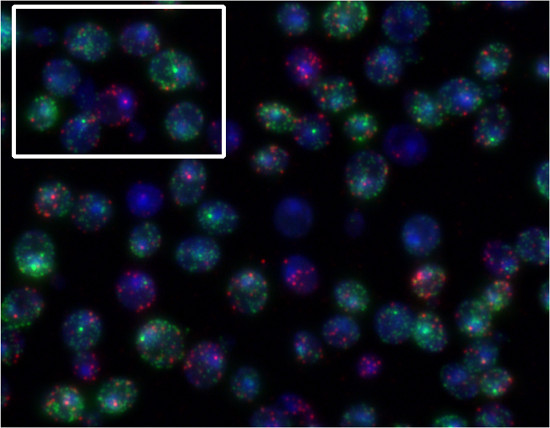
Рисунок 5. Представитель результаты Стелларис процедуры FISH. Клетки дрожжей МАТа одновременно воздействию 30 нг / мл α-фактора и 0,75 М сорбитол в течение 10 мин и одновременно исследовали на FUS1 (Квазар 670, красный) и STL1 (Квазар 570, зеленый) транскриптов. В выделенном окне, мы можем видеть одну ячейку реагируя только на феромоны (FUS1 стартовый сайт, красный), а другой преимущественно в ответ на сорбит (STL1 сайт начала, зеленый).
Обсуждение
На сегодняшний день, в первую очередь рыба была низкой пропускной методом. Использование Cy3, Cy3.5 и Cy5 красители ограничивает количество генов можно исследовать на отдельные клетки до трех одновременно. Некоторые дополнительные зонды были разработаны (Stellaris), но количество различимых зондов по-прежнему не более семи. Чтобы обойти это ограничение, комбинаторные маркировки стратегии с использованием нескольких флуорофоров были использованы для создания штрих-кодов для различных видов мРНК 19,20. Совсем недавно, Любек и Цай использоваться оптические и спектральные штриховое кодирование для количественной 32 различных видов одновременно с рыбой в одиночных клетках дрожжей 19. Один из недостатков этого недавнего комбинаторный подход требует использования сверхразрешения микроскопии. Анализ необходимо различать штрих зондов также довольно сложным.
Мы обнаружили, что Cy3 и Cy3.5 предпочтительнее Cy5 для рыб экспериментов. Один из недостатков Cy5 краситель является его чувствительностьк фотообесцвечивания. Тем не менее, Stellaris недавно разработала Cy5 варианты, которые рекламируются как более устойчивы к фотообесцвечивания, и может облегчить это технический вопрос. Также стоит отметить, что рыба дорогая метод для реализации, и что обе певицы и Stellaris зондов обычно стоят $ 700 - $ 1000 за набор зондов, хотя цены на коммерчески доступных зонды должны уменьшаться в будущем. Щадящая реагентов и эффективной маркировки приносит Певица зондов до нижнего диапазона в цене.
Одним из основных технических задач является разделение одного против нескольких зондов пятна, которые требует реализации сложных точечного определения алгоритмов. Это может занять обширный обзор руководства, чтобы настроить параметры анализа изображений для конкретных экспериментальных установок. Схема нашей вычислительной трубопровода с соответствующими функциями MATLAB приведена в разделе 7 Протокола. Этот вопрос несколько облегчены Stellaris пробы, которые обладают только одна метка на зонде. Поэтому требуется колокализации несколькими зондами видеть сигнала.
Поскольку FISH требует фиксации клеток, он не облегчает отслеживание отдельных клеток с течением времени. Ранее мы использовали данные FISH снимок реконструировать динамику экспрессии генов в отдельных метаболически Велоспорт дрожжей населения 6. Метаболический Велоспорт наблюдается в предварительно морили голодом, непрерывными культур, и характеризуется общепопуляционными коллективные колебания в потреблении кислорода. Эти колебания связаны с геном-широкие колебания, которые происходят стенограммы половина всех генов дрожжей на разных этапах потребления кислорода. Мы стремились, чтобы определить, метаболические Велоспорт присутствовал в несинхронизированную непрерывной культуры дрожжей. Если присутствует, стенограмм, которые антикоррелированы в синхронных групп населения также должны быть антикоррелированы несинхронизированную в одиночных камерах, и наоборот для коррелированных транскриптов.
ЛОР "> Для восстановления динамики производства в мРНК время наблюдаемые данные снимка должно быть по сравнению с тем, что ожидается от модели базового поведения. Существуют теоретические ограничения, когда такие" снимки "данных экспрессии генов может быть использован для определения основной динамики экспрессии генов и какие виды моделей можно выделить 21. для метаболического цикла данных, а не непосредственно показывающие наличие временных колебаний, статистические измерения были осуществлены обосновать, что на самом деле существует автономная ячейка колебательные программы в соответствии с объемной микрочипов измерений.Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие между собой финансовые интересы.
Благодарности
Это исследование было поддержано грантами GM046406 (к БД) и Национального института общих медицинских наук Центра биологии Количественный (GM071508). RSM признает финансирование из NSF Высшее исследовательский грант. MNM поддерживается Льюиса Сиглера стипендий. Мы хотели бы выразить признательность членам Botstein лаборатории за полезные обсуждения и бывших членов Allegra Петти и Николай Славов за их вклад в метаболический цикл проекта. Мы благодарим Даниэля Zenklusen Роберт Зингер и для того, чтобы нас начали с рыбой методом.
Материалы
| Name | Company | Catalog Number | Comments |
| Vanadyl Ribonucleoside Complex | NEB | S1402S | |
| Lyticase | Sigma | L5263 | |
| E. coli tRNA | Roche | 1010954001 | |
| BSA (RNase free) | Ambion | ||
| Beta-mercapt–thanol | Fisher | 03446l | |
| DAPI, dilactate | Sigma | D9564 | |
| PBS 10X (RNase free) | Ambion | AM9624 | |
| Triton X-100 | Shelton Scientific | ||
| Dextran sulfate | Sigma | D6001 | Or equivalent |
| Saline-sodium citrate (SSC) 20X | VWR | 82021-484 | |
| Formamide (deionized) | Ambion | AM9342 | |
| Nuclease-free water | Ambion | AM9932 | |
| Alpha-D-glucose | Sigma | 158968 | For GLOX solution |
| 1 M Tris-HCl, pH 8.0 | Ambion | AM9855G | |
| 100% Ethanol | |||
| Glucose oxidase | Sigma | G0543 | For GLOX solution |
| Catalase | Sigma | C3155 | For GLOX solution |
| Concanavalin A | MP Biomedicals | 150710 | |
| Polylysine (0.01%) | Sigma | P8920 | |
| Coverslips | Warner Instruments | Cs-18R15 | |
| Prolong Gold Mounting Medium | Invitrogen | P36934 | |
| QIAquick Nucleotide Removal Kit | QIAGEN | 28304 | |
| FISH Probes | Biosearch Technologies | Custom order for your desired mRNA sequence | |
| Glass bottom 96-well plates | Nunc | 265300 | Alternative to coverslips |
| 12-well plates | BD Falcon | 351143 | |
| Cy3, Cy3.5, Cy5 dyes | GE Healthcare | monofunctional NHS-ester | |
| EQUIPMENT | |||
| Plasma-Preen I Cleaner | Terra Universal | 9505-00 | Controller (Cat #9505-17 optional) |
| Vacuum Pump | Alcatel | 205SDMLAM | For operating Plasma-Preen |
| Widefield Fluorescence Microscope | Olympus | IX81 | Or equivalent |
| 100X objective | Olympus | 1-UB617R | |
| Light Source | X-Cite | XCT 10-A | Or equivalent |
| Filter Sets | Chroma | U-NSP100V2-SPR, U-NSP101V2-SPR, U-NSP102V2-SPR, U-NSP103V2-SPR,U-NSP104V2-SPR. | |
| Cooled CCD or EMCCD Camera | Hamamatsu | C4742-98-24ER | |
Ссылки
- Femino, A. M., Fay, F. S., Fogarty, K., Singer, R. H. Visualization of single RNA transcripts in situ. Science. 280, 585-590 (1998).
- Gall, J. G., Pardue, M. L. Formation and Detection of Rna-DNA Hybrid Molecules in Cytological Preparations. Proceedings of the National Academy of Sciences of the United States of America. 63, 378 (1969).
- Jones, K. W. Chromosomal and Nuclear Location of Mouse Satellite DNA in Individual Cells. Nature. 225, 912 (1970).
- Bauman, J. G., Wiegant, J., Borst, P., van Duijn, P. A new method for fluorescence microscopical localization of specific DNA sequences by in situ hybridization of fluorochromelabelled RNA. Exp Cell Res. 128, 485-490 (1980).
- Singer, R. H., Ward, D. C. Actin gene expression visualized in chicken muscle tissue culture by using in situ hybridization with a biotinated nucleotide analog. Proc. Natl. Acad. Sci. U.S.A. 79, 7331-7335 (1982).
- Silverman, S. J., et al. Metabolic cycling in single yeast cells from unsynchronized steady-state populations limited on glucose or phosphate. Proc. Natl. Acad. Sci. U.S.A. 107, 6946-6951 (2010).
- Trcek, T., Larson, D. R., Moldon, A., Query, C. C., Singer, R. H. Single-molecule mRNA decay measurements reveal promoter- regulated mRNA stability in yeast. Cell. 147, 1484-1497 (2011).
- Bertrand, E., et al. Localization of ASH1 mRNA particles in living yeast. Mol Cell. 2, 437-445 (1998).
- Gandhi, S. J., Zenklusen, D., Lionnet, T., Singer, R. H. Transcription of functionally related constitutive genes is not coordinated. Nat. Struct. Mol. Biol. 18, 27-34 (2011).
- Itzkovitz, S., et al. Single-molecule transcript counting of stem-cell markers in the mouse intestine. Nature Cell Biology. 14, 106-U193 (2012).
- Raj, A., Rifkin, S. A., Andersen, E., van Oudenaarden, A. Variability in gene expression underlies incomplete penetrance. Nature. 463, 913-U984 (2010).
- Raj, A., Tyagi, S. Detection of individual endogenous RNA transcripts in situ using multiple singly labeled probes. Methods Enzymol. 472 (10), 365-386 (2010).
- Trcek, T., et al. Single-mRNA counting using fluorescent in situ hybridization in budding yeast. Nature Protocols. 7, 408-419 (2012).
- Raj, A., vanden Bogaard, P., Rifkin, S. A., van Oudenaarden, A., Tyagi, S. Imaging individual mRNA molecules using multiple singly labeled probes. Nature Methods. 5, 877-879 (2008).
- Otsu, N. A Tlreshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man and Cybernetics. 9, 62-66 (1979).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophys J. 82, 2775-2783 (2002).
- McIsaac, R. S., et al. Fast-acting and nearly gratuitous induction of gene expression and protein depletion in Saccharomyces cerevisiae. Molecular biology of the cell. 22, 4447-4459 (2011).
- Lubeck, E., Cai, L. Single-cell systems biology by super-resolution imaging and combinatorial labeling. Nature Methods. 9, 743-U159 (2012).
- Levsky, J. M., Shenoy, S. M., Pezo, R. C., Singer, R. H. Single-cell gene expression profiling. Science. 297, 836-840 (2002).
- Wyart, M., Botstein, D., Wingreen, N. S. Evaluating Gene Expression Dynamics Using Pairwise RNA FISH Data. Plos Computational Biology. 6, (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены