Method Article
Diseño y fabricación de Ultralight Peso, ajustables Sondas Multi-electrodos para electrofisiológicos grabaciones en ratones
* Estos autores han contribuido por igual
En este artículo
Resumen
Understanding the neural substrates of behavior requires brain circuit ensemble recording. Because of its genetic tractability, the mouse offers a model for circuit dissection and disease mimicry. Here, a method of designing and fabricating miniaturized probes is described that is suitable for targeting deep brain structure in the mouse.
Resumen
El número de investigaciones fisiológicas en el musculus ratón, mus, ha experimentado un reciente aumento, en paralelo con el crecimiento en los métodos de genética dirigidos por disección microcircuito y el modelado de la enfermedad. La introducción de la optogenética, por ejemplo, ha permitido para la manipulación bidireccional de las neuronas identificadas genéticamente-, a una resolución temporal sin precedentes. Para sacar provecho de estas herramientas y obtener una perspectiva de las interacciones dinámicas entre los microcircuitos cerebrales, es esencial que se tiene la capacidad de grabar de conjuntos de neuronas profundamente dentro del cerebro de este pequeño roedor, tanto en los preparativos de la cabeza-fijo y comportarse libremente. Para grabar desde estructuras profundas y capas de células diferenciadas requiere una preparación que permite el avance preciso de electrodos hacia regiones cerebrales deseadas. Para grabar conjuntos neurales, es necesario que cada electrodo sea movible independientemente, permitiendo que el experimentador para resolver las células individuales, dejando Barrioelectrodos ORING inalteradas. Para hacer las dos cosas en un ratón libremente comportarse requiere una unidad de electrodo que es ligero, resistente y altamente personalizable para orientar las estructuras específicas del cerebro.
Se presenta una técnica para el diseño y fabricación en miniatura, peso ultraligero, guías de electrodos Microdrive que son individualmente personalizable y fácil montaje de las piezas disponibles en el mercado. Estos dispositivos son fácilmente escalables y pueden adaptarse a la estructura en la mira; se ha utilizado con éxito para grabar desde regiones talámicas y corticales en un animal de comportarse libremente durante el comportamiento natural.
Introducción
Mus musculus tiene, debido a su maleabilidad genética, se convierten rápidamente en el modelo animal de elección para los fisiólogos interesados en la disección de nivel de microcircuito de neuronas genéticamente determinadas, y en la investigación de los modelos de ratón de la enfermedad humana. Por ejemplo, la reciente introducción de herramientas genéticas causales, tales como actuadores optogenética genéticos y químicos ha permitido experimentadores para probar la necesidad y la suficiencia de los circuitos neuronales identificados en el comportamiento de 1-4. La amplia disponibilidad de transgénicos conductor líneas de ratón recombinante (Cre-líneas), ha ampliado la facilidad experimental por el cual subtipos neuronales están dirigidos, añadiendo al valor del ratón para estos experimentos 5.
Del mismo modo, las pantallas de genética y amplias asociaciones del genoma de los trastornos neurológicos y psiquiátricos comunes han facilitado la identificación de factores de riesgo genético para la enfermedad cerebral 6,7. Estos avances, combinados con el crecimientocaja de herramientas para la manipulación genética y la ingeniería del genoma en ratones, han hecho que el organismo de elección para modelar enfermedades humanas. La combinación de modelos de enfermedad y herramientas genéticas causales ofrece una oportunidad sin precedentes para la comprensión de las enfermedades del cerebro y la identificación de objetivos a nivel de circuito para las intervenciones.
Para aprovechar plenamente estas herramientas moleculares y obtener una perspectiva de la función microcircuito en la salud y la enfermedad, que es esencial para acoplarlos con lecturas fisiológicas de la actividad cerebral. Idealmente, el experimentador sería capaz de supervisar un gran número de neuronas mientras se mantiene la resolución de una sola célula. Extracelulares, grabaciones multi-electrodos en animales comportarse libremente ofrecen tales oportunidades; sin embargo, el uso de esta tecnología en el ratón ha sido limitada. Para grabar de blancos pequeños (por ejemplo, la capa CA1 en el hipocampo), es necesario ya que los pequeños movimientos en electrodos de registro siguientes Surgic el uso de electrodos ajustablesal implante que sea imposible mantener la estabilidad de grabación 8,9. Tradicionalmente, los métodos que se han empleado para mover los electrodos dentro del cerebro imponen limitaciones de peso cuando se usa en el ratón, por lo que es difícil de grabación de par de un gran número de neuronas con el comportamiento en este organismo.
Aquí, se introducen métodos para fabricar,, microelectrodos ultra-ligeros en miniatura que son individualmente personalizable para la región del cerebro está dirigida, la optogenética-compatible y fácilmente ensamblados de partes disponibles en el mercado. Cada "Microdrive" dentro de la multi-electrodo "hyperdrive" utiliza un mecanismo de resorte y el tornillo para hacer avanzar el electrodo y un riel de plástico, construido en el cuerpo hyperdrive, para contrarrestar el par del tornillo. En primer lugar, se describe el proceso de diseño de los órganos de hipervelocidad y microdrives en un programa de CAD para la impresión 3D. Mediante el diseño de cuerpos de hipervelocidad que se personalizanpara estructuras específicas, es posible aumentar la precisión de la focalización y para aumentar aún más el rendimiento de la preparación. En segundo lugar, el proceso de fabricación se describe en detalle, en el que la matriz multi-electrodo está montado a mano a partir de piezas que están disponibles comercialmente. Esta técnica se ha utilizado, con éxito, para grabar desde conjuntos de neuronas en el hipocampo, el tálamo y la corteza en el animal libremente comportarse durante forrajeo natural y operante tareas.
Protocolo
1. Diseño Intención
- Identificar la región cerebral de elección (núcleo geniculado lateral (LGN, tálamo visual)) desplazándose por las secciones sagitales de los atlas del cerebro del ratón electrónicos.
- En coordenadas A / P (-2,3 a -2,7 mm), el LGN es más amplia. Utilice esta región para diseñar la parte inferior de accionamiento (inferior),.
NOTA: Un total de 8 electrodos independientemente móviles puede ser utilizada para combatir LGN (4-6 electrodos harán al LGN, se añaden 2-4 electrodos para compensar los errores de implantación, la Figura 1A). - En Solidworks, dibujar un boceto del diseño del cuerpo (Figura 1B) en el plano frontal. Haga clic en boceto y, a continuación, utilizar la combinación de líneas y curvas para dibujar un boceto que incluirá los contornos de las bases en coche, manijas y poliamida medio ranuras, como se muestra. Asegúrese de que el contorno no contiene ninguno de los huecos abiertos. Luego haga clic en Salir Sketch.
- A continuación, seleccione ambos planos frontales y, y haga clic en "Create Eje ". A continuación, cree el modelo de cuerpo de diseño 3D girando el contorno dibujo azul resaltado (Figura 1B) 360 °. En el menú de funciones, haga clic en "Revolución de saliente / base". Elija la línea media como el eje de revolución. En la sección Parámetros, bajo la dirección 1 clic Ciegos y, bajo ángulo de seleccionar 360,00 grados. En la sección de curvas de nivel seleccionado, asegúrese de que el azul destacó contorno es la seleccionada.
- Crear una poliimida media ranura en la rotación del rojo contornos 13 ° (Figura 1C, la parte superior izquierda) destacó. Los pasos son idénticos a 1.4 anterior, excepto para la indicación de ángulo
- Cree una unidad maneja girando el contorno verde 15 ° (Figura 1C, arriba a la derecha).
- Crear la segunda asa de la unidad mediante la función de patrón circular (Figura 1C, abajo a la izquierda). En el menú de funciones, haga clic en "modelo circular". En los parámetros, seleccione la línea media como eje de revolución. Seleccione 180,00 grados como el ángulo, y 2 como el número de casos. Asegúrese de que el primer mango está seleccionado en "Operaciones para crear matriz".
- Crear dieciséis poliimida medias ranuras utilizando la función patrón circular (Figura 1C, abajo a la izquierda). Realice movimientos similares a 1.7, pero seleccione la primera media ranura poliimida como las "Operaciones para crear matriz". El ángulo es de 22,5 ° y el número de casos son 16 (Nota: esto es sólo 360 ° dividido por el número de veces que desea que el patrón de la función)
- Crear un nuevo plano en el que dibujar el receptáculo poliimida. Lograr esto haciendo clic en "Insertar" en el menú principal. Haga clic en "Geometría de referencia", seleccione los dos lados de las ranuras medio de poliimida, y luego haga clic en "Crear nuevo Plane"; (Figura 1D, arriba)
- Crear el receptáculo Microdrive (el orificio del tornillo, agujero poliimidas y ferrocarril anti-torsión (Figura 1D, abajo). Lograr esto mediante la creaciónun boceto que abarca todas estas características en el nuevo plano creado en 1.9. Tenga en cuenta que para los carriles anti-torsión, defina una línea central entre los dos lados de las ranuras superiores de poliamida. Entonces, dibujar los carriles anti-torsión mediante la creación de dos círculos perpendicular a la línea central, cuyos centros están separados radio 1, y luego recortar el contorno medio.
- En el menú de funciones, haga clic en "Extrusión saliente / base" para crear el carril antipar y elegir una extrusión ciego de 10 mm que van hacia arriba y 2 mm de ir hacia abajo. Por el agujero del tornillo y el agujero de poliamida, haga clic en "corte Extrusión", y elegir 6mm ciego, y algunos mms van al alza tanto (Figura 1E, izquierda).
- Patrón el receptáculo micro-unidad de 16x, utilizando el centro como el eje de revolución (22,5 °, 16 casos, separación igual), (Figura 1E, derecha)
- En la parte superior de la empuñadura, dibujar una caja de 3 mm x 3 mm a partir de la punta del centro de la empuñadura de accionamiento, frente a la de una central dexis. Extruya este 2 mm hacia arriba usando la función "Extrusión Boss". Dibuja círculos de 1 mm de diámetro en los lugares en los que los tornillos del BEI continuará. Después, hace 1,5 mm "Extrude Cut" para hacer un agujero. Entonces, el patrón de la caja y el agujero dos veces utilizando la función Patrón Circular (Superposición de texto: 180 °, 2 casos, el mismo espacio, alrededor del eje central).
- Utilice las dimensiones (en milímetros) en la figura 1F para dibujar un boceto pieza superior. Utilice la opción "Extrusión saliente / base" para hacer un modelo 3D de la misma.
NOTA: Después de estos pasos el diseño de la unidad está completa. El cuerpo duro físico se crea a través del proceso de estereolitografía. Hay una serie de empresas que ofrecen la impresión de estereolitografía basado en archivos STL. Recomendamos los servicios que pueden imprimir en plástico duro (como Accura® 55), con una resolución mínima de al menos 0,1 mm.
2. Preparación de Componentes Hyperdrive
- Coloque una pequeña(: '. / 0116' ID / OD 0.0071 ''; pared: 0,00225) trozo de cinta de doble cara en una superficie plana y cortar el número necesario de 31 tubos de poliimida G a aproximadamente 8 centímetros (Figuras 2A - 2B) .
- Coloque la primera capa de tubos de guía de la cinta de doble cara, teniendo cuidado de colocar tubos de guía lo más cerca posible el uno al otro en la cinta. Frote una pequeña cantidad de delgada, pegamento de cianoacrilato sobre la capa de poliimidas. (Figura 2C)
- Rápidamente diseñar una segunda capa de poliimidas (Figura 2D).
- Crear un marcador de posición de fibra óptica utilizando una cánula de 26 g. Asegúrese de que este está lubricado con un lubricante a base de teflón antes de ser incorporado en el montaje (Figura 2E).
- Aplicar una línea de epoxy 4-5 mm de longitud perpendicular al haz de poliimida (Figura 2F). Una vez que el epoxi haya endurecido (2-3 horas), retire el adhesivo de la capa inferior y reePoxy el otro lado. Después de que el epoxi se ha endurecido de nuevo, el 26 T cánula se puede quitar y el constructo de corte en el medio utilizando una hoja de afeitar (Figura 2G), resultando en dos matrices de poliimida, cada uno de los cuales pueden ser utilizados para una hyperdrive (Figura 2H).
- Imprimir la plantilla de cono en una hoja de papel transparente y cortar una hoja de papel de aluminio correspondiente servicio pesado (Figuras 3A - 3C).
- Aplicar una capa de epoxi para la hoja de aluminio y aplicar rápidamente el papel de la transparencia. El uso de un objeto pesado o una clavija de madera, suavizar el epoxi de manera que se distribuye de manera uniforme (Figura 3D).
- Corte la plantilla de cono y la abrazadera juntas usando una pinza. Por último, utilice otro poco de epoxi para fijar permanentemente las piezas (Figura 3E).
3. Montaje Final del Microdrive
- Conecte el BEI para el cuerpo en coche, Y vuelva a insertar la cánula 26 T a través de la matriz de tubo guía de poliamida. Alinear la matriz de poliamida con el cuerpo duro utilizando el agujero de fibra óptica en el BEI para asegurar que los tubos de guía son perpendiculares al BEI y epoxi de la matriz para el cuerpo duro que velan por garantizar que ningún epoxi fluye en los tubos de guía o en la cuerpo duro (Figuras 4A - 4C).
- Asignar cada tubo de guía en la matriz de poliimida a un soporte correspondiente en la pared interna del cuerpo de la unidad. Deslizar un pequeño anillo de 33 g de poliimida sobre cada tubo de guía y en el soporte y aplicar una pequeña cantidad de pegamento de cianoacrilato para fijar cada tubo guía. (Figuras 4D - 4E) Finalmente, epoxi todo el aparato a la pared interna del cuerpo de la unidad y cortar las poliimidas de forma que sobresalgan justo por encima del labio interior (Figuras 4F - 4G).
- Construir un conjunto de Microdrive poniendo uno de la costumbre-btornillos UILT través del agujero central de una pieza superior seguido por uno de los muelles de 5 mm. Deslizar el orificio exterior de la pieza superior sobre uno de los carriles, y conducir suavemente el tornillo. Conducir el tornillo hasta que la primavera llega a su extensión mínima comprimido. (Figuras 4H - 4E) Repita este proceso para cada riel / Microdrive (Figura 4J).
- Gire el array de unidades boca abajo y tomar una imagen de la matriz del tubo guía. Esta imagen se utiliza para asignar la ubicación del tubo de guía correspondiente a cada microdrive (Figura 4K).
- Insertar un tubo de poliimida (0,005 ') en cada tubo de guía de la parte inferior de la base de la unidad. Deje que el tubo portador ampliar 1-2 mm de la parte superior de la Microdrive completamente bajada y registro en la fotografía de la identidad del micro-unidad correspondiente. (Cifras 4L - 4M)
- Epoxi el tubo de poliamida al soporte Microdrive, teniendo cuidado de no let epoxi ejecuta a través de la Microdrive en la primavera o el tornillo (Figuras 4 N, 4P - 4T).
- Baje completamente todos los microdrives. Cortar todos los tubos de poliimida a ras en la parte inferior de la matriz de poliimida (Figura 4O).
- Monte la placa de interfaz de electrodo a la base de unidad con dos # 00-90 x 3.16 '' tornillos (Figura 4R).
NOTA: En este punto la matriz unidad está lista para ser cargada con stereotrodes o tetrodos. Para más detalles sobre la construcción tetrodo y carga, consulte 10. La base de la unidad impresa y los microdrives han sido diseñados en SolidWorks 2011 software CAD 3D: Enlace para descargar archivos de SolidWorks. - Después de la carga, invertir la unidad y cuidadosamente baje el cono de blindaje sobre la unidad de modo que sólo sobresale la pieza inferior. Coloque el cono de apantallamiento por epoxying el cono al cuerpo duro.
- Después se une el cono, tira de una pequeña longitud dealambre de acero inoxidable (0.008 '' Bare, 0.011 '' Coated) y el pasador al BEI. Rayar la parte interior de aluminio del cono con una aguja y conectar a tierra el alambre de acero al cono utilizando pintura de plata. Una vez que la pintura de plata se ha secado, reforzar con un poco de epoxi. Alternativamente, el alambre de acero se puede conectar directamente al cono con un poco de epoxi conductor (MG Chemicals, Surrey, Canadá).
Resultados
Construcción del implante es un proceso que comienza con el diseño de la hipervelocidad 3D impreso (Figura 1), de proceder a la construcción de la pieza inferior (Figura 2), el cono de apantallamiento (Figura 3), y el montaje final de la hipervelocidad, por construcción individual de los microdrives (Figura 4). Estos pasos son seguidos por la carga de los microdrives con electrodos (ver 10). Después de esta etapa, es posible utilizar estos dispositivos para grabar desde múltiples regiones del cerebro. En la Figura 5, ejemplo traza de una grabación simultánea del núcleo geniculado lateral (LGN) y del hipocampo (HPC) se muestran. La estabilidad de las unidades individuales se muestran en la Figura 5B ha sido notable, que muestra formas de onda constante durante un transcurso de varios días. Estas neuronas se confirmaron para ser LGN neuronas por ser sensibles a la estimulación diodo emisor de luz, como se muestra por laperistimulus tiempo histograma (PSTH) en la Figura 5C. En esta misma preparación, HPC potencial de campo local se registró como un proxy para el estado conductual. Estos rastros mostraron ondas agudas onda (Figura 5D), durante la quiescencia de comportamiento, en consonancia con su origen hipocampal.
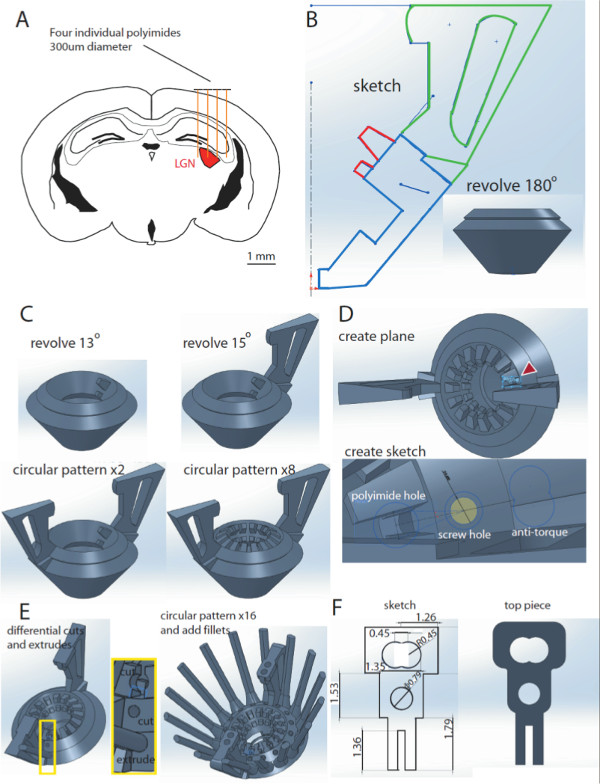
Figura 1 Diseño de la hipervelocidad en Solidworks. A. Representación esquemática de una sección coronal de un cerebro de ratón en A / P coordina -2,3 a -2,7 mm desde el bregma. Cuatro poliimidas individuales (300 m) se dibujan encima de la corteza, que ilustra la orientación de la región de LGN (rojo) con electrodos. B. Esbozo del cuerpo de diseño. Rotatorio del contorno azul 180 ° da como resultado un modelo del cuerpo de diseño 3D (recuadro). C. La adición de ranuras de poliimida y unidad maneja al cuerpo de diseño. Rotatorio del highl rojocontornos ighted en B por 13 ° da como resultado una media ranura poliimida (arriba izquierda). Un asa de la unidad se añade al hacer girar el contorno verde en B por 15 ° (arriba a la derecha). El segundo mango se agrega mediante la función de patrón circular (parte inferior izquierda). La misma función se puede utilizar para crear las ranuras medio de poliamida 16 (inferior derecha). D. Un nuevo avión se añade al diseño (arriba), que permite crear un nuevo boceto para el receptáculo Microdrive, compuesto por el orificio del tornillo, poliimidas agujero y ferrocarril antipar (parte inferior). E. Estas funciones se llevarán a cabo en el diseño de utilizar las funciones de corte y extrusión y giraron 360 ° para crear 16 receptáculos. F. Dimensiones del boceto pieza superior (izquierda) y el modelo 3D (derecha ). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 Preparación de la pieza inferior de la hipervelocidad. A. El primer tubo de poliimida se coloca en una cinta de doble cara. B. tubos posteriores se colocan individualmente, teniendo cuidado de minimizar el espacio entre los tubos. C. Después de la primera capa se presenta , una capa delgada de pegamento de cianoacrilato se aplica D. Una segunda capa de poliimidas se añade rápidamente antes de que se seca el pegamento. E. En la parte superior del haz de poliimidas, se añade un T cánula 26 como un marcador de posición para la fibra óptica. F . Toda la construcción se fija de forma segura con una gota de epoxi. G. Después de la retirada de la cánula, el constructo se puede cortar en el medio con una hoja de afeitar, proporcionando dos piezas inferiores idénticos. H. Ver en la superficie de corte de un acabado pieza inferior, lo que ilustra las dos filas dobles de cuatro poliimidasy el agujero para la fibra óptica. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figura 3 Montaje de la hipervelocidad. A. La matriz de poliimida se inserta en el cuerpo de la unidad, y se alinea con la tarjeta de interfaz electrónica (BEI) utilizando la cánula 26 g. B. Una pequeña cantidad de epoxi se utiliza para fijar la matriz de poliimida para el cuerpo de accionamiento. C. Una segunda aplicación de epoxi puede ser necesario, después de lo cual el exceso de epoxi debe dremeled vista en D. superior en el cuerpo de la unidad con la matriz insertada. E. El uso de un pequeño trozo de tubo de poliimida 33 G, el exterior tubos guía están fijados en las ranuras correspondientes del cuerpo duro. F. Todos los tubos de guía exteriores deben ser mapeados a un carril, teniendo cuidado de minimizar la tensión en los tubos. G. Después de todos los tubos de guía exteriores se asignan, se debe fijar con resina epoxi y se corta justo por encima del labio interior. H. Un Microdrive montaje, que consiste en un tornillo de la medida, un resorte de 5 mm y una pieza superior debe ser montado y se coloca sobre un carril correspondiente a uno de los tubos de guía. I. Cada conjunto microdrive debe ser atornillado cuidadosamente en el cuerpo de accionamiento. J. Después del montaje, cada tubo guía debe tener un Microdrive correspondiente K. Vista inferior de la poliimida matriz L -.. M. Tubos de poliimida (0,005 ') se insertan en cada tubo guía exterior. N. Cada tubo guía interior debe encajar perfectamente en el tenedor de él es Microdrive correspondiente. O. Los tubos de poliamida interiores están unidos con epoxi para el Microdrive correspondiente ycortar tan corto como sea posible. Después de todos los tubos de guía interiores están pegado con resina, los tubos de guía interior que sobresalen de la poliamida-matriz se deben cortar a ras con el borde de la matriz. P. invertido visión macro de la unidad durante la carga del tubo guía interior. Q. Top visión macro de la unidad durante la carga interior del tubo guía. R. Totalmente montado hyperdrive con el BEI adjunta, listo para ser cargado con electrodos. Por favor haga clic aquí para ver una versión más grande de esta figura.

. Figura 4 Preparación del cono de apantallamiento plantilla A. Cono impreso en papel transparente B -. D. Una hoja de papel de aluminio se encola a la plantilla utilizando una capa fina de epoxi. E. < / Strong> Después de cortar la plantilla, se forma el cono y pegados con epoxi.

Figura 5. grabaciones multi-sitio utilizando el hyperdrive ultraligero-peso. A. Imagen de un ratón libremente comportarse con la hipervelocidad implantado. B. Ejemplos de dos formas de onda única unidad grabaciones de este ratón. C. Izquierda, Sección coronal del cerebro de ratón destacar el núcleo geniculado lateral, donde algunos de los electrodos se redujeron. Derecha, ejemplo peristimulus histogramas de tiempo (PSTHs) de dos neuronas LGN alineados a la estimulación visual (barra amarilla). D. Derecho, sección coronal destacando el hipocampo (HPC), donde se redujeron otro conjunto de electrodos. Derecha, ejemplo de campo local de potencial grabación de una ondulación del hipocampo (resaltado en rojo).

Figura 6 Visión general de los componentes de accionamiento. (Izquierda) Visión de conjunto de los componentes de hipervelocidad. (Derecha) Ilustración de na asamblea Microdrive individual.
Discusión
Este protocolo describe el proceso de construcción de una matriz Microdrive ultra-ligero para dirigir una o varias regiones del cerebro en el ratón. Después de las etapas finales de la construcción, la hipervelocidad está listo para ser implantado utilizando técnicas de implantación quirúrgica estándar y se fija al cráneo del ratón con cemento dental. Mensaje de la implantación, los electrodos puede ser avanzado de forma independiente cada uno con un destornillador pequeño, mientras que el ratón está inmovilizado con las manos. La distancia que cada uno por turno avances de electrodos se determina por el paso del tornillo. Utilizando los tornillos que se hace referencia aquí avanza cada electrodo aproximadamente 150 mm por vuelta, aunque medio y cuartos de vueltas se pueden usar para una mayor resolución.
Las dimensiones del trazo de la figura 1B determinan el tamaño global del implante, por lo tanto, una manera obvia a escala implantes bidireccionalmente es cambiar las dimensiones en que bosquejo crítico. Además, THe longitud de los tornillos puede ser extendida para apuntar estructuras cerebrales más profundos. Recomendamos ENCARGO tornillos de titanio, como los que son luz y menos frágil que el acero. Tenga en cuenta que los rieles antipar necesitan para escalar linealmente con la longitud del tornillo, y en este punto no han determinado la duración máxima a que estas estructuras se pueden imprimir. Para dirigirse a múltiples regiones del cerebro, la forma de la pieza de fondo puede ser modificado. La adición de arandelas conocidos de tamaño (espesor de 200 micras), podría proporcionar espaciadores necesarios entre poliimidas dirigidas a estructuras cerebrales separadas (por ejemplo, el hipocampo y la corteza prefrontal). Estos podrían ser incluidos en los pasos de montaje pieza inferior, y más tarde cortados después se endurece la resina epoxi.
Una gran limitación de este diseño es su dependencia del software propietario (Solidworks en este caso). El desarrollo futuro de los programas de código abierto que proporcionan interfaces de usuario amigable propicio para el diseño de estos equipos con un mínimo backg ingenieríaronda sería de enorme beneficio para la comunidad de las neurociencias.
Este método ofrece varias ventajas sobre los métodos existentes. En primer lugar, el diseño es simple, depende de muy pocos bocetos (Figura 1). En segundo lugar, es ultra-ligero, que no requiere cemento dental o un material grueso para entrar en su asamblea. En general, pesa alrededor de 1,7 g - casi un tercio del peso de los implantes disponibles comercialmente de una funcionalidad similar. En tercer lugar, no requiere equipo especializado para hacer - el cuerpo del implante puede ser impreso en 3D a partir de múltiples fuentes (por ejemplo approto.com, pero hay varios otros); los tornillos pueden ser personalizados (por ejemplo antrinonline.com); los resortes están disponibles comercialmente (por ejemplo leesprings.com); y como resultado todo el proceso de montaje puede suceder en un día. Finalmente, estos implantes se han utilizado para grabar desde múltiples regiones del cerebro durante la búsqueda de alimento natural, las tareas de comportamiento estructurados y del sueño (Figura5).
Las futuras aplicaciones de este método incluyen la implementación de su escalabilidad. Es probable que el implante puede ser bidireccional escala simplemente cambiando 1) el tamaño del trazo de la figura 1B y, 2) el número de receptáculos Microdrive (Figura 1D) estampadas. Por ejemplo, se puede escalar hacia abajo para registro de ratones comportarse libremente en el desarrollo temprano, y se escala hacia arriba para grabar a partir de ratas, conejos, hurones y primates no humanos tal vez.
Una última palabra es para recordar al lector que fundamental para la implementación exitosa del método descrito es para crear prototipos que implementan las modificaciones a .stl archivos de diseño unidos. El lector se dará cuenta, por ejemplo, que el diseño adjunto figura la "figura 8" carril antipar. Este fue el mejor diseño posible dada la limitación de la impresión en 3D, ya que a menudo se requiere que perforamos estos agujeros. Tener que ser un círculo, lo compestabilidad romise, pero tener que ser un cuadrado o una forma en ángulo limitaría la capacidad de fijar las imperfecciones de impresión en 3D mediante perforación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
We thank members of the Wilson lab for their helpful advice on the fabrication method.
This work was supported by the Simons Foundation, a NIH pathway to independence career award from the NINDS and a NARSAD Young Investigator Award (to M.M.H.) as well as grants from the NIH (to M.A.W.).
Materiales
| Name | Company | Catalog Number | Comments |
| Microdrive screws | Antrin | Half Circle 0.6 UNM Titanium Screws. 8 mm thread. 9 mm length from under head. | |
| Tap-ease | AGS CO. | #TA2 | Tapping Grease |
| Microdrives | See .STL file | ||
| Drive Body | See .STL file | ||
| Outer Polyimide Guide Tube | Minvasive Components | IWG Item # 72113300022-012 | Length: 12’’, ID: 0.0071’’, OD: 0.0116’’, WALL: 0.00225’’ |
| Inner Polyimide Guide Tube | Minvasive Components | IWG Item # 72113900001-012 | Length: 12’’, ID: 0.0035’’, OD: 0.0055’’, WALL: 0.001’’ |
| Grounding Wire | A-M Systems, Inc. | Catalog # 791900 | 0.008'' Bare, 0.011'' Coated |
| Tri-Flow | Teflon based lubricant - Aerosol | ||
| Microdrive Springs | Lee Spring | Part # CB0050B 07 E | Outside Diameter: 1.016 mm, Hole Diameter: 1.193 mm, Wire Diameter: 0.127 mm, Free Length: 10.160 mm, Solid Length: 3.581 mm |
| Z-poxy 5 Minute | Pacer Technology (Zap) | PT37 | |
| Silver Paint | GC Electronics | Part #: 22-023 | Silver Print II |
| Tri-Flow | 20009 | ||
| 26 G Hypodermic Tube - Stainless Steel | Small Parts | HTXX-26T-12-10 | Length: 12’’, ID: 0.012’’, OD: 0.018’’ |
| EIB screws | Component Supply Co. | MX-0090-03SP | #00-90 x 3/16’’ |
| Fine Scissors - Toughcut | Fine Science Tools | 14058-09 | 22 mm |
| Transparency Paper | 3M | PP2500 | |
| Aluminum Foil | Reynold's Wrap Heavy Duty | Extra Thick |
Referencias
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Halassa, M. M., et al. Selective optical drive of thalamic reticular nucleus generates thalamic bursts and cortical spindles. Nat Neurosci. 14, 1118-1120 (2011).
- Tsien, J. Z., et al. Subregion- and cell type-restricted gene knockout in mouse brain. Cell. 87, 1317-1326 (1996).
- Nestler, E. J., Hyman, S. E. Animal models of neuropsychiatric disorders. Nat Neurosci. 13, 1161-1169 (2010).
- Collins, P. Y., et al. Grand challenges in global mental health. Nature. 475, 27-30 (2011).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Wilson, M. A., McNaughton, B. L. Reactivation of hippocampal ensemble memories during sleep. Science. 265, 676-679 (1994).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados