Method Article
Projeto e fabricação de Ultraleve Peso, ajustável Sondas Multi-eletrodo para gravações eletrofisiológicas em Ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Understanding the neural substrates of behavior requires brain circuit ensemble recording. Because of its genetic tractability, the mouse offers a model for circuit dissection and disease mimicry. Here, a method of designing and fabricating miniaturized probes is described that is suitable for targeting deep brain structure in the mouse.
Resumo
O número de investigações fisiológicas no musculus rato, mus, sofreu um aumento recente, em paralelo com o crescimento nos métodos de genética de segmentação para dissecção microcircuito e modelagem de doenças. A introdução de Optogenetics, por exemplo, tem permitido a manipulação bidireccional de neurónios identificados geneticamente, em uma resolução temporal sem precedentes. Para capitalizar sobre essas ferramentas e obter insights sobre as interações dinâmicas entre microcircuitos do cérebro, é essencial que a pessoa tem a capacidade de gravar a partir de conjuntos de neurônios no interior do cérebro deste pequeno roedor, em ambas as preparações fixo-cabeça e se comportando livremente. Para gravar a partir de estruturas profundas e camadas de células distintas requer uma preparação que permite o avanço precisa de eletrodos para regiões cerebrais desejados. Para gravar conjuntos neurais, é necessário que cada um dos eléctrodos ser independentemente móvel, permitindo que o experimentador para resolver as células individuais, deixando neighbeletrodos Oring imperturbável. Para fazer as duas coisas em um rato comportando livremente requer uma unidade de eletrodo que é leve, resistente e altamente personalizável para a segmentação de estruturas cerebrais específicas.
Uma técnica para a concepção e fabricação de miniatura, peso ultraleve, matrizes de eletrodos de micro-unidade que são individualmente personalizável e facilmente montado a partir de peças disponíveis comercialmente é apresentado. Estes dispositivos são facilmente escalável e pode ser personalizado para a estrutura a ser alvo; que tem sido utilizado com sucesso para gravar a partir de regiões do tálamo e do córtex de um animal comportando livremente durante seu comportamento natural.
Introdução
Mus musculus tem, devido à sua rastreabilidade genética, tornar-se rapidamente o modelo animal de escolha para os fisiologistas interessados em nível de microcircuito dissecção de neurônios identificados geneticamente e na investigação de modelos de rato da doença humana. Por exemplo, a recente introdução de ferramentas genéticas causais, tais como atuadores genéticos optogenetic e químicas permitiu experimentalistas para testar a necessidade e suficiência dos circuitos neurais identificados no comportamento 1-4. A ampla disponibilidade de transgênicos linhagens recombinantes driver do mouse (CRE-linhas), ampliou a facilidade experimental pelo qual os subtipos de neurônios são direcionados, somando-se o valor do mouse para estas experiências 5.
Da mesma forma, as telas genéticas e genômicas amplas associações de distúrbios neurológicos e psiquiátricos comuns têm facilitado a identificação de fatores de risco genético para a doença cerebral 6,7. Estes avanços, combinados com o crescimentocaixa de ferramentas para a manipulação genética e engenharia de genoma em camundongos, fizeram o organismo de escolha para a modelagem de doenças humanas. A combinação de modelos de doenças e ferramentas genéticas causais oferece uma oportunidade sem precedentes para a compreensão de doenças do cérebro e identificar alvos no nível do circuito de intervenções.
Para tirar pleno partido destas ferramentas moleculares e ganhar a introspecção em função microcircuito na saúde e na doença, é essencial para associá-los com leituras fisiológicos da atividade cerebral. Idealmente, o experimentador seria capaz de controlar um grande número de neurónios, mantendo a resolução de células simples. Extracelulares, gravações multi-eletrodos em animais se comportando livremente fornecer tal oportunidade; no entanto, o uso desta tecnologia no rato tem sido limitado. Para gravar a partir de pequenos alvos (por exemplo, a camada CA1 do hipocampo), o uso de eletrodos ajustáveis é necessário como pequenos movimentos em eletrodos de registro seguintes Surgicimplantação al tornar impossível a manutenção da estabilidade de gravação 8,9. Tradicionalmente, os métodos que têm sido empregados para mover eletrodos dentro do cérebro impor limitações de peso quando usado no rato, tornando-se um desafio para a gravação par de um grande número de neurônios com o comportamento neste organismo.
Aqui, os métodos são introduzidos para a fabricação em miniatura, ultra-leves, matrizes de microeletrodos que são individualmente customizável a região do cérebro a ser alvo, optogenética-compatível, e facilmente montado a partir de peças disponíveis no mercado. Cada "microdrive" dentro do multi-eletrodo "hipervelocidade" utiliza um mecanismo de mola e parafuso para fazer avançar o eletrodo e um trilho de plástico, integrado ao corpo da hipervelocidade, para contrariar o torque do parafuso. Primeiro, o processo de concepção dos corpos Hyperdrive e microdrives em um programa CAD para a impressão 3D é descrito. Ao projetar corpos Hyperdrive que são personalizadosde estruturas específicas, é possível aumentar a precisão de orientação e para aumentar ainda mais o rendimento da preparação. Em segundo lugar, o processo de fabricação é descrito em detalhe, em que a matriz de multi-eléctrodo é montada a partir de peças de mão que estão disponíveis comercialmente. Esta técnica tem sido utilizada, com sucesso, para gravar a partir de conjuntos de neurônios no hipocampo, tálamo e córtex no animal se comportar livremente durante o forrageamento natural e tarefas operantes.
Protocolo
1. Intenção do projeto
- Identificar a região do cérebro de escolha (núcleo geniculado lateral (LGN, tálamo visual)), percorrendo as seções sagital do cérebro do rato atlas eletrônicos.
- No coordenadas A / P (-2,3 - -2,7 mm), o LGN é mais largo. Use esta região para projetar a parte inferior da unidade (peças inferiores).
NOTA: Um total de 8 eletrodos independentemente móveis podem ser usados para direcionar LGN (4-6 eletrodos vai fazer isso para o LGN, 2-4 eletrodos são adicionados para compensar erros de implantação, Figura 1A). - No SolidWorks, desenhar um esboço do corpo de design (Figura 1B) no plano frontal. Clique esboço e, em seguida, usar a combinação de linhas e curvas para fazer um desenho que irá incluir os contornos para a base da unidade, puxadores e poliamida meia ranhuras, como mostrado. Certifique-se de que o contorno não contém lacunas abertas. Em seguida, clique em Sair do esboço.
- Em seguida, selecione a frente e os aviões certos, e clique em "Create Axis ". Em seguida, crie o modelo de corpo de design 3D rodando o contorno de esboço azul realçado (Figura 1B) 360 °. No menu de recursos, clique em "Revolved Boss / Base". Escolha a linha média como o eixo de revolução. Na seção de parâmetros, sob a direção de um clique Cego, e sob ângulo selecionar 360,00 graus. Na seção contornos selecionado, verifique se o azul destacou contorno é o selecionado.
- Criar meia um slot poliimida revolvendo o vermelho destacou contornos 13 ° (Figura 1C, canto superior esquerdo). Passos são idênticos aos 1.4 acima, excepto para a especificação ângulo
- Criar uma unidade lida pelo revolvimento do contorno verde 15 ° (Figura 1C, canto superior direito).
- Crie a segunda alça da unidade usando a função padrão circular (Figura 1C, canto inferior esquerdo). No menu de recursos, clique em "Circular Pattern". Em parâmetros, escolha a linha média como eixo de revolução. Selecione uma80,00 graus como o ângulo, e 2 como o número de ocorrências. Certifique-se que o primeiro identificador é selecionado em "Recursos para Pattern".
- Criar dezesseis poliimida meia-slots com a função padrão circular (Figura 1C, canto inferior esquerdo). Realize movimentos semelhantes a 1.7, mas marcar a primeira metade do slot poliimida como os "Recursos para padrão". O ângulo é de 22,5 ° eo número de casos são 16 (Nota: esta é apenas a 360 ° dividido pelo número de vezes que você quer padrão o recurso)
- Criar um novo plano no qual desenhar o receptáculo poliimida. Conseguir isso clicando em "Inserir" no menu principal. Clique em "Geometria de referência", selecione os dois lados de slots de meia poliimida e clique em "Criar Novo Plano"; (Figura 1E, em cima)
- Crie o receptáculo microdrive (o orifício do parafuso, polyimides buraco e anti-binário ferroviário (Figura 1D, inferior). Conseguir isso através da criaçãoum esboço que engloba todas estas características sobre o novo plano criado em 1,9. Note-se que para os carris de anti-torque, definem uma linha de centro, entre os dois lados das ranhuras superiores de poliamida. Em seguida, desenhe os trilhos anti-torque através da criação de dois círculos perpendicular à linha central, cujos centros são um raio de distância, e, em seguida, corte o contorno do meio.
- No menu Recursos, clique em "Extrude Boss / Base" para criar o trilho anti-torque e escolher uma extrusão cega de 10 mm que vai para cima e dois milímetros de ir para baixo. Para o orifício do parafuso e furo poliimida, clique em "cut Extrude" e escolha seis milímetros cego, e alguns mms indo para cima para ambos (Figura 1E, esquerda).
- Padrão receptáculo micro-drive 16x, utilizando o centro como o eixo de revolução (22,5 °, 16 casos, espaçamento igual), (Figura 1E, à direita)
- Na parte superior da alavanca, desenhar um quadro 3 mm x 3 milímetros começando na extremidade do centro da unidade de punho, de frente para o centro de umxis. Expulse esta 2 milímetros para cima usando a função "Extrude Boss". Desenhe círculos de 1mm de diâmetro nos locais em que os parafusos do BEI vai continuar. Depois, fazer 1,5 milímetros "Extrude Cut" para fazer um buraco. Então, padrão da caixa e buraco duas vezes usando a função Padrão Circular (Sobreposição de texto: 180 °, 2 casos, espaçamento igual, em torno do eixo central).
- Use as dimensões (em milímetros) na Figura 1F para desenhar um esboço parte superior. Use o "Extrude Boss / Base" para fazer um modelo 3D do mesmo.
NOTA: Após essas etapas o projeto da unidade está completa. O corpo rígido físico é criado através do processo de estereolitografia. Há uma série de empresas que oferecem impressão estereolitografia baseado em arquivos STL. Recomendamos serviços que podem imprimir em plástico duro (como Accura® 55), com uma resolução mínima de pelo menos 0,1 mm.
2 Preparação de componentes Hyperdrive
- Coloque uma pequena(: '. / 0116' ID / OD 0,0071 ''; Wall: 0,00225) pedaço de fita dupla face em uma superfície plana e cortar o número necessário de 31 g de tubos de poliamida para cerca de 8 centímetros (Figuras 2A - 2B) .
- Coloque para fora a primeira camada de tubos de guia na fita dupla face, tendo o cuidado de colocar tubos de guia o mais próximo possível um do outro na fita. Dab uma pequena quantidade de finos, de cola de cianoacrilato sobre a camada de poli-imidas. (Figura 2C)
- Estabelecer rapidamente a uma segunda camada de poli-imidas (Figura 2D).
- Criar um espaço reservado de fibra óptica usando uma cânula 26 G. Certifique-se de que este é lubrificado com um lubrificante à base de Teflon, antes de serem incorporados na montagem (Figura 2E).
- Aplique uma linha de epóxi 4-5 mm de comprimento perpendicular ao feixe de poliimida (Figura 2F). Uma vez que o epóxi endurecido (2-3 horas), remova a fita da camada inferior e reePOxy o outro lado. Depois do epóxi ter endurecido de novo, a 26 L de uma cânula pode ser removida e a construção de corte no meio utilizando uma lâmina de barbear (Figura 2G), resultando em duas matrizes de poliamida, cada um dos quais pode ser usado para uma hiperpropulsão (Figura 2H).
- Imprima o modelo de cone em uma folha de papel a transparência e cortar uma folha correspondente da folha de alumínio resistente (Figuras 3A - 3C).
- Aplicar uma camada de epóxi à folha de alumínio e aplicar rapidamente o papel transparência. Usando um objecto pesado ou um pino de madeira, suavizar o epoxi de modo que ele é distribuído uniformemente (Figura 3D).
- Recorte o molde cone e apertar em conjunto, utilizando um jacaré. Finalmente, use outra bagatela de epóxi para fixar permanentemente as peças (Figura 3e).
3. montagem final do Microdrive
- Prenda o BEI para o corpo rígidoE reinserir o 26 G cânula através da matriz de tubo guia poliimida. Alinhe a matriz de poliimida com o corpo rígido usando o buraco de fibra óptica no BEI para garantir que os tubos de guia são perpendiculares ao BEI e epóxi a matriz para o corpo rígido com cuidado para garantir que nenhum epóxi flui para os tubos de guia ou na corpo rígido (Figuras 4A - 4C).
- Mapear cada tubo guia na matriz de poliimida para um suporte correspondente na parede interna do corpo da unidade. Deslize um pequeno anel de 33 L de poliimida, sobre cada tubo de guia e para dentro do suporte e aplicar uma pequena quantidade de cola de cianoacrilato para fixar cada tubo guia. (Figuras 4D - 4E) Finalmente, epóxi todo o aparelho para a parede interior do corpo da unidade e cortar as poliamidas de modo a que se projectem ligeiramente acima do rebordo interior (Figuras 4F - 4G).
- Construir uma montagem microdrive, colocando uma das custom-bparafusos uilt através do orifício central de uma peça superior, seguido de uma das molas 5 mm. Deslize o orifício exterior da peça de topo sobre uma das calhas, e suavemente a inserção do parafuso. Dirija o parafuso até que a mola atinge o comprimento mínimo comprimido. (Figuras 4H - 4I) Repita esse processo para cada trilho / Microdrive (Figura 4J).
- Vire a matriz de unidade de cabeça para baixo e tirar uma foto da matriz de tubo guia. Esta imagem será utilizada para mapear a localização do tubo guia correspondente para cada microdrive (Figura 4K).
- Inserir um tubo de poliimida (0,005 ") em cada tubo de guia a partir da parte inferior da base da unidade. Deixe o tubo transportador estender 1-2 mm de distância do topo da microdrive totalmente abaixada e registro na fotografia da identidade do micro-drive correspondente. (Figuras 4L - 4M)
- Epóxi tubo de poliimida ao suporte Microdrive, tomando cuidado para não let epóxi executado através do Microdrive para a primavera ou parafuso (Figuras 4 N, 4P - 4T).
- Totalmente menor todas as microdrives. Cortar todos os tubos de descarga de poliimida fora na parte inferior da matriz de poliimida (Figura 4O).
- Monte a placa de interface eletrodo à base da unidade utilizando dois # 00-90 x 3/16 "dos parafusos (Figura 4R).
NOTA: Neste ponto, a matriz de unidade está pronta para ser carregado com stereotrodes ou tetrodes. Para mais detalhes sobre a construção tetrodo e carregamento, consulte 10. A base da unidade impressa e os microdrives foram projetados em SolidWorks 2011 software 3D CAD: link para baixar os arquivos do SolidWorks. - Após o carregamento, a unidade de inverter cuidadosamente e diminuir o cone de blindagem sobre a unidade de forma que apenas a parte inferior sobressai. Cole o cone de proteção por epoxying o cone com o corpo rígido.
- Após o cone está ligado, tira um pequeno comprimento defio de aço inoxidável (0,008 'Bare, 0,011' Revestido) eo pino ao BEI. Raspe o interior da peça, o cone de alumínio com uma agulha e o fio de terra para o cone de aço usando tinta de prata. Uma vez que a pintura prata secou, reforçar com um pouco de epóxi. Alternativamente, o arame de aço pode ser directamente ligado ao cone com um pouco de epóxi condutora (MG Chemicals, Surrey, Canadá).
Resultados
Construção do implante é um processo que se inicia com o desenho do 3D impressa hiperpropulsão (Figura 1), se proceder à construção da peça de fundo (Figura 2), o cone de blindagem (Figura 3), e a montagem final do hiperpropulsão, pela construção individual dos microdrives (Figura 4). Estes passos são seguidos por carregar os microdrives com eletrodos (ver 10). Seguindo este passo, é possível utilizar estes dispositivos para gravar a partir de várias regiões do cérebro. Na Figura 5, a partir de um exemplo traça gravação simultânea do núcleo geniculado lateral (CGL) e do hipocampo (HPC) são mostrados. A estabilidade das unidades individuais mostrados na Figura 5B foi notável, que mostra formas de onda consistentes ao longo de um curso de vários dias. Estes neurónios foram confirmadas como neurónios LGN por ser sensível à luz emissora de diodo estimulação, como mostrado pelaperistimulus tempo histograma (PSTH) na Figura 5C. Nesta mesma preparação, HPC potencial de campo local foi registrado como um proxy para o estado comportamental. Esses traços mostrou ondulações acentuadas onda (Figura 5D), durante uma inibição comportamental, de acordo com a sua origem no hipocampo.
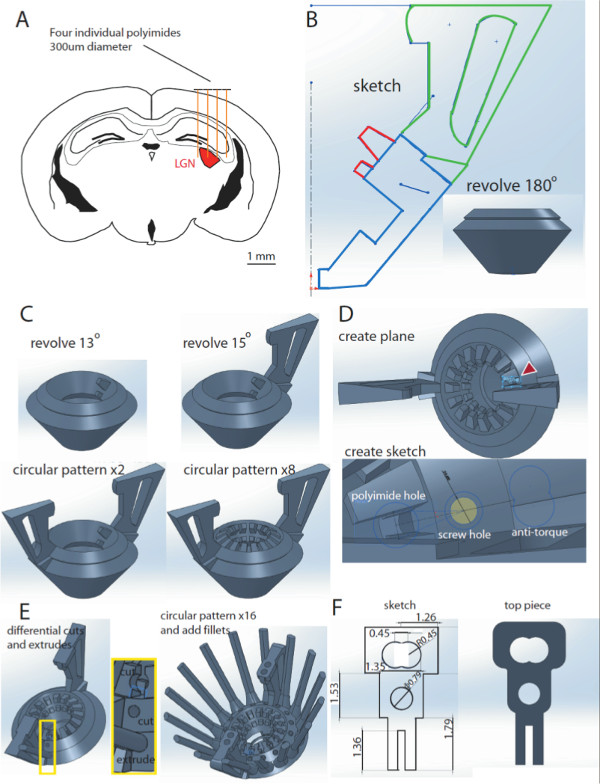
Figura 1 Projetando a hipervelocidade, Solidworks. A. Esquema de uma secção coronal do cérebro do rato em A / P coordena -2,3 - -2,7 mm de bregma. Quatro polyimides individuais (300 mM) são desenhadas acima do córtex, o que ilustra a segmentação da região de LGN (vermelho) com eletrodos. B. Esboço do corpo design. Rotativo o contorno azul 180 ° resulta em um modelo de corpo de design 3D (no detalhe). C. A adição de slots de poliimida e unidade lida com o corpo design. Rotativo a highl vermelhocontornos ighted em B por 13 ° resulta em um half-slot de poliimida (superior esquerdo). Uma alça da unidade é adicionada através da rotação de contorno verde em B por 15 ° (canto superior direito). A segunda alça é adicionado usando a função padrão circular (canto inferior esquerdo). A mesma função pode ser usada para criar os 16 slots de meia poliimida (canto inferior direito). D. Um novo plano é adicionado ao projeto (em cima), que permite criar um novo esboço para o receptáculo microdrive, composta pelo orifício do parafuso, polyimides buraco e ferroviário anti-torque (em baixo). E. Esses recursos serão implementados no projeto usando as funções de corte e de extrusão e girava 360 ° para criar 16 recipientes. F. Dimensões do esboço peça superior (esquerda) e do modelo 3D (direita ). Clique aqui para ver uma versão maior desta figura.

Figura 2 Preparando a parte inferior da hipervelocidade. A. O primeiro tubo de poliimida é colocado fita dupla face. B. tubos subseqüentes são colocados individualmente, tendo o cuidado para minimizar o espaço entre os tubos. C. Após a primeira camada é colocada para fora , uma fina camada de cola de cianoacrilato é aplicado D. Uma segunda camada de poli-imidas é adicionado rapidamente antes de a cola é seca. E. No topo do feixe de poliimidas, um G cânula 26 é adicionado como um local para a fibra óptica. F . Toda a construção está firmemente fixada com uma gota de epóxi. G. Após a remoção da cânula, a construção pode ser cortado no meio com uma lâmina de barbear, obtendo-se dois pedaços de fundo idênticas. H. Ver na superfície de corte de uma acabado peça de fundo, que ilustra as duas filas de quatro poliimidaseo buraco para a fibra óptica. Clique aqui para ver uma versão maior desta figura.

Figura 3 Montagem da hipervelocidade. A. A matriz de poliimida é inserido no corpo rígido, e alinhado com a placa de interface eletrônica (BEI), utilizando a cânula 26 G. B. Uma pequena quantidade de epóxi é usado para fixar a matriz de poliimida para o corpo rígido. C. Uma segunda aplicação de epoxi pode ser necessária, após o que o excesso de epoxi deve ser dremeled distância D. vista superior do corpo rígido com a matriz inserido. E. Usando um pequeno pedaço de tubo de poliimida 33 L, o exterior tubos de guia estão ligados nas ranhuras correspondentes do corpo rígido. F. Todos os tubos de guia exteriores devem ser mapeados para um trilho, tendo o cuidado para minimizar a tensão sobre os tubos. G. Depois de todos os tubos de guia exteriores são mapeados, eles devem ser protegidos com epóxi e corte um pouco acima do lábio interno. H. A Microdrive montagem, que consiste de um parafuso construído por encomenda, uma mola 5 mm e uma parte superior deve ser montado e colocado sobre um carril correspondente a um dos tubos de guia. I. Cada conjunto microdrive deve ser cuidadosamente aparafusado no corpo rígido. J. Após a montagem, cada tubo guia deve ter um microdrive correspondente K. Vista inferior da poliimida matriz L -.. M. Tubos de poliimida (0.005 ') são inseridas em cada tubo guia exterior. N. Cada tubo guia interno deve caber confortavelmente no garfo dele é microdrive correspondente. O. Os tubos de poliamida internos são presos com epóxi para o Microdrive correspondente ecorte tão curto quanto possível. Depois de todos os tubos de guia interiores são epoxied, os tubos de guia interior que saem da matriz de poliamida devem ser cortados rente com o lábio da matriz. P. invertido visão macro da unidade durante o carregamento do tubo guia interior. Q. Top visão macro da unidade durante o carregamento do tubo guia interior. R. Totalmente montado hipervelocidade com o BEI ligado, pronto para ser carregado com eletrodos. Clique aqui para ver uma versão maior desta figura.

. Figura 4 Preparando o cone de proteção modelo A. Cone impresso em papel transparência B -. D. A folha de alumínio é colada ao molde usando uma fina camada de epóxi. E. < / Forte> Depois de cortar o molde, o cone é formado e coladas umas às outras com epóxi.

Figura 5 gravações Multi-site usando a hipervelocidade ultralight de peso. Uma. Imagem de um rato comportando livremente com a hipervelocidade implantado. B. Exemplos de duas unidades de formas de onda único gravações deste mouse. C. Esquerda, corte coronal do cérebro do rato com destaque para o núcleo geniculado lateral, onde alguns dos eletrodos foram reduzidos. Certo, exemplo peristimulus histogramas de tempo (PSTHs) de dois neurônios LGN alinhados à estimulação visual (barra amarela). D. Direito, corte coronal com destaque para o hipocampo (HPC), onde um outro conjunto de eletrodos foram reduzidos. Certo, Exemplo de campo local, potencial de gravação de uma ondulação do hipocampo (destaque vermelho).

Figura 6 Visão geral dos componentes de acionamento. (Esquerda) visão abrangente dos componentes Hyperdrive. (Direito) Ilustração de montagem na microdrive individual.
Discussão
Este protocolo descreve o processo de construção de uma matriz microdrive ultra-leve para alvejar uma única ou múltiplas regiões cerebrais no mouse. Após as etapas finais de construção, a hipervelocidade está pronto para ser implantado usando técnicas de implante cirúrgico padrão e afixado ao crânio do rato com cimento dental. Pós-implantação, os eletrodos podem cada ser avançado independentemente usando uma pequena chave de fenda, enquanto o mouse é contido com a mão. A distância por sua vez, que cada eletrodo avanços é determinado pelo passo do parafuso. Utilizando os parafusos referenciados aqui avança cada eletrodo aproximadamente 150 mm por sua vez, embora metade e quartas de voltas pode ser utilizado para uma maior resolução.
As dimensões do esboço na Figura 1B determinar o tamanho total do implante, por conseguinte, uma forma óbvia para dimensionar implantes bidireccional é a alteração das dimensões em que esboço crítico. Além disso, the o comprimento dos parafusos pode ser estendida para atingir as estruturas mais profundas do cérebro. Recomendamos personalizado feito parafusos de titânio, como os que são leves e menos frágil do que o aço. Note-se que os trilhos antitorque preciso dimensionar de forma linear com o comprimento do parafuso, e, neste ponto, não se determinou o comprimento máximo a que estas estruturas podem ser impressas. Para atingir várias regiões do cérebro, a forma da parte inferior pode ser modificado. A adição de arruelas conhecidos tamanho (espessura de 200 um), poderia fornecer espaçadores necessários entre polyimides segmentação estruturas cerebrais separados (por exemplo, o hipocampo eo córtex pré-frontal). Estes poderiam ser incluídos nas etapas de montagem parte de fundo, e depois cortados após o epoxi endurece.
A grande limitação deste projeto é a sua dependência de software proprietário (Solidworks, neste caso). O desenvolvimento futuro de programas de código aberto que fornecem interfaces conviviais propício para a concepção de tal equipamento com o mínimo de fu engenhariarodada seria de grande benefício para a comunidade da neurociência.
Este método proporciona várias vantagens sobre os métodos existentes. Primeiro, o design é simples, dependente de poucos desenhos (Figura 1). Segundo, é ultra-leve, sem necessidade de cimento dental ou material pesado para entrar em sua montagem. Em geral, pesa cerca de 1,7 g - cerca de um terço do peso dos implantes comercialmente disponíveis de funcionalidade semelhante. Em terceiro lugar, ele não requer nenhum equipamento especializado para fazer - o corpo do implante pode ser impresso em 3D a partir de várias fontes (por exemplo approto.com, mas existem vários outros); os parafusos podem ser feitos (por exemplo antrinonline.com); as molas estão comercialmente disponíveis (por exemplo leesprings.com); e como resultado a totalidade do processo de montagem pode acontecer em um dia. Finalmente, estes implantes têm sido usados para gravar a partir de várias regiões do cérebro durante o forrageamento naturais, tarefas comportamentais estruturadas e sono (Figura5).
As aplicações futuras deste método incluem a implementação de sua escalabilidade. É provável que o implante pode ser dimensionado bidireccionalmente simplesmente mudando 1) o tamanho do esboço na Figura 1B e, 2) o número de recipientes de micro-unidade (Figura 1D) modelado. Por exemplo, ele pode ser escalado para baixo, para registro de agir livremente ratos início do desenvolvimento, e escalado para cima, para gravar a partir de ratos, coelhos, furões e primatas não-humanos, talvez.
A palavra final é para lembrar ao leitor que críticos para a implementação bem sucedida do método descrito é o protótipo de todas as modificações que implementar para .stl arquivos de projeto em anexo. O leitor notará, por exemplo, que o desenho em anexo contém um "Figura 8" anti-torque ferroviário. Este foi o melhor projeto possível, dada a limitação de impressão 3D, como muitas vezes é necessário que nós perfuramos esses buracos. Tê-lo ser um círculo, se cortesiaestabilidade romise, mas ter que ser um quadrado ou uma forma angular que limitaria a capacidade de corrigir imperfeições de impressão 3D por perfuração.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
We thank members of the Wilson lab for their helpful advice on the fabrication method.
This work was supported by the Simons Foundation, a NIH pathway to independence career award from the NINDS and a NARSAD Young Investigator Award (to M.M.H.) as well as grants from the NIH (to M.A.W.).
Materiais
| Name | Company | Catalog Number | Comments |
| Microdrive screws | Antrin | Half Circle 0.6 UNM Titanium Screws. 8 mm thread. 9 mm length from under head. | |
| Tap-ease | AGS CO. | #TA2 | Tapping Grease |
| Microdrives | See .STL file | ||
| Drive Body | See .STL file | ||
| Outer Polyimide Guide Tube | Minvasive Components | IWG Item # 72113300022-012 | Length: 12’’, ID: 0.0071’’, OD: 0.0116’’, WALL: 0.00225’’ |
| Inner Polyimide Guide Tube | Minvasive Components | IWG Item # 72113900001-012 | Length: 12’’, ID: 0.0035’’, OD: 0.0055’’, WALL: 0.001’’ |
| Grounding Wire | A-M Systems, Inc. | Catalog # 791900 | 0.008'' Bare, 0.011'' Coated |
| Tri-Flow | Teflon based lubricant - Aerosol | ||
| Microdrive Springs | Lee Spring | Part # CB0050B 07 E | Outside Diameter: 1.016 mm, Hole Diameter: 1.193 mm, Wire Diameter: 0.127 mm, Free Length: 10.160 mm, Solid Length: 3.581 mm |
| Z-poxy 5 Minute | Pacer Technology (Zap) | PT37 | |
| Silver Paint | GC Electronics | Part #: 22-023 | Silver Print II |
| Tri-Flow | 20009 | ||
| 26 G Hypodermic Tube - Stainless Steel | Small Parts | HTXX-26T-12-10 | Length: 12’’, ID: 0.012’’, OD: 0.018’’ |
| EIB screws | Component Supply Co. | MX-0090-03SP | #00-90 x 3/16’’ |
| Fine Scissors - Toughcut | Fine Science Tools | 14058-09 | 22 mm |
| Transparency Paper | 3M | PP2500 | |
| Aluminum Foil | Reynold's Wrap Heavy Duty | Extra Thick |
Referências
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Halassa, M. M., et al. Selective optical drive of thalamic reticular nucleus generates thalamic bursts and cortical spindles. Nat Neurosci. 14, 1118-1120 (2011).
- Tsien, J. Z., et al. Subregion- and cell type-restricted gene knockout in mouse brain. Cell. 87, 1317-1326 (1996).
- Nestler, E. J., Hyman, S. E. Animal models of neuropsychiatric disorders. Nat Neurosci. 13, 1161-1169 (2010).
- Collins, P. Y., et al. Grand challenges in global mental health. Nature. 475, 27-30 (2011).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Wilson, M. A., McNaughton, B. L. Reactivation of hippocampal ensemble memories during sleep. Science. 265, 676-679 (1994).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados