Method Article
La inmunoterapia sublingual como alternativa para inducir protección contra las infecciones respiratorias agudas
En este artículo
Resumen
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
Resumen
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
Introducción
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
Protocolo
Procedimientos con animales se realizaron de conformidad con el N ° 071140-000821-12 protocolos y 08052010, aprobado por la Comisión Honoraria de Experimentación Animal y la Junta Directiva de la Escuela de Medicina de la Universidad de la República - Uruguay.
1. la administración sublingual del agente terapéutico
- Preparar la solución que contiene el agente terapéutico a ensayar. Ajustar la concentración de administrar un volumen máximo de 10 l por ratón.
NOTA: Para flagelina purificada a partir de Salmonella enterica serovar Typhimurium la dosis óptima para inducir protección en el ratón infectado con la primera dosis letal de S. pneumoniae serotipo 1 E1586, causando una mortalidad del 100% es de 10 g / ratón. Flagelina solución debe calentarse a 65 ° C durante 5 min para asegurar la liberación de los monómeros. Para obtener más información acerca de la purificación flagelina véase la referencia 26.- Varconcentración eficaz y de diferentes agentes inmunomoduladores de acuerdo a su tamaño molecular, la pureza, la susceptibilidad a la proteolisis y el uso de agentes mucoadhesivos. Ajustar la concentración óptima para cada compuesto a ensayar para maximizar sus efectos. Si se han realizado estudios previos por vía intranasal para un compuesto particular, utilizar una dosis inicial de 5 a 10 veces más alta para probar su eficacia por vía sublingual.
- Anestesiar a los ratones mediante la inyección de un cóctel que contiene 110 mg / kg de ketamina con 5,5 mg / kg Xylacine y dejar que los animales descansan durante 7 a 10 min.
- Confirme la anestesia adecuada presionando suavemente la almohadilla plantar de una de las patas traseras; si anestesiado adecuadamente el animal no se mueve en respuesta al estímulo.
- Extender una capa delgada de ungüento veterinario sobre los ojos de cada ratón para evitar la sequedad, mientras que bajo anestesia.
NOTA: los anestésicos inhalatorios como isofluorano también se pueden utilizar en lugar de ketamina / Xylacine si un sistema equiparped con conos de cámara y de la nariz de inducción está disponible. Use la cámara de inducción para anestesiar a los animales y administrar el inmunoestimulante por vía sublingual. Conectar inmediatamente el animal a un cono de la nariz durante al menos 15 min para mantenerlo bajo anestesia, para evitar tragar y permitir la absorción del compuesto terapéutico. - Pipetear la solución que contiene la solución inmunoestimulante o control del vehículo; usando el pulgar y el dedo índice de la mano no dominante tome el ratón y manténgalo en posición vertical.
- Usando el lugar mano dominante un par de pinzas cerradas bajo la lengua y mantenerla en su lugar usando los dedos medio y anular, abra las pinzas para levantar ligeramente la lengua.
- Tomar la pipeta y administrar la solución sobre el suelo de la boca y del lado dorsal de la lengua.
- Retire la pinza y dejar que el resto del ratón para 3 a 5 minutos antes de volver a ponerlo en la jaula. Para asegurar que se mantiene la normotermia en el micrófono anestesiadoe, conecte las jaulas a un sistema de calentador de jaula. Si tal sistema no está disponible, lugar ratones pertenecientes al mismo grupo de tratamiento de nuevo en la correspondiente jaula uno al lado del otro sobre la ropa de cama y cubren parcialmente con hojas de papel de seda limpias para ayudar a mantener la temperatura corporal.
- Recoger muestras de tejido en cualquier punto de tiempo después de la instilación del agente inmunomodulador para analizar los cambios en las poblaciones de células inducidas por el tratamiento.
NOTA: En esta administración protocolo particular de flagelina se realizó 2 horas antes de la exposición. Determinar el tiempo óptimo entre el tratamiento y el desafío para cada agente terapéutico particular y el patógeno a ensayar.
2 Preparación de la suspensión bacteriana e intranasal Challenge con Streptococcus pneumoniae
NOTA: S. pneumoniae es un patógeno humano natural que puede causar enfermedades mortales como la neumonía invasiva, sepsisy meningitis. La transmisión puede ocurrir por inhalación o por contacto con la mucosa. Por lo tanto, todas las muestras que pueden haber estado en contacto con S. pneumoniae debe manejarse en una instalación adecuada Nivel de Bioseguridad II utilizando una cabina de bioseguridad clase II. Revise los procedimientos normalizados de trabajo de su institución en relación con el manejo de patógenos Tipo II para la ropa de protección, eliminación de residuos y las medidas de seguridad adicionales que resulten aplicables. Los animales infectados deben mantenerse en jaulas ventiladas individualmente en aisladores equipadas con filtros HEPA. Vacunas contra el neumococo y la terapia con antibióticos están disponibles. Para obtener más información, consulte las referencias 27 y 1.
- Descongelar una alícuota de una suspensión de trabajo de Streptococcus pneumoniae del conocido número CFU bacteriana preparada como se describe en el 15.
- Centrifugar durante 5 minutos a 2500 xg y RT.
- Descartar el sobrenadante y lavar el sedimento bacteriano suspendiéndolo en 1 ml de stsolución salina erile. Use puntas con filtro en la preparación de diluciones bacterianas suspensión, o para el desafío animal.
- De nuevo como centrífuga descrito en el paso 2.2.
- Desechar el sobrenadante y resuspender el sedimento en el volumen apropiado de solución salina estéril para obtener una suspensión de 4x10 5 UFC / l 50. Esta dosis corresponde a la dosis bacteriana mínimo de S. pneumoniae serotipo 1 E1586 que causa 100% de mortalidad en ratones BALB / c de acuerdo con estudios previos 15.
NOTA: Al establecer un modelo de neumonía neumocócica en ratones, la dosis mínima bacteriana que causa 100% de mortalidad se debe determinar para cada combinación particular de cepa bacteriana, serotipo y cepa de ratón. - Homogeneizar la suspensión bacteriana mediante agitación o pipeteando arriba y abajo 5 veces.
- Cargar 50 l de la suspensión bacteriana usando una punta de filtro estéril e inculcar el volumen total en la nariz de un ratón anestesiado. Sostenga el UPRI ratónluchar durante 2 minutos y se deja reposar en posición dorsal durante 2 min más. Aplique un ungüento veterinario en los ojos y devolver los animales a la jaula; asegúrese de mantener la normotermia, mientras que bajo anestesia.
NOTA: En este estudio la exposición bacteriana se realizó en un volumen de 50 l para asegurar la entrega de al menos 90% del total de CFU en los pulmones como se determinó previamente en 15,28. Para minimizar la angustia de los volúmenes más pequeños del animal (por ejemplo, 20 l) pueden ser utilizados. Sin embargo, la prestación eficiente de bacterias en los pulmones debe ser revisado; esto se puede hacer por la recolección de los pulmones 5 min después de la provocación y contando UFC en homogeneizado de pulmones mediante siembra de diluciones seriadas en placas de agar-sangre. - Confirmar los números de UFC en la suspensión bacteriana utilizada para la infección en placas de diluciones en serie de 10 veces sobre las placas de agar sangre. Incubar O / N a 37 ° C con 5% de CO 2 y contar el número de colonias mucoides presentar una característica de halo verde de albacterias hemolíticas pha.
3. Tissue Recogida y preparación de muestras para Citometría (FACS) Análisis de Flujo
3.1) Colección de tejidos
- La eutanasia a los animales por dislocación cervical o el uso de una cámara de CO 2; abrir la cavidad torácica todo el camino hasta el cuello y hacer una incisión a lo largo de las patas delanteras para exponer el lado ventral del cuello y el área submandibular.
- Con las pinzas de punta curvada finas tirar suavemente hasta las glándulas salivales y el tejido blando adyacente para exponer el lado dorsal de la piso de la boca. Con unas pinzas de punta fina curvada, tomar la mandíbula y los ganglios linfáticos mandibulares accesorias tirando suavemente y colocarlos en un tubo que contiene RPMI completo (cRPMI, de 500 ml-10% suero bovino fetal, 5 ml de una solución que contiene 10.000 U / ml solución de penicilina y 10 mg / ml de estreptomicina y 5 ml de L-glutamina 200 mM) o solución conservante ácido nucleico de acuerdo con el procedimiento descendente que sellevarse a cabo más tarde.
- Para abrir la cavidad torácica hacer una incisión en el diafragma; usando un par de pinzas-rata dentada sujetar el cartílago xifoides del esternón y corta cuidadosamente las costillas en ambos lados dorsales a partir de las falsas costillas todo el camino hasta llegar al punto en el que las verdaderas costillas se unen al manubrio del esternón.
- Al mantener el cartílago xifoides del esternón con las pinzas, tire suavemente para exponer los órganos de la cavidad torácica.
- Retire las costillas completamente cortando las primeras costillas y la clavícula. El timo aparecerá como una estructura blanca de dos lóbulos situados en la parte anteroventral del tórax cerca de la base del corazón.
- Tome uno de los lóbulos de sujeción con un par de pinzas y usar un par de tijeras para quitar los ligamentos entre su cara inferior y el pericardio. Proceda a retirar el segundo lóbulo.
- Identificar la cavidad abdominal y abrir cortando a lo largo del eje medio de la mpared uscular para exponer los órganos. Con un par de pinzas de cortar la vena cava posterior y la aorta torácica; eliminar el exceso de sangre con un tejido absorbente.
- Para analizar los residentes e infiltrantes poblaciones de células de los alvéolos realizan el lavado broncoalveolar (BAL). Cortar los músculos en la parte ventral del cuello para exponer la tráquea y el esófago; para separarlos hacen incisiones en los lados laterales y dorsales de las estructuras.
- Levante la tráquea con las pinzas y hacer una pequeña incisión con un bisturí para introducir una pipeta de transferencia de punta fina llena con 1 ml de PBS sin Ca 2 + / Mg 2 + más EDTA 1 mM. Inculcar y aspirar el volumen total al menos tres veces; aspirar y transferir la suspensión celular a un tubo de 1,5 ml estéril y colóquelo sobre hielo.
- Para analizar las poblaciones celulares presentes en el parénquima pulmonar, primero perfundir los pulmones mediante la inyección de 5 ml de PBS sin Ca2 + / Mg2 + más EDTA 1 mM en el ventrículo derechodel corazón.
NOTA: Esto eliminará la mayor parte de las células rojas de la sangre y las células inmunes presentes en los vasos sanguíneos de los pulmones. Si la perfusión se realizó correctamente, los pulmones de color cambiará de color rosa a blanco. - Aislar el corazón de los pulmones mediante la sujeción de la base del ventrículo izquierdo y delicadamente cortar los vasos sanguíneos con tijeras para quitar completamente. Tome los pulmones perfundidos y colocarlos en cRPMI o solución conservante ácido nucleico según el análisis de aguas abajo a realizar.
- Para el análisis de las poblaciones de células en la mucosa sublingual, aislar la cabeza del animal y quitar las glándulas salivales y el tejido blando adyacente si no se ha hecho en el paso 3.2.1.
- Hacer una incisión en cada lado de la boca hasta llegar a la articulación de la mandíbula y separar la mandíbula inferior con la lengua y el suelo de la boca, el uso de clavos fijan en el tablón de disección. Tire hacia arriba de la lengua; utilizando un bisturí hacer una incisión en el baSE de la lengua con el piso de la boca hasta llegar a los terceros molares para exponer la mucosa sublingual.
- Sacar la lengua por completo; tomar un punzón de biopsia de 0,5 mm y colocarlo al lado de los incisivos inferiores. Corte de la inserción del tejido gingival sublingual y presione suavemente hasta que el suelo de la boca ha sido cortada por completo.
- Repetir una vez más ahora colocar el punzón de biopsia cerca de los terceros molares para completar la eliminación del tejido sublingual. Colocar en un tubo limpio que contiene cRPMI o conservante ácido nucleico.
3.2) Preparación de la muestra para el análisis FACS.
- Transferencia de tejido de los pulmones aislados de cada ratón en una placa de 24 pocillos y picar con un par de tijeras limpias hasta obtener pequeños trozos de tejido de aproximadamente 2 mm. Añadir 1 ml por pocillo de medio de digestión que contiene 30 mg de colagenasa tipo II, 50 mg de ADNasa-I en 1 ml de RPMI sin FBS. Suavemente con la pipeta cinco veces e incubar a37 ° C y 5% de CO2 durante 40 min.
- Para el análisis de poblaciones celulares en el tejido sublingual, sustituir el medio digestión en 3.2.1 con una que contiene 2 unidades de dispasa, 30 mg de colagenasa de tipo II, 50 mg de DNAsa I en 1 ml de RPMI. Incubar el tejido recogido de un ratón en 500 l de medio de digestión durante 20 min a 37 ° C en un agitador orbital a 50 rpm.
- Después de la incubación, la pipeta hacia arriba y abajo hasta 10 veces o 30 segundos hasta que la mayor parte del tejido se ha interrumpido. Se filtra la suspensión celular a través de un filtro de células de 40 micras estéril y lavar con 5 ml de PBS suplementado con EDTA 5 mM.
NOTA: La digestión completa de la matriz extracelular y el tejido fibroso no se logrará. Sin embargo, no se recomiendan tiempos de incubación más largos en presencia de colagenasa y / o dispasa o trituración agresivo ya que se traducirá en un aumento de la muerte y la destrucción de las proteínas extracelulares que afectan al resultado global de la F celularACS. - Se centrifuga a 400 xg, 5 min, 4 ° C.
- Para el análisis de las poblaciones de células en el BAL, centrifugar las células a 400 xg, 5 min, a 4 ° C y continúe con el paso 3.2.4.
- Para el análisis de poblaciones celulares en los ganglios linfáticos, coloque un colador de 70 micras de células en una placa de Petri estéril y poner los ganglios linfáticos junto con 1 ml de cRPMI en el colador. Saque el paso de un 2 ml jeringa estéril y lo utilizan como una mano de mortero para aplastar a los ganglios linfáticos en contra de malla del tamiz. Enjuague el filtro de células con 1 ml de cRPMI fresco y transferir las células de la placa de Petri a un tubo estéril.
- Tomar una alícuota representativa de cada muestra y teñirla con azul de tripano para determinar el número de células viables.
- Resuspender las células en FACS-EDTA: PBS-EDTA 5 mM-1% de albúmina de suero bovino para formar una suspensión de 2x10 7 células / ml y añadir 50 l en un tubo de citómetro.
- Preparar una mezcla que contiene el anticuerpo 2X aproxopriate combinaciones de anticuerpos contra marcadores de superficie y fluorocromos de acuerdo con el instrumento FACS disponible. Añadir 50 l de la mezcla de anticuerpos 2X en cada tubo que contiene la suspensión celular.
NOTA: Valorar cada anticuerpo marcado con fluorocromo para determinar la cantidad óptima a emplear, para un protocolo detallado véase la referencia 29. - Incubar 30 minutos en hielo en la oscuridad.
- Lavar una vez con 3 ml de FACS-EDTA y centrifugar las células por centrifugación a 400 xg durante 5 min a 4 ° C, resuspender las células en 200 l del mismo tampón y analizar en un citómetro de flujo.
NOTA: Si el manejo de un gran número de muestras, el protocolo de tinción para el análisis de FACS descrito anteriormente se puede realizar en placas de 96 pocillos de fondo en U en lugar de tubos de citómetro. Sin embargo, si se utiliza de 96 pocillos pasos placas de lavado se debe realizar mediante la adición de hasta 200 l de FACS-EDTA y repetir 4 veces desacelerándose las células a 400 xg durante 5 min a 4 ° C entre cada washipaso ng. - En este punto, fijar las muestras para el análisis en el citómetro de flujo más tarde (hasta 72 h después de la fijación).
- Para fijar las células, después de marcar con los FACS-anticuerpos lavar las células en PBS sin Ca 2 + / Mg2 +, EDTA 1 mM sin FBS. Suspender las células en 50 l del mismo tampón y añadir 50 l de una solución recién preparada de paraformaldehído al 4% en hipertónica (2X) PBS sin Ca 2 + / Mg 2 +.
- Incubar durante 20 min a temperatura ambiente y lavar 3 veces en FACS-EDTA.
- Resuspender las células en 200 l de FACS-EDTA y se almacenan a 4 ° C y protegido de la luz durante un máximo de 72 h.
NOTA: FSC-SSC puede verse afectada por la fijación. Si la fijación de las muestras, compruebe la compatibilidad de anticuerpos marcados con fluorescencia con el fabricante ya que los tintes tándem se pueden degradar en presencia de agentes de fijación. Si las muestras procedían de animales infectados fijación es muy recomendable para eliminar los agentes patógenos viables estarán presentes cuando Analycantar las muestras en la máquina FACS desde microaerosols se pueden generar durante la adquisición de la muestra.
4. total extracción de RNA, cDNA de síntesis y PCR en tiempo real.
4.1) La extracción de RNA y la síntesis de ADNc.
- Homogeneizar el tejido en la solución de conservante de ácido nucleico de elección por disrupción mecánica (por ejemplo, usando un homogeneizador rotor-estator, de alta velocidad de agitación tejido-ruptor y perlas, etc). Se centrifuga a 12.600 xg durante 15 min y 4 ° C para eliminar los restos de tejido. Transferir el sobrenadante a un tubo limpio.
- Extraer el ARN con el método de elección, siguiendo las instrucciones del fabricante.
NOTA: El ARN es muy susceptible a la degradación, si no se va a utilizar inmediatamente después del aislamiento, hacer alícuotas y almacenarlas en RNAsa tubos libres a -80 ° C. Evite congelar y descongelar repetidamente. Los tubos deben ser manejados con guantes en todo momento. Después de descongelar las muestras de uniempre mantenerlos en hielo. - Medir la absorbancia de ácidos nucleicos a 260 nm y calcular la concentración en g / l.
- Prepare DNasa-I mezcla por adición de (por ejemplo 1): 7.6 l de agua ultrapura, 1 l de tampón 10X DNasa I, 0,4 l de DNasa-I (grado de amplificación) stock 1 U / l, y añadir 8,4 l de la ADNasa-I de la mezcla a cada muestra que contiene 1 g de ARN total.
- Utilice ARN a una concentración de 1 g / l y realizar la reacción de retrotranscripción (RT-PCR) mediante la adición de 1 l de la ARN total como plantilla. Si las muestras son demasiado diluido y la concentración es más baja de lo esperado, añadir volúmenes más grandes de ARN total en lugar de agua. No exceda 20% del volumen final de reacción al añadir el ARN especialmente si el protocolo de extracción de ARN de elección involucrado mezcla de fenol-cloroformo ya que las trazas de fenol podrían afectar el rendimiento de la RT-PCR.
- Incubar 15 min a RT seguido por 10 min a 4 ° C o ice. (No exceda el tiempo de incubación !!)
- Añadir 1 l de EDTA 25 mM (grado biología molecular) a cada tubo y se incuba a 65 ° C durante 10 min para inactivar la DNasa-I.
- Preparar retrotranscripción (RT) de mezcla de la siguiente manera (para 1 reacción): 1 l cebadores hexámeros al azar Stock 0,2 mg / ml, 1 mu l de stock dNTPs 10 mM, 4 l de tampón 5X M-MLV RT-, 2 l de DTT 0,1 M, 1 l RNAse OUT de stock 40 U / l, y 1 l M-MLV retrotranscriptasa de stock 200 U / l.
- Añadir 10 l de RT-PCR se mezclan para el tubo de reacción 10 l de DNasa-I.
- Llevar a cabo la reacción de PCR en un termociclador de acuerdo con el siguiente programa:
1X ciclo: 10 min, 25 ° C; 50 min, 37 ° C; 15 min, 70 ° C - Diluir el ADNc 1: 5 mediante la adición de 80 l de agua ultrapura. Almacenar a -20 ° C.
4.2) PCR en tiempo real (qPCR).
- Prepare la mezcla de reacción qPCR de la siguiente manera (para 1 reacción): mezcla maestra 5 l que contiene Taq ADN Polymerase, SYBR tinte verde, PCR Buffer, mezcla dNTP y MgCl2 (ver 4.2.2 más abajo); 0,9 l de una solución 10 mM de stock del cebador directo, 0,9 l de una solución 10 mM de stock del cebador inverso, 1,2 l de agua ultrapura, y 2 l de molde de ADNc previamente diluido como se indica en el paso 4.1.10.
NOTA: concentración de reactivos y ciclismo protocolos utilizados en esta sección han sido optimizados para ser llevado a cabo específicamente con los reactivos e instrumentos descritos en la "Tabla de Materiales y Reactivos", otras marcas pueden ser utilizadas, pero los volúmenes de reacción, concentración de reactivos y protocolo de ciclos pueden variar. Compruebe las instrucciones de su fabricante antes de la realización de RT-qPCR. - Instale el instrumento qPCR de la siguiente manera:
1X ciclo: 15 min, 95 ° C
40X ciclos: 15 seg, 95 ° C seguido de 1 min, 60 ° C (en este punto adquieren fluorescencia).
NOTA: Para la cuantificación relativa de ARNm de acuerdo con el método de Ct 30 una reference gen debe ser seleccionado para la normalización de los valores de Ct. Gen de referencia de elección debe ser probado bajo condiciones de ensayo específicas como su expresión puede variar; Actb, Gapdh o 18S son algunos de los genes normalmente seleccionada como referencias. - Establecer el valor de umbral y analizar los datos.
Resultados
La inmunoterapia sublingual puede ser utilizado con éxito para modular la respuesta inmune pulmones. Hemos demostrado que una sola dosis de flagelina, el agonista de TLR5 y NLRC4, puede inducir la regulación al alza significativa del ARNm que codifica el CXCL1 quimiocinas, CCL20 y la citoquina IL-6 en comparación con los controles tratados con solución salina. Dobla la inducción de los niveles de mRNA alcanzó un máximo de 8 horas después de la ITSL y volver a los niveles basales después de 20 horas (Figura 1). Sin embargo, cuando SLIT se realizó 2 horas antes de la infección intranasal con S. Pneumoniae, los niveles de CXCL1 e IL6 mRNA permanecieron significativamente upregulated incluso 24 horas después de SLIT comparación con los animales no tratados (Figura 2).
Análisis de las poblaciones de células en el BAL y tejido pulmonar por FACS reveló que los animales tratados con FliC por vía sublingual habían aumento del número de neutrófilos en las vías respiratorias, pero no en el tejido de los pulmones (Figura 3).
Finalmente, la supervivencia después del desafío neumocócica se comparó en los animales tratados previamente con FliC por vía sublingual o con solución salina como control. Como se muestra en la Figura 4, la SLIT con flagelina promovió la protección y el aumento de la supervivencia contra la neumonía neumocócica aguda.
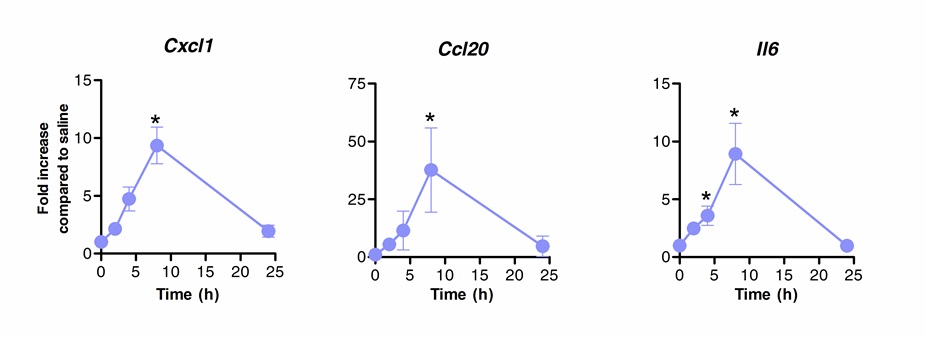
Figura 1. Cinética de perfil transcripcional de los pulmones después de la inmunoterapia sublingual con flagelina. Ocho a 10 semanas de edad ratones BALB / c (n = 4) fueron tratados con 10 g de flagelina o solución salina por vía sublingual bajo anestesia. Los pulmones se recogieron en diferentes puntos de tiempo y se colocaron en conservante de ácido nucleico. Extracción de RNA total se realizó y se sintetizó ADNc. niveles de mRNA fueron evaluados por PCR en tiempo real utilizando los cebadores específicos enumerados en Table 1. cuantificación relativa se realizó de acuerdo? Ct método usando niveles Actb de ARNm para la normalización. Los resultados se muestran como veces mayor en comparación con el grupo de solución salina tratada como mediana ± SEM. Los asteriscos indican diferencias estadísticamente significativas (p <0,05), calculado de acuerdo con la prueba de Mann-Whitney. Los resultados son representativos de 2 experimentos independientes.
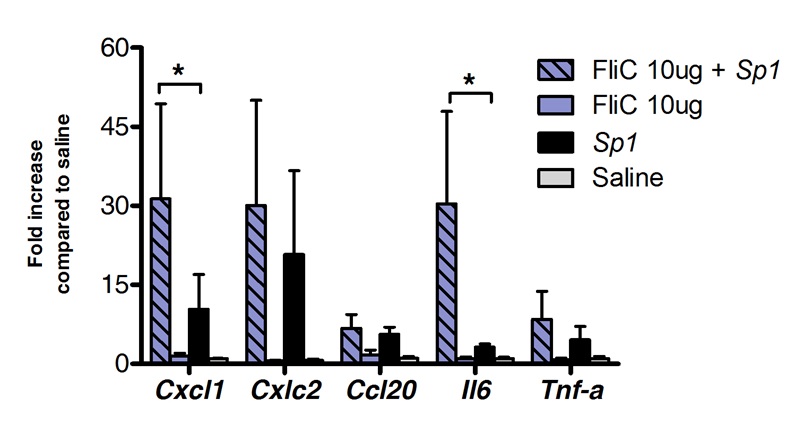
Figura 2. perfil transcripcional pulmones durante la neumonía neumocócica después de la inmunoterapia sublingual con (n = grupo tratado para n = 4 para el grupo control y 7) flagelina. Ocho a 10 semanas de edad ratones BALB / c fueron tratados con 10 g de flagelina o solución salina por vía sublingual bajo anestesia. 2 horas más tarde los ratones se expusieron por vía intranasal con la dosis letal mínima (MLD), causando 100% de mortalidad de un aislamiento clínico de S. pneumoniae serotipo 1 E1585, correspondiente a 4x10 5 UFC / l 50. Se recogieron los pulmones 24 h después del desafío y se almacenan en conservante de ácido nucleico hasta la extracción de ARN y síntesis de ADNc se llevaron a cabo. PCR en tiempo real se llevó a cabo (Ver la lista de cebadores en la Tabla 1) y la cuantificación relativa se realizó de acuerdo? Ct método utilizando niveles de ARNm Actb para la normalización. Los resultados se muestran como veces mayor en comparación con el grupo de solución salina tratada como mediana ± SEM. Los asteriscos indican diferencias estadísticamente significativas (p <0,05), calculado de acuerdo con la prueba de Mann-Whitney.
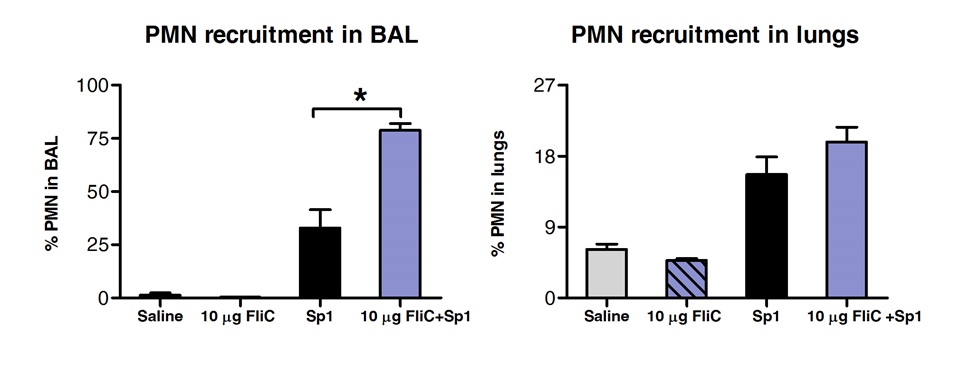
Figura 3 Análisis de neutrófilos polimorfonucleares (PMN) el reclutamiento en el tejido de las vías respiratorias y pulmones después de la ITSL. Ocho a10 semanas de edad ratones BALB / c (n = 4) fueron tratados con 10 g de flagelina o solución salina por vía sublingual bajo anestesia. 2 horas más tarde los ratones se expusieron por vía intranasal con la MLD de S. pneumoniae serotipo 1 E1585. 24 horas después de la exposición, BAL se realizó y los pulmones se procesaron para el análisis FACS. PMN se identificaron como células CD11b Ly6G altas / alta / CD11c negativos y basado en el perfil FCS-SSC. Los resultados se expresan como porcentaje de PMN con respecto del número total de células en BAL o los pulmones. Las barras representan media ± SEM. Los asteriscos indican diferencias estadísticamente significativas (p <0,05), calculado de acuerdo con una sola vía de Mann-Whitney.
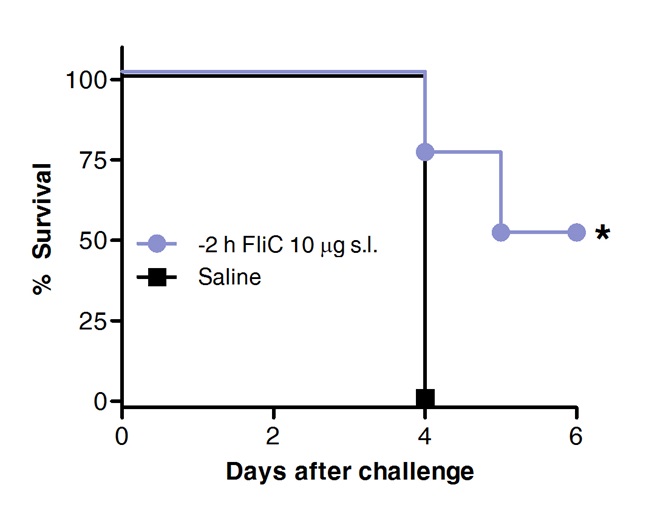
Figura 4. SLIT con flagelina protege a los ratones contra la neumonía neumocócica aguda. Ocho a 10 semanas de edad ratones BALB / c (n = 8) fueron tratados con 10 g de flagelina o solución salina por vía sublingual bajo anestesia. 2 horas más tarde los ratones se expusieron por vía intranasal con la MLD de S. pneumoniae serotipo 1 E1585. La supervivencia se evaluó sobre una base diaria. Las curvas de Kaplan-Meier se compararon según test de Log-rank (Mantel-Cox). Los asteriscos indican diferencias estadísticamente significativas (p <0,05) .Results son representativos de 2 experimentos independientes.
| Nombre | Secuencia 5'-3 ' | Longitud del producto de PCR (pb) |
| mB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| mB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| mIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| mIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
Tabla 1 lista Primer utilizado para el análisis de PCR en tiempo real. Secuencias de cebadores específicos utilizados para el análisis qPCR. Adelante y cebadores para ACTB ratón revertir, Cccl20, CXCL1, Il6, TNFa y CXCL1 se presentan como secuencias 5'-3 'y la longitud de producto esperado se indica en pares de bases (pb).
Discusión
La administración sublingual de agentes terapéuticos ha demostrado como un medio útil para modular la respuesta inmune en el tracto respiratorio. La principal ventaja de SLIT para el tratamiento de afecciones respiratorias es que no implica la entrega directa de los compuestos en los pulmones o la nariz, siendo más seguro que los tratamientos basados en la administración intranasal 31.
La inmunoterapia sublingual puede utilizarse para modular la respuesta inmune de diferentes maneras, ya sea para la inducción de respuestas reguladoras que pueden mejorar los síntomas de la inflamación alérgica y el asma o 32 para inducir la activación transitoria de mecanismos inmunes innatas para tratar infecciones pulmonares agudas como se muestra aquí.
El modelo de ratón se presenta en este vídeo es un método conveniente para la detección de diferentes compuestos como agentes terapéuticos para SLIT.
Este modelo animal ofrece un medio útil para determinar el impactode SLIT en la respuesta inmune de los pulmones, así como en otros órganos (por ejemplo., ganglios linfáticos de drenaje o de los sitios de la mucosa distales) que no puede ser imitado por el uso de modelos in vitro. Aunque hay varios artículos que describen los resultados obtenidos con la inmunoterapia sublingual, métodos de desarrollo para los procedimientos de administración sublingual no se han facilitado todavía. Además, el modelo se puede utilizar para la evaluación de las vacunas sublinguales con el objetivo de conferir protección sistémica así como local en el tracto respiratorio.
Como se muestra en el vídeo adjunto, la administración sublingual de los compuestos es un procedimiento simple que puede ser realizado fácilmente sin la necesidad de una amplia formación. Por lo general, una persona competente en el manejo de animales requerirá 1 hora para realizar la ITSL en un grupo de 10 ratones utilizando anestésicos inyectables como se describe en este protocolo. Si reto neumocócica se realiza, así, se requerirá 90 min adicional para prepararla suspensión bacteriana y realizar desafío intranasal de los animales.
Los protocolos de FACS presentados aquí permiten la caracterización adecuada de impacto de la ITSL en el sitio local de la administración, ganglios linfáticos de drenaje, así como sus efectos sobre la dinámica celular de los pulmones.
El análisis separado de la broncoalveolar parénquima pulmonar contenido y es importante para discriminar residente inmune de las vías respiratorias y de la infiltración de los tipos de células de las que quedan dentro del tejido. El análisis del contenido BAL permite el estudio de la facturación de los macrófagos alveolares, así como la dinámica de reclutamiento células en los espacios alveolares inducidas por diferentes tratamientos, por ejemplo., PMN, eosinófilos, monocitos. BAL también se puede utilizar para evaluar la presencia de citocinas y quimiocinas secretadas por el ensayo de inmunoabsorción ligado a enzimas (ELISA) o la detección de anticuerpos IgA secretados inducidos después de la vacunación sublingual. Estudio de los tejidos de los pulmonespermitirá caracterización de otros tipos de células, células dendríticas Clásicamente, las células T y células B.
Preparación de muestras de BAL y los ganglios linfáticos para el análisis FACS es simple. Después de la recogida de la muestra, se requieren normalmente de 60 minutos para completar el protocolo de tinción durante 10-20 muestras. En contraste, el aislamiento de las células de los pulmones o el tejido sublingual requerirá más tiempo ya que se requiere la digestión de la matriz extracelular. La absorción del agente terapéutico administrado por vía sublingual puede abordarse mediante el seguimiento de las moléculas con fluorescencia o marcadas radiactivamente utilizando en los sistemas de formación de imágenes in vivo.
La inmunoterapia sublingual es un método atractivo para inducir eficazmente las respuestas inmunes en el tracto respiratorio, así como sistémicamente que puede ser utilizado para tratar o prevenir enfermedades respiratorias. La elucidación de los mecanismos que determinan la activación vs tolerancia de la respuesta inmune en el tracto respiratorio después de SLIT ies crucial para permitir el diseño racional de nuevas estrategias terapéuticas que podrían ser utilizados solos o en combinación con tratamientos disponibles contra diferentes condiciones respiratorias.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
Materiales
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
Referencias
- . Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999 (2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1 (2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados