Method Article
L'immunoterapia sublinguale come alternativa di indurre una protezione contro le infezioni respiratorie acute
In questo articolo
Riepilogo
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
Abstract
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
Introduzione
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
Protocollo
Le procedure che coinvolgono animali sono stati eseguiti in conformità con i protocolli N ° 071140-000821-12 e 08.052.010 approvato dalla Commissione onorario per Sperimentazione animale e del Consiglio della Scuola di Medicina, Universidad de la República direttiva - Uruguay.
1 sublinguale Amministrazione della terapeutica dell'agente
- Preparare la soluzione contenente l'agente terapeutico da testare. Regolare la concentrazione di amministrare un volume massimo di 10 ml per topo.
NOTA: Per flagellin purificato da Salmonella enterica sierotipo Typhimurium la dose ottimale di indurre una protezione nel topo infettato con la prima dose letale di S. pneumoniae sierotipo 1 E1586, un tasso di mortalità del 100% è di 10 mcg / mouse. Flagellina soluzione deve essere riscaldata a 65 ° C per 5 minuti per assicurare il rilascio dei monomeri. Per ulteriori informazioni sulla purificazione flagellin vedi riferimento 26.- Varconcentrazione efficace y di diversi agenti immunomodulatori secondo la sua dimensione molecolare, la purezza, la suscettibilità alla proteolisi e l'uso di agenti mucoadesivi. Regolare la concentrazione ottimale per ogni composto da testare per massimizzare i suoi effetti. Se sono stati condotti studi precedenti per via intranasale per un particolare composto, utilizzare una dose iniziale da 5 a 10 volte superiore per testare la sua efficacia per via sublinguale.
- Anestetizzare i topi iniettando un cocktail contenente 110 mg / kg di ketamina con 5,5 mg / kg Xylacine e lasciare che gli animali riposare per 7-10 minuti.
- Verificare il corretto anestesia premendo delicatamente la zampa di una delle zampe posteriori; se adeguatamente anestetizzato l'animale non si muove in risposta allo stimolo.
- Stendere un sottile strato di vet unguento negli occhi di ogni mouse per prevenire la secchezza mentre sotto anestesia.
NOTA: anestetici inalatorie come isofluorane possono essere utilizzati anche al posto ketamina / Xylacine se un sistema equipped con camera e naso induzione coni è disponibile. Utilizzare la camera di induzione per anestetizzare gli animali e amministrare il immunostimolante per via sublinguale. Collegare immediatamente l'animale a un cono di naso per almeno 15 minuti per tenerlo sotto anestesia per evitare di deglutizione e permettere l'assorbimento del composto terapeutico. - Pipettare la soluzione contenente la soluzione immunostimolante o controllo del veicolo; utilizzando il pollice e l'indice della mano non dominante prendere il mouse e tenerlo in posizione verticale.
- Utilizzando il posto mano dominante un paio di pinze chiuse sotto la lingua e tenerlo in posizione con le dita medio e anulare, aprire le pinze per sollevare leggermente la lingua.
- Prendere la pipetta e somministrare la soluzione sul pavimento della bocca laterale e dorsale della lingua.
- Rimuovere le pinze e lasciare il resto del mouse per 3 a 5 minuti prima di rimetterlo in gabbia. Per garantire che normotermia è mantenuto nella microfono anestetizzatoe collegare le gabbie di un sistema di riscaldamento gabbia. Se tale sistema non è disponibile, luogo topi appartenenti al medesimo gruppo di trattamento di nuovo nel corrispondente una gabbia accanto all'altro sopra la biancheria da letto e in parte li coprono con fogli di carta tissue pulite per aiutarli a mantenere la temperatura corporea.
- Raccogliere campioni di tessuto in qualsiasi punto di tempo dopo l'instillazione di un agente immunomodulante per analizzare variazioni delle popolazioni cellulari indotte dal trattamento.
NOTA: In questo particolare protocollo di somministrazione flagellin è stata effettuata 2 ore prima della sfida. Determinare il tempo ottimale tra il trattamento e la sfida per ogni particolare agente terapeutico e patogeno da testare.
2 Preparazione della sospensione batterica e intranasale sfida con Streptococcus pneumoniae
NOTA: S. pneumoniae è un patogeno umano naturale che può causare malattie mortali come la polmonite invasiva, sepsie meningite. La trasmissione può avvenire per inalazione o contatto con la mucosa. Pertanto, tutti i campioni che possono essere state a contatto con S. pneumoniae deve essere gestita in un apposito impianto di biosicurezza di livello II con un armadio biosicurezza di classe II. Controllare le procedure operative standard della vostra istituzione per quanto riguarda la manipolazione di agenti patogeni di tipo II per indumenti protettivi, smaltimento dei rifiuti e le misure di sicurezza supplementari che possono applicarsi. Gli animali infetti devono essere tenuti in gabbie a ventilazione individuale in isolatori dotati di filtri HEPA. Vaccini anti-pneumococco e la terapia antibiotica sono disponibili. Per ulteriori informazioni, vedere i riferimenti 27 e 1.
- Scongelare una aliquota di uno stock sospensione di lavoro di Streptococcus pneumoniae di nota numero CFU batterica preparato come descritto in 15.
- Centrifugare per 5 minuti a 2500 xg e RT.
- Eliminare il surnatante e lavare il pellet batterico sospendendolo in 1 ml di stsoluzione salina erile. Utilizzare puntali con filtro per la preparazione batteriche di sospensione, diluizioni o per sfida animale.
- Centrifuga di nuovo come descritto al punto 2.2.
- Eliminare il supernatante e risospendere il pellet in volume appropriato di soluzione salina sterile per ottenere una sospensione di 4x10 5 CFU / 50 microlitri. Questa dose corrisponde alla dose minima batterica di S. pneumoniae sierotipo 1 E1586 che provoca una mortalità del 100% in topi BALB / c secondo studi precedenti 15.
NOTA: Quando si stabilisce un modello di polmonite pneumococcica nei topi, la dose batterica minima che provoca il 100% di mortalità deve essere determinata per ogni particolare combinazione di ceppo batterico, sierotipo e ceppo del mouse. - Omogeneizzare la sospensione batterica vortex o pipettare su e giù per 5 volte.
- Carico 50 ml di sospensione batterica con una punta filtro sterile e infondere il volume totale nelle narici di un topo anestetizzato. Tenere il upri del mouseght per 2 minuti e lasciare riposare in posizione dorsale per altri 2 min. Applicare veterinario unguento sui occhi e tornare gli animali per gabbia; assicurarsi di mantenere la normotermia mentre sotto anestesia.
NOTA: In questo studio sfida batterica è stata effettuata in un volume di 50 microlitri per garantire la consegna di almeno il 90% del totale CFU nei polmoni come precedentemente determinato in 15,28. Per ridurre al minimo disagio dei volumi minori dell'animale (ad esempio, 20 ml) può essere utilizzato. Tuttavia, la consegna efficiente di batteri nei polmoni deve essere controllato; questo può essere fatto raccogliendo i polmoni 5 minuti dopo la sfida e il conteggio CFU in omogenati polmonari da placcatura diluizioni seriali su piastre di agar sangue. - Confermare i numeri di CFU della sospensione batterica utilizzata per l'infezione da placcatura diluizioni seriali di 10 volte su piastre di agar sangue. Incubare O / N a 37 ° C con il 5% di CO 2 e contare il numero di colonie mucoidi presentano un caratteristico alone verde di albatteri pha emolitiche.
3 Tissue Raccolta e preparazione del campione per Citometria a flusso (FACS) Analisi
3.1) raccolta di tessuto
- Euthanize l'animale da dislocazione cervicale o utilizzando una camera di CO 2; aprire la cavità toracica tutta la strada fino al collo e fare un'incisione lungo le zampe anteriori per esporre il lato ventrale del collo e zona sottomandibolare.
- Con le belle punta ricurva pinza tirare delicatamente le ghiandole salivari e dei tessuti molli adiacenti per esporre il lato dorsale del pavimento della bocca. Utilizzando curve pinze punta sottile, prendere la mandibolare e accessori linfonodi mandibolari tirando delicatamente e metterli in una provetta contenente RPMI completo (cRPMI, per 500 ml-10% di siero fetale bovino, 5 ml di una soluzione contenente 10.000 U / ml penicillina e 10 mg / ml di streptomicina soluzione e 5 ml di L-glutammina 200 mM) o soluzione di acido nucleico conservante secondo il procedimento a valle che verràessere effettuata successivamente.
- Per aprire la cavità toracica fare una incisione nella membrana; utilizzando un paio di pinze ratto-dentata morsetto la cartilagine xifoideo dello sterno e con attenzione tagliare le costole su entrambi i lati dorsali a partire dalle costole false tutta la strada fino a raggiungere il punto in cui le costole vere incontrano il manubrio dello sterno.
- Tenendo la cartilagine xifoideo dello sterno con le pinze, tirare delicatamente per esporre gli organi della cavità toracica.
- Rimuovere le costole completamente tagliando le prime costole e la clavicola. Il timo apparirà come una struttura bianca di due lobi situati nella porzione anteroventral del torace vicino alla base del cuore.
- Prendete uno dei lobi fissando con un paio di pinze e utilizzare un paio di forbici per rimuovere i legamenti tra la sua faccia inferiore e il pericardio. Procedere per rimuovere il secondo lobo.
- Identificare la cavità addominale e aprirlo tagliando lungo l'asse mediano del mmuro uscular per esporre gli organi. Con un paio di pinze tagliare la cava posteriore e vena aorta toracica; rimuovere l'eccesso di sangue con un tessuto assorbente.
- Per analizzare le popolazioni di cellule residenti e infiltranti degli alveoli eseguire lavaggio broncoalveolare (BAL). Tagliare i muscoli nella parte ventrale del collo per esporre la trachea e l'esofago; separarli fare incisioni a fianchi laterali e dorsali delle strutture.
- Sollevare la trachea con le pinze e fare una piccola incisione con un bisturi per introdurre un trasferimento pipetta sottile punta riempita con 1 ml di PBS senza Ca 2 + / Mg 2 + + 1 mM EDTA. Infondere e aspirare il volume totale di almeno tre volte; aspirare e trasferire la sospensione cellulare di una provetta sterile da 1,5 ml e posizionarlo sul ghiaccio.
- Per analizzare le popolazioni cellulari presenti nel parenchima polmonare, prima defluire in polmoni iniettando 5 ml di PBS senza Ca 2 + / Mg 2 + e 1 mM EDTA nel ventricolo destrodel cuore.
NOTA: Ciò elimina la maggior parte dei globuli rossi e le cellule immunitarie presenti nei vasi sanguigni dei polmoni. Se perfusione è stata eseguita correttamente, i polmoni colore si sposterà dal rosa al bianco. - Isolare cuore dai polmoni fissando dalla base del ventricolo sinistro e delicatamente tagliare i vasi sanguigni con forbici per rimuovere completamente. Dai polmoni perfusi e metterli in cRPMI o soluzione di acido nucleico conservante in base all'analisi valle da eseguire.
- Per l'analisi delle popolazioni di cellule della mucosa sublinguale, isolare la testa dell'animale e rimuovere le ghiandole salivari e dei tessuti molli adiacenti se non è stato fatto nella fase 3.2.1.
- Fare un'incisione su ciascun lato della bocca fino a raggiungere l'articolazione mandibola e separare la mascella inferiore insieme con la lingua e pavimento della bocca, utilizzando perni di fissaggio a bordo dissezione. Tirare la lingua; utilizzando un bisturi fanno un'incisione in cui il baSE della lingua incontra il pavimento della bocca fino a raggiungere i terzi molari per esporre la mucosa sublinguale.
- Rimuovere completamente la lingua; prendere una biopsia 0,5 millimetri e posizionarlo accanto ai incisivi inferiori. Tagliare dall'inserimento del tessuto gengivale sublinguale e premere delicatamente fino a quando il pavimento della bocca è stato tagliato fuori completamente.
- Ripetere ancora una volta ora mettendo la biopsia vicino ai terzi molari per completare la rimozione del tessuto sublinguale. Mettere in una provetta pulita contenente cRPMI o conservanti acido nucleico.
3.2) Preparazione dei campioni per l'analisi FACS.
- Trasferire tessuto isolato da ogni topo dei polmoni in una piastra da 24 pozzetti e tritateli con un paio di forbici pulita fino ad ottenere piccoli pezzi di tessuto di circa 2 mm. Aggiungere 1 ml per pozzetto di mezzo di digestione contenente 30 mg di collagenasi di tipo II, 50 mg DNAsi-I in 1 ml di RPMI senza FBS. Pipettare su e giù per cinque volte e incubare a37 ° C e 5% di CO 2 per 40 min.
- Per l'analisi di popolazioni cellulari nel tessuto sublinguale, sostituire il mezzo digestione in 3.2.1 con una contenente 2 unità di dispasi, 30 mg di tipo II collagenasi 50 mg DNAsi-I in 1 ml di RPMI. Incubare il tessuto prelevato da un topo in 500 ml di mezzo di digestione per 20 minuti a 37 ° C in un agitatore orbitale a 50 rpm.
- Dopo l'incubazione, pipettare su e giù fino a 10 volte o 30 secondi fino a quando la maggior parte del tessuto è stato interrotto. Filtrare la sospensione cellulare anche se un 40 micron filtro cella sterile e lavare con 5 ml di PBS completato con 5 mM EDTA.
NOTA: la digestione completa della matrice extracellulare e tessuto fibroso non sarà raggiunto. Tuttavia, tempi di incubazione più lunghi in presenza di collagenasi e / o dispasi o triturazione aggressivo non sono raccomandati in quanto si tradurrà in un aumento della morte cellulare e distruzione delle proteine extracellulari che incidono sul risultato complessivo della FACS. - Centrifugare a 400 xg, 5 min, 4 ° C.
- Per l'analisi delle popolazioni cellulari in BAL, centrifugare le cellule a 400 xg, 5 min, a 4 ° C e continuare con il passo 3.2.4.
- Per l'analisi di popolazioni cellulari nei linfonodi, inserire un filtro 70 micron cella su una piastra di Petri sterile e mettere la linfonodi insieme con 1 ml di cRPMI nel filtro. Estrarre il tuffo di una 2 ml siringa sterile e usarlo come un pestello per schiacciare i linfonodi nei confronti della maglia del filtro. Sciacquare il filtro cella con 1 ml di fresca cRPMI e trasferire le cellule dalla capsula di Petri in una provetta sterile.
- Prelevare un'aliquota rappresentante di ciascun campione e macchiare con Trypan Blue per determinare il numero di cellule vitali.
- Risospendere le cellule in FACS-EDTA: PBS-EDTA 5 mM-1% di siero bovino Albumina per comporre una sospensione di 2x10 7 cellule / ml e aggiungere 50 ml in un tubo citometro.
- Preparare una miscela di anticorpi 2X contenente l'appropriate combinazioni di anticorpi contro marcatori di superficie e fluorocromi in base allo strumento FACS disponibile. Aggiungere 50 microlitri della miscela anticorpale 2X in ogni provetta contenente la sospensione cellulare.
NOTA: Titolare ciascun fluorocromo anticorpo marcato per determinare la quantità ottimale da utilizzare, per un protocollo dettagliato vedi riferimento 29. - Incubare 30 min in ghiaccio al buio.
- Lavare una volta con 3 ml di FACS-EDTA e centrifugare le cellule per centrifugazione a 400 xg per 5 minuti a 4 ° C, risospendere le cellule in 200 microlitri dello stesso tampone e analizzare in un citometro di flusso.
NOTA: Se la manipolazione di un gran numero di campioni, il protocollo di colorazione per l'analisi FACS sopra descritto può essere eseguito in piastre a 96 pozzetti con fondo a U, invece di tubi citometro. Tuttavia, se si utilizza 96 pozzetti passi piastre di lavaggio deve essere eseguita aggiungendo fino a 200 ml di FACS-EDTA e ripetendo 4 volte la filatura le cellule a 400 xg per 5 minuti a 4 ° C tra ogni washipasso ng. - A questo punto, fissare i campioni per l'analisi del citometro a flusso più tardi (fino a 72 ore dopo la fissazione).
- Per fissare le cellule, dopo marcatura con i FACS-anticorpi lavare le cellule in PBS senza Ca 2 + / Mg 2 +, 1 mM EDTA, senza FBS. Sospendere le cellule in 50 ml dello stesso tampone e aggiungere 50 ml di una soluzione di paraformaldeide al 4% appena preparata in ipertonica (2X) PBS senza Ca 2 + / Mg 2 +.
- Incubare per 20 min a RT e lavare 3 volte in FACS-EDTA.
- Risospendere le cellule in 200 microlitri di FACS-EDTA e conservare a 4 ° C e al riparo dalla luce per un massimo di 72 ore.
NOTA: FSC-SSC può essere influenzata da fissazione. Se il fissaggio di controllo campioni compatibilità di anticorpi marcati modo fluorescente con il produttore in quanto coloranti tandem possono essere degradati in presenza di agenti fissativi. Se i campioni provenivano da animali infetti fissazione è altamente raccomandato per garantire che non patogeni vitali saranno presenti quando Analycantano i campioni in macchina FACS dal microaerosols possono essere generati durante l'acquisizione del campione.
4 Estrazione di RNA totale, cDNA Synthesis e Real Time PCR.
4.1) estrazione di RNA e sintesi di cDNA.
- Omogeneizzare il tessuto nella soluzione di acido nucleico di conservante scelta dalla rottura meccanica (ad esempio, utilizzando un omogeneizzatore rotore-statore, ad alta velocità di agitazione tessuto-ruptor e perline, ecc). Centrifugare a 12.600 xg per 15 min e 4 ° C per rimuovere i frammenti di tessuto. Trasferire il surnatante in una provetta pulita.
- Estrarre l'RNA con il metodo di scelta seguendo le istruzioni del produttore.
NOTA: RNA è altamente suscettibile alla degradazione, se non sta per essere utilizzato subito dopo l'isolamento, rendere aliquote e memorizzarli in tubi liberi RNAsi a -80 ° C. Evitare cicli ripetuti di congelamento e scongelamento. I tubi devono essere maneggiati con i guanti in ogni momento. Dopo lo scongelamento dei campioni di unlways tenerli su ghiaccio. - Misurare l'assorbanza di acidi nucleici a 260 nm e calcolare la concentrazione in mg / mL.
- Preparare DNAse-impasto con l'aggiunta di (per 1 campione): 7.6 ml di acqua ultrapura, 1 ml di tampone 10X DNAse-I, 0,4 microlitri di DNAsi-I (grado di amplificazione) stock 1 U / ml e aggiungere 8,4 ml di il DNAse-I mix di ogni campione contenente 1 mg di RNA totale.
- Utilizzare RNA ad una concentrazione di 1 mg / mL ed eseguire la reazione retrotrascrizione (RT-PCR) aggiungendo 1 ml di RNA come stampo. Se i campioni sono troppo diluito e la concentrazione è inferiore al previsto, aggiungere grandi quantità di RNA totale invece di acqua. Non superare il 20% del volume finale di reazione quando si aggiunge l'RNA specialmente se il protocollo di estrazione di RNA di scelta coinvolto miscela di fenolo-cloroformio dal fenolo tracce potrebbero influenzare il rendimento della RT-PCR.
- Incubare 15 minuti a temperatura ambiente seguita da 10 minuti a 4 ° C o ice. (Non superare il tempo di incubazione !!)
- Aggiungere 1 ml di EDTA 25 mM (grado biologia molecolare) a ciascuna provetta e incubare a 65 ° C per 10 minuti per inattivare il DNAsi-I.
- Preparare retrotrascrizione (RT) mix come segue (per 1 reazione): 1 ml primer esameriche casuali stock 0,2 mg / ml, 1 ml dNTP magazzino 10 mm, 4 microlitri di buffer 5X M-MLV-RT, 2 microlitri DTT 0,1 M, 1 ml RNAse OUT magazzino 40 U / ml, e 1 ml M-MLV retrotranscriptase magazzino 200 U / ml.
- Aggiungere 10 ml di RT-PCR mescolano alla DNAsi-I tubo di reazione 10 microlitri.
- Effettuare la reazione PCR in un termociclatore secondo il seguente programma:
Ciclo 1X: 10 min, 25 ° C; 50 min, 37 ° C; 15 min, 70 ° C - Diluire il cDNA 1: 5 con l'aggiunta di 80 ml di acqua ultrapura. Conservare a -20 ° C.
4.2) Real time PCR (qPCR).
- Preparare la miscela di reazione qPCR come segue (per 1 reazione): 5 ml master mix contenente Taq DNA Polymerase, colorante SYBR Green, PCR Buffer, dNTP mix e MgCl 2 (vedi 4.2.2); 0,9 ml di una soluzione 10 mM magazzino del primer forward, 0,9 ml di una soluzione 10 mM magazzino del primer reverse, acqua ultrapura 1.2 ml, e 2 ml di template cDNA precedentemente diluiti come indicato al punto 4.1.10.
NOTA: concentrazione di reagente e in bicicletta protocolli utilizzati in questa sezione sono stati ottimizzati per essere effettuata in concreto con i reagenti e gli strumenti descritti nella "Tabella dei Materiali e reagenti", altre marche possono essere utilizzati, ma volumi di reazione, la concentrazione del reagente e il protocollo di ciclismo possono variare. Controllare le istruzioni del produttore prima di eseguire RT-qPCR. - Impostare lo strumento qPCR come segue:
Ciclo 1X: 15 min, 95 ° C
40X cicli: 15 sec, 95 ° C seguita da 1 min, 60 ° C (a questo punto acquisiscono fluorescenza).
NOTA: Per la quantificazione relativa dell'mRNA secondo il metodo Ct 30 un reference gene deve essere selezionato per la normalizzazione dei valori Ct. Riferimento gene di scelta deve essere testato in condizioni di analisi specifiche come la sua espressione può variare; ACTB, GAPDH o 18S sono alcuni dei geni normalmente scelto come riferimenti. - Impostare il valore di soglia e analizzare i dati.
Risultati
Immunoterapia sublinguale può essere utilizzato con successo per modulare la risposta immunitaria polmoni. Abbiamo mostrato che una singola dose di flagellina, l'agonista TLR5 e NLRC4, può indurre significativo sovraregolazione del mRNA codificante la CXCL1 chemochine, CCL20 e la citochina IL-6 rispetto ai controlli trattati con soluzione salina. Fold induzione di livelli di mRNA alzato a 8 ore dopo SLIT e tornare ai livelli basali dopo 20 ore (Figura 1). Tuttavia, quando la SLIT è stata effettuata 2 ore prima infezione intranasale con S. Pneumoniae, i livelli di CXCL1 e IL6 mRNA rimasero sovraregolati significativamente anche 24 ore dopo SLIT rispetto agli animali non trattati (Figura 2).
Analisi delle popolazioni cellulari in BAL e tessuto polmonare mediante FACS rivelato che gli animali trattati con FLIC per via sublinguale avevano aumentato numero di neutrofili nelle vie aeree, ma non nel tessuto dei polmoni (Figura 3).
Infine, la sopravvivenza dopo la sfida pneumococcica è stato confrontato in animali precedentemente trattati con FLIC per via sublinguale o con soluzione salina come controllo. Come mostrato in Figura 4, SLIT con flagellin promosso protezione e aumentato la sopravvivenza contro la polmonite pneumococcica acuta.
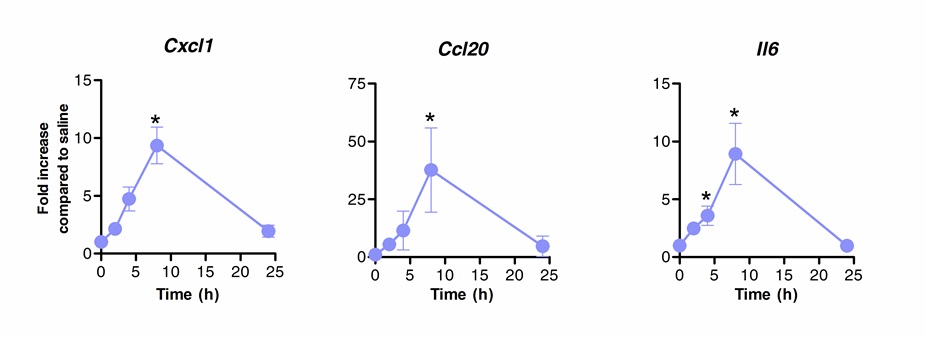
Figura 1: Cinetica di profilo trascrizionale dei polmoni dopo immunoterapia sublinguale con flagellina. Otto a 10 settimane di età topi BALB / c (n = 4) sono stati trattati con 10 mg di flagellin o soluzione salina per via sublinguale sotto anestesia. I polmoni sono stati raccolti in diversi momenti e posti in conservante acido nucleico. Estrazione di RNA totale è stato eseguito e cDNA è stato sintetizzato. livelli di mRNA sono stati valutati mediante real time PCR usando primer specifici elencati in Tabl1 e quantificazione relativa è stata eseguita secondo il metodo ΔCt utilizzando i livelli ACTB mRNA per la normalizzazione. I risultati sono mostrati come volte maggiore rispetto al gruppo trattato con soluzione salina come mediana ± SEM. Gli asterischi indicano differenze statisticamente significative (p <0.05) calcolati in base al test di Mann-Whitney. I risultati sono rappresentativi di 2 esperimenti indipendenti.
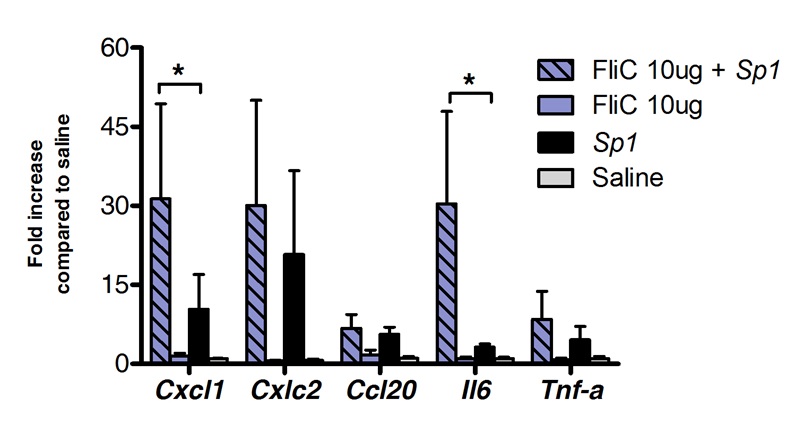
Profilo trascrizionale Figura 2 polmoni durante la polmonite pneumococcica dopo immunoterapia sublinguale con flagellina. Otto a 10 settimane i topi BALB / c (n = 4 per il gruppo di controllo e n = 7 per il gruppo trattato) sono stati trattati con 10 mg di flagellin o soluzione salina da via sublinguale sotto anestesia. 2 ore più tardi topi sono stati sfidati per via intranasale con la dose letale minima (MLD) causando 100% di mortalità di un isolato clinico di S. pneumoniae sierotipo 1 E1585, corrispondente a 4x10 5 CFU / 50 microlitri. I polmoni sono stati raccolti 24 ore dopo la sfida e conservati in conservante acido nucleico finché sono stati eseguiti estrazione di RNA e cDNA sintesi. Real time PCR è stata effettuata (vedi elenco in fondo Tabella 1) e relativa quantificazione è stata eseguita secondo il metodo ΔCt utilizzando i livelli ACTB mRNA per la normalizzazione. I risultati sono mostrati come volte maggiore rispetto al gruppo trattato con soluzione salina come mediana ± SEM. Gli asterischi indicano differenze statisticamente significative (p <0.05) calcolati in base al test di Mann-Whitney.
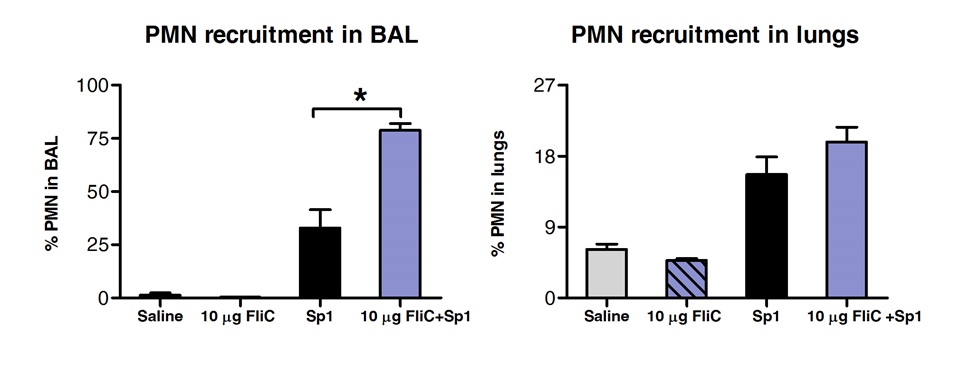
Figura 3 Analisi dei polimorfonucleati neutrofili (PMN) reclutamento nel tessuto e le vie respiratorie polmoni dopo SLIT. Eight di10 settimane topi BALB / c (n = 4) sono stati trattati con 10 mg di flagellin o soluzione salina per via sublinguale sotto anestesia. 2 ore più tardi topi sono stati sfidati per via intranasale con la MLD di S. pneumoniae sierotipo 1 E1585. 24 ore dopo la sfida, BAL è stata eseguita e polmoni sono stati elaborati per l'analisi FACS. PMN sono stati identificati come cellule CD11b Ly6G alta / alta / CD11c negativi e basato sul profilo FCS-SSC. I risultati sono espressi come percentuale di PMN rispetto di numero di cellule totali in BAL o polmoni. Barre rappresentano mediana ± SEM. Gli asterischi indicano differenze statisticamente significative (p <0.05) calcolati secondo senso unico test di Mann-Whitney.
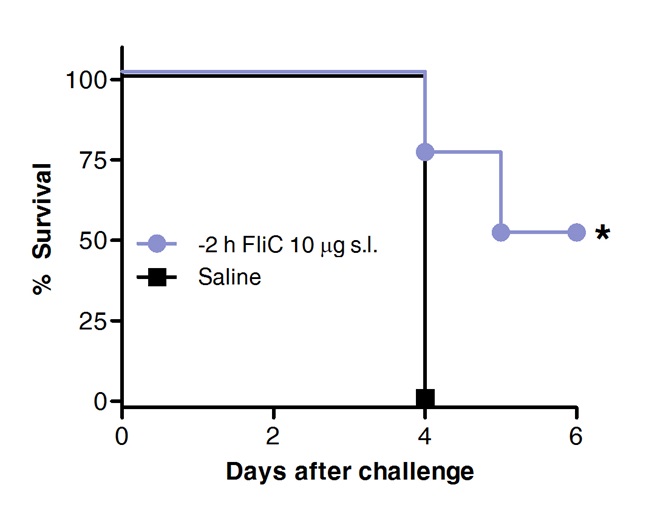
Figura 4 SLIT con flagellin protegge i topi contro la polmonite pneumococcica acuta. Otto a 10 settimane di età BALB / c topi (n = 8) sono stati trattati con 10 mg di flagellin o soluzione salina per via sublinguale sotto anestesia. 2 ore più tardi topi sono stati sfidati per via intranasale con la MLD di S. pneumoniae sierotipo 1 E1585. La sopravvivenza è stata valutata su base giornaliera. Le curve di Kaplan-Meier sono stati confrontati in base Log-rank (Mantel-Cox) test. Gli asterischi indicano differenze statisticamente significative (p <0,05) .Results sono rappresentativi di 2 esperimenti indipendenti.
| Nome | Sequenza 5'-3 ' | PCR lunghezza del prodotto (bp) |
| mB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| mB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| mIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| mIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
Tabella 1 Lista Primer utilizzati per real time PCR. Sequenze di primer specifiche utilizzate per l'analisi qPCR. Avanti e indietro primer per il mouse ACTB, Cccl20, CXCL1, IL6, TNFa e CXCL1 sono presentati come sequenze 5'-3 'e la durata prevista del prodotto è indicato in paia di basi (bp).
Discussione
Somministrazione sublinguale di agenti terapeutici è stato dimostrato come un mezzo utile per modulare la risposta immunitaria nel tratto respiratorio. Il vantaggio principale della SLIT per il trattamento delle malattie respiratorie è che non comporta la consegna diretta dei composti nei polmoni o le narici, essendo più sicuro di trattamenti basati sulla somministrazione intranasale 31.
Immunoterapia sublinguale può essere utilizzato per modulare la risposta immunitaria in modi diversi, sia per l'induzione di risposte normative che possono migliorare i sintomi di infiammazione allergica e asma 32 o per indurre l'attivazione transitoria dei meccanismi immunitari innati per trattare le infezioni polmonari acute come mostrato qui.
Il modello di topo presentato in questo video è un metodo conveniente per lo screening di composti diversi, come agenti terapeutici per SLIT.
Questo modello animale offre un utile mezzo per determinare l'impattodella SLIT nella risposta immunitaria dei polmoni e in altri organi (ad es., linfonodi drenanti o siti mucose distali) che non può essere imitato con l'uso di modelli in vitro. Anche se ci sono diversi documenti che descrivono i risultati ottenuti con l'immunoterapia sublinguale, non sono stati resi ancora disponibili metodi dettagliati per le procedure di somministrazione sublinguale. Inoltre, il modello può essere utilizzato per la valutazione dei vaccini sublinguali inibitori a conferire protezione sistemica e locale nel tratto respiratorio.
Come mostrato nel video allegato, la somministrazione sublinguale di composti è una procedura semplice che può essere facilmente eseguita senza la necessità di una formazione. In genere, una persona abile nella manipolazione degli animali richiede 1 ora per eseguire SLIT in un gruppo di 10 topi utilizzando anestetici iniettabili come descritto in questo protocollo. Se sfida pneumococco viene eseguita come pure, 90 min aggiuntivo sarà richiesto per prepararesospensione batterica ed effettuare intranasale sfida degli animali.
I protocolli FACS qui presentati consentono comoda caratterizzazione dell'impatto della SLIT nel sito locale di somministrazione, linfonodi, nonché i loro effetti sulla dinamica delle cellule dei polmoni.
Analisi separata dei contenuti e del polmone broncoalveolare parenchima è importante per discriminare residente immunitario delle vie respiratorie "e infiltrazione tipi di cellule da quelle che rimangono all'interno del tessuto. L'analisi del contenuto BAL consente lo studio del fatturato macrofagi alveolari nonché le dinamiche di cellule assunzione negli spazi alveolari indotte da trattamenti diversi, ad esempio., PMN, eosinofili, monociti. BAL può essere utilizzato anche per valutare la presenza di citochine e chemochine secrete da Enzyme-linked immunosorbent assay (ELISA) o il rilevamento di anticorpi IgA secreti ottenuta dopo la vaccinazione sublinguale. Studio del tessuto dei polmonipermetterà la caratterizzazione di altri tipi di cellule, le cellule dendritiche in stile classico, le cellule T e le cellule B.
Preparazione dei campioni BAL e linfonodi per l'analisi FACS è semplice. Dopo la raccolta del campione, normalmente 60 minuti sono necessari per completare il protocollo di colorazione per 10-20 campioni. Al contrario, l'isolamento di cellule da polmoni o tessuto sublinguale richiede più tempo in quanto è necessaria la digestione della matrice extracellulare. L'assorbimento dell'agente terapeutico consegnato da via sublinguale può essere affrontato il monitoraggio di molecole modo fluorescente o marcati radioattivamente utilizzando sistemi di imaging in vivo.
Immunoterapia sublinguale è un metodo interessante per indurre efficacemente risposte immunitarie nel tratto respiratorio e sistemica che può essere usato per trattare o prevenire patologie respiratorie. Delucidazione dei meccanismi che determinano l'attivazione vs tolleranza della risposta immunitaria nel tratto respiratorio dopo SLIT is cruciale per permettere progettazione razionale di nuove strategie terapeutiche che possono essere usati da soli o in combinazione con trattamenti contro patologie respiratorie diverse.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
Materiali
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
Riferimenti
- . Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999 (2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1 (2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon