Method Article
Sublinguale Immuntherapie als Alternative zum Schutz vor akuten Atemwegsinfektionen ausgelöst werden
In diesem Artikel
Zusammenfassung
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
Zusammenfassung
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
Einleitung
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
Protokoll
Uruguay - Verfahren, die Tiere wurden in Übereinstimmung mit den Protokollen N ° 071140-000821-12 und 08.052.010 durch die Ehrenkommission für Tierversuche und der Richtlinie Vorstand der School of Medicine, Universidad de la República genehmigt geführt.
1. sublinguale Verabreichung des Therapeutikums
- Bereiten Sie die Lösung, die das therapeutische Mittel zu testen. Konzentration einzustellen, um ein maximales Volumen von 10 ul pro Maus zu verwalten.
HINWEIS: Für gereinigt Flagellin von Salmonella enterica Serovar Typhimurium die optimale Dosis, um den Schutz in der Maus mit dem ersten tödlichen Dosis von S. infiziert induzieren pneumoniae Serotyp 1 E1586, 100% Mortalität beträgt 10 ug / Maus. Flagellin Lösung ist bei 65 ° C für 5 min erhitzt werden, um die Freisetzung der Monomere zu gewährleisten. Für weitere Informationen über Flagellin Reinigung siehe Referenz 26.- Vary wirksame Konzentration verschiedener immunmodulierender Wirkstoffe entsprechend ihrer Molekülgröße, die Reinheit, die Anfälligkeit gegenüber Proteolyse und die Verwendung der mucoadhäsiven Mittel. Einzustellen optimale Konzentration für jede Verbindung, die getestet werden, um ihre Wirkung zu maximieren. Wenn frühere Studien durch intranasale Route haben für eine bestimmte Verbindung durchgeführt wurde, verwenden Sie eine Anfangsdosis von 5 bis 10-mal höher, um seine Wirksamkeit durch sublinguale testen.
- Anästhesierung der Mäuse durch Injektion eines Cocktails, die 110 mg / kg Ketamin mit 5,5 mg / kg Xylacine und ließ die Tiere ruhen für 7 bis 10 min.
- Überprüfen Sie die Betäubung durch leichtes Drücken der Pfotenballen von einem der Hinterbeine; wenn sie richtig betäubt das Tier nicht als Reaktion auf den Stimulus zu bewegen.
- Eine dünne Schicht der Tierarzt Salbe in den Augen jeder Maus zur Trockene, während der Narkose zu verhindern.
HINWEIS: Inhalationsanästhesie wie Isofluoran können auch verwendet werden anstelle Ketamin / Xylacine wenn ein System auszustattenped mit Induktionskammer und Nase Kegel zur Verfügung. Verwenden Sie die Induktionskammer, um die Tiere zu betäuben und Verwaltung des Immunstimulans durch sublinguale Route. Sofort schließen Sie das Tier einem Nasenkegel für mindestens 15 min, um es unter Narkose zu halten, um zu vermeiden, Schlucken und ermöglichen die Absorption des therapeutischen Verbindung. - Pipettieren die Lösung, die das Immunstimulans oder Fahrzeugsteuerungslösung; mit dem Daumen und Zeigefinger der nicht-dominanten Hand zu nehmen die Maus und halten Sie es in vertikaler Position.
- Mit der dominanten Hand Platz ein geschlossener Zange unter die Zunge und halten Sie sie mit den Mittel-und Ringfinger, öffnen Sie die Zange leicht die Zunge zu heben.
- Nehmen Sie die Pipette und Verwaltung der Lösung auf den Boden der Mundhöhle und dorsalen Seite der Zunge.
- Entfernen Sie die Zange und lassen Sie die Maus Rest für 3 bis 5 min, bevor es wieder in den Käfig. Um sicherzustellen, dass Normothermie in der narkotisierten mic gehaltene, verbinden die Käfige zu einem Käfig Heizsystem. Wenn ein solches System nicht verfügbar ist, statt Mäuse der gleichen Behandlung Gruppe gehören, wieder in den entsprechenden Käfig nebeneinander über das Bettzeug und sie teilweise bedecken mit sauberem Gewebe Papierbögen zu helfen, die Körpertemperatur zu halten.
- Sammeln von Gewebeproben zu jedem Zeitpunkt nach der Instillation von immunmodulatorischen Mittel, um Änderungen in den Zellpopulationen, die durch die Behandlung induzierte analysieren.
HINWEIS: In diesem speziellen Protokoll Verabreichung von Flagellin wurde 2 h vor Herausforderung durchgeführt. Bestimmung der optimalen Zeit zwischen Behandlung und Herausforderung für jedes bestimmte therapeutische Mittel und Erreger getestet werden.
2. Vorbereitung der Bakteriensuspension und intranasale Herausforderung mit Streptococcus pneumoniae
HINWEIS: S. pneumoniae ist eine natürliche menschliche Krankheitserreger, der lebensbedrohlichen Krankheiten wie Lungenentzündung invasive, Sepsis verursachen könnenund Meningitis. Übertragung auftreten kann, wenn sie eingeatmet oder in Kontakt mit der Schleimhaut. Daher wurden alle Proben, die in Kontakt mit S. gewesen sein kann pneumoniae muss in einem angemessenen Biosicherheitsstufe II Anlage mit einer Klasse II Biosicherheitswerkbank behandelt werden. Überprüfen Sie die Standard Operating Procedures Ihrer Institution im Umgang mit dem Typ-II-Erreger für Schutzkleidung, Entsorgung und zusätzliche Sicherheitsmaßnahmen, die zutreffen können. Infizierte Tiere sollten einzeln in Käfigen gelüfteten in Isolatoren mit HEPA-Filter ausgestattet gehalten werden. Anti-Pneumokokken-Impfstoffe und Antibiotika-Therapie zur Verfügung. Für weitere Informationen siehe Referenzen 27 und 1.
- Auftauen einem aliquoten Teil einer Arbeitsstoffsuspension von Streptococcus pneumoniae von bekannten bakteriellen CFU Zahl hergestellt werden, wie in 15 beschrieben.
- Zentrifuge 5 min bei 2500 × g und Raumtemperatur.
- Überstand verwerfen und waschen das Bakterienpellet durch Suspendieren in 1 ml sterile Kochsalzlösung. Filterspitzen bei der Vorbereitung Bakteriensuspension, Verdünnungen oder zur Tier Herausforderung.
- Zentrifuge wieder wie in Schritt 2.2 beschrieben.
- Überstand verwerfen und das Pellet in dem entsprechenden Volumen von steriler Kochsalzlösung, um eine Suspension von 4x10 5 CFU / 50 ul zu erhalten. Diese Dosis entspricht der minimalen Dosis von Bakterien S. pneumoniae-Serotyp 1, E1586, die 100% Mortalität verursacht in BALB / c-Mäusen nach früheren Studien 15.
HINWEIS: Bei der Festlegung eines Modells der Pneumokokken-Pneumonie bei Mäusen, die minimale Bakteriendosis verursacht 100% der Sterblichkeit muss für jede einzelne Kombination von Bakterienstamm, Serotyp und Maus-Stamm bestimmt werden. - Homogenisierung der Bakteriensuspension durch Vortexen oder Auf-und Abpipettieren 5 mal.
- Last 50 ul der Bakteriensuspension mit einem Sterilfilter Spitze und vermitteln das Gesamtvolumen in die Nasenlöcher eines narkotisierten Maus. Halten Sie die Maus UPRIght für 2 Minuten und lassen Sie es in Rückenlage ruhen für weitere 2 min. Gelten Tierarzt Salbe auf die Augen und die Tiere zurück in den Käfig; stellen Sie sicher, Normothermie während der Narkose zu halten.
HINWEIS: In dieser Studie bakteriellen Herausforderung wurde in einem Volumen von 50 ul durchgeführt, die Lieferung von zumindest 90% der gesamten CFU in den Lungen sicherzustellen, wie zuvor in 15,28 bestimmt. Um Not kleineren Volumina des Tieres (beispielsweise 20 ul) verwendet werden, zu minimieren. Allerdings müssen effiziente Lieferung von Bakterien in den Lungen überprüft werden; dies kann durch die Ernte der Lunge 5 min nach Herausforderung und Zählen CFU in Lunge Homogenaten durch Plattierung serielle Verdünnungen auf Blut-Agar-Platten durchgeführt werden. - Bestätigen Sie die CFU Zahlen in die Bakteriensuspension für eine Infektion durch Plattierung verwendet serielle 10-fache Verdünnungen auf Blutagarplatten. Inkubieren O / N bei 37 ° C mit 5% CO 2 und zählen die Anzahl der schleimige Kolonien präsentiert einen grünen Halo charakteristisch für alpha hämolytische Bakterien.
3. Gewebeentnahme und Probenvorbereitung für die Durchflusszytometrie (FACS) Analyse
3.1) Gewebesammlung
- Das Tier einschläfern durch Genickbruch oder mit einem CO 2-Kammer; öffnen den Brustraum den ganzen Weg bis zum Hals und einen Einschnitt entlang der Vorderbeine, die Bauchseite des Halses und Unterkieferspeichelbereich aus.
- Mit der feinen Spitze gebogenen Pinzette vorsichtig nach oben ziehen die Speicheldrüsen und der angrenzenden Weichgewebe, um die Rückenseite des Mundbodens aus. Mit gebogenen dünnen Spitze Pinzette, nehmen Sie die Unterkiefer-und Unterkiefer Zubehör Lymphknoten durch Hochziehen sanft und legen Sie sie in ein Röhrchen mit komplettem RPMI (cRPMI, 500 ML 10% fötale Rinderserum, 5 ml einer Lösung, die 10.000 U / ml Penicillin und 10 mg / ml Streptomycin-Lösung und 5 ml L-Glutamin 200 mm) oder Nukleinsäure-Konservierungslösung nach dem nachgelagerten Verfahren, dass Willspäter durchgeführt werden.
- So öffnen Sie die Brusthöhle einen Einschnitt in der Membran; mit ein Paar von rat-Zahnzangen klemmen die Xyphoid Knorpel des Brustbeins und sorgfältig geschnitten, die Rippen an beiden dorsalen Seiten ausgehend von den falschen Rippen ganzen Weg bis zum Erreichen der Punkt, wo die wahren Rippen erfüllen die Brustbein.
- Durch Halten der Schwertfortsatz des Brustbeins Knorpel mit der Zange, ziehen Sie vorsichtig, um die Organe der Brusthöhle aus.
- Entfernen Sie die Rippen vollständig, indem die ersten Rippen und des Schlüsselbeins. Der Thymus ist als weißen Struktur aus zwei Lappen in anteroventral Teil des Thorax nahe der Basis des Herzens befindet, angezeigt.
- Nehmen Sie eine der Keulen durch Klemmen Sie es mit einer Pinzette und verwenden Sie eine Schere, um die Bänder zwischen ihrer unteren Fläche und der Herzbeutel zu entfernen. Fahren Sie mit dem zweiten Lappen entfernen.
- Identifizieren Sie die Bauchhöhle und öffnen Sie sie, indem entlang der Mittelachse des muscular Wand, um die Organe aus. Mit einer Pinzette schneiden die hintere Hohlvene und Aorta; entfernen Sie das überschüssige Blut mit einem saugfähigen Gewebe.
- Um zu analysieren, die ansässigen und Infiltrieren Zellpopulationen der Alveolen führen Bronchiallavage (BAL). Schneiden Sie die Muskeln im ventralen Teil des Halses, um die Luft-und Speiseröhre freizulegen; sie zu trennen, Einschnitte bei lateralen und dorsalen Seite der Strukturen.
- Heben Sie die Luftröhre mit der Zange und einen kleinen Schnitt mit dem Skalpell, um eine dünne Spitze-Transferpipette mit 1 ml PBS gefüllt, ohne Ca 2 + / Mg 2 + plus 1 mM EDTA einzuführen. Vermitteln und saugen sich das Volumen auf mindestens drei Mal; absaugen und übertragen die Zellsuspension in ein steriles 1,5-ml-Röhrchen und legen Sie es auf Eis.
- Die Zelle in Lungenparenchym vorliegenden Populationen zu analysieren ersten Perfusion der Lunge durch Einspritzen von 5 ml PBS ohne Ca 2 + / Mg 2 + und 1 mM EDTA in den rechten Ventrikeldes Herzens.
HINWEIS: Dies wird die meisten der roten Blutzellen und Immunzellen in der Lunge Blutgefäße vorhanden beseitigen. Wenn Perfusion korrekt durchgeführt wurde, werden die Lungen Farbe von rosa bis weiß verschieben. - Trennen Sie das Herz von den Lungen durch Klemm es von der Basis des linken Ventrikels und fein schneiden, die Blutgefäße mit einer Schere, um es vollständig zu entfernen. Nehmen perfundierten Lunge und sie in cRPMI oder Nukleinsäurekonservierungslösung in Abhängigkeit von der stromabwärts Analyse durchgeführt werden.
- Für die Analyse der Zellpopulationen in der sublingualen Schleimhaut, isolieren den Kopf des Tieres, und entfernen Sie die Speicheldrüsen und der angrenzenden Weichgewebe, wenn es nicht in Schritt 3.2.1 getan.
- Einen Einschnitt auf jeder Seite der Mündung bis zum Erreichen der Unterkiefer gemeinsam und die untere Kiefer zusammen mit der Zunge und des Mundbodens, mit Stiften fixieren auf die Zerlegung Bord. Ziehen Sie die Zunge; mit einem Skalpell einen Einschnitt, wo der base der Zunge trifft den Boden der Mundhöhle bis zum Erreichen der dritten Molaren, die sublinguale Schleimhaut freizulegen.
- Entfernen Sie die Zunge vollständig; einen 0,5 mm-Biopsie Punch und legen Sie sie neben den unteren Schneidezähnen. Aus der Zahnfleisch Einsetzen der sublingualen Gewebe geschnitten und drücken Sie vorsichtig, bis der Boden der Mundhöhle wurde komplett geschnitten.
- Wiederholen Sie nun ein weiteres Mal, indem die Biopsie Punch in der Nähe der dritten Molaren um die Entfernung der sublingualen Gewebe abzuschließen. Auf ein sauberes Röhrchen mit cRPMI oder Nukleinsäurekonservierungsmittel.
3.2) Probenvorbereitung für die FACS-Analyse.
- Transfer der Lunge Gewebe aus jeder Maus isoliert in eine 24-Well-Platte und Hackfleisch mit einem sauberen Schere, bis man kleine Gewebestücke von etwa 2 mm. 1 ml pro Vertiefung der Digestionsmedium, enthaltend 30 mg Collagenase Typ II, 50 ug DNAse-I in 1 ml RPMI ohne FBS. Pipette auf und ab fünf Mal und Inkubation bei37 ° C und 5% CO 2 für 40 min.
- Für die Analyse der Zellpopulationen in die sublinguale Gewebe, ersetzen Sie den Digestionsmedium in 3.2.1 mit einem mit 2 Einheiten von Dispase, 30 mg Collagenase Typ II, 50 ug DNAse-I in 1 ml RPMI. Inkubieren der aus einer Maus in 500 ul Verdauungsmedium für 20 min gesammelt Gewebe bei 37 ° C in einem Orbitalschüttler bei 50 Upm.
- Nach der Inkubation Pipette nach oben und unten bis zu 10-fache oder 30 Sekunden, bis das meiste des Gewebes gestört ist. Filtern der Zellsuspension wenn ein 40 um sterile Zell Sieb und Waschen mit 5 ml PBS, ergänzt mit 5 mM EDTA.
HINWEIS: Der vollständige Verdau der extrazellulären Matrix und Fasergewebe nicht erreicht werden. Jedoch sind längere Inkubationszeiten in Gegenwart von Collagenase und / oder Dispase oder aggressive Verreiben nicht empfohlen, da es zu einer erhöhten Zelltod und Zerstörung von extrazellulären Proteinen beeinflussen das Gesamtergebnis des F führenACS-Analyse. - Zentrifuge bei 400 × g, 5 min, 4 ° C beträgt.
- Zur Analyse der Zellpopulationen in BAL, Zentrifugieren der Zellen bei 400 × g, 5 min, bei 4 ° C und weiter zu dem Schritt 3.2.4.
- Für die Analyse von Zellpopulationen in den Lymphknoten, setzen Sie ein 70 um Zell Sieb auf eine sterile Petrischale und legte den Lymphknoten zusammen mit 1 ml cRPMI in das Sieb. Nehmen Sie den Sprung von einem 2 ml sterile Spritze und verwenden Sie es als Stößel auf die Lymphknoten gegen Maschen des Siebes zertreten. Spülen der Zell Sieb mit 1 ml frischem cRPMI und übertragen die Zellen aus der Petrischale in ein steriles Röhrchen.
- Eine repräsentative Aliquot jeder Probe und färben sie mit Trypanblau, um lebensfähige Zellzahl zu bestimmen.
- Die Zellen in FACS-EDTA: PBS-5 mM EDTA-1% Bovine Serum Albumin-zu machen, eine Suspension von 2x10 7 Zellen / ml und 50 ul in ein Durchflusszytometer Röhre.
- Bereiten Sie eine Mischung 2X Antikörper, die die ca.opriate Kombinationen von Antikörpern gegen Oberflächenmarker und Fluorochrome nach den vorliegenden FACS Instrument. Dann werden 50 ul 2X-Antikörper-Mischung in jedes Röhrchen, das die Zellsuspension.
HINWEIS: titriert jedes Fluorochrom-markierten Antikörper, um die optimale Menge zu bestimmen, die verwendet werden, für eine detaillierte Protokoll siehe Referenz 29. - Inkubieren 30 min auf Eis im Dunkeln.
- Waschen einmal mit 3 ml FACS-EDTA und Spin-down die Zellen durch Zentrifugation bei 400 × g für 5 min bei 4 ° C, Resuspendieren der Zellen in 200 ul des gleichen Puffers und im Durchflußzytometer analysiert.
HINWEIS: Bei der Handhabung einer großen Anzahl von Proben kann der Färbungsprotokoll für oben beschriebene FACS-Analyse in U-Boden-96-Well-Platten statt Zytometer Rohre durchgeführt werden. Wenn jedoch unter Verwendung von 96-Well-Platten Waschschritte müssen durch Zugabe von bis zu 200 ul FACS-EDTA und wiederholen 4mal Abzentrifugieren der Zellen bei 400 × g für 5 min bei 4 ° C zwischen jedem Washi geführt werdenng Schritt. - An diesem Punkt fixieren die Proben für die Analyse im Durchflusszytometer später (bis zu 72h nach Fixation).
- Um die Zellen zu fixieren, nach Markierung mit der FACS-Antikörper waschen die Zellen in PBS kein Ca 2 + / Mg 2 +, 1 mM EDTA ohne FBS. Die Zellen in 50 ul des gleichen Puffers und 50 ul einer frisch hergestellten 4% Paraformaldehydlösung in hypertonischen (2X) PBS ohne Ca 2 + / Mg 2 +.
- Inkubieren für 20 min bei RT und 3 x waschen in FACS-EDTA.
- Resuspendieren der Zellen in 200 ul FACS-EDTA und bei 4 ° C und vor Licht für bis zu 72 h geschützt.
HINWEIS: FSC-SSC kann durch Fixierung betroffen sein. Wenn Festsetzung der Proben Verträglichkeit zu prüfen, fluoreszenzmarkierten Antikörpern mit dem Hersteller seit Tandem Farbstoffe können in Anwesenheit von Fixierungsmitteln abgebaut werden. Wenn Proben von infizierten Tieren stammen Fixierung wird dringend empfohlen, um sicherzustellen, dass keine lebensfähigen Krankheitserreger vorhanden sein, wenn analysingen die Proben in FACS-Maschine, da microaerosols können bei der Erfassung der Probe erzeugt werden.
4. Gesamt-RNA-Extraktion, cDNA-Synthese und Real Time PCR.
4.1) RNA-Extraktion und cDNA-Synthese.
- Homogenisieren des Gewebes in der Nukleinsäurekonservierungslösung der Wahl durch mechanische Zerstörung (zB mit einem Rotor-Stator-Homogenisator, High-Speed-Schütteln Gewebe ruptor und Perlen, etc.). Zentrifuge bei 12.600 × g für 15 min und 4 ° C, um die Gewebetrümmer zu entfernen. Den Überstand in ein sauberes Röhrchen.
- Entpacken Sie die RNA mit der Methode der Wahl folgenden Herstelleranweisungen.
HINWEIS: Die RNA ist sehr anfällig für Abbau, wenn sie nicht gehen, um sofort nach der Isolierung verwendet werden, stellen Teilmengen und speichern sie in RNAse freie Röhrchen bei -80 ° C. Vermeiden Sie wiederholtes Einfrieren und Auftauen. Die Rohre müssen mit Handschuhen zu jeder Zeit behandelt werden. Nach dem Auftauen der Proben einmmer halten sie auf Eis. - Die Absorption von Nukleinsäuren bei 260 nm und die Berechnung der Konzentration in ug / ul.
- Bereiten DNAse-I durch Zugabe von mischen (für 1 Probe): 7,6 ul von ultrareinem Wasser, 1 ul 10fach DNAse-I-Puffer, 0,4 ul DNAse-I (Verstärkung Grad) stock 1 U / ul, und fügen Sie 8,4 ul DNase-I zu jeder Probe, die 1 ug der Gesamt-RNA gemischt.
- Verwenden RNA in einer Konzentration von 1 ug / ul und führen die Retrotranskription Reaktion (RT-PCR), die durch Zugabe von 1 ul der Gesamt-RNA als Matrize. Wenn die Proben zu stark verdünnt und die Konzentration geringer als erwartet ist, fügen Sie größere Mengen an Gesamt-RNA anstelle von Wasser. 20% des endgültigen Reaktionsvolumen nicht überschreiten, wenn die Zugabe der RNA speziell, wenn die RNA-Extraktionsprotokoll der Wahl beteiligt Phenol-Chloroform-Gemisch, da Phenolspuren könnte die Ausbeute der RT-PCR zu beeinflussen.
- Inkubieren 15 min bei RT, gefolgt von 10 min bei 4 ° C oder ice. (Nicht die Inkubationszeit nicht überschreiten !!)
- 1 ul 25 mM EDTA (für die Molekularbiologie) zu jedem Röhrchen und Inkubation bei 65 ° C für 10 min, um die DNAse-I zu inaktivieren.
- Bereiten Retrotranskription (RT)-Mix (für 1-Reaktion), wie folgt: 1 ul Zufalls-Hexamer-Primer Lager 0,2 mg / ml, 1 ul dNTPs Lager 10 mm, 4 ul 5X M-MLV-RT-Puffer, 2 ul DTT 0,1 M, 1 ul RNase OUT Lager 40 U / ul und 1 ul M-MLV retrotranscriptase Lager 200 U / ul.
- Werden 10 ul RT-PCR-Gemisch zu der 10 ul DNAse-I-Reaktionsrohr.
- Durchführung der PCR-Reaktion in einem Thermocycler nach dem folgenden Programm:
1X Zyklus: 10 min, 25 ° C; 50 min, 37 ° C; 15 min, 70 ° C - Verdünne die cDNA von 1: 5 durch Zugabe von 80 ul von Reinstwasser. Lagerung bei -20 ° C.
4.2) Echtzeit-PCR (qPCR).
- Bereiten qPCR-Reaktionsmischung wie folgt (für 1 Reaktion): 5 ul Master-Mix Taq DNA mit Polymerase, SYBR Green-Farbstoff, PCR-Puffer, dNTP-Mix und MgCl 2 (siehe 4.2.2); 0,9 ul einer 10 uM Stammlösung von dem Vorwärts-Primer, 0,9 ul einer 10 uM Stammlösung des Reverse-Primers, 1,2 ul ultrareinem Wasser und 2 ul cDNA-Matrize zuvor verdünnt, wie in Schritt 4.1.10 angegeben.
HINWEIS: Reagenz Konzentration und Radfahren Protokolle in diesem Abschnitt verwendet wurden optimiert, um insbesondere mit den in "Tabelle der Materialien und Reagenzien" beschriebenen Reagenzien und Instrumenten durchgeführt werden, andere Marken verwendet werden, aber Reaktionsvolumina kann Reagenzkonzentration und Radfahren Protokoll variieren. Überprüfen Sie Ihre Anweisungen des Herstellers, bevor RT-qPCR. - Einrichten der qPCR Instrument wie folgt:
1X Zyklus: 15 min, 95 ° C
40X Zyklen: 15 sec, 95 ° C, gefolgt von 1 min, 60 ° C (zu diesem Zeitpunkt erwerben Fluoreszenz).
HINWEIS: Für die relative Quantifizierung der mRNA nach der CT-Verfahren 30 a reference Gens muss für die Normalisierung der Ct-Werte ausgewählt werden. Referenzgens der Wahl sollte unter spezifischen Testbedingungen getestet, wie seine Expression kann variieren; ACTB GAPDH oder 18S sind einige der Gene in der Regel als Referenz ausgewählt. - Richten Sie den Schwellenwert und die Daten zu analysieren.
Ergebnisse
Sublinguale Immuntherapie erfolgreich zur Lunge Immunantwort zu modulieren. Wir haben gezeigt, dass eine Einzeldosis von Flagellin, das TLR5 und NLRC4 Agonist kann eine signifikante Hochregulation der mRNA induzieren die Chemokine CXCL1, CCL20 und das Zytokin IL-6 im Vergleich zu Kochsalzlösung behandelten Kontrollen kodiert. Fach Induktion der mRNA-Spiegel erreichte bei 8 h nach SLIT und zurück zum Basisspiegel nach 20 h (Abbildung 1). Allerdings, wenn SLIT wurde 2 Stunden vor intranasale Infektion mit S. Pneumoniae durchgeführt, Ebenen und IL-6 mRNA CXCL1 blieb deutlich sogar 24 Stunden nach der SLIT hochreguliert im Vergleich zu nicht behandelten Tieren (Abbildung 2).
Analyse der Zellpopulationen in BAL und Lungengewebe durch FACS zeigte, dass die Tiere mit FliC durch sublinguale behandelt hatte Anzahl von Neutrophilen in die Atemwege in der Lunge Gewebe (3) angehoben, jedoch nicht.
Schließlich wurde das Überleben nach Pneumokokken-Herausforderung in Tieren, die vorher mit FliC durch sublinguale oder mit Salzlösung als Kontrolle behandelt wurden, verglichen. Wie in Abbildung 4 dargestellt, SLIT mit Flagellin gefördert Schutz und erhöhte Überlebens gegen akute Pneumokokken-Lungenentzündung.
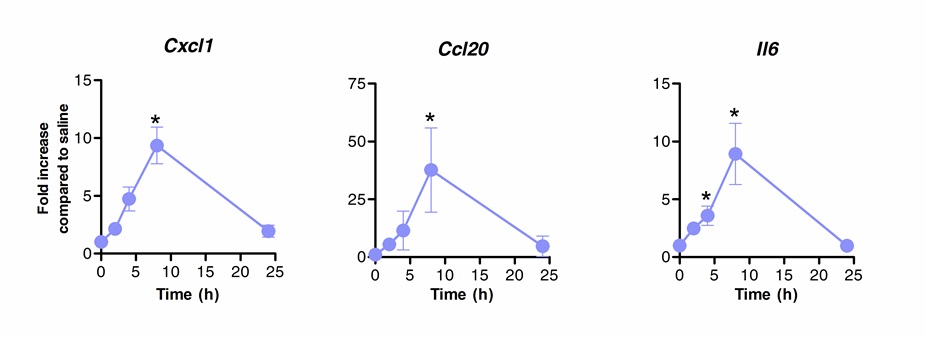
Abbildung 1. Kinetik der Transkriptionsprofils der Lunge nach der sublingualen Immuntherapie mit Flagellin. Acht bis 10 Wochen alte BALB / c-Mäuse (n = 4) wurden mit 10 ug des Flagellin-oder Kochsalzlösung durch sublinguale unter Anästhesie behandelt. Lungen wurden zu verschiedenen Zeitpunkten gesammelt und Nukleinsäurekonservierungs platziert. Gesamt-RNA-Extraktion durchgeführt und cDNA synthetisiert. mRNA-Spiegel wurden durch Echtzeit-PCR mit spezifischen Primern in Tabl aufgeführt ausgewertetE 1. Die relative Quantifizierung wurde nach ACt Methode mit actb mRNA-Spiegel für die Normalisierung durchgeführt. Die Ergebnisse werden als fache Steigerung im Vergleich zu Kochsalzlösung behandelten Gruppe als Median ± SEM dargestellt. Sternchen zeigen statistisch signifikante Unterschiede (p <0,05) nach Mann-Whitney-Test berechnet. Ergebnisse sind repräsentativ für 2 unabhängige Experimente.
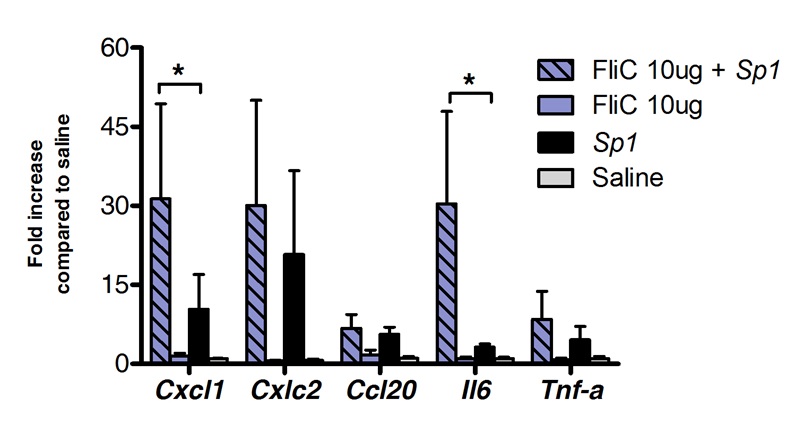
Transkriptionsprofils Figur 2. Lungen während Pneumokokkenpneumonie nach sublingualer Immuntherapie mit Flagellin Acht bis 10 Wochen alte BALB / c-Mäuse (n = 4 n = 7 für Kontrollgruppe und behandelte Gruppe). Wurden mit 10 ug des Flagellin-oder Kochsalzlösung durch die behandelte sublinguale unter Narkose. 2 h später wurden die Mäuse intranasal mit der minimalen letalen Dosis (MLD) Bewirken 10 gefordert0% Mortalität einer klinischen Isolat von S. pneumoniae-Serotyp 1 E1585 entsprechend 4x10 5 CFU / 50 ul. Lungen wurden gesammelt von 24 Stunden nach der Herausforderung und Nukleinsäurekonservierungsmittel gelagert, bis RNA-Extraktion und cDNA-Synthese durchgeführt. Echtzeit-PCR durchgeführt (siehe Primer Liste in Tabelle 1) und relative Quantifizierung wurde nach ACt Methode mit actb mRNA-Spiegel für die Normalisierung durchgeführt. Die Ergebnisse werden als fache Steigerung im Vergleich zu Kochsalzlösung behandelten Gruppe als Median ± SEM dargestellt. Sternchen zeigen statistisch signifikante Unterschiede (p <0,05) nach Mann-Whitney-Test berechnet.
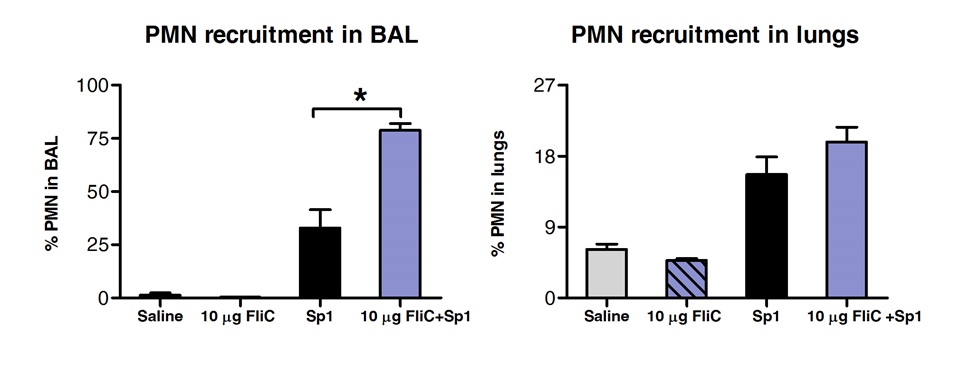
Abbildung 3. Analyse der polymorphkernigen Neutrophilen (PMN) Rekrutierung in Lunge und der Atemwege Gewebe nach SLIT. Acht bis10 Wochen alt BALB / c-Mäuse (n = 4) wurden mit 10 ug von Flagellin oder Kochsalzlösung durch sublinguale unter Anästhesie behandelt. 2 Stunden später wurden die Mäuse durch intranasale Route mit der MLD von S. herausgefordert pneumoniae Serotyp 1 E1585. 24 Stunden nach der Herausforderung, BAL wurde durchgeführt, und die Lungen wurden für die FACS-Analyse verarbeitet. PMN wurden als Ly6G hoch / CD11b hoch / CD11c negativen Zellen identifiziert und basierend auf der FCS-SSC-Profil. Die Ergebnisse sind als Prozentsatz der PMN bezüglich der Gesamtzellzahl in BAL oder der Lunge exprimiert. Balken stellen Median ± SEM. Sternchen zeigen statistisch signifikante Unterschiede (p <0,05) nach einem Wege Mann-Whitney-Test berechnet.
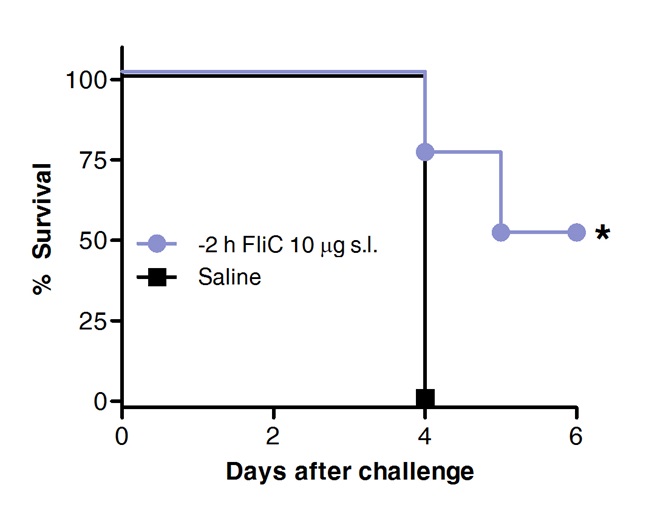
Abbildung 4. SLIT mit Flagellin schützt Mäuse gegen akute Pneumokokken-Lungenentzündung. Acht bis 10 Wochen alte BALB / c-Mäuse (n = 8) wurden mit 10 ug von Flagellin oder Kochsalzlösung durch sublinguale unter Anästhesie behandelt. 2 Stunden später wurden die Mäuse durch intranasale Route mit der MLD von S. herausgefordert pneumoniae Serotyp 1 E1585. Überlebensrate wurde täglich bewertet. Kaplan-Meier-Kurven wurden nach Log-Rank (Mantel-Cox) Test verglichen. Sternchen zeigen statistisch signifikante Unterschiede (p <0,05) .Results Vertreter von 2 unabhängigen Experimenten.
| Name | Sequenz 5'-3 ' | PCR Produktlänge (bp) |
| mB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| mB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| mIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| mIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
Tabelle 1. Liste Primer für Echtzeit-PCR-Analyse verwendet. Spezifische Primer-Sequenzen für die qPCR-Analyse verwendet. Vorwärts und Rückwärts-Primer für Maus actb werden Cccl20, CXCL1, IL-6, TNFa und CXCL1 als 5'-3'-Sequenzen präsentiert und erwartete Produkt Länge in Basenpaaren (bp) angegeben.
Diskussion
Sublinguale Verabreichung von therapeutischen Mitteln ist ein nützliches Mittel, um die Immunreaktion in den Atemtrakt modulieren bewährt. Der Hauptvorteil der Schlitz zur Behandlung von Erkrankungen der Atemwege ist, dass es keine direkte Bereitstellung von Verbindungen in die Lungen oder die Nasenlöcher, wobei sicherer als Behandlungen auf die intranasale Verabreichung 31.
Sublinguale Immuntherapie verwendet werden, um die Immunantwort auf unterschiedliche Weise modulieren, entweder zur Induktion von regulatorischen Reaktionen, die die Symptome der allergischen Entzündung und Asthma zu lindern kann 32 oder transiente Aktivierung der angeborenen Immunmechanismen zu induzieren, um akute Lungeninfektionen zu behandeln, wie hier dargestellt.
Das Maus-Modell in diesem Video dargestellt ist eine bequeme Methode zum Screening von verschiedenen Verbindungen als therapeutische Mittel zur geschnitten.
Dieses Tiermodell bietet ein nützliches Mittel, um die Auswirkungen zu ermittelnder Schlitz in der Lunge Immunantwort als auch in anderen Organen (zB., Lymphknoten oder entfernten Schleimhautstellen), die nicht durch die Verwendung von in vitro-Modellen nachgeahmt werden kann. Obwohl es mehrere Arbeiten, die Ergebnisse mit sublingualen Immuntherapie gewonnen werden, detaillierte Methoden für die Verfahren der sublingualen Verabreichung haben noch nicht verfügbar gemacht worden. Zusätzlich kann das Modell für die Bewertung der sublingualen Impfstoffe Ziel, systemische als auch lokale Schutz der Atemwege übertragen werden.
Wie in der begleitenden Video gezeigt, ist die sublinguale Verabreichung von Verbindungen ein einfaches Verfahren, das einfach und ohne die Notwendigkeit von umfangreichen Ausbildung durchgeführt werden kann. Typischerweise wird eine Person beherrschen Tier Handhabung erfordern 1 h bis SLIT in einer Gruppe von 10 Mäusen mit injizierbaren Anästhetika, wie in diesem Protokoll beschrieben durchzuführen. Wenn Pneumokokken Herausforderung wird ebenfalls durchgeführt, werden 90 zusätzliche Minuten zur Vorbereitung werdenDie Bakteriensuspension und führen intranasale Herausforderung der Tiere.
Die hier vorgestellten FACS Protokolle ermöglichen eine bequeme Charakterisierung der Auswirkungen der SLIT am lokalen Standort der Verwaltung, Lymphknoten sowie deren Auswirkungen auf die Zelldynamik der Lunge.
Separate Analyse der bronchoalveolären Inhalt und Lungenparenchym ist wichtig, um die Atemwege "Immun Wohnsitz und Infiltrieren Zelltypen von denen, die im Gewebe bleiben diskriminieren. Analyse der BAL Inhalt ermöglicht die Untersuchung von Alveolarmakrophagen Umsatz sowie die Dynamik von Zellen Rekrutierung in die Alveolen durch verschiedene Behandlungen induziert, zB., PMN, Eosinophile, Monozyten. BAL kann auch verwendet werden, um die Anwesenheit von sezernierten Zytokine und Chemokine durch Enzyme-linked Immunosorbent Assay (ELISA) oder den Nachweis von IgA-Antikörper sekretiert nach sublingualer Impfung ausgelöste bewerten. Untersuchung der Lunge Gewebewird Charakterisierung von anderen Zelltypen, klassisch dendritischen Zellen, T-Zellen und B-Zellen zu ermöglichen.
Vorbereitung der BAL-Proben und Lymphknoten für FACS-Analyse ist einfach. Nach der Probenahme werden in der Regel 60 Minuten benötigt, um den Färbungsprotokoll für 10-20 Proben abzuschließen. Im Gegensatz dazu wird die Isolation von Zellen aus Lungen oder sublingual Gewebe mehr Zeit erfordern, da die Verdauung der extrazellulären Matrix ist nicht erforderlich. Absorption des therapeutischen Mittels durch sublinguale geliefert durch Verfolgung von fluoreszierend oder radioaktiv markierte Moleküle mit in vivo-Bildgebungssysteme behandelt werden.
Sublinguale Immuntherapie ist eine attraktive Methode effektiv induzieren Immunreaktionen in den Atemwegen als auch systemisch verwendet werden können, zu behandeln oder zu verhindern Atemwegserkrankungen. Aufklärung der Mechanismen, die die Aktivierung vs Toleranz der Immunreaktion in den Atemtrakt nach SLIT is entscheidend für das rationale Design von neuen therapeutischen Strategien, die allein oder in Kombination mit verfügbaren Behandlungen gegen verschiedene Erkrankungen der Atemwege verwendet werden könnte, zu ermöglichen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
Materialien
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
Referenzen
- . Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999 (2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1 (2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten