Method Article
L'immunothérapie sublinguale comme une alternative à induire une protection contre les infections respiratoires aiguës
Dans cet article
Résumé
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
Résumé
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
Introduction
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
Protocole
Procédures impliquant des animaux ont été effectuées en conformité avec le protocole n ° 08052010 071140-000821-12 et approuvé par la Commission honoraire pour l'expérimentation animale et le Conseil de la Faculté de médecine, Université de la République directive - Uruguay.
1. sublinguale administration de l'agent thérapeutique
- Préparation de la solution contenant l'agent thérapeutique à tester. Ajuster la concentration d'administrer un volume maximum de 10 ul par souris.
REMARQUE: Pour flagelline purifiée à partir de Salmonella enterica sérotype Typhimurium la dose optimale pour induire une protection chez la souris infectée par la première dose létale de S. pneumoniae de sérotype 1 E1586, ce qui provoque une mortalité de 100% est de 10 pg / souris. solution de flagelline doit être chauffé à 65 ° C pendant 5 min pour assurer la libération des monomères. Pour plus d'informations sur la purification de la flagelline voir référence 26.- Varconcentration efficace y de différents agents immunomodulateurs fonction de sa taille moléculaire, la pureté, la susceptibilité à la protéolyse et l'utilisation d'agents muco-adhésifs. Ajuster la concentration optimale pour chaque composé à tester afin de maximiser les effets. Si des études antérieures par voie intranasale ont été réalisées pour un composé particulier, utiliser une dose initiale de 5 à 10 fois supérieure à tester son efficacité par voie sublinguale.
- Anesthésier la souris par l'injection d'un cocktail contenant 110 mg / kg de kétamine avec 5,5 mg / kg Xylacine et de laisser les animaux se reposent pendant 7 à 10 min.
- Confirmez anesthésie appropriée en appuyant doucement sur la patte de l'une des pattes postérieures; si bien anesthésié l'animal ne se déplace pas en réponse au stimulus.
- Étendre une mince couche de pommade vétérinaire sur les yeux de chaque souris pour prévenir la sécheresse alors que sous anesthésie.
REMARQUE: Les anesthésiques par inhalation comme isofluorane peuvent également être utilisés à la place de kétamine / Xylacine si un système équiperped avec chambre et le nez cônes induction est disponible. Utilisez la chambre d'induction pour anesthésier les animaux et administrer le immunostimulant par voie sublinguale. Connecter immédiatement l'animal à un cône de nez pendant au moins 15 min pour le garder sous anesthésie pour éviter d'avaler et permettre l'absorption du composé thérapeutique. - Pipeter la solution contenant la solution d'immunostimulant ou le contrôle du véhicule; avec le pouce et l'index de la main non dominante prend la souris et maintenez-le en position verticale.
- Utilisation de la place de la main dominante une paire de pinces fermées sous la langue et le maintenir en place à l'aide des doigts majeur et l'annulaire, ouvrir légèrement la pince pour soulever la languette.
- Prendre la pipette et administrer la solution sur la surface du côté de la bouche et dorsale de la langue.
- Retirer les pinces et laisser le reste de la souris pendant 3 à 5 min avant de le remettre dans la cage. Afin de s'assurer que la normothermie est maintenue dans le micro anesthésiée, connecter les cages à un système de chauffage cage. Si tel système n'est pas disponible, placez la souris appartenant au même groupe de traitement de nouveau dans une cage correspondante côté de l'autre sur la literie et les couvrent que partiellement avec des feuilles de papier de soie propres à les aider à maintenir la température du corps.
- Prélever des échantillons de tissus à n'importe quel point dans le temps après l'instillation de l'agent immunomodulateur à analyser les changements dans les populations de cellules induites par le traitement.
NOTE: Dans l'administration de ce protocole particulier de la flagelline a été réalisée 2 h avant l'épreuve. Déterminer le temps optimal entre le traitement et le défi pour chaque agent thérapeutique particulier et l'agent pathogène à tester.
2 Préparation de la suspension bactérienne et intranasale Challenge Streptococcus pneumoniae
REMARQUE: S. pneumoniae est un agent pathogène humain naturel qui peut provoquer des maladies mortelles comme la pneumonie invasive, la septicémieet la méningite. La transmission peut se produire lorsque inhalé ou en contact avec la muqueuse. Par conséquent, tous les échantillons qui ont pu être en contact avec S. pneumoniae doit être traitée dans une installation de biosécurité de niveau II appropriée en utilisant une enceinte de sécurité biologique de classe II. Vérifiez les procédures d'opération standard de votre institution en matière de manipulation des agents pathogènes de type II pour les vêtements de protection, l'élimination des déchets et des mesures de sécurité supplémentaires qui peuvent s'appliquer. Les animaux infectés doivent être gardés dans des cages individuellement ventilées dans des isolateurs équipés de filtres HEPA. Vaccins anti-pneumococciques et antibiothérapie sont disponibles. Pour plus d'informations voir les références 27 et 1.
- Décongeler une aliquote de suspension d'un stock de travail de Streptococcus pneumoniae de nombre d'UFC bactérienne connue préparé comme décrit dans 15.
- Centrifuger pendant 5 min à 2500 xg et RT.
- Jeter le surnageant et laver le culot bactérien par mise en suspension dans 1 ml de stsolution saline erile. Utiliser des pointes de filtre lors de la préparation de suspension bactérienne, dilutions ou de contestation des animaux.
- Centrifuger à nouveau comme décrit dans l'étape 2.2.
- Jeter le surnageant et remettre en suspension le culot dans le volume approprié de solution saline stérile pour obtenir une suspension de 4x10 5 UFC / 50 pi. Cette dose correspond à la dose minimale bactérienne de S. pneumoniae de sérotype 1 E1586 qui provoque une mortalité de 100% chez des souris BALB / c selon des études antérieures 15.
REMARQUE: Lors de l'établissement d'un modèle de pneumonie à pneumocoque chez la souris, la dose minimale bactérienne provoquant 100% de mortalité doit être déterminée pour chaque combinaison particulière de la souche bactérienne, le sérotype et souche de souris. - Homogénéiser la suspension bactérienne par vortex ou aspiration et refoulement 5 fois.
- Charge 50 pl de la suspension bactérienne à l'aide d'une pointe de filtre stérile et inculquer le volume total dans les narines d'une souris anesthésiée. Tenez le UPRI de la sourisght pendant 2 min et laisser reposer en position dorsale pendant 2 min. Appliquer vétérinaire pommade sur les yeux et le retour des animaux à la cage; assurez-vous de maintenir la normothermie sous anesthésie.
NOTE: Dans cette étude provocation bactérienne a été réalisée dans un volume de 50 ul pour assurer la livraison d'au moins 90% du total de CFU dans les poumons que déterminé précédemment à 15,28. Pour minimiser la détresse de petits volumes de l'animal (par exemple, 20 pi) peuvent être utilisés. Cependant, la livraison efficace des bactéries dans les poumons doit être cochée; cela peut se faire par récolte les poumons 5 min après la provocation et le comptage des CFU dans les homogénats de poumons par étalement des dilutions en série sur des plaques de gélose-sang. - Confirmer le nombre de CFU dans la suspension bactérienne utilisée pour l'infection par étalement des dilutions en série de 10 fois sur des plaques de gélose au sang. Incuber O / N à 37 ° C avec 5% de CO 2 et de compter le nombre de colonies mucoïdes présentant une caractéristique de halo vert d'albactéries pha de hémolytiques.
3 Collection de tissus et la préparation d'échantillons pour la cytométrie de flux (FACS)
3.1) collection de tissus
- Euthanasier l'animal par dislocation cervicale ou à l'aide de CO 2 chambre; ouvrir la cavité thoracique tout le chemin jusqu'à la nuque et faire une incision le long des jambes avant d'exposer la face ventrale du cou et sous-maxillaire.
- Avec la pointe recourbée pinces fines tirez doucement les glandes salivaires et les tissus mous adjacents à exposer la face dorsale du plancher de la bouche. Utilisation de courbes fines pinces de pointe, prendre la mandibule et les ganglions lymphatiques mandibulaires accessoires en tirant délicatement et placez-les dans un tube contenant RPMI complet (cRPMI, pour 500 ML 10% du fœtus de sérum bovin, 5 ml d'une solution contenant 10 000 U / ml La pénicilline et 10 mg / ml de streptomycine et 5 ml de solution de L-Glutamine 200 mM) ou de la solution de conservation de l'acide nucléique selon le procédé en aval qui serontêtre effectuée plus tard.
- Pour ouvrir la cavité thoracique faire une incision dans la membrane; en utilisant une paire de pinces à dents de souris serrer le cartilage xiphoïde du sternum et soigneusement couper les nervures des deux côtés dorsaux à partir de fausses côtes tout le chemin jusqu'à atteindre le point où les nervures se rencontrent véritables du manubrium du sternum.
- En tenant le cartilage xiphoïde du sternum avec la pince, tirez doucement pour exposer les organes de la cavité thoracique.
- Retirer les côtes complètement en coupant les premières côtes et la clavicule. Le thymus apparaît comme une structure blanche de deux lobes situés dans la partie antéro du thorax à proximité de la base du coeur.
- Prenez l'un des lobes de serrage avec une paire de pinces et d'utiliser une paire de ciseaux pour enlever les ligaments entre sa face inférieure et le péricarde. Continuer à supprimer le deuxième lobe.
- Identifier la cavité abdominale et l'ouvrir en coupant le long de l'axe médian de la mparoi uscular pour exposer les organes. Avec une paire de pinces couper la veine cave postérieure et l'aorte thoracique; éliminer l'excès de sang avec un tissu absorbant.
- Pour analyser les populations de cellules résidentes et infiltrant des alvéoles effectuent un lavage broncho-alvéolaire (BAL). Couper les muscles dans la partie ventrale du cou pour exposer la trachée et de l'œsophage; à séparer les incisions font sur les côtés latéraux et dorsales des structures.
- Soulevez la trachée avec la pince et faire une petite incision avec un scalpel à introduire une pipette de transfert mince de pointe remplie de 1 ml de PBS sans Ca2 + / Mg 2 + plus 1 mM d'EDTA. Instiller et aspirer le volume total au moins trois fois; aspirer et transférer la suspension cellulaire dans un tube stérile de 1,5 ml et le placer sur de la glace.
- Pour analyser les populations de cellules présentes dans le parenchyme pulmonaire, les poumons première perfuser en injectant 5 ml de PBS sans Ca2 + / Mg2 + + 1 mM d'EDTA dans le ventricule droitdu cœur.
NOTE: Cela permettra d'éliminer la plupart des globules rouges et des cellules immunitaires présentes dans les vaisseaux sanguins des poumons. Si la perfusion a été effectuée correctement, la couleur des poumons passera du rose au blanc. - Isoler le coeur des poumons par serrage de l'embase du ventricule gauche et délicatement couper des vaisseaux sanguins avec des ciseaux pour le retirer complètement. Prenez les poumons perfusés et les placer dans cRPMI ou solution nucléique conservateur acide en fonction de l'analyse en aval à effectuer.
- Pour l'analyse des populations de cellules de la muqueuse sublinguale, isoler la tête de l'animal et enlever les glandes salivaires et les tissus mous adjacents si elle n'a pas été fait à l'étape 3.2.1.
- Faire une incision sur chaque côté de la bouche jusqu'à l'articulation de la mandibule et séparer la mâchoire inférieure avec la langue et le plancher de la bouche, en utilisant des épingles fixer sur le tableau de dissection. Tirez la langue; l'aide d'un scalpel faire une incision où la basoi de la languette rencontre le plancher de la bouche jusqu'à ce qu'il atteigne les troisièmes molaires pour exposer la muqueuse sublinguale.
- Retirez la langue complètement; faire une biopsie poinçon de 0,5 mm et le placer à côté des incisives inférieures. Couper de l'insertion du tissu gingival sublinguale et appuyez doucement jusqu'à ce que le plancher de la bouche a été coupé complètement.
- Répéter une fois de plus placer maintenant le poinçon de biopsie à proximité des troisièmes molaires pour compléter l'ablation du tissu sublinguale. Placer sur un tube propre contenant cRPMI ou conservateur acide nucléique.
3.2) La préparation des échantillons pour l'analyse FACS.
- Transférer le tissu du poumon isolé à partir de chaque souris dans une plaque à 24 puits et les hacher avec une paire de ciseaux propres jusqu'à l'obtention de petits morceaux de tissu d'environ 2 mm. Ajouter 1 ml par puits de milieu de digestion contenant 30 mg de collagénase de type II, 50 ug DNAse I dans 1 ml de milieu RPMI sans SVF. Introduire à la pipette de haut en bas cinq fois et incuber à37 ° C et 5% de CO2 pendant 40 min.
- Pour l'analyse des populations de cellules dans le tissu par voie sublinguale, remplacer le milieu de digestion dans 3.2.1 avec un contenant 2 unités de dispase, 30 mg de collagénase de type II, 50 ug DNAse I dans 1 ml de RPMI. Incuber le tissu prélevé à partir de l'une souris dans 500 pi de milieu de digestion de 20 minutes à 37 ° C dans un agitateur orbital à 50 rpm.
- Après incubation, on pipette de haut en bas jusqu'à 10 fois ou plus de 30 secondes jusqu'à ce que le tissu a été perturbé. On filtre la suspension de cellules si une cellule 40 um stérile filtre et on lave avec 5 ml de PBS supplémenté avec 5 mM d'EDTA.
REMARQUE: La digestion complète de la matrice extracellulaire et de tissu fibreux ne sera pas atteint. Cependant, des temps plus longs d'incubation en présence de collagénase et / ou la dispase ou trituration agressif ne sont pas recommandées, car il en résultera une augmentation de la mort cellulaire et la destruction des protéines extracellulaires qui affectent le résultat d'ensemble du FACS. - Centrifugeuse à 400 xg, 5 min, 4 ° C.
- Pour l'analyse des populations cellulaires dans le BAL, centrifuger les cellules à 400 xg, 5 min, à 4 ° C et passez à l'étape 3.2.4.
- Pour l'analyse des populations de cellules dans les ganglions lymphatiques, placer un filtre de 70 um de la cellule sur une boîte de Pétri stérile et on a mis le ganglions lymphatiques avec 1 ml de cRPMI dans la crépine. Prenez le plongeon d'une seringue stérile de 2 ml et l'utiliser comme un pilon pour écraser les ganglions lymphatiques contre la maille de la crépine. Rincer la crépine de cellules avec 1 ml de cRPMI frais et transférer les cellules de la boîte de Pétri dans un tube stérile.
- Prenez une portion représentative de chaque échantillon et tacher avec du bleu Trypan pour déterminer le nombre de cellules viables.
- Remettre en suspension les cellules dans de l'EDTA-FACS: PBS-EDTA 5 mM, 1% de sérum albumine bovine à obtenir une suspension de 2x10 7 cellules / ml et ajouter 50 ul dans un tube cytomètre.
- Préparer un mélange d'anticorps 2X contenant l'appropriate combinaisons d'anticorps dirigés contre des marqueurs de surface et des fluorochromes selon l'instrument FACS disponible. Ajouter 50 ul de l'anticorps mélange 2X dans chaque tube contenant la suspension cellulaire.
REMARQUE: Titrer chaque anticorps marqué par un fluorochrome pour déterminer la quantité optimale à utiliser, pour un protocole détaillé voir référence 29. - Incuber 30 min sur la glace dans l'obscurité.
- Laver une fois avec 3 ml de FACS-EDTA et centrifuger les cellules par centrifugation à 400 g pendant 5 min à 4 ° C, remise en suspension des cellules dans 200 ul du même tampon et analyser dans un cytomètre de flux.
NOTE: Si la manipulation d'un grand nombre d'échantillons, le protocole de coloration à l'analyse FACS décrit ci-dessus peut être effectuée dans des plaques à fond en U à 96 puits à la place de tubes cytomètre. Cependant, si l'on utilise des plaques à 96 puits étapes de lavage doit être effectué par l'addition de 200 ul de FACS-EDTA et répétant quatre fois filage vers le bas des cellules à 400 xg pendant 5 min à 4 ° C entre chaque washiétape ng. - À ce stade, fixer les échantillons pour l'analyse par cytométrie en flux plus tard (jusqu'à 72h après fixation).
- Pour fixer les cellules, après marquage avec les FACS-anticorps laver les cellules dans du PBS sans Ca 2 + / Mg 2 +, 1 mM EDTA sans FBS. Suspendre les cellules dans 50 ul du même tampon et ajouter 50 ul d'une solution à 4% de paraformaldehyde fraîchement préparé dans hypertonique (2X) du PBS sans Ca2 + / Mg2 +.
- Incuber pendant 20 min à température ambiante et laver 3 fois dans FACS-EDTA.
- Remettre en suspension les cellules dans 200 ul de FACS-EDTA et conserver à 4 ° C et à l'abri de la lumière pendant 72 h.
REMARQUE: FSC-SSC peut être affectée par la fixation. Si la fixation des échantillons de vérifier la compatibilité des anticorps marqués par fluorescence avec le fabricant depuis colorants en tandem peuvent être dégradés en présence d'agents de fixation. Si les échantillons proviennent d'animaux infectés fixation est fortement recommandé de veiller à ce qu'aucun des agents pathogènes viables seront présents lors analychanter les échantillons dans la machine FACS depuis microaerosols peuvent être générées lors de l'acquisition de l'échantillon.
4 Extraction de l'ARN total, synthèse d'ADNc et PCR en temps réel.
4.1) Extraction de l'ARN et synthèse de l'ADNc.
- Homogénéiser le tissu dans la solution de conservation de l'acide nucléique de choix par rupture mécanique (par exemple, en utilisant un homogénéisateur à rotor-stator, à haute vitesse d'agitation et de tissus ruptor billes, etc). Centrifuger à 12 600 g pendant 15 min et 4 ° C pour éliminer les débris de tissu. Transférer le surnageant dans un tube propre.
- Extrait de l'ARN avec la méthode de choix en suivant les instructions du fabricant.
REMARQUE: l'ARN est très sensible à la dégradation, si elle ne va pas être utilisé tout de suite après l'isolement, faire des aliquotes et les stocker dans des tubes sans RNase à -80 ° C. Évitez congélation et décongélation répétée. Les tubes doivent être manipulés avec des gants en tout temps. Après décongélation des échantillons deoujours les garder sur la glace. - Mesurer l'absorption d'acides nucléiques à 260 nm et le calcul de la concentration en pg / pl.
- Préparez DNAse-je mélanger par addition de (1 échantillon): 7,6 pi d'eau ultra-pure, 1 pl de tampon 10X DNase I, 0,4 pi de DNase I (niveau d'amplification) stock 1 U / ul, et ajouter 8,4 pi de la DNAse-je mélanger à chaque échantillon contenant 1 ug d'ARN total.
- Utilisation d'ARN à une concentration de 1 ug / ul et réaliser la réaction de rétrotranscription (RT-PCR) en ajoutant 1 pi de l'ARN total en tant que matrice. Si les échantillons sont trop dilué et la concentration est plus faible que prévu, d'ajouter de plus grands volumes d'ARN total à la place de l'eau. Ne pas dépasser 20% du volume final de la réaction lors de l'ajout de l'ARN spécialement si le protocole d'extraction d'ARN de choix impliqué mélange phénol-chloroforme, depuis des traces de phénol peuvent affecter le rendement de la RT-PCR.
- Incuber 15 minutes à température ambiante puis 10 min à 4 ° C ou iCE. (Ne pas dépasser la durée d'incubation !!)
- Ajouter 1 pi d'EDTA 25 mM (moléculaire de qualité biologie) à chaque tube et on incube à 65 ° C pendant 10 minutes pour inactiver la DNase-I.
- Préparer rétrotranscription (RT) mélange comme suit (pour une réaction): 1 ul d'amorces hexamères aléatoires licence 0,2 mg / ml, 1 ul de dNTP stock 10 mM, tampon 5X M-MLV-RT 4 pl, 2 pl de DTT 0,1 M, 1 ul actions RNAse OUT 40 U / ul, et 1 pi M-MLV rétrotranscriptase actions 200 U / pl.
- Ajouter 10 ul de mix RT-PCR à la DNAse I-tube de réaction de 10 ul.
- Effectuer la réaction de PCR dans un thermocycleur selon le programme suivant:
Cycle 1X: 10 min, 25 ° C; 50 min, 37 ° C; 15 min, 70 ° C - Diluer l'ADNc de 1: 5 par ajout de 80 pl d'eau ultrapure. Stocker à -20 ° C.
4.2) PCR en temps réel (qPCR).
- Préparer qPCR mélange réactionnel comme suit (pour 1 réaction): mélange maître 5 pi contenant la Taq ADN Polymerase, SYBR colorant vert, tampon PCR, dNTP mix et MgCl 2 (voir 4.2.2 ci-dessous); 0,9 pi d'une solution 10 uM d'actions de l'amorce de l'avant, 0,9 pi d'une solution 10 uM d'achat d'actions de l'amorce inverse, l'eau ultra-pure de 1,2 pi et 2 pi de matrice d'ADNc, préalablement diluée comme indiqué dans l'étape 4.1.10.
NOTE: protocoles concentration des réactifs et des cyclistes utilisés dans cette section ont été optimisés pour être réalisée spécifiquement avec les réactifs et instruments décrits dans le "Tableau des Matériaux et réactifs", d'autres marques peuvent être utilisés, mais les volumes de réaction, la concentration des réactifs et le protocole de vélo peuvent varier. Vérifiez vos instructions du fabricant avant de procéder à la RT-qPCR. - Mettre en place l'instrument qPCR comme suit:
Cycle de 1X: 15 min, 95 ° C
40X cycles: 15 sec, 95 ° C puis 1 min, 60 ° C (à cette acquisition fluorescence point).
Remarque: Pour la quantification relative de l'ARNm selon la méthode d'un Ct 30 référee gène doit être choisi pour la normalisation des valeurs de Ct. Référence gène de choix devrait être testée dans des conditions d'essai spécifiques comme son expression peut varier; ACTB, GAPDH ou 18S sont certains des gènes habituellement choisis comme références. - Mettre en place la valeur de seuil et analyser les données.
Résultats
L'immunothérapie sublinguale peut être utilisé avec succès pour moduler la réponse immunitaire des poumons. Nous avons montré qu'une seule dose de la flagelline, l'agoniste et NLRC4 TLR5, peut induire une régulation à la hausse significative de l'ARNm codant pour la CXCL1 des chimiokines, CCL20 et la cytokine IL-6 par rapport à une solution saline traitée contrôles. Pliez induction de niveaux d'ARNm a culminé à 8 h après fente et revenir à des niveaux de base après 20 heures (Figure 1). Toutefois, lorsque SLIT a été effectuée 2 heures avant l'infection intranasale avec S. Pneumoniae, les niveaux de CXCL1 et IL6 ARNm demeurent significativement régulés à la hausse, même 24 heures après SLIT par rapport aux animaux non traités (figure 2).
L'analyse des populations cellulaires dans le BAL et le tissu pulmonaire par FACS a montré que les animaux traités avec FliC par voie sublinguale ont augmenté le nombre de neutrophiles dans les voies respiratoires, mais pas dans les tissus des poumons (Figure 3).
Enfin, la survie après provocation pneumococcique a été comparée chez des animaux préalablement traités avec FliC par voie sublinguale ou avec une solution saline comme témoin. Comme le montre la figure 4, VSL avec flagelline promu protection et augmenté la survie contre la pneumonie à pneumocoques aigu.
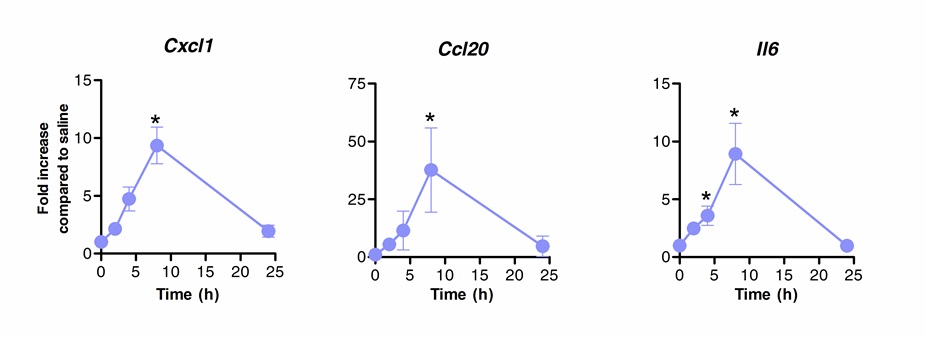
Figure 1: Cinétique de profil de transcription des poumons après l'immunothérapie sublinguale avec la flagelline. Des souris BALB / c âgées de huit à dix semaines (n = 4) ont été traités avec 10 pg de la flagelline ou une solution saline par voie sublinguale, sous anesthésie. Les poumons ont été prélevés à différents moments et on les place dans de conservation des acides nucléiques. Extraction de l'ARN total a été effectuée et l'ADNc a été synthétisé. les niveaux d'ARNm ont été évalués par PCR en temps réel utilisant des amorces spécifiques figurant dans Table 1. quantification relative a été réalisée selon la méthode ACt utilisant des niveaux d'ARNm ACTB pour la normalisation. Les résultats sont présentés comme multiplication par rapport à une solution saline groupe traité par la médiane ± SEM. Les astérisques indiquent les différences statistiquement significatives (p <0,05), calculée selon le test de Mann-Whitney. Les résultats sont représentatifs de deux expériences indépendantes.
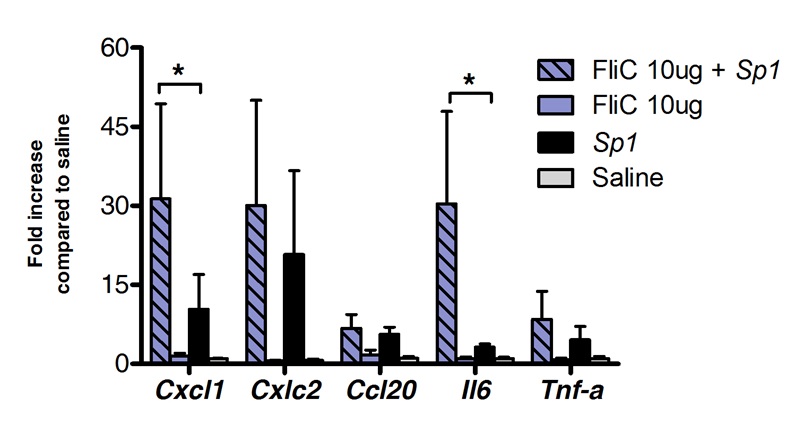
Profil transcriptionnel de Figure 2 poumons pendant la pneumonie à pneumocoque après immunothérapie sublinguale avec la flagelline (n 7 n = 4 pour le groupe témoin et = pour le groupe traité). Huit à 10 semaines souris BALB / c ont été traités avec 10 mg de flagelline ou une solution saline par voie sublinguale, sous anesthésie. 2 heures plus tard souris ont été exposées par voie intranasale avec la dose létale minimale (DLM), provoquant 10Mortalité de 0% d'un isolat clinique de S. pneumoniae de sérotype 1 E1585, correspondant à 4x10 5 UFC / 50 pi. Les poumons ont été prélevés 24 heures après la provocation et stockés dans de préservation de l'acide nucléique jusqu'à ce que l'extraction d'ARN et synthèse d'ADNc ont été réalisées. PCR en temps réel a été effectuée (Voir la liste amorce dans le tableau 1) et la quantification relative a été réalisée selon la méthode ACt utilisant des niveaux d'ARNm ACTB pour la normalisation. Les résultats sont présentés comme multiplication par rapport à une solution saline groupe traité par la médiane ± SEM. Les astérisques indiquent les différences statistiquement significatives (p <0,05), calculée selon le test de Mann-Whitney.
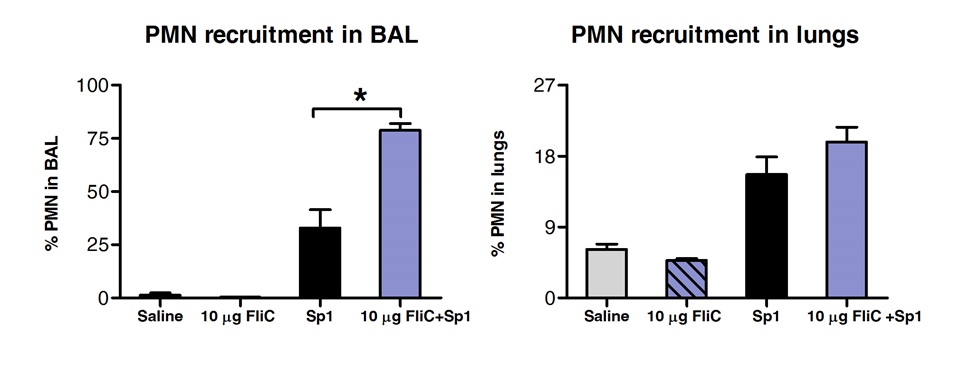
Figure 3 Analyse des polynucléaires neutrophiles (PMN) le recrutement dans les tissus et les voies respiratoires des poumons après fente. Huit àDes souris BALB / c âgées de 10 semaines (n = 4) ont été traités avec 10 pg de la flagelline ou une solution saline par voie sublinguale, sous anesthésie. 2 heures plus tard souris ont été exposées par voie intranasale avec le MLD de S. pneumoniae de sérotype 1 E1585. 24 heures après la provocation, BAL a été effectuée et les poumons ont été traitées pour l'analyse FACS. PMN ont été identifiés comme CD11b cellules Ly6G haut / haut / CD11c négatifs et basé sur le profil FCS-SSC. Les résultats sont exprimés en tant que pourcentage de PMN à l'égard du nombre total de cellules dans le BAL et les poumons. Les barres représentent médiane ± SEM. Les astérisques indiquent les différences statistiquement significatives (p <0,05), calculée selon une voie test de Mann-Whitney.
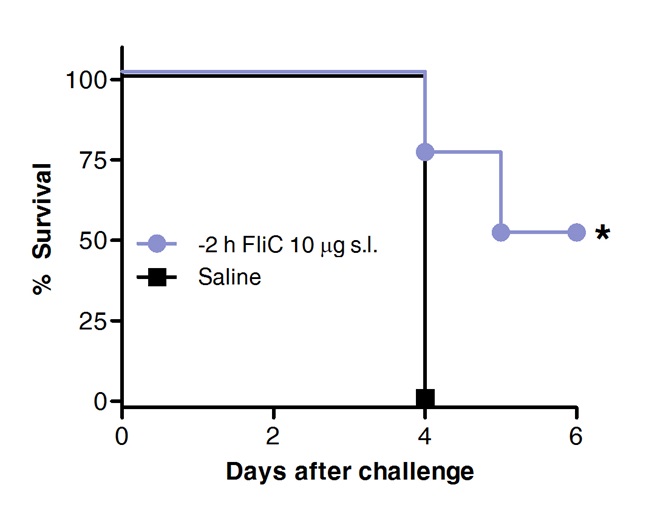
Figure 4 VSL avec flagelline protège les souris contre la pneumonie à pneumocoques aigu. Huit à 10 semaines les souris BALB / c (n = 8) ont été traitées avec 10 pg de la flagelline ou une solution saline par voie sublinguale, sous anesthésie. 2 heures plus tard souris ont été exposées par voie intranasale avec le MLD de S. pneumoniae de sérotype 1 E1585. La survie a été évaluée sur une base quotidienne. Les courbes de Kaplan-Meier ont été comparés selon log-rank (Mantel-Cox) test. Les astérisques indiquent les différences statistiquement significatives (p <0,05) .Résultats sont représentatifs de deux expériences indépendantes.
| Nom | Séquence 5'-3 ' | PCR longueur du produit (pb) |
| mB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| mB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| mIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| mIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
Le tableau 1 liste d'amorces utilisés pour l'analyse par PCR en temps réel. Des séquences d'amorces spécifiques utilisées pour l'analyse qPCR. Amorces sens et antisens pour ACTB de la souris, Cccl20, CXCL1, IL6, TNFa et CXCL1 sont présentés comme des séquences 5'-3 'et la longueur de produit attendu est indiqué en paires de bases (pb).
Discussion
L'administration sublinguale d'agents thérapeutiques a été prouvé comme un moyen utile pour moduler la réponse immunitaire dans les voies respiratoires. Le principal avantage de VSL pour le traitement des maladies respiratoires est qu'elle n'implique pas la livraison directe des composés dans les poumons ou les narines, être sûr que les traitements basés sur l'administration intranasale 31.
L'immunothérapie sublinguale peut être utilisé pour moduler la réponse immunitaire de différentes façons, que ce soit pour l'induction de réponses de régulation qui peut améliorer les symptômes de l'inflammation allergique et l'asthme 32 ou à induire une activation transitoire de mécanismes immunitaires innées pour traiter des infections pulmonaires aiguës comme indiqué ici.
Le modèle de souris présentée dans cette vidéo est un procédé commode pour le criblage de composés différents comme agents thérapeutiques pour fente.
Ce modèle animal offre un moyen utile pour déterminer l'impactde la SLIT dans la réponse immunitaire des poumons, ainsi que dans d'autres organes (par exemple,. drainage des ganglions lymphatiques ou des sites distaux des muqueuses) qui ne peut pas être imitée par l'utilisation de modèles in vitro. Bien qu'il existe plusieurs documents qui décrivent les résultats obtenus en utilisant l'immunothérapie sublinguale, méthodes détaillées pour les procédures de l'administration sublinguale n'ont pas encore été mis à disposition. En outre, le modèle peut être utilisé pour l'évaluation de vaccins sublinguaux visant à conférer une protection systémique ainsi que locale dans les voies respiratoires.
Comme montré dans la vidéo d'accompagnement, l'administration sublinguale de composés est une procédure simple qui peut être facilement réalisée sans qu'il soit nécessaire de formation étendue. En règle générale, une personne compétent dans la manipulation des animaux, il faudra 1 heure pour effectuer SLIT dans un groupe de 10 souris en utilisant des anesthésiques injectables comme décrit dans ce protocole. Si la récusation contre le pneumocoque est effectuée ainsi, 90 min supplémentaire sera nécessaire pour préparerla suspension bactérienne et effectuer provocation intranasale des animaux.
Les protocoles FACS présentés ici permettent de caractériser pratique de l'impact de la fente sur le site de l'administration locale, les ganglions lymphatiques drainant ainsi que leurs effets sur la dynamique des cellules des poumons.
L'analyse séparée de la teneur et du parenchyme pulmonaire bronchoalvéolaire est important de discriminer résidant à l'abri de l'infiltration des voies respiratoires et des types de cellules à partir de ceux qui restent à l'intérieur du tissu. L'analyse du contenu BAL permet l'étude du chiffre d'affaires des macrophages alvéolaires ainsi que la dynamique de recrutement des cellules dans les espaces alvéolaires induits par des traitements différents, par exemple., PMN, les éosinophiles, les monocytes. BAL peut également être utilisé pour évaluer la présence de cytokines et de chimiokines sécrétées par Enzyme-linked immunosorbent assay (ELISA) ou la détection d'anticorps IgA sécrétées induites après vaccination par voie sublinguale. Etude du tissu du poumonpermettant la caractérisation d'autres types de cellules, les cellules dendritiques Classiquement, les cellules T et les cellules B.
Préparation des échantillons de LBA et les ganglions lymphatiques de l'analyse FACS est simple. Après la collecte de l'échantillon, normalement de 60 minutes sont nécessaires pour compléter le protocole de coloration pour 10-20 échantillons. En revanche, l'isolement de cellules provenant de tissu pulmonaire ou par voie sublinguale, il faudra plus de temps car la digestion de la matrice extracellulaire est nécessaire. L'absorption de l'agent thérapeutique administré par voie sublinguale peut être adressée par le suivi de fluorescence des molécules radiomarquées ou en utilisant des systèmes d'imagerie in vivo.
L'immunothérapie sublinguale est une méthode attrayante pour induire efficacement des réponses immunitaires de l'appareil respiratoire ainsi que de manière systémique qui peut être utilisé pour traiter ou prévenir des troubles respiratoires. L'élucidation des mécanismes de détermination de la tolérance par rapport à l'activation de la réponse immunitaire dans les voies respiratoires après SLIT is cruciale pour permettre la conception rationnelle de nouvelles stratégies thérapeutiques qui peuvent être utilisés seuls ou en combinaison avec différents traitements disponibles contre les affections respiratoires.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
matériels
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
Références
- . Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999 (2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1 (2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon