Method Article
Сублингвальной иммунотерапии как альтернатива Вызвать защиты от острыми респираторными инфекциями
В этой статье
Резюме
The present work illustrates the convenience of using sublingual immunotherapy to boost the innate immune response in the lungs and confer protection against acute pneumococcal pneumonia in mouse.
Аннотация
Sublingual route has been widely used to deliver small molecules into the bloodstream and to modulate the immune response at different sites. It has been shown to effectively induce humoral and cellular responses at systemic and mucosal sites, namely the lungs and urogenital tract. Sublingual vaccination can promote protection against infections at the lower and upper respiratory tract; it can also promote tolerance to allergens and ameliorate asthma symptoms. Modulation of lung’s immune response by sublingual immunotherapy (SLIT) is safer than direct administration of formulations by intranasal route because it does not require delivery of potentially harmful molecules directly into the airways. In contrast to intranasal delivery, side effects involving brain toxicity or facial paralysis are not promoted by SLIT. The immune mechanisms underlying SLIT remain elusive and its use for the treatment of acute lung infections has not yet been explored. Thus, development of appropriate animal models of SLIT is needed to further explore its potential advantages.
This work shows how to perform sublingual administration of therapeutic agents in mice to evaluate their ability to protect against acute pneumococcal pneumonia. Technical aspects of mouse handling during sublingual inoculation, precise identification of sublingual mucosa, draining lymph nodes and isolation of tissues, bronchoalveolar lavage and lungs are illustrated. Protocols for single cell suspension preparation for FACS analysis are described in detail. Other downstream applications for the analysis of the immune response are discussed. Technical aspects of the preparation of Streptococcus pneumoniae inoculum and intranasal challenge of mice are also explained.
SLIT is a simple technique that allows screening of candidate molecules to modulate lungs’ immune response. Parameters affecting the success of SLIT are related to molecular size, susceptibility to degradation and stability of highly concentrated formulations.
Введение
The overall goal of this work is to illustrate the benefits of sublingual immunotherapy for the treatment of acute respiratory infections (ARI) and present the advantages of this delivery route compared to other routes of administration, namely intranasal.
ARI cause millions of deaths every year especially in children under five. Streptococcus pneumoniae remains as one of the major etiological agents of bacterial pneumonia in infants and the elderly1,2. To present, the main available treatment relies on the use of antibiotics but resistant strains are continuously arising3,4.
SLIT induces broad responses at systemic and also mucosal level, particularly at the respiratory tract5. It has proven effectiveness against influenza infection, promoting long term protection with production of humoral and cellular responses6,7. Besides, it has been shown that prophylactic treatment with bacterial lysates delivered by sublingual route reduced exacerbations of chronic obstructive bronchitis in the elderly8 and prevented recurrent respiratory infections in children9. SLIT has been widely used for the treatment of allergies and asthma. Clinical studies had not only demonstrated its efficacy to modulate the immune response in the respiratory tract but also its safety10. Despite the growing interest of pharmaceutical companies and researchers in SLIT, the mechanisms involved in the induction of mucosal immune responses after sublingual delivery of compounds remain obscure. Recently, attention has been focused on the mechanisms promoting tolerance associated with allergen desensitization. It has been proposed that resident and recruited cells at the sublingual mucosa, like dendritic cells and macrophages, can promote tolerance after SLIT11-13. Dendritic cells of the oral mucosa can promote IFN-gamma and IL-10 producing T helper cells11 as well as recirculate to the distal genital mucosa and promote CD8+ T cells14. However, little is known about the impact of SLIT on innate cells or its capacity to improve pathogen clearance during acute respiratory infections.
The natural control of pneumococcal infection in the lungs greatly depends on the efficient and swift activation of local innate defences. We previously showed that enhancement of lungs’ innate immunity by a single intranasal dose of flagellin (FliC), a TLR5 and NLRC4 agonist, protects 75-100% of mice challenged with a lethal dose of a clinical isolate of Streptococcus pneumoniae serotype 1. This protection was shown to be dependent on local recruitment of GR1+ cells (likely polymorphonuclear neutrophils, PMNs) and not dependent on antibodies, B or T cells15.
Flagellin is the structural component of the bacterial flagellum. In its monomeric form it is recognized by two Pathogen Recognition Receptors (PRRs), TLR5 that senses extracellular FliC16 and NLRC4/NAIP5 inflammasome that detects intracellular flagellin17,18. When FliC is sensed by the PRRs an important inflammatory response is triggered. We and others have demonstrated that instillation of purified FliC from Salmonella enterica serovar Typhimurium into the lungs drives swift production of chemokines and cytokines specially when recognized by the lungs’ epithelium that in turn orchestrate the recruitment of immune cells into the airways, mainly PMNs15,19-21. Although transient, the substantial neutrophil infiltration that takes place into the airways after nasal delivery of FliC could be a concern if moving towards clinical therapies for human use. Excessive inflammation could be detrimental for the lungs’ function. Moreover, it has been shown that intranasal delivery of immunostimulatory molecules may cause facial paralysis and/or brain toxicity22-24.
Sublingual immunotherapy offers a safer alternative to modulate the immune response in the respiratory tract compared to the intranasal route. It is non-invasive, painless, simple and has good patient compliance25. Furthermore, as mentioned before, it can induce protective responses in the respiratory mucosa without the risks associated to direct intranasal or intrapulmonary delivery of formulations. Sublingual route could be alternatively used to deliver molecules that have great effects onto the lung’s immune system but that have been proven to be toxic or to elicit great inflammation when administered intranasally. Besides these advantages, formulations for sublingual immunotherapy have lower cost of manufacture since non-sterile products can be delivered by this route and endotoxic shock is not a concern for SLIT. On the other hand, it is worth noticing that higher doses of the immunostimulatory compounds compared to those used by intranasal or parenteral routes are necessary to induce an immune response in the lungs; also highly concentrated solutions are needed when using the mouse model of SLIT since the anatomical site where the formulations are deposited is small.
Based on our previous published data, we developed a model of protection using sublingual immunotherapy with flagellin as model immunostimulant. We demonstrated that a single dose of flagellin induced 60% survival against invasive pneumococcal pneumonia caused by the serotype 1 strain while all mice in the control group died of infection within 5 days. Flow cytometry analysis showed that higher numbers of PMN are recruited into the airways of protected animals after sublingual treatment with flagellin suggesting that these cells might be involved in the mechanism of protection induced by sublingual immunotherapy.
This video shows in detail how to perform sublingual immunotherapy and also how to recover relevant tissue from the sublingual mucosa, draining lymph nodes as well as lungs and airways to perform further analysis. Additionally, it illustrates the general technique of cell preparation for FACS analysis and briefly shows how to prepare Streptococcus pneumoniae suspensions and how to perform intranasal infections in mouse to set up the acute infection model.
протокол
Процедуры с участием животных были проведены в соответствии с протоколами N ° 071140-000821-12 и 08052010, утвержденной Почетного комиссии экспериментов на животных и директивы Совета Школы медицины, Универсидад де ла Република - Уругвай.
1 сублингвального введения терапевтического агента
- Приготовьте раствор, содержащий терапевтический агент для тестирования. Отрегулируйте концентрацию администрировать максимальный объем 10 мкл на мышь.
ПРИМЕЧАНИЕ: Для очищенной флагеллина от Salmonella enterica серовар Typhimurium оптимальную дозу, чтобы вызвать защиту в мыши, инфицированной первой смертельной дозы S. пневмонии серотип 1 E1586, в результате чего 100% смертность составляет 10 мкг / мышь. Флагеллин раствор должен быть нагрет при 65 ° С в течение 5 мин, чтобы обеспечить высвобождение мономеров. Для получения дополнительной информации о очистки флагеллина увидеть ссылку 26.- Varу эффективная концентрация различных иммуномодулирующих агентов в соответствии с его размером молекул, чистоты, восприимчивость к протеолизу и использование мукоадгезивных веществ. Регулировка оптимальной концентрации для каждого соединения для тестирования, чтобы максимизировать его последствий. Если предыдущие исследования по интраназально были проведены для конкретного соединения, использовать начальную дозу 5 до 10 раз выше, чтобы проверить его эффективность на Сублингвальный.
- Анестезировать мышей путем введения коктейль, содержащий 110 мг / кг кетамина с 5,5 мг / кг Xylacine и пусть животные отдохнуть от 7 до 10 мин.
- Подтвердите правильное обезболивание, слегка нажав подушечку лапы одного из задних ног; если правильно наркозом животное не будет двигаться в ответ на стимул.
- Нанесите тонкий слой ветеринарной мази на глаза каждой мыши, чтобы предотвратить сухость в то время как под наркозом.
Примечание: анестетики, такие как ингаляционных изофлуораном может быть также использован вместо Кетамин / Xylacine если система оснаститьдоваться индукционных камерных и головных частей доступен. Используйте индукционный камеру обезболить животных и администрировать иммуностимулирующее по Сублингвальный. Сразу подключения животное к носовой обтекатель, по крайней мере 15 минут, чтобы держать его под наркозом, чтобы избежать глотания и позволяют поглощение терапевтического соединения. - Внесите раствор, содержащий иммуностимулирующим или управления транспортным средством решения; используя большой палец и указательный палец не доминантной рукой взять мышь и держать его в вертикальном положении.
- Использование главенствующих мест руку пару закрытых щипцов под язык и удерживать его на месте с помощью средним и безымянным пальцами, открыть щипцы слегка поднять язык.
- Возьмите пипетку и администрирования раствора на дне полости рта и спинной стороне языка.
- Удалите пинцетом и пусть остальное мыши для 3 до 5 мин, прежде чем положить его обратно в клетку. Чтобы гарантировать, что нормотермии поддерживается в анестезированной микрофоне, соединить клетки к системе клетка нагревателя. Если такая система отсутствует, место мышей, принадлежащих к той же группе лечения обратно в соответствующей клетке одного рядом друг с другом на постельные принадлежности и частично покрыть их с чистыми ткани бумажные листы, чтобы помочь им поддерживать температуру тела.
- Сбор образцов тканей в любой момент времени после закапывания в иммуномодулирующего средства для анализа изменений в клеточных популяций, вызванных лечения.
ПРИМЕЧАНИЕ: В данном конкретном администрации протокола флагеллина проводили 2 ч до заражения. Определить оптимальное время между лечением и вызов для каждого конкретного терапевтического агента и возбудителя для тестирования.
2 Получение бактериальной суспензии и Интраназальное Вызов с Пневмококк
ПРИМЕЧАНИЕ: С. пневмонии является естественным патоген человека, что может причинить опасные заболевания, как инвазивные пневмонии, сепсисаи менингит. Передача может происходить при вдыхании или в контакте с слизистой оболочки. Таким образом, все образцы, которые, возможно, были в контакте с S. пневмонии необходимо обращаться в соответствующий биозащиты Уровень II объекта с использованием кабинет биобезопасности класса II. Проверьте стандартными оперативными процедурами вашего учреждения по обращению с Тип патогенов II для защитной одежды, утилизации отходов и дополнительных мер безопасности, которые могут применяться. Зараженные животные должны храниться в отдельности вентилируемые клетки в изоляторах, оснащенных HEPA фильтры. Анти-пневмококковой вакцины и антибиотикотерапия доступны. Для получения дополнительной информации см ссылки 27 и 1.
- Оттепель аликвоту рабочей фондовом приостановлении Пневмококк известной бактериальной КОЕ числа, полученного, как описано в 15.
- Центрифуга течение 5 мин при 2500 мкг в и РТ.
- Удалите супернатант и мыть бактериальных гранул путем приостановления его в 1 мл улerile солевой раствор. Используйте советы фильтра при подготовке бактериальной суспензии, разведения или для животных вызов.
- Центрифуга снова, как описано на стадии 2.2.
- Жидкость над осадком сливают и вновь суспендируют таблетку в соответствующем объеме стерильного физиологического раствора, чтобы получить суспензию 4х10 5 КОЕ / 50 мкл. Эта доза соответствует минимальному бактериальной дозы S. пневмонии серотип 1 E1586, который вызывает 100% смертность в BALB / с мышей в соответствии с предыдущими исследованиями 15.
Примечание: При создании модели пневмококковой пневмонии у мышей, минимальная доза, вызывающая бактериальный 100% смертности должен быть определен для каждого конкретного сочетания бактериального штамма серотипа, и штамм мыши. - Гомогенизируют бактериальной суспензии путем встряхивания или пипетки вверх и вниз 5 раз.
- Нагрузка 50 мкл бактериальной суспензии, используя стерильный наконечник фильтра и привить общий объем в ноздри с наркозом мыши. Держите UPRI мышиGHT в течение 2 мин и дайте ему отдохнуть в положении лежа на спине в течение еще 2 мин. Применить ветеринар мазь на глазах и вернуть животных в клетку; убедитесь, чтобы сохранить нормотермию под наркозом.
Примечание: В этом исследовании бактериальной задача была выполнена в объеме 50 мкл, чтобы гарантировать доставку по крайней мере, 90% от общего КОЕ в легкие, как определено выше в 15,28. Чтобы свести к минимуму стресс небольших объемов животного (например, 20 мкл) могут быть использованы. Тем не менее, эффективная доставка бактерий в легкие должны быть проверены; это может быть сделано путем сбора легких 5 мин после того, как вызов и подсчета КОЕ в гомогенатах легких "путем посева разведений на кровеносных-агаром. - Подтверждение числа КОЕ в бактериальной суспензии, используемой для инфекции путем посева последовательных 10-кратных разведений на чашки с кровяным агаром. Выдержите O / N при 37 ° С с 5% CO 2 и подсчитать количество мукоидного колоний представляя зеленым ореолом характеристику альPHA гемолитические бактерии.
3 Tissue Сбор и подготовки образцов для проточной цитометрии (FACS) Анализ
3.1) коллекция тканей
- Усыпить животное смещением шейных позвонков или с помощью СО 2 камеры; открыть грудной полости весь путь до шеи и сделать надрез вдоль передних ног, чтобы разоблачить брюшной стороне шеи и подчелюстной области.
- С тонким наконечником пинцетов осторожно потяните ее слюнных желез и прилегающей мягкой ткани, чтобы разоблачить спинной стороне дна полости рта. Использование изогнутых тонким кончиком пинцета, принять нижнечелюстного и аксессуаров нижней челюсти лимфатические узлы, потянув аккуратно и поместите их в пробирку, содержащую полную RPMI (cRPMI, для 500 ML-10% фетальной бычьей сывороткой, 5 мл раствора, содержащего 10 000 ЕД / мл пенициллина и 10 мкг / мл стрептомицина раствора и 5 мл L-глютамина 200 мм) или раствор нуклеиновой кислоты консервант в соответствии с процедурой, ниже по течению, которые будутосуществляться позже.
- Чтобы открыть грудной полости сделать надрез в диафрагме; Используя пару крыс-зубчатые щипцы зажать xyphoid хряща грудины и аккуратно вырезать ребра на обоих спинных сторон не начиная от ложных ребер вплоть до достижения точки, где истинные ребра встретиться рукояткой грудины.
- Удерживая xyphoid хряща грудины с пинцетом, подтянуть аккуратно выставлять органы грудной полости.
- Удалить ребра полностью за счет сокращения первые ребра и ключицу. Тимус появится в виде белого структуры двух лопастей, расположенных в антеровентральном части грудной клетки близко к основанию сердца.
- Возьмите одну из долей, зажимая его с парой щипцов и использовать ножницы, чтобы удалить связок между его нижней поверхности и перикарда. Продолжать для удаления второго лепесток.
- Определить в брюшную полость и открыть его разрезанием вдоль срединной оси мuscular стены, чтобы разоблачить органы. С парой щипцов сократить задней полой вены и грудной аорты; удаления избытка крови с абсорбирующей тканью.
- Для анализа резиденты и проникают клеточные популяции из альвеол выполнения бронхоальвеолярной (БАЖ). Вырезать мышцы в вентральной части шеи, чтобы разоблачить трахею и пищевод; , чтобы отделить их делать надрезы в боковых и спинной сторон структур.
- Поднимите трахею с пинцетом и сделать небольшой надрез скальпелем ввести пипетки передачи тонких наконечник, наполненный 1 мл PBS без Ca 2 + / Mg 2 + плюс 1 мМ ЭДТА. Привить и аспирации с получением общего объема, по крайней мере три раза; аспирата и передачи клеточной суспензии в стерильную пробирку 1,5 мл и поместить его на льду.
- Для анализа клеточных популяций, присутствующих в легочной паренхимы, сначала заливать в легкие путем инъекции 5 мл PBS без Са2 + / Mg 2 + плюс 1 мМ ЭДТА в правый желудочексердца.
ПРИМЕЧАНИЕ: Это устранит большинство эритроцитов и иммунных клеток, присутствующих в кровеносные сосуды легких. Если перфузия осуществлялась правильно, легкие цвета сместится от розового до белого. - Изолировать сердце от легких путем зажима его от основания левого желудочка и деликатно сократить кровеносные сосуды с ножницами, чтобы удалить его полностью. Принять перфузией легких и поместить их в cRPMI или нуклеиновой кислоты раствор консерванта в зависимости от нисходящего анализа должны быть выполнены.
- Для анализа клеточных популяций в подъязычной слизистой, изолировать голову животного и удаления слюнных желез и прилегающей мягкой ткани, если это не было сделано на шаге 3.2.1.
- Сделайте надрез на каждой стороне рта до достижения нижней челюсти совместные и самостоятельные нижнюю челюсть вместе с языком и дна полости рта, используя булавки закрепить ее на рассечение борту. Поднимите язык; с помощью скальпеля сделать надрез, где баSE языка не отвечает дна полости рта до достижения третьи моляры, чтобы разоблачить сублингвально слизистую оболочку.
- Снимите язык полностью; взять 0,5 мм биопсии удар и поместить его рядом с нижних резцов. Порезать от десневого вставки подъязычной ткани и аккуратно нажмите до дна полости рта, была вырезана полностью.
- Повторите еще раз в настоящее время размещение биопсии удар рядом с третьих моляров до полного удаления подъязычной ткани. Поместите на чистую пробирку, содержащую cRPMI или консервант нуклеиновой кислоты.
3.2) Подготовка проб для анализа FACS.
- Передача ткани легких ", выделенный из каждой мыши в 24-луночный планшет и фарш их чистой ножницами до получения мелких кусочков ткани примерно 2 мм. Добавить 1 мл на лунку пищеварения среде, содержащей 30 мг коллагеназы типа II, 50 мкг ДНКазы I в 1 мл RPMI без FBS. Внесите вверх и вниз в пять раз и инкубировать при37 ° С и 5% СО 2 в течение 40 мин.
- Для анализа клеточных популяций в подъязычной ткани, заменить пищеварение среду в 3.2.1 с одним, содержащей 2 ед диспаза, 30 Тип мг II коллагеназы, 50 мкг ДНКазы-I в 1 мл RPMI. Инкубируйте ткани, собранные от одной мыши в 500 мкл среды пищеварения течение 20 мин при 37 ° С в орбитальном шейкере при 50 оборотах в минуту.
- После инкубации пипетки вверх и вниз в 10 раз или 30 сек, пока большая часть ткани не была нарушена. Фильтр клеточной суспензии при том, что сетчатый фильтр стерильные клетки 40 мкм и промывали 5 мл PBS с добавлением 5 мМ ЭДТА.
ПРИМЕЧАНИЕ: Полное переваривание внеклеточного матрикса и фиброзной ткани не будут достигнуты. Тем не менее, более длительные времена инкубации в присутствии коллагеназы и / или диспазы или агрессивного растиранием не рекомендуется, так как это приведет к увеличению гибели клеток и разрушение внеклеточных белков, влияющих на общий результат FACS анализ. - Центрифуга при 400 х г, 5 мин, 4 ° C.
- Для анализа клеточных популяций в БАЛ, центрифуги клетки при 400 мкг, 5 мин, при 4 ° С и перейдите к шагу 3.2.4.
- Для анализа клеточных популяций в лимфатических узлах, разместить 70 мкм ячейки фильтра на стерильную чашку Петри и поставить лимфатических узлов вместе с 1 мл cRPMI в сито. Выньте шаг из 2 мл стерильный шприц и использовать его в качестве пестиком, чтобы сокрушить лимфатические узлы против сетки сетчатый фильтр в. Промыть фильтр клеток с 1 мл свежей cRPMI и передавать клетки из чашек Петри в стерильную пробирку.
- Принять репрезентативной аликвоту каждой пробы и окрашивают его с трипановым синим, чтобы определить количество жизнеспособных клеток.
- Ресуспендируют клеток в FACS-EDTA: PBS-5 мМ ЭДТА-1% бычьего сывороточного Albumin-, чтобы компенсировать суспензии 2х10 7 клеток / мл и добавляют 50 мкл в цитометре трубки.
- Приготовьте смесь 2X антитела, содержащий проверopriate комбинации антител против поверхностных маркеров и флуорохромами По имеющейся FACS инструмента. Добавить 50 мкл 2X смеси антител в каждую пробирку, содержащую суспензию клеток.
Примечание: титрование каждый Флуорохром-меченого антитела для определения оптимального количества, которые будут использоваться, для детального протокола смотри ссылку 29. - Выдержите 30 минут на льду в темноте.
- Промыть один раз с 3 мл FACS-EDTA и спин вниз клетки центрифугированием при 400 х г в течение 5 мин при 4 ° С, ресуспендирования клеток в 200 мкл того же самого буфера и анализа в цитометр потока.
Примечание: Если обработка большое количество образцов, протокол для окрашивания FACS анализа, описанного выше, могут быть выполнены в U-донными 96-луночных планшетах, а не цитометра труб. Тем не менее, при использовании 96-а шаги пластины стиральные должны выполняться путем добавления до 200 мкл FACS-EDTA и повторяя его 4 раза летел вниз клетки на 400 мкг в течение 5 мин при 4 ° С между каждой васинг шаг. - В этот момент фиксации образцов для анализа в проточном цитометре позже (до 72 ч после фиксации).
- Чтобы зафиксировать клетки, после маркировки с FACS-антител промыть клетки в PBS нет Ca 2 + / Mg 2 +, 1 мМ ЭДТА без FBS. не суспендирования клеток в 50 мкл того же самого буфера и добавить 50 мкл свежеприготовленного 4% раствором параформальдегида в гипертонической (2x) PBS не Ca 2 + / Mg 2 +.
- Инкубировать в течение 20 мин при комнатной температуре и промыть 3 раза в FACS-EDTA.
- Ресуспендируют клеток в 200 мкл FACS-EDTA и хранить при температуре 4 ° С и защищенном от света до 72 часов.
ПРИМЕЧАНИЕ: FSC-SSC могут быть затронуты фиксации. Если фиксации образцы проверить совместимость флуоресцентно меченых антител с производителем, так как тандемные красители могут ухудшиться в присутствии фиксирующие агентов. Если образцы возник из зараженных животных фиксация настоятельно рекомендуется убедиться, что никаких жизнеспособных патогенов не будет присутствовать при Analyпеть образцы в машине FACS с microaerosols можно сформировать в процессе приобретения образца.
4 Всего Экстракция РНК, кДНК Синтез и ПЦР в реальном времени.
4.1) Выделение РНК и синтез кДНК.
- Гомогенизируют ткани в нуклеиновой консервант кислота решения выбора механическим разрушением (например, с помощью роторно-статорной гомогенизатора, высокая скорость встряхивания тканевой ruptor и бусы, и т.д.). Центрифуга при 12600 х г в течение 15 мин и 4 ° С, чтобы удалить твердые частицы ткани. Передача супернатант в чистую пробирку.
- Извлечение РНК с методом выбора следующей инструкции производителя.
ПРИМЕЧАНИЕ: РНК степени подвержены деградации, если она не будет использоваться сразу после выделения, сделать аликвоты и хранить их в РНКазы труб при -80 ° С. Повторное замораживание и оттаивание. Трубы должны быть в перчатках во все времена. После оттаивания образцовсегда держите их на льду. - Измеряют поглощение нуклеиновых кислот при 260 нм и расчета концентрации в мкг / мкл.
- Подготовка ДНКазы-я смешать с добавлением (для образца 1): 7,6 мкл ультрачистой воды, 1 мкл 10Х ДНКазы I-буфера, 0,4 мкл ДНКазы I-амплификации (класс) складе 1 ед / мкл, а также добавить 8,4 мкл ДНКазы-я смешать с каждым образцом, содержащим 1 мкг общей РНК.
- С помощью РНК при концентрации 1 мкг / мкл, и выполнить retrotranscription реакции (RT-PCR) с добавлением 1 мкл общей РНК в качестве матрицы. Если образцы слишком разбавленный и концентрация ниже, чем ожидалось, добавить большие объемы тотальной РНК вместо воды. Не более 20% от конечного объема реакции при добавлении РНК особенно, если протокол экстракции РНК выбора участвовать фенол-хлороформ, так как фенольные следов может повлиять на выход RT-PCR.
- Инкубировать 15 мин при комнатной температуре с последующим 10 мин при 4 ° С или ясе. (Не превышайте время инкубации !!)
- Добавить 1 мкл 25 мМ EDTA (молекулярная биология класса) в каждую пробирку и инкубируют при 65 ° С в течение 10 мин для инактивации ДНКазы I.
- Подготовка retrotranscription (RT) смесь следующим образом (в течение 1 реакции): 1 мкл случайных праймеров гексамера фондовых 0,2 мг / мл, 1 мкл дНТФ складе 10 мм, 4 мкл 5Х М-MLV-RT буфера, 2 мкл 0,1 М ДТТ, 1 мкл РНКазы OUT складе 40 ед / мкл, и 1 мкл M-MLV retrotranscriptase складе 200 ед / мкл.
- Добавить 10 мкл ОТ-ПЦР смешать с 10 мкл ДНКазы-I реакционную трубку.
- Проведение ПЦР-реакции в амплификатор в соответствии со следующей программой:
1X цикл: 10 мин, 25 ° C; 50 мин, 37 ° С; 15 мин, 70 ° С - Развести кДНК 1: 5 добавлением 80 мкл ультрачистой воды. Хранить при -20 ° C.
4.2) ПЦР в реальном времени (КПЦР).
- Подготовьте КПЦР реакционной смеси следующим образом (за 1 реакции): 5 мкл основной смеси, содержащей Taq ДНК Polymerase, SYBR Green краситель, буфер для ПЦР, дНТФ смесь и MgCl 2 (4.2.2 ниже); 0,9 мкл 10 мкМ исходного раствора прямого праймера, 0,9 мкл 10 мкМ исходного раствора обратного праймера, 1,2 мкл ультрачистой воды, и 2 мкл матрицы кДНК, предварительно разбавленной как показано на этапе 4.1.10.
Примечание: Реагент концентрации и велосипедных протоколы, используемые в этом разделе, были оптимизированы, чтобы быть осуществлена в частности, с реагентами и инструментов, описанных в "Таблице материалы и реагенты", других марок могут быть использованы, но реакционные объемы, концентрации реагентов и протоколов на велосипеде может изменяться. Проверьте свои инструкции производителя перед выполнением RT-КПЦР. - Установите инструмент КПЦР следующим образом:
1X цикл: 15 мин, 95 ° C
40X циклов: 15 сек, 95 ° C, затем 1 мин, 60 ° C (в этой точке флуоресценции приобретают).
Примечание: Для относительного количественного определения мРНК в соответствии с методом CT 30 Ссылки на сайтыэ ген должен быть выбран для нормализации значений Ct. Ссылка ген выбора должны быть проверены при определенных условиях анализа, как его экспрессия может изменяться; ACTB, GAPDH или 18S некоторые из генов, как правило, выбирается в качестве ссылок. - Настройка порогового значения и анализировать данные.
Результаты
Сублингвальная иммунотерапия может быть успешно использован для модуляции иммунного ответа легких. Мы показали, что одна доза флагеллина, агониста TLR5 и NLRC4, может вызвать значительное повышение экспрессии мРНК, кодирующей CXCL1 хемокинов, CCL20 и цитокин IL-6 по сравнению с получавшими физиологический раствор управления. Сложите индукция уровней мРНК достиг 8 ч после SLIT и вернуться в базальных уровней после 20 часов (Рисунок 1). Однако, когда SLIT проводили 2 ч до инфицирования интраназально с S. Пневмонии, уровни CXCL1 и IL6 мРНК оставались значительно усиливает свою активность даже через 24 часа после SLIT сравнению с необработанными животными (рисунок 2).
Анализ клеточных популяций в БАЛ и легочной ткани по FACS показали, что у животных, обработанных Флик по Сублингвальный увеличилось количество нейтрофилов в дыхательных путях, но не в ткани легких »(рисунок 3).
И, наконец, выживание после того, как вызов был пневмококковой по сравнению в животных, получавших ранее FLIC по Сублингвальный или солевым раствором в качестве контроля. Как показано на рисунке 4, SLIT с флагеллина способствует защите и увеличению выживаемости против острого пневмококковой пневмонии.
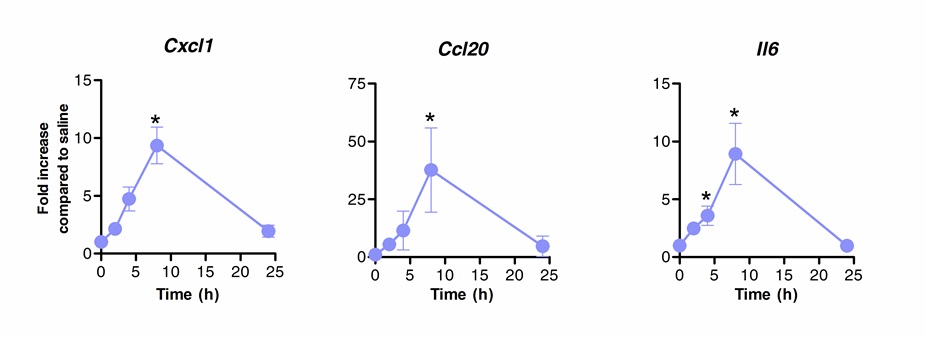
Рис.1 Кинетика транскрипции профиль легких "после сублингвального иммунотерапии с флагеллина. Восьми до 10 недель BALB / с мышей (п = 4) обрабатывали 10 мкг флагеллина или физиологического раствора по Сублингвальный под наркозом. Легкие собирали в различные моменты времени и помещают в консерванта нуклеиновой кислоты. Всего Выделение РНК проводили и кДНК синтезировали. Уровни мРНК оценивали путем ПЦР в реальном времени с использованием специфических праймеров, перечисленных в табле 1 Относительная количественная была выполнена в соответствии метод & Delta; CТ используя уровни ACTB мРНК для нормализации. Результаты представлены в виде кратное увеличение по сравнению с группой, обработанной физиологическим раствором в качестве медианы ± SEM. Звездочки указывают статистически значимые различия (р <0,05), рассчитанные в соответствии с критерия Манна-Уитни. Результаты представляют из 2 независимых экспериментах.
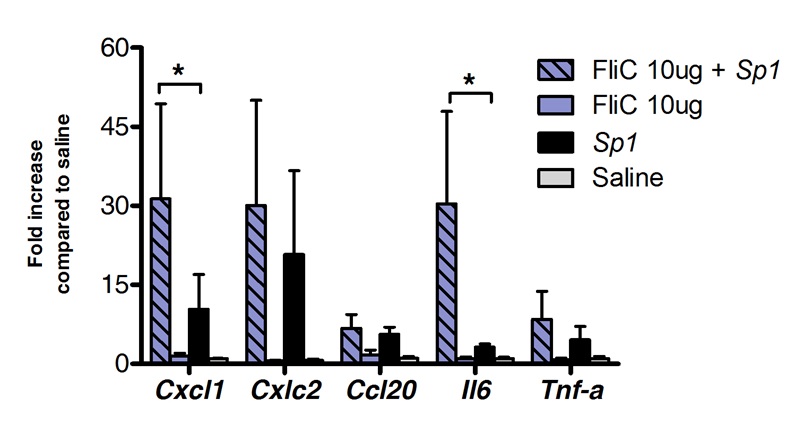
Транскрипции профиль Рисунок 2 легких "во пневмококковой пневмонии после сублингвального иммунотерапии с флагеллином восьми до 10 недель линии BALB / C мышей (п = 4 7 для контрольной группы и п = для обработанной группы). Обрабатывали 10 мкг флагеллином или физиологического раствора с помощью Сублингвальный под наркозом. 2 часа спустя мышей заражали интраназально маршрута с минимальным летальной дозой (MLD), вызывающим 100% смертность клинического изолята S. пневмонии серотип 1 E1585, соответствующий 4х10 5 КОЕ / 50 мкл. Легкие собирали через 24 часа после заражения и сохраняются в консерванта нуклеиновой кислоты до тех пор, экстракции РНК и синтез кДНК не проводились. ПЦР в реальном времени проводили (См праймера список в таблице 1) и относительной количественное была выполнена в соответствии метод & Delta; CТ используя уровни ACTB мРНК для нормализации. Результаты представлены в виде кратное увеличение по сравнению с группой, обработанной физиологическим раствором в качестве медианы ± SEM. Звездочки указывают статистически значимые различия (р <0,05), рассчитанные в соответствии с критерия Манна-Уитни.
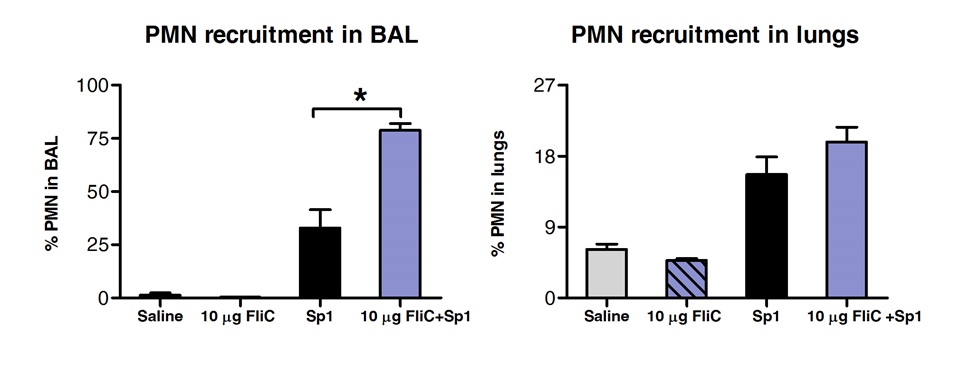
Рисунок 3 Анализ полиморфноядерных нейтрофилов (ПМН) вербовка в ткани и дыхательных путей легких "после SLIT. Восемь с10 недель линии BALB / C мышей (п = 4) обрабатывали 10 мкг флагеллином или физиологического раствора с помощью Сублингвальный под анестезией. 2 часа спустя мышей заражали по интраназально с MLD из S. пневмонии серотип 1 E1585. 24 ч после контрольного заражения, БАЛ была выполнена и легкие были обработаны для анализа FACS. ПМН были определены как Ly6G высоких / CD11b высокого / CD11c негативных клеток и на основе профиля FCS-SSC. Результаты выражены в процентах от PMN в отношении от общего количества клеток в BAL или легких. Полосы представляют медианы ± SEM. Звездочки указывают статистически значимые различия (р <0,05), рассчитанные в соответствии с односторонним Манна-Уитни.
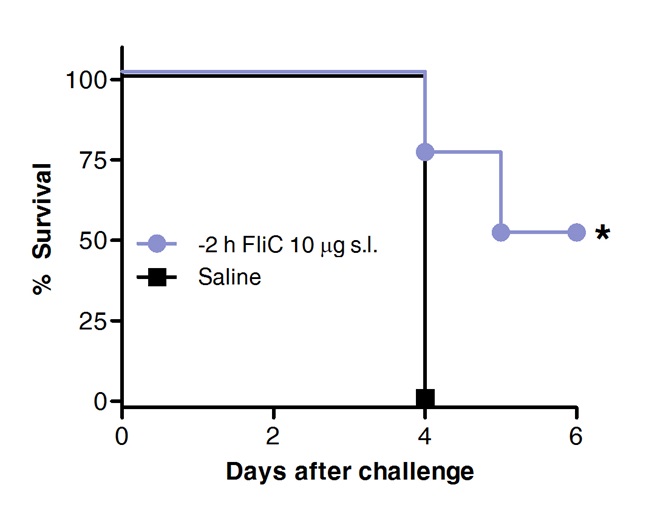
Рисунок 4 SLIT с флагеллина защищает мышей от острой пневмококковой пневмонии. От восьми до 10 недель мышей BALB / C мышей (N = 8) обрабатывали 10 мкг флагеллином или физиологического раствора с помощью Сублингвальный под наркозом. 2 часа спустя мышей заражали по интраназально с MLD из S. пневмонии серотип 1 E1585. Выживание оценивали на ежедневной основе. Кривые Каплана-Мейера по сравнению соответствии лог-рангового (каминные-Cox). Звездочки указывают статистически значимых различий (р <0,05) .Results представляют из 2 независимых экспериментов.
| Имя | Последовательность 5'-3 ' | ПЦР длина изделия (б.п.) |
| MB-actin_F | GCTTCTTTGCAGCTCCTTCGT | 68 |
| MB-actin_R | CGTCATCCATGGCGAACTG | |
| mCCL20_F | TTTTGGGATGGAATTGGACAC | 69 |
| mCCL20_R | TGCAGGTGAAGCCTTCAACC | |
| mCXCL1_F | CTTGGTTCAGAAAATTGTCCAAAA | 84 |
| mCXCL1_R | ACGGTGCCATCAGAGCAGTCT | |
| MIL-6_F | GTTCTCTGGGAAATCGTGGAAA | 78 |
| MIL-6_R | AAGTGCATCATCGTTGTTCATACA | |
| mTNFalpha_F | CATCTTCTCAAAATTCGAGTGACAA | 63 |
| mTNFalpha_R | CCTCCACTTGGTGGTTTGCT | |
| mCxcl2_F | CCCTCAACGGAAGAACCAAA | 72 |
| mCxcl2_R | CACATCAGGTACGATCCAGGC |
Таблица Список 1 Праймер используется для ПЦР в реальном времени анализа. Специфические последовательности праймеров, используемых для анализа КПЦР. Прямого и обратного праймеров для мыши ACTB, Cccl20, CXCL1, IL6, TNFA и CXCL1 представлены в виде последовательностей 5'-3 'и ожидать длина кабеля указывается в пар оснований (АД).
Обсуждение
Сублингвального введения терапевтических агентов было доказано в качестве полезного средства, чтобы модулировать иммунный ответ в дыхательных путях. Основным преимуществом прорезь для лечения респираторных заболеваний является то, что оно не связано с прямой доставки соединений в легкие или нос, чтобы быть более безопасными, чем процедуры, основанные на интраназального введения 31.
Сублингвальная иммунотерапия может быть использован для модуляции иммунного ответа по-разному, либо для индукции регуляторных реакций, которые могут смягчить симптомы аллергического воспаления и астмы 32 или вызвать временный активацию врожденного иммунитета механизмов для лечения острых легочных инфекций, как показано здесь.
Модель мыши представлены в этом видео является удобным методом для скрининга различных соединений в качестве терапевтических агентов для щели.
Эта модель животных предлагает полезные средства для определения влияниящелевой в иммунном ответе легких ", а также в других органах (например,., сливного лимфатических узлов или сайтов дистальных слизистых), которые не могут быть имитировали с помощью моделей в пробирке. Хотя есть несколько работ, которые описывают результаты, полученные с помощью сублингвального иммунотерапии, подробные методы для процедур сублингвального введения еще не были доступны. Кроме того, модель может быть использована для оценки подъязычной вакцин, направленных для придания системного, а также локальной защиты в дыхательных путях.
Как показано на прилагаемом видео, сублингвального введения соединений является простой процедурой, которая может быть легко выполнена без необходимости длительной подготовки. Как правило, человек специалистами в обработке животного потребует 1 час, чтобы выполнить щель в группе из 10 мышей с использованием инъекционных анестетиков, как описано в данном протоколе. Если пневмококковой задача выполняется, а, 90 дополнительный мин потребуется подготовитьбактериальную суспензию и выполнять интраназального заражения животных.
Протоколы FACS, представленные здесь позволяют удобное характеристику влияния щели на местном сайте администрации, осушение лимфатические узлы, а также их воздействия на динамику клеточных легких.
Отдельный анализ бронхоальвеолярного содержимого и легких паренхимы важно различать иммунную жителя и проникновения типы клеток из тех, которые остаются в тканях дыхательных путей. Анализ содержания БАЛ позволяет изучение альвеолярного оборота макрофагов, а также динамику клеток призыва в альвеолярных пространств, на различных методов лечения, например., PMNs, эозинофилов, моноцитов. БАЛ также может быть использован для оценки присутствия секретируемых цитокинов и хемокинов иммуноферментного анализа (ELISA) или обнаружения секретируемых IgA антител, вызываемых после сублингвального вакцинации. Исследование ткани легких "позволит характеристику других типов клеток, классически дендритных клеток, Т-клеток и В-клеток.
Подготовка образцов BAL и лимфатических узлов для анализа FACS проста. После отбора проб, обычно 60 мин необходимы для завершения протокол окрашивания в течение 10-20 образцов. В отличие от этого, выделение клеток из легких или сублингвального ткани требует больше времени, так как переваривание внеклеточного матрикса не требуется. Поглощение терапевтического агента поставляемого Сублингвальный может быть решена путем отслеживания флуоресцентно или радиоактивно меченых молекул с использованием в системах визуализации естественных.
Сублингвально иммунотерапия является привлекательным способом, чтобы эффективно индуцировать иммунный ответ в дыхательных путях, а также системно, которые могут быть использованы для лечения или предупреждения респираторных заболеваний. Выяснения механизмов, определяющих активацию против толерантности иммунной реакции в дыхательных путях после РАЗРЕЗА IS важно, чтобы рациональной разработки новых терапевтических стратегий, которые могут быть использованы отдельно или в сочетании с известными процедурами в отношении различных респираторных заболеваний.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We acknowledge Dr. Jean-Claude Sirard from the Center for Infection and Immunity of Lille, Institute Pasteur de Lille-France, for kindly providing the purified flagellin and Dr. Teresa Camou, Director of the National Reference Laboratory, Ministry of Health of Uruguay for kindly providing the pneumococcal strain.
The authors would like to express their acknowledgement to Mr. Diego Acosta and Mr. Ignacio Turel form BichoFeo Producciones-Uruguay for their commitment and hard work during the entire video production and edition.
This work was supported by the grants PR_FCE_2009_1_2783 and BE_POS_2010_1_2544 from the National Agency of Research and Innovation, ANII from Uruguay, the Program for Development of Basic Sciences, PEDECIBA of Uruguay and Sectoral Commission of Scientific research, CSIC-Universidad de la República, Uruguay.
Материалы
| Name | Company | Catalog Number | Comments |
| Ketamine solution (50 mg/ml) | Pharma Service, Uruguay | ||
| Xilacine solution (2 %) | Portinco S.A., Uruguay | ||
| Sterile 1 ml syringe | Modern, Uruguay | ||
| Sterile 27 G needle | Modern, Uruguay | ||
| RPMI 1640 | General Electric Health Care | E15885 | |
| Fetal Bovine Serum | ATCC | 302020 | |
| Penicillin/Streptomycin Solution | SIGMA | P4333 | |
| Sterile PBS without Ca2+/Mg2+ | PAA | H21002 | |
| Type-I Collagenase | Life Technologies/Gibco | 17100017 | |
| Deoxyribonuclease I (DNAse-I) | SIGMA | D4513 | |
| Dispase | Life Technologies/Gibco | 17105041 | |
| PerCP-Cy5.5 conjugated rat anti mouse IgG2b anti CD11b | BD | 550993 | Clone M1/70 |
| APC conjugated hamster anti mouse IgG1 anti CD11c | BD | 550261 | Clone HL3 |
| APC-Cy7 conjugated rat anti mouse IgG2a anti Ly6G | BD | 560600 | Clone 1A8 |
| Sterile Saline Solution | Laboratorio Farmaco Uruguayo, Uruguay | ||
| Tryptic Soy Agar | BD Difco, France | 236950 | |
| Defibrinated Sheep Blood | Biokey, Uruguay | ||
| Sterile Petri Dishes | Greiner | 633180 | |
| p10 Pipette | Gilson | F144802 | |
| p20 Pipette | Eppendorf | 3120000097 | |
| p200 Pipette | Gilson | F123601 | |
| p200 Pipette | Capp | C200 | |
| p200 Pipette | Eppendorf | 3120000054 | |
| p1000 Pipette | Eppendorf | 3120000062 | |
| Sterile Filter Tips p10 | Greiner | 771288 | |
| Sterile Filter Tips p200 | Greiner | 739288 | |
| Sterile Filter Tips p1000 | Greiner | 750288 | |
| Vortex | BIOSAN | V1-plus | |
| Stainless steel fine tip forceps | SIGMA | Z168785/Z168777 | Curved and straight |
| Dressing tissue forceps | SIGMA | F4392 | Length 8 inches |
| Micro-dissecting forceps | SIGMA | F4017 | Straight |
| Micro-dissecting forceps | SIGMA | F4142 | Curved |
| Mayo Scissors | SIGMA | Z265993 | |
| Scalpel | SAKIRA MEDICAL | ||
| Sterile Biopsy Punch Ø 3mm | Stiefel Laboratories Ltd. | 2079D | 5 mm diameter can also be used |
| Sterile 1.5 ml Tubes | Deltalab | 200400P | |
| Sterile 15 ml Tubes | Greiner | 188271 | |
| Sterile 50 ml Tubes | Greiner | 227261 | |
| Sterile serological pipettes 5 ml | Greiner | 606160 | |
| Sterile serological pipettes 10 ml | Greiner | 607160 | |
| Sterile serological pipettes 25 ml | Greiner | 760180 | |
| Biological safety cabinet, class II | Thermo Scientific | 1300 series, type A2 | |
| Micro-Isolator Rack | RAIR IsoSystem | 76144W | Super Mouse 1800 AllerZone |
| Refrigerated Microcentrifuge | Eppendorf | Legend Micro 21R | |
| Microcentrifuge | Heraeus | Biofuge-pico | |
| Centrifuge | Thermo Scientific | Sorval ST40R | |
| CO2 Incubator | Thermo Scientific | Model 3111 | |
| Sterile Thin-tip pasteur pipettes | Deltalab | D210022 | |
| Sterile pasteur pipettes | Deltalab | 200007 | |
| Sterile 24-well plate | Greiner | 662160 | |
| Trypan Blue Solution | Life Technologies | T10282 | |
| Automatic Cell Counter - Countess | Life Technologies | C10227 | |
| Countess Cell Counting Chamber Slides | Life Technologies | C10312 | |
| Flow Cytometry Tubes | BD | 343675 | |
| Flow Cytometer - FACS Canto-II | BD | ||
| Real Time PCR Instrument - Rotor Gene Q or ABI 7900 | Qiagen / Applied Biosystems | ||
| Trizol Reagent | Life Technologies | 15596-026 | Molecular Biology Grade |
| DNAse-I | Life Technologies | 18068-015 | Molecular Biology Grade |
| DNAse-I Buffer 10X | Life Technologies | 18068015 | Molecular Biology Grade |
| EDTA 25 mM | Life Technologies | 18068015 | Molecular Biology Grade |
| Ultra-Pure Water | Life Technologies | 10977 | Molecular Biology Grade |
| RNAse Out | Life Technologies | 100000840 | Molecular Biology Grade |
| Random Hexamer Primers | Life Technologies | N8080127 | Molecular Biology Grade |
| M-MLV-RT buffer | Life Technologies | 18057-018 | Molecular Biology Grade |
| M-MLV-RT enzime | Life Technologies | 28025-021 | Molecular Biology Grade |
| QuantiTect Syber Green PCR Kit | Qiagen | 204143 | Molecular Biology Grade |
| Specific primers | Life Technologies | Molecular Biology Grade |
Ссылки
- . Pneumococcal vaccines WHO position paper--2012. Weekly Epidemiological Record. 14, 129-144 (2012).
- Appelbaum, P. C., et al. Carriage of antibiotic-resistant Streptococcus pneumoniae by children in eastern and central Europe-a multicenter study with use of standardized methods. Clin Infect Dis. 23, 712-717 (1996).
- Ramirez, J. A., Anzueto, A. R. Changing needs of community-acquired pneumonia. J Antimicrob Chemother. 66, 3-9 (2011).
- Cuburu, N., et al. Sublingual immunization induces broad-based systemic and mucosal immune responses in mice. Vaccine. 25, 8598-8610 (2007).
- Pedersen, G. K., et al. Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP. PLoS One. 25, 1-12 (2011).
- Song, J. H., et al. Sublingual vaccination with influenza virus protects mice against lethal viral infection. Proc Natl Acad Sci USA. 105, 1644-1649 (2008).
- Cogo, R., Ramponi, A., Scivoletto, G., Rippoli, R. Prophylaxis for acute exacerbations of chronic bronchitis using an antibacterial sublingual vaccine obtained through mechanical lysis: a clinical and pharmacoeconomic study. Acta Biomed. 74, 76-87 (2003).
- Rosaschino, F., Cattaneo, L. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination with sublingually administered Polyvalent Mechanical Bacterial Lysates (PMBL). Acta Biomed. 75, 171-178 (2004).
- Senna, G., Caminati, M., Canonica, G. W. Safety and tolerability of sublingual immunotherapy in clinical trials and real life. Curr Opin Allergy Clin Immunol. 13, 656-662 (2013).
- Mascarell, L., et al. Oral dendritic cells mediate antigen-specific tolerance by stimulating TH1 and regulatory CD4+ T cells. J Allergy Clin Immunol. 122, 603-609 (2008).
- Mascarell, L., et al. Mapping of the lingual immune system reveals the presence of both regulatory and effector CD4+ T cells. Clin Exp Allergy. 39, 1910-1919 (2009).
- Mascarell, L., et al. Oral macrophage-like cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice. Mucosal Immunology. 4, 638-647 (2011).
- Hervouet, C., et al. Antigen-bearing dendritic cells from the sublingual mucosa recirculate to distant systemic lymphoid organs to prime mucosal CD8 T cells. Mucosal Immunology. 7, 280-291 (2014).
- Munoz, N., et al. Mucosal administration of flagellin protects mice from Streptococcus pneumoniae lung infection. Infect Immun. 78, 4226-4233 (2010).
- Hayashi, F., et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature. 410, 1099-1103 (2001).
- Lightfield, K. L., et al. Critical function for Naip5 in inflammasome activation by a conserved carboxy-terminal domain of flagellin. Nature Immunology. 9, 1171-1178 (2008).
- Lightfield, K. L., et al. Differential requirements for NAIP5 in activation of the NLRC4 inflammasome. Infect Immun. 79, 1606-1614 (2011).
- Honko, A. N., Mizel, S. B. Mucosal administration of flagellin induces innate immunity in the mouse lung. Infect Immun. 72, 6676-6679 (2004).
- Janot, L., et al. Radioresistant cells expressing TLR5 control the respiratory epithelium's innate immune responses to flagellin. Eur J Immunol. 39 (6), 1587-1596 (2009).
- Van Maele, L., et al. TLR5 signaling stimulates the innate production of IL-17 and IL-22 by CD3(neg)CD127+ immune cells in spleen and mucosa. J Immunol. 185, 1177-1185 (2010).
- Lee, S. J., et al. Neurologic adverse events following influenza A (H1N1) vaccinations in children. Pediatrics international: official journal of the Japan Pediatric Society. 54, 325-330 (2012).
- Lewis, D. J., et al. Transient facial nerve paralysis (Bell's palsy) following intranasal delivery of a genetically detoxified mutant of Escherichia coli heat labile toxin. PLoS One. 4, e6999 (2009).
- Mutsch, M., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 350, 896-903 (2004).
- Kuo, C. H., Wang, W. L., Chu, Y. T., Lee, M. S., Hung, C. H. Sublingual immunotherapy in children: an updated review. Pediatr Neonatol. 50, 44-49 (2009).
- Nempont, C., Cavet, D., Rumbo, M., Bompard, C., Villeret, V., Sirard, J. C. Deletion of flagellin's hypervariable region abrogates antibody-mediated neutralization and systemic activation of TLR5-dependent immunity. J. Immunol. 181, 2036-2043 (2008).
- Marques, J. M., et al. Protection against Streptococcus pneumoniae serotype 1 acute infection shows a signature of Th17- and IFN-gamma-mediated immunity. Immunobiology. 217, 420-429 (2012).
- Stewart, C. C., Stewart, S. J., et al. Titering antibodies. Current Protocols in Cytometry. 4, Unit 4.1 (2001).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125 (2006).
- Pedersen, G., Cox, R. The mucosal vaccine quandary: intranasal vs. sublingual immunization against influenza. Human Vaccines & Immunotherapeutics. 8, 689-693 (2012).
- Vitaliti, G., et al. Mucosal immunity and sublingual immunotherapy in respiratory disorders. Journal of Biological Regulators and Homeostatic Agents. 26, S85-S93 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены