Method Article
Análisis para el Desarrollo de los cardiomiocitos mediante inmunofluorescencia en el corazón de embriones de ratón
En este artículo
Resumen
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Resumen
Durante el desarrollo del corazón, la generación de unidades estructurales y funcionales de miocardio específico incluyendo sarcómeros, miofibrillas contráctiles, discos intercalares y costameres requiere el montaje coordinada de múltiples componentes en tiempo y espacio. La interrupción en el montaje de estos componentes conduce a defectos en el corazón del desarrollo. Técnicas de tinción de inmunofluorescencia se utilizan comúnmente en cultivos de cardiomiocitos para sondear la maduración de las miofibrillas, pero este enfoque ex vivo está limitada por el grado en que los miocitos se diferencian completamente en la cultura, la falta de entradas mecánicas normales in vivo, y la ausencia de señales endocárdico. Aplicación de técnicas de inmunofluorescencia para el estudio de desarrollo de corazón de ratón es deseable pero técnicamente más difícil, y los métodos a menudo carecen de sensibilidad y resolución suficiente para visualizar los sarcómeros en las primeras etapas del desarrollo del corazón. Aquí se describe un método robusto y reproducible para co-immunostain muproteínas ltiple o para co-visualizar una proteína fluorescente con la tinción de inmunofluorescencia en el corazón embrionario del ratón y utilizan este método para analizar las miofibrillas en desarrollo, discos intercalares y costameres. Este método se puede aplicar más para evaluar cardiomiocitos cambios estructurales causados por mutaciones que conducen a defectos en el corazón del desarrollo.
Introducción
Durante el desarrollo, las contracciones del corazón comienzan poco después de cardiomiocitos migran a la línea media y forman el 1,2 tubo cardíaco lineal. El sarcómero es la unidad contráctil básica dentro de los cardiomiocitos; esta estructura del citoesqueleto altamente organizada contiene filamentos de actina anclados a la Z-disco por sarcoméricas α-actinina (s-α-actinina) y las fibras de miosina anclados a la línea M (Figura 1). Como el cardiomiocito madura, sarcómeros se reúnen en serie para formar miofibrillas que se extienden a través de la célula. Las miofibrillas están anclados a los extremos de los cardiomiocitos por el disco intercalado, la estructura de la unión célula-célula que contiene un cruce de transición con un subconjunto de elementos de Z-discos, como s-α-actinina 3, adherens proteínas de unión, tales como N-cadherina y catenina β, proteínas de unión brecha, y desmosomas (Figura 1) 4. A lo largo de la membrana longitudinal, los Z-discos de miofibrillas periféricas tambiénadjuntar a la membrana celular a través de costameres; estas adhesiones focales especializados proporcionan un anclaje entre la miofibrilla, membrana plasmática, y la matriz extracelular para proporcionar soporte estructural adicional a la de los cardiomiocitos (Figura 1) 4. Temprano en el desarrollo del corazón, los cardiomiocitos se disponen en proyecciones similares a dedos llamadas trabéculas que sobresalen en el espacio ventricular y contienen miofibrillas relativamente maduros 5. A medida que avanza el desarrollo del corazón, los cardiomiocitos en la región sub-epicárdica proliferan para formar el miocardio compacto que comprende las paredes ventriculares, pero sarcómero y montaje miofibrilla se retrasó en comparación con el miocardio trabecular 5,6.
Modelos de sarcómero y montaje miofibrilla provienen en gran parte de los estudios de inmunofluorescencia en cultivos de cardiomiocitos 7-10, que son sencillas, pero carecen de un entorno tridimensional, el flujo sanguíneo, y los contactos con otra célula cardíacas presente en vivo. de alta resolución estudios estructurales mediante inmunofluorescencia en el corazón embrionario del ratón son técnicamente difícil, y pocos estudios han explorado la aparición de los discos intercalares y costameres durante ratón desarrollo cardíaco. La proteína de unión adherente β catenina aparece para localizar a los discos intercalados por día embrionario (E) 17,5 11, N-cadherina se localiza en estructuras lineales que pueden representar intercalado discos de E18.5 12 frente a 13 días después del parto 0, y costameres hayan comprobado en E18.5 14, pero estas proteínas muestran la distribución de la membrana difusa y más continua en momentos anteriores del desarrollo 11-13.
Aquí se describe un método sencillo y reproducible para la inmunotinción y microscopía de fluorescencia de ratón seccionado corazones embrionarias que permite el análisis detallado de las miofibrillas y el desarrollo de los cardiomiocitos, incluida la aparición de Intercalated Discos que tan pronto como E12.5 y costameres nacientes en E16.5. Este protocolo puede ser útil para sondear los efectos de las mutaciones sobre la formación del sarcómero, así como las miofibrillas y cardiomiocitos maduración.
Protocolo
NOTA: Todos los procedimientos experimentales fueron aprobados por el Comité de Cuidado de Animales y el empleo UCSF Institucional.
1. La crioconservación y Fijación de embrionarios corazones de ratón.
1.1) Snap-congelación corazones embrionarias
- Llenar un 3,5 cm Placa de Petri y 7 mm criomoldes con temperatura óptima de corte (OCT) medio (ver Materiales Tabla). En una campana química, enfriar 2-metilbutano en nitrógeno líquido.
- Dispensar 30 ml de salina tamponada con fosfato (PBS) en 10 platos petri cm, 10 ml de PBS en 3,5 cm petri platos y colocar todos los platos petri en hielo. Preparar una placa de 10 cm y varios 3,5 cm de platos por ratón embarazada.
- Aislar embriones como se describió anteriormente 15, la realización de la disección en PBS enfriado con hielo.
- En pocas palabras, la eutanasia a la hembra embarazada que usa CO 2 narcosis y dislocación cervical.
- Hacer una incisión en el abdomen, diseccionar el útero mediante la reducción de los vasos along de la curvatura interior del útero, el útero y transferir a una placa de Petri de 10 cm que contiene PBS enfriado con hielo.
- Cortar el útero entre cada embrión y la transferencia a un 3,5 cm placa de Petri individual que contiene PBS enfriado con hielo. Aislar cada embrión como se describe 15.
- Abrir la cavidad pericárdica utilizando unas pinzas finas, quitar el corazón lejos de los pulmones y la vasculatura por el corte en la aorta, vena cava inferior, y las venas pulmonares, y transferir a la placa de Petri 3,5 cm que contiene octubre
- Deja que el corazón se equilibre en octubre durante varios segundos, y luego transferir el corazón en el molde 7 mm que contiene octubre Orientar la pared anterior del corazón a la parte inferior del molde.
- Con cuidado, coloque el molde en líquido 2-metilbutano enfriado con nitrógeno. Tenga cuidado de no permitir que el líquido 2-metilbutano toque el octubre o el corazón. Congele hasta que el OCT es sólido de color blanco, a continuación, transferir el molde para un cubo de hielo que contiene hielo seco. Pasar a la siguiente embrión.
- Wrap criomoldes en papel de aluminio y se almacena a -80 ° C hasta el momento de cryosectioning.
1.2) Alternativa: paraformaldehído (PFA) de fijación, crioprotector y octubre incrustar corazones embrionarias
- Llenar los pocillos de una placa de cultivo tisular de 12 pocillos con 4% de PFA en PBS 1x.
- Diseccionar los corazones embrionarios como se describe en 1.1.3. Coloque cada corazón en un pozo que contiene 4% PFA y fijar a 4 ° CO / N.
- Crioprotección: utilizando una pipeta de transferencia de plástico, mover cada corazón a un tubo de microcentrífuga de 1,5 ml que contiene 1,5 ml de 15% de sacarosa en PBS y agitar suavemente a 4 ° C hasta que el corazón se hunde hasta el fondo del tubo (varias horas a O / N ). Transferir cada corazón a un tubo de microcentrífuga de 1,5 ml que contiene 1,5 ml de 30% de sacarosa en PBS y agitar suavemente a 4 ° C de nuevo hasta que el corazón se hunde hasta el fondo del tubo (varias horas a O / N).
- Con una pipeta de transferencia de plástico, coloque el corazón cryoprotected en octubre y dejar reposar y estabilizardurante varios minutos para eliminar el exceso de sacarosa, a continuación, transferir el corazón en el molde 7 mm que contiene octubre Orientar la pared anterior del corazón a la parte inferior del molde.
- Congelar el corazón en OCT colocando el molde en cualquiera enfriado con nitrógeno 2-metilbutano líquido o hielo seco.
- Envuelva criomoldes en papel de aluminio y se almacena a -80 ° C hasta el momento de cryosectioning.
2. cryosectioning
- Ajuste la temperatura del criostato a -17 ° C.
- Lugar criomoldes en la cámara de criostato y alcance la temperatura de 15 a 20 min.
- Invierta el criomolde y utilizar una suave presión para expulsar el bloque de corazón del molde. Orientar la pared anterior del corazón a la parte superior del bloque de tejido moldeado.
- Coloque una gota grande de octubre en el mandril, y montar el bloqueo cardíaco en la caída de octubre de congelar en el mandril. Mantener la orientación tal que la pared anterior del corazón está más alejado del mandril.
- Cargue el mandril y montado élarte bloque en el soporte objeto criostato. Ajuste de modo que el ángulo de la cuchilla es de 3-5 ° respecto a la muestra.
- Recoger 10 micras secciones en portaobjetos de microscopio que han sido pre-tratadas con un recubrimiento cargado positivamente (ver Tabla de Materiales). Deje que se seque completamente antes de guardar a -80 ° C.
3. La inmunofluorescencia
- Por secciones snap-congelados, fijar y permeabilizar el tejido en acetona durante 10 minutos en una campana de extracción a temperatura ambiente.
- Para las secciones snap-congelados y fijos-PFA, se incuban en PBS-0,1% de Triton X-100 durante 20 min para eliminar PTU y para permeabilizar secciones fijas-PFA.
- Bloquear durante 45 min en tampón de bloqueo 1x, diluido en PBS.
- Si se utiliza un anticuerpo primario generado en ratón, incubar en burro o de cabra anti-ratón IgG (H + L) fragmento Fab monovalente diluido 1: 100 en PBS-0,1% de Tween 20 durante 45 min a RT (ver Discusión).
- Incubar en anticuerpo primario o anticuerpos diluido en tampón de bloqueo 1x durante 2 horas a RT oO / N a 4 ° C (véase la Tabla de Materiales / Equipo para diluciones específicas).
- Lavar secciones en 1X PBS tres veces durante 10 min a TA.
- Incubar en Alexa Fluor anticuerpo secundario conjugado diluido 1: 500 en tampón de bloqueo durante 2 horas a RT, protegido de la luz.
- Lavar secciones en 1X PBS tres veces durante 10 min a TA, protegido de la luz.
- Opcional: Incubar en colorante Hoechst diluido 1: 2000 en PBS a RT (protegido de la luz) para etiquetar los núcleos, luego enjuague con PBS.
- Post-fix etiquetado secciones en 1% PFA durante 1 min a TA.
- Monte desliza en un medio anti-fade (con DAPI si los núcleos no están ya etiquetados) mediante la colocación de dos gotas de medio en cada extremo de la corredera y luego cubrir con un cubreobjetos. Sello cubreobjetos con esmalte de uñas. Almacenar protegido de la luz a 4 ° C hasta el momento de la imagen.
4. Confocal de imágenes y análisis de imágenes
- Encienda las longitudes de onda apropiadas láser, cámara y confocal inc microscopioLuding motor escenario y motor z. El lanzamiento del programa de software de imágenes. Utilice los 405, 488, y 561 longitudes de onda láser para obtener imágenes de las secciones 568-manchados Hoechst-, Alexa 488 y Alexa, respectivamente.
NOTA: Consulte la Tabla de materiales para nuestras especificaciones de hardware y software. - Montar la corredera de control (cubreobjetos fuera de servicio por un microscopio invertido) en el escenario de diapositivas.
- Utilizando el objetivo 4X (ver Tabla de Materiales), encontrar la muestra y el área de interés. Capture la imagen para usar como un mapa cuando la formación de imágenes a gran aumento.
- Retire la tapa, haciendo ajustes mínimos a la etapa de diapositivas. Cambie al objetivo de inmersión en aceite de 60x (ver Tabla de Materiales), coloque una pequeña gota de aceite en el objetivo, y reemplazar la corredera (cubreobjetos hacia abajo) en el escenario de diapositivas.
- Encuentra muestra de nuevo. Ajustar la potencia del láser, tiempo de exposición, y binning a los niveles deseados para cada canal.
NOTA: Utilizamos generalmente la potencia del láser de 0,8, el tiempo de exposición de la cámara de 100 ms, y hurgar en la basura de 2 (see Tabla de Materiales para las especificaciones de hardware y software); ajustes óptimos deben determinarse empíricamente para cada experimento.- Una vez determinados los valores óptimos, utilizar la misma configuración para todos los cortes de tejido dentro del experimento. Utilice el histograma de intensidad observar la gama de intensidad óptima para cada canal (esta información se utilizó para el análisis).
- Generar pila az utilizando la función de adquisición: seleccionar los canales apropiados láser, a continuación, seleccione los límites superior e inferior de la pila de z. Elegir tamaño az paso de pila que es la mitad del valor de la rebanada de espesor óptico proporcionado por el software. Haga clic en "Ejecutar" para recoger las imágenes.
- Utilice Fiji 16 o un programa similar para el análisis de imágenes. En Fiji, abra el archivo de pila z con opción de modo de color de encargo y los canales divididos en ventanas separadas. Abra el "Ajuste de Brillo / Contraste" herramienta de la Imagen pulldown menú; dentro de cada canal, set el rango óptimo de intensidad histograma determina en 4.5.1. Aplicar estos rangos de canal para todas las pilas de z que se analiza.
- Combinar los canales individuales en una sola imagen compuesta utilizando Imagen-> menú desplegable de colores.
- Crear una pila z aplanado de la imagen compuesta usando la Imagen-> Stacks-> menú proyecto z. Esta imagen será mucho más brillante la imagen 3D que; ajustar el rango de intensidad histograma para la muestra de control para evitar la sobresaturación, y aplicar la misma configuración a la experimental aplanado pila z.
- Para generar una imagen en 3D, utilice primero la Imagen-> Stacks-> menú de proyectos en 3D 17. Elija el eje x o y-eje de rotación. Establecer el espaciado rebanada como el mismo número de micras como el tamaño de paso pila z. Elija la rotación total deseada y establecer el incremento del ángulo de rotación a 1. A continuación, abra la imagen J Visor 3D de los plugins del menú desplegable. Elija la imagen compuesta generada en 4.8, pantalla como volumen, y establecer el Remuestreo factor a 1 o 2.
Resultados
Las Figuras 2 a 6 muestran los resultados típicos para co-tinción de proteínas diferentes en un corazón snap-congelado y fijado con acetona. El anticuerpo contra la s-α-actinina Z-discos reproducible etiquetados y discos intercalados con alta especificidad y el fondo mínimo (Figuras 2A, 3A, 4A, 5A, 6A y 6C); la Figura 6 demuestra que el anti-ratón IgG (H + L) fragmento Fab monovalente bloquea eficazmente ratón endógeno unión de IgG anti-ratón de anticuerpos secundarios. El anticuerpo contra la proteína de unión adherente β catenina une la membrana de ambos cardiomiocitos y células no cardiomiocitos, y co-localización con s-α-actinina ocurrió en discos intercalados presuntos en E16.5 (Figura 2C y D), como se espera de la patrón de tinción catenina β en el corazón adulto 18. β1 integrina inmunofluorescencia en el corazón embrionario es especialmente difícil y, a menudo no logra identificar las adhesiones focales 14, pero β1 integrina tinción en estos estudios reveló señal con la misma periodicidad que Z-discos s-α-actinina marcado, posiblemente reflejando costameres nacientes que forman en E16.5 (Figura 3D).
En E12.5, s-α-actinina y tropomiosina (proteína filamento delgado sarcómero) inmunofluorescencia reveló un patrón de tinción con periodicidad regular en cardiomiocitos trabecular consistentes con miofibrillas maduros en estas células (Figuras 4A y 5A para s-α-actinina; Figura 4B para tropomiosina). Tinción N-cadherina en cardiomiocitos trabecular en corazones E12.5 tendía a colocalize con áreas de tinción s-α-actinina intensa (Figura 5 B - D y la Figura 6A - C) posiblemente representan intercalado discos. Encontraste con los miocitos trabeculares, s-α-actinina en la zona compacta era más puntiforme que lineal, y la tinción fue difusa tropomiosina en lugar de lineal (Figura 4A y 4B). Por lo tanto, el montaje del sarcómero puede ocurrir más tarde en compacto en comparación con el miocardio trabecular. Además, los patrones diferenciales de s-α-actinina y tropomiosina en la zona compacta sugieren que el S-α-actinina organiza en puntos lagrimales y inmaduras Z-discos primeros, mientras que tropomiosina incorporación en el filamento delgado puede ser un acontecimiento posterior en el montaje de las miofibrillas.
Figura 7, Película 1 y Movie 2 demuestran los resultados típicos de un E12.5 corazón embrionario fijo-MF. En estos ejemplos, un embrión transgénico LifeAct-RFPruby se utiliza para la formación de imágenes; el transgén LifeAct-RFPruby 19 etiquetas de actina filamentosa pero requiere PFA fijación. Z-discos etiquetados con s-α-actinina eran fáciles de visualizar en la mayoría de las áreas, pero la relación señal-ruido era Decre Ased comparación con snap-congelados secciones del corazón (Figura 7A); esta señal era la típica de inmunofluorescencia s-α-actinina en tejido fijado-MF, en el que los epítopos pueden estar enmascarados por la proteína enlaces cruzados. Figura 7B muestra co-visualización de actina filamentosa y immunolabeled s-α-actinina dentro miofibrillas (puntas de flecha) y actina filamentosa dentro de las células endocárdicas adyacentes a los miocitos trabeculares (flechas). Tridimensional de reconstrucción de imagen reveló detalles adicionales: cardiomiocitos individuales fueron más fáciles de discernir, miofibrillas dentro de un cardiomiocitos fueron más o menos paralelas entre sí, pero los cardiomiocitos individuales se orientan en ángulos diferentes entre sí (Figura 7C y D, Película 1 y Película 2 ). La aproximación entre las células del endocardio y cardiomiocitos se aprecia mejor en las vistas tridimensionales también.
">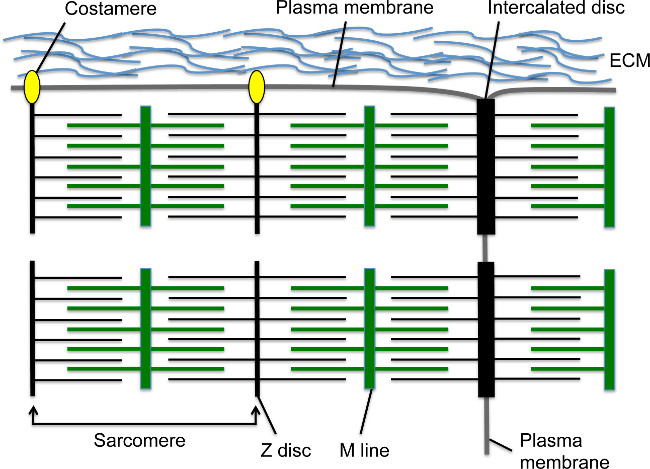
Figura 1. sarcómeros cardiomiocitos, discos intercalares y costameres. El disco Z anclas filamentos de actina, mientras que la línea M ancla fibras de miosina, que se superponen a los filamentos de actina. El sarcómero comprende un disco Z - línea M - unidad Z-disco. Múltiples sarcómeros en serie crean una miofibrilla. El extremo lateral de la miofibrilla se inserta en la frontera transversal de los cardiomiocitos en una estructura de unión célula-célula especializada llamada el disco intercalado. Miofibrillas periféricos se conectan a la membrana plasmática de los cardiomiocitos longitudinal a través costameres, que forman adhesiones focales con la matriz extracelular entre los cardiomiocitos. Por favor, haga clic aquí para ver una versión más grande de esta figura.
pload / 52644 / 52644fig2.jpg "/>
Figura 2. s- α-actinina y β catenina inmunofluorescencia en el día embrionario 16,5. El corazón se extirpó, se congelaron rápidamente, cryosectioned, fijado con acetona, y se inmunotiñeron usando (A) clon de anticuerpo monoclonal de ratón contra EA53 s-α-actinina, que imágenes cardiomiocitos etiquetado Z-disco y discos intercalares, y (B) de conejo de anticuerpos contra la proteína polycloncal unión adherente β catenina. (C) Fusionada muestran s-α-actinina y tinción catenina β. (D) ampliada área de interés del grupo C ; marca asteriscos presume discos intercalados con co-localización de s-α-actinina y catenina β. Las imágenes se obtuvieron de la pared ventricular izquierda periférica o miocardio compacta, con la capa epicárdica en la parte superior izquierda de los paneles AC. Histograma Intensidad rango de visualización 460-1600 (fuera of posible 0-65535) tanto para las s-α-actinina / 488 nm y β catenina / canales 561 nm láser. Barra de escala 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
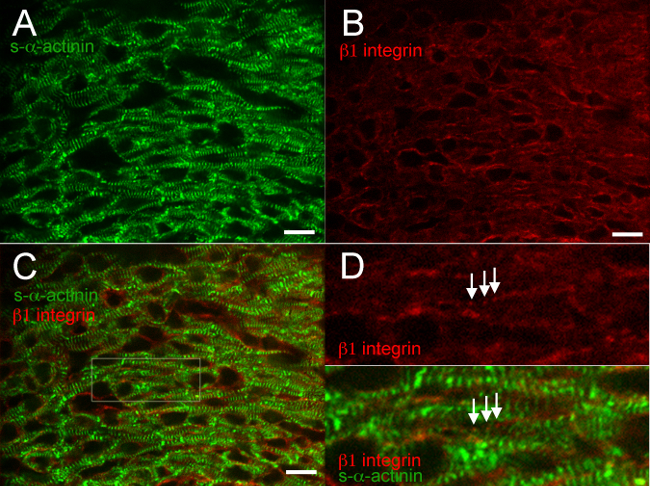
Figura 3. s- α-actinina y β inmunofluorescencia 1 integrina en el día embrionario 16,5. El corazón se extirpó, se congelaron rápidamente, cryosectioned, fijado en acetona, y se inmunotiñeron usando (A) clon de anticuerpo monoclonal de ratón contra EA53 s-α-actinina y anticuerpos (B) de cabra policlonal contra la proteína de adhesión focal β1 integrina. (C) se fusionaron imágenes muestran la integrina β1 en los cardiomiocitos, así como las células no cardiomiocitos. Nota tanto difusa ypuntiforme β1 integrina señal en cardiomiocitos (D) área de interés desde el panel C. Nota punteada, tinción integrina β1 periódica (flechas) con periodicidad similar a la cercana s-α-actinina-tinción en Z-discos ampliada.; estas estructuras pueden representar costameres. Las imágenes se obtuvieron a partir del miocardio ventricular izquierda compacto. Histograma Intensidad rango de visualización 460-1200 (de posible 0-65535) para el / 488 canal láser nm s-α-actinina y 460-600 para el canal nm láser β1 integrina / 561. Barra de escala 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
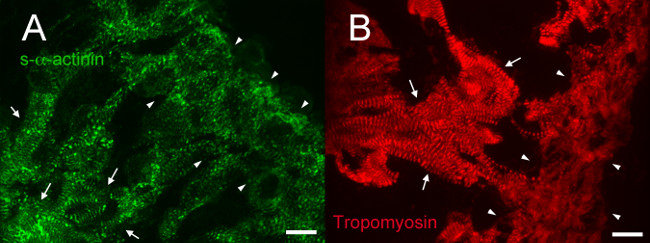
Figura 4. s- α-actinina e inmunofluorescencia tropomiosina en el día embrionario 12.5: organización miofibrillas en trabecular y el miocardio compacto. Corazones de embriones littermate se extirparon, se congelaron rápidamente, cryosectioned, fijos-acetona, y se inmunotiñeron usando (A) clon de anticuerpo monoclonal de ratón contra EA53 s-α-actinina y (B) del anticuerpo monoclonal de ratón contra la miofibrilla filamento delgado tropomiosina proteína (Estudios del Desarrollo del Banco hibridoma CH1). Trabecular (flechas) y miocardio compacto (puntas de flecha) se indican. Nota tinción s-α-actinina lineal con periodicidad regular en el miocardio trabecular, en comparación con una variedad de patrones de tinción incluyendo puntos lagrimales, así como tinción lineal en la capa compacta (A). Tenga en cuenta también la tinción tropomiosina lineal con periodicidad regular en el miocardio trabecular pero tinción más difusa en el miocardio compacto. Histograma Intensidad rango de visualización 460-1,400 (de posible 0-65535) para el canal de s-α-actinina y 460-1,000 para el canal de la tropomiosina. Barra de escala 10 micras.Objetivo "https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
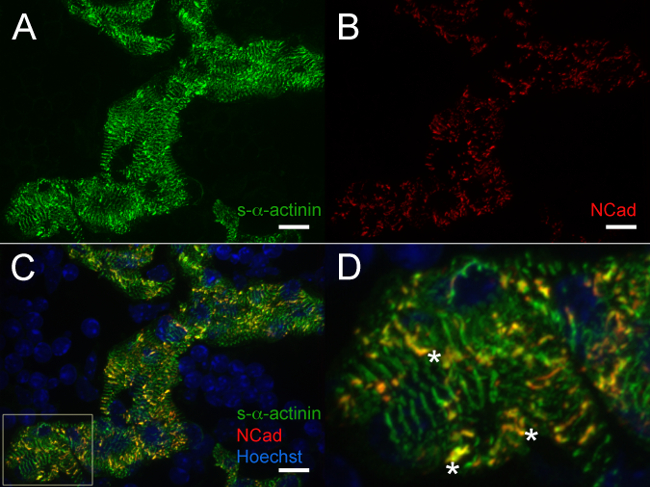
Figura 5. s- α-actinina y la inmunofluorescencia N-cadherina en el día embrionario 12,5:. Miofibrillas y discos intercalados en cardiomiocitos trabeculares se extirpó el corazón, se congelaron rápidamente, cryosectioned, fijado en acetona, y se inmunotiñeron usando (A) clon monoclonal de ratón EA53 anticuerpo contra s-α-actinina y el anticuerpo policlonal (B) de conejo contra la proteína de adhesión focal N-cadherina. 0.2 micras rodajas ópticos fueron recolectados como pila az y pilas z fueron aplanados para generar las imágenes. (C) fusionadas pilas aplanados muestran tanto la N-cadherina y tinción s-α-actinina en cardiomiocitos trabecular como wcom o núcleos marcados con colorante Hoechst (D) ampliadas área de interés desde el panel C.; asteriscos marcan los discos intercalados con co-localización de s-α-actinina y N-cadherina. Histograma Intensidad rango de visualización 470-1,200 (de posible 0-65535) para el / 405 canal nm láser Hoechst y 470-2,000 tanto para el s-α-actinina / 488 nm y N-cadherina / 561 canales láser nm. Barra de escala 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
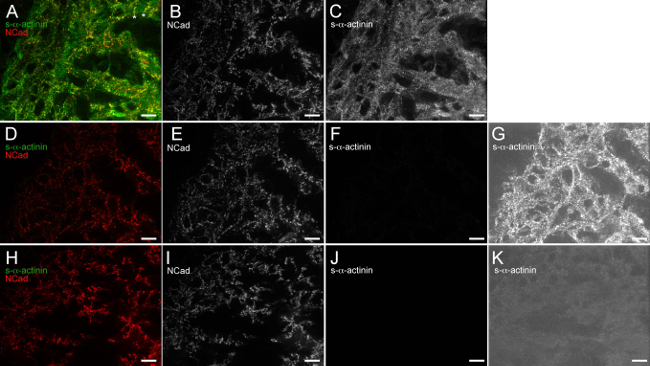
Figura anti-IgG de ratón 6. (H + L) fragmento Fab monovalente bloquea eficazmente ratón endógeno vinculante por anti-ratón secundaria de anticuerpos IgG. La E12.5 corazón embrionario fue extirpada, broche de congelados, cryosectioned, fija-acetona y inmunoteñidas. (Ac) Secciones fueron bloqueadas con tampón de bloqueo 1x seguido por fragmento de anti-IgG de ratón monovalente Fab, expuesto a clon monoclonal de ratón EA53 anticuerpo primario contra la s-α-actinina y policlonal de conejo anticuerpo primario contra la N-cadherina, se lavó, y se expone Alexa Fluor 488 anti-ratón y Alexa Fluor 586 anti-conejo anticuerpos secundarios. (A) Imagen Fusionada usando histograma intensidad rango de visualización 480 a 2500 (de un total posible 0-65535). Regiones nota asteriscos en la que N-cadherina señal se limita a la extrema transversal de los cardiomiocitos trabecular, lo que probablemente representa intercalado discos nacientes. (B) N-cadherina sólo canales mediante histograma intensidad rango de visualización 480-2,500. (C) s-α -actinina único canal utilizando el histograma de intensidad rango de visualización 480-2,500. (DG) Las secciones se bloquearon con 1x tampón de bloqueo sólo (sin anti-IgG de ratón fragmento Fab monovalente etapa de bloqueo), expuestos a policlonal de conejoimagen anticuerpo primario contra la N-cadherina sólo (sin anticuerpo primario monoclonal de ratón), se lavó, y se expone a Alexa Fluor 488 anti-ratón y Alexa Fluor 586 anti-conejo anticuerpos secundarios. (D) se fusionaron utilizando el histograma de intensidad rango de visualización 480-2500. canal mediante (E) N-cadherina sólo canales mediante histograma intensidad rango de visualización 480-2500. (F) canal utilizando histograma intensidad rango de visualización 480-2,500 s-α-actinina-solamente. (G) sólo s-α-actinina- de alta sensibilidad histograma de intensidad rango de visualización 480 a 530, que revela la detección de fondo de IgG de ratón endógeno en la ausencia de la IgG monovalente fragmento Fab etapa de bloqueo anti-ratón. (HK) Secciones fueron bloqueadas con tampón de bloqueo 1x seguido por anti-IgG de ratón fragmento Fab monovalente, expuesto a anticuerpo policlonal de conejo primaria contra la N-cadherina (sin anticuerpo primario monoclonal de ratón), se lavó, y se expone a Alexa Fluor 488 anti-ratón y unalexa Fluor 586 anti-conejo anticuerpos secundarios. (H) Imagen Fusionada utilizando rango de visualización del histograma intensidad 480-2,500. (I) N-cadherina sólo canales mediante histograma intensidad rango de visualización 480-2,500. (J) s-α-actinin- único canal usando histograma intensidad rango de visualización 480-2,500. (K) de canal con alta sensibilidad rango de visualización del histograma intensidad 480-530, lo que demuestra la falta de detección endógeno fondo IgG ratón solamente-α-actinina-s cuando la IgG anti-ratón se utiliza monovalente Fab fragmento etapa de bloqueo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
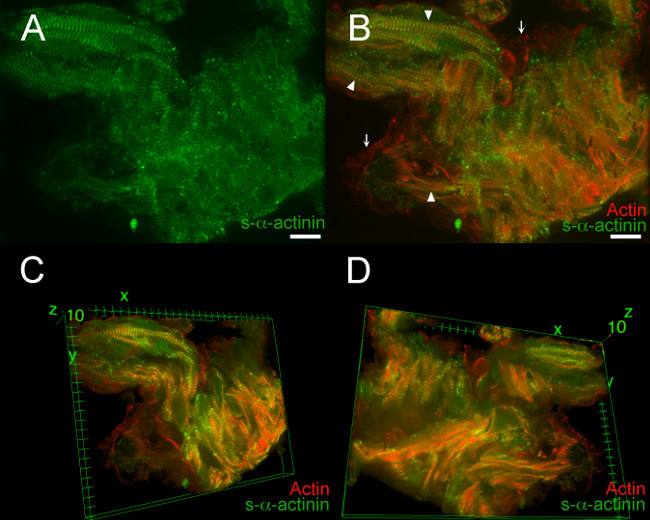
Figura 7. s- α-actinina y organización de actina en cardi trabecularomyocytes en el día embrionario 12.5. La línea de ratones transgénicos LifeAct-RFPruby se utilizan para visualizar actina filamentosa 19, mientras que el anticuerpo monoclonal de ratón EA53 clon contra s-α-actinina se utiliza para etiquetar Z-discos y discos intercalares. Los embriones fueron fijadas-MF. 0.2 micras rodajas ópticos fueron recolectados como pila az (A) pila z aplanado muestra que s-α-actinina tinción fue más difusa en el tejido fijo-PFA que en complemento congelado y acetona secciones fijas (Figuras 2-5).. (B ) pila z aplanado muestra tanto actina filamentosa y s-α-actinina. Fluorescencia actina filamentosa localizada entre Z-discos dentro de miofibrillas (puntas de flecha). Fluorescencia actina filamentosa también se observó en las células endocárdicas que recubren los miocitos trabecular (flechas). (C) Vista tridimensional de los cardiomiocitos trabeculares, como se ve desde la parte superior de la pila. (D) Vista tridimensional delos cardiomiocitos trabeculares, como se ve desde la parte inferior de la pila. Histograma de intensidad rango de visualización 470 a 900 (de posible 0-65535) tanto para el canal de láser de 488 nm y para el canal de láser de 561 nm en A y B; Rango de visualización de 460 a 800 para los dos canales en C y D. La barra de escala 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
Movie 1. 360 ° vista 3D de rotación de s- α-actinina y organización de actina en cardiomiocitos trabecular en el día embrionario 12.5. La pila de imágenes de la figura 6 se hizo en tres dimensiones utilizando la imagen J Visor 3D plug-in en el programa de análisis de imagen Fiji. Histograma de intensidad rango de visualización 470 a 800 (de posible 0-65535), tanto para los canales de 488 nm y 561 nm láser.
Movie 2. Seleccionados vistas en 3D de s- α-actinina y actina organización en cardiomiocitos trabecular en el día embrionario 12.5. La pila de imágenes de la figura 6 se hizo en tres dimensiones utilizando la imagen J Visor 3D plug-in en el programa de análisis de imagen Fiji. Rotaciones pequeñas alrededor de las x, y, y hachas de z mostraron relativamente alineados miofibrillas dentro de los cardiomiocitos pero mala alineación entre la mayoría de los cardiomiocitos. Rotaciones pequeños también demostraron la aproximación de las células endocárdicas carecen s-α-actinina alrededor de cardiomiocitos. Intensidad histograma rango de visualización 470 a 800 (de posible 0-65535) tanto para el 488 nm y 561 nm canales láser.
Discusión
La técnica de fijación del tejido óptima y la dilución deben determinarse empíricamente para cada anticuerpo. En nuestras manos, complemento de congelación es superior a la PFA de fijación para varios antígenos, incluyendo cardiomiocitos s-α-actinina, β-catenina, β1-integrina, tropomiosina, talina (no mostrado) y N-cadherina; en contraste, PFA fijación produce resultados superiores para la quinasa de adhesión focal (no mostrado). Los enlaces cruzados de proteínas formadas por PFA pueden enmascarar epítopos y anticuerpos límite vinculante; la recuperación de antígeno puede ser necesario en tales casos, y los métodos para la recuperación de antígeno se puede encontrar en otro lugar 20. La concentración de PFA o la longitud de la fijación pueden reducirse para reducir el enmascaramiento de epítopos, con condiciones óptimas determinadas empíricamente para cada anticuerpo y en cada etapa de desarrollo. Controles negativos deberían utilizarse al caracterizar un nuevo anticuerpo o mutante cardiaca, incluyendo suero pre-inmune como al control del anticuerpo primario y un "no anticuerpo primario" control. El uso de ratones knockout es un control negativo ideal, pero letalidad temprana impide su uso para muchos de los productos de los genes estudiados aquí.
El uso de volúmenes adecuados para sumergir completamente las diapositivas experimentales y de control en el mismo bloqueo de inmunofluorescencia, anticuerpos, y las soluciones de lavado era importante como era suave balanceo de diapositivas durante la incubación para asegurar una exposición uniforme de las secciones a las soluciones. Este enfoque minimiza la variabilidad técnica en la tinción entre las secciones y diapositivas en un experimento. Cuando el costo limita el volumen de solución de anticuerpo, utilizar una pluma de Papanicolaou para limitar el flujo de soluciones más allá de las secciones de tejido y mantener los portaobjetos en una cámara húmeda durante las incubaciones largas. Si un anticuerpo monoclonal de ratón primario - y por lo tanto un anticuerpo secundario anti-ratón - está siendo usado, una segunda etapa de bloqueo para cubrir inmunoglobulinas de ratón endógenos será necesario (paso 3.4) para disminuir la señal de fondo no específica.
Técnicas de microscopía y de procesamiento de imágenes adecuadas son fundamentales para la obtención de información biológica precisa 21. El histograma de intensidad indica la distribución de los píxeles en cada nivel de intensidad (0-65535 niveles de una imagen de 16 bits para) para cada color. Fondo, brillo y contraste se puede ajustar mediante el establecimiento de un rango de visualización intensidad que flanquea el pico del histograma; para hacer comparaciones válidas entre las condiciones, se deben utilizar los mismos ajustes entre el control y las condiciones experimentales.
Este protocolo proporciona un método fiable para analizar la maduración y el desarrollo de los cardiomiocitos en el corazón de embriones de ratón nativo. Mientras inmunofluorescencia de proteínas de cardiomiocitos específica a menudo se utiliza para marcar los cardiomiocitos durante el desarrollo, pocos estudios emplean técnicas que permiten el análisis de alta resolución de la estructura miofibrilar y la aparición de los discos intercalares y costameres 12-14,22,23. Esta técnica se puede utilizar para en vevaluación ivo de las mutaciones que causan defectos en el corazón del desarrollo, como un medio para identificar los cambios en la maduración de los cardiomiocitos que puedan arrojar luz sobre los mecanismos de las anomalías estructurales.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Materiales
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Referencias
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados