Method Article
Analisi di Cardiomyocyte Sviluppo usando immunofluorescenza in cuore embrionali di topo
In questo articolo
Riepilogo
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Abstract
Durante lo sviluppo del cuore, la generazione di unità strutturali e funzionali specifici del miocardio tra cui sarcomeri, miofibrille contrattili, dischi intercalari, e costameres richiede il montaggio coordinato di più componenti in tempo e nello spazio. Turbativa in assemblaggio di questi componenti comporta difetti cardiaci sviluppo. Tecniche di colorazione immunofluorescenza sono usati comunemente in cardiomiociti in coltura per sondare la maturazione myofibril, ma questo approccio ex vivo è limitata dalla misura in cui saranno completamente miociti differenziare in coltura, mancanza di normali ingressi meccanici in vivo, e l'assenza di segnali endocardici. Applicazione di tecniche di immunofluorescenza allo studio di sviluppare cardiaca mouse è desiderabile, ma tecnicamente più impegnativo, e metodi spesso non sensibilità e risoluzione sufficiente per visualizzare sarcomeres nei primi stadi di sviluppo del cuore. Qui, si descrive un metodo affidabile e riproducibile di co-mu immunostainproteine ltiple o di co-visualizzare una proteina fluorescente con immunofluorescenza nel cuore embrionale del mouse e utilizzare questo metodo per analizzare miofibrille in via di sviluppo, dischi intercalari, e costameres. Questo metodo può essere ulteriormente applicato per valutare cardiomiociti cambiamenti strutturali causate da mutazioni che portano a difetti cardiaci sviluppo.
Introduzione
Durante lo sviluppo, le contrazioni del cuore iniziano subito dopo cardiomiociti migrano alla linea mediana e formano il tubo cuore 1,2 lineare. Il sarcomero è l'unità contrattile base ai cardiomiociti; tale struttura citoscheletrica altamente organizzata contiene filamenti di actina ancorate al Z-disco sarcomerica α-actinina (s-α-actinina) e fibre miosina ancorate alla linea M (Figura 1). Come il cardiomiociti matura, sarcomeri assemblare in serie per formare miofibrille che si estendono attraverso la cella. Miofibrille sono ancorate alle estremità della cardiomiociti dal disco intercalato, la struttura giunzionale cellula-cellula che contiene una giunzione di transizione con un sottoinsieme di elementi Z-disco come s-α-actinina 3, adherens proteine di giunzione come N-caderina e β catenina, proteine gap di giunzione, e desmosomi (Figura 1) 4. Lungo la membrana longitudinale, gli Z-dischi di miofibrille periferici anchecollegare alla membrana cellulare via costameres; queste adesioni focali specializzati forniscono un ancoraggio tra miofibrilla, membrana plasmatica, e matrice extracellulare per fornire ulteriore supporto strutturale al cardiomiociti (Figura 1) 4. All'inizio dello sviluppo del cuore, cardiomiociti sono disposti in proiezioni simili a dita noti come trabecole che sporgono nello spazio ventricolare e contengono miofibrille relativamente maturi 5. Come procede lo sviluppo del cuore, i cardiomiociti nella regione sub-epicardica proliferano a formare il miocardio compatto che comprende le pareti ventricolari, ma sarcomero e montaggio myofibril sono in ritardo rispetto al miocardio trabecolare 5,6.
Modelli di sarcomero e montaggio myofibril provengono in gran parte da studi di immunofluorescenza su cardiomiociti in coltura 7-10, che sono semplici, ma non dispongono di un ambiente tridimensionale, il flusso di sangue, e contatti con altre cellule cardiaches presenti in vivo. studi strutturali ad alta risoluzione con immunofluorescenza nel cuore embrionale del mouse sono tecnicamente impegnativo, e pochi studi hanno esplorato l'emergere di dischi intercalari e costameres durante topo sviluppo cardiaco. La proteina adherens giunzione β catenina sembra localizzare a dischi intercalari di giorno embrionale (E) 17,5 11, N-caderina localizza a strutture lineari che possono rappresentare dischi intercalari di E18.5 12 contro postnatale giorno 0 13, e costameres siano state accertate su E18.5 14, ma queste proteine di membrana visualizzare la distribuzione diffusa e più continuo in precedenti momenti di sviluppo 11-13.
Qui, descriviamo un metodo semplice e riproducibile per immunostaining e microscopia a fluorescenza di topo sezionata cuori embrionali che permette l'analisi dettagliata di myofibril e dello sviluppo dei cardiomiociti, tra cui l'emergere di intercalated Dischi già nel E12.5 e costameres nascenti a E16.5. Questo protocollo può essere utile per sondare gli effetti delle mutazioni sulla formazione sarcomere nonché myofibril e cardiomiociti maturazione.
Protocollo
NOTA: Tutte le procedure sperimentali sono stati approvati dalla cura degli animali e uso Comitato UCSF istituzionale.
1. Crioconservazione e fissazione delle embrionali Cuori mouse.
1.1) Snap-congelamento cuori embrionali
- Riempire un 3,5 centimetri petri piatto e 7 mm cryomolds con Optimal taglio temperatura (OCT) medio (vedi Materiali tabella). In una cappa chimica, raffreddare 2-metilbutano in azoto liquido.
- Dispensare 30 ml di tampone fosfato salino (PBS) in 10 centimetri di Petri piatti, 10 ml di PBS in 3,5 centimetri di Petri piatti, e mettere tutti i piatti di Petri sul ghiaccio. Preparare un piatto 10 centimetri e diversi 3,5 centimetri piatti per il mouse incinta.
- Isolare embrioni come precedentemente descritto 15, eseguendo la dissezione in PBS freddo.
- In breve, eutanasia la femmina incinta con CO 2 narcosi e dislocazione cervicale.
- Fare un'incisione nell'addome, sezionare l'utero tagliando i vasi along la curvatura interna dell'utero, e trasferire l'utero di una capsula di Petri 10 centimetri contenente PBS ghiacciato.
- Tagliare l'utero tra ogni embrione e il trasferimento ad un individuo 3,5 centimetri piastra di Petri contenente ghiacciata PBS. Isolare ogni embrione come descritto 15.
- Aprire la cavità pericardica utilizzando una pinza sottile, rimuovere il cuore lontano da polmoni e vasi tagliando alla aorta, vena cava inferiore, e vene polmonari, e trasferire in cm Petri 3,5 contenente ottobre
- Lasciate che il cuore equilibrare in OCT per alcuni secondi, quindi trasferire il cuore nello stampo di 7 mm avente ottobre Orientare la parete anteriore del cuore al fondo dello stampo.
- Inserire delicatamente lo stampo in azoto liquido raffreddato 2-metilbutano. Fare attenzione a non permettere a 2 metilbutano liquido per toccare il cuore di Office o. Congelare fino al ottobre è solido bianco, poi il trasferimento lo stampo di un secchio di ghiaccio contenente ghiaccio secco. Passare al successivo dell'embrione.
- Wrap cryomolds in un foglio e conservare a -80 ° C fino al momento criosezionamento.
1.2) Alternativa: Paraformaldeide (PFA) che fissa, cryoprotecting, e ottobre incorporamento cuori embrionali
- Riempire i pozzetti di una piastra di coltura tissutale 12-bene con 4% PFA in 1x PBS.
- Sezionare i cuori embrionali, come descritto in 1.1.3. Posizionare ogni cuore in un pozzo contenente 4% PFA e fissare a 4 ° CO / N.
- Crioprotezione: con una pipetta di plastica trasferimento, spostare ogni cuore ad una provetta da 1,5 ml microcentrifuga contenente 1,5 ml di 15% di saccarosio in PBS e agitare delicatamente a 4 ° C fino al cuore scende sul fondo del tubo (diverse ore a O / N ). Trasferire ogni cuore ad un 1,5 ml provetta contenente 1,5 ml di 30% di saccarosio in PBS e agitare delicatamente a 4 ° C fino a che il cuore scende sul fondo del tubo (diverse ore per O / N).
- Usando una pipetta di trasferimento in plastica, posizionare cuore crioprotetti in OCT e lasciarlo equilibrareper alcuni minuti per eliminare l'eccesso di saccarosio, quindi trasferire il cuore nello stampo di 7 mm avente ottobre Orientare la parete anteriore del cuore al fondo dello stampo.
- Fermo cuore in OCT ponendo lo stampo sia raffreddato con azoto 2-metilbutano liquido o ghiaccio secco.
- Avvolgere cryomolds in fogli e conservare a -80 ° C fino al momento criosezionamento.
2. criosezionamento
- Impostare la temperatura criostato a -17 ° C.
- Posizionare cryomolds nella camera criostato e raggiunga la temperatura per 15-20 minuti.
- Invertire la cryomold e utilizzare una leggera pressione per espellere il blocco cardiaco dallo stampo. Orientare la parete anteriore del cuore per la parte superiore del blocco di tessuto stampato.
- Mettere una grossa goccia di ottobre sul mandrino, e montare il blocco cardiaco sul calo ottobre a congelare sul mandrino. Mantenere l'orientamento tale che la parete anteriore del cuore è lontano dal mandrino.
- Caricare il mandrino e montato luiarte blocco sul portaoggetti criostato. Regolare in modo che l'angolo della lama è 3-5 ° rispetto al campione.
- Colleziona 10 micron sezioni su vetrini da microscopio che sono stati pre-trattati con un rivestimento carica positiva (vedi Materiali tabella). Lasciare asciugare completamente prima di riporlo a -80 ° C.
3. immunofluorescenza
- Per le sezioni snap-congelate, correggere e permeabilize tessuti in acetone per 10 minuti in una cappa aspirante a RT.
- Per le sezioni snap-congelate e PFA-fisse, incubare in PBS-0.1% Triton X-100 per 20 minuti per rimuovere Office e di permeabilize sezioni PFA-fisse.
- Block per 45 min in 1x tampone bloccante, diluito in PBS.
- Se si utilizza un anticorpo primario generato nel topo, incubare in asino o di capra anti-topo IgG (H + L) monovalente frammento Fab diluito 1: 100 in PBS-0.1% Tween 20 per 45 minuti a temperatura ambiente (vedi Discussione).
- Incubare in anticorpo primario o anticorpi diluito in 1x tampone bloccante per 2 ore a temperatura ambiente oO / N a 4 ° C (vedi tabella dei materiali / Attrezzature per diluizioni specifici).
- Lavare le sezioni in PBS 1x tre volte per 10 minuti a RT.
- Incubare in Alexa Fluor-coniugato anticorpo secondario diluito 1: 500 in tampone di bloccaggio per 2 ore a temperatura ambiente, al riparo dalla luce.
- Lavare le sezioni in 1x PBS tre volte per 10 minuti a temperatura ambiente, al riparo dalla luce.
- Optional: incubare in Hoechst colorante diluito 1: 2.000 in PBS a RT (protetto dalla luce) a etichettare nuclei, poi risciacquare con PBS.
- Post-fix etichettato sezioni in 1% PFA per 1 min a RT.
- Mount scorre in mezzo anti-fade (con DAPI se nuclei non sono già etichettati) posizionando due gocce di supporto su ogni estremità della slitta e quindi coprire con un vetrino coprioggetto. Seal coprioggetto con smalto. Conservare protetto dalla luce a 4 ° C fino al momento di immagine.
4. confocale Imaging and Image Analysis
- Attivare le lunghezze d'onda appropriate laser, macchina fotografica, e confocale microscopio incLuding fase mover e z motore. Avviare il programma software di imaging. Utilizzare i 405, 488, e 561 lunghezze d'onda laser per l'imaging Hoechst-, Alexa 488-, e Alexa sezioni 568-colorate, rispettivamente.
NOTA: Vedi Tabella Materiali per le nostre specifiche hardware e software. - Montare il vetrino di controllo (coprivetrino premuto per un microscopio invertito) sul palco diapositiva.
- Usando l'obiettivo 4X (vedi Materiali Tavolo), trovare il campione e area di interesse. Cattura l'immagine da utilizzare come mappa quando l'imaging ad alto ingrandimento.
- Rimuovere il vetrino, le regolazioni minime per la fase di presentazione. Passare l'obiettivo ad immersione 60x olio (vedi Materiali Tavolo), posizionare una piccola goccia di olio sull'obiettivo, e sostituire la slitta (coprivetrino giù) sul palco diapositiva.
- Trova di nuovo campione. Impostare la potenza del laser, tempo di esposizione, e binning ai livelli desiderati per ciascun canale.
NOTA: Usiamo generalmente potenza del laser di 0.8, tempo di esposizione della fotocamera di 100 msec, e binning di 2 (see Materiali Tavolo per le specifiche hardware e software); impostazioni ottimali devono essere determinati empiricamente per ogni esperimento.- Una volta che le impostazioni ottimali sono determinate, utilizzare le stesse impostazioni per tutte le sezioni di tessuto all'interno dell'esperimento. Utilizzare l'istogramma intensità notare la gamma ottimale intensità per ciascun canale (queste informazioni verranno utilizzate per l'analisi).
- Generare pila az utilizzando la funzione di acquisizione: selezionare i canali laser appropriate, quindi scegliere i limiti superiore e inferiore della pila z. Seleziona taglia az passo stack che è la metà del valore dello spessore fetta ottica fornita dal software. Fare clic su "Esegui" per raccogliere le immagini.
- Utilizzare Fiji 16 o un programma analogo per l'analisi delle immagini. All'interno di Fiji, aprire il file di stack z con l'opzione modalità colore personalizzata e i canali suddivisi in finestre separate. Aprire la "Regolazione Luminosità / Contrasto" strumento dal menù a tendina immagine; all'interno di ciascun canale, set il range ottimale di intensità istogramma determinato in 4.5.1. Applicare questi intervalli di canale per tutti gli stack z analizzato.
- Unire i singoli canali in un'unica immagine composita utilizzando Immagine-> menu a discesa Colore.
- Creare uno stack z appiattito dalla immagine composita con il Image-> Stacks-> menu project z. L'immagine sarà significativamente più luminosa l'immagine 3D di; regolare la gamma di intensità istogramma per il campione di controllo per evitare sovrasaturazione, e applicare le stesse impostazioni per la sperimentazione appiattito z stack.
- Per generare una immagine 3D, prima di utilizzare il Image-> Stacks-> Menu progetto 3D 17. Scegliere l'asse x o y-asse di rotazione. Impostare la spaziatura fetta come lo stesso numero di micron come dimensione dello stack z passo. Scegli la rotazione totale desiderata e impostare l'incremento di angolo di rotazione a 1. Aprire quindi l'immagine J 3D Viewer dal Plugin menu a tendina. Scegli l'immagine composita generata in 4.8, display come Volume, e impostare il Recampionamento fattore da 1 o 2.
Risultati
Le figure da 2 a 6 mostrano risultati tipici per co-colorazione delle proteine differenti in un cuore snap-congelato e acetone-fisso. L'anticorpo contro s-α-actinina riproducibile etichettati Z-dischi e dischi intercalati con alta specificità e sfondo minima (figure 2A, 3A, 4A, 5A, 6A e 6C); figura 6 dimostra che l'anti-topo IgG (H + L) monovalente frammento Fab blocca efficacemente IgG topo endogena vincolante da anticorpi secondari anti-topo. L'anticorpo contro la proteina adherens giunzione β catenina legata alla membrana sia cardiomiociti e cellule non-cardiomiociti, e co-localizzazione con s-α-actinina è verificato in dischi intercalari presunti a E16.5 (Figura 2C e D), come previsto dalla β modello catenina colorazione nel cuore adulto 18. β1 integrina immunofluorescenza nel cuore embrionale è particolarmente impegnativo e spesso non riesce a individuare adesioni focali di 14, ma il segnale β1 colorazione integrina in questi studi ha rivelato con la stessa periodicità Z-dischi-s-α-actinina marcato, forse riflettendo costameres nascenti formando a E16.5 (Figura 3D).
A E12.5, s-α-actinina e tropomiosina (sarcomere proteine sottile filamento) immunofluorescenza ha rivelato un pattern di colorazione con periodicità regolare in cardiomiociti trabecolare coerenti con miofibrille maturi in queste cellule (Figure 4A e 5A per s-α-actinina; Figura 4B per tropomyosin). N-caderina colorazione in cardiomiociti trabecolare a cuori E12.5 tendeva colocalizza con le aree di intensa s-α-actinina colorazione (Figura 5B - D e Figure 6A - C) che forse rappresenta dischi intercalari. Incontrasto al miociti trabecolare, s-α-actinina nella zona compatta era più puntata che lineare, e tropomiosina colorazione era diffusa piuttosto che lineare (Figura 4A e 4B). Così, il montaggio sarcomere può verificarsi più tardi nel compatto rispetto al miocardio trabecolare. Inoltre, i modelli differenziali di s-α-actinina e tropomiosina nella zona compatta suggeriscono che s-α-actinina organizza in puncta e immaturi Z-dischi primi, mentre tropomiosina incorporazione nella sottile filamento può essere un evento più tardi in assemblea myofibril.
Figura 7, Film 1, e Movie 2 dimostrano risultati tipici di un cuore embrionale PFA-fisso E12.5. In questi esempi, un embrione transgenico LifeAct-RFPruby è stato utilizzato per l'imaging; il transgene LifeAct-RFPruby 19 etichette actina filamentosa ma richiede la fissazione PFA. Z-dischi etichettati con s-α-actinina erano facili da visualizzare in molte aree, ma il rapporto segnale-rumore era decre ASED rispetto a scatto congelati sezioni di cuore (Figura 7A); questo segnale era tipico per s-α-actinina immunofluorescenza nel tessuto PFA-fisso, in cui epitopi possono essere mascherati da proteine cross-link. Figura 7B mostra co-visualizzazione di actina filamentosa e immunolabeled s-α-actinina all'interno miofibrille (punte di freccia) e actina filamentosa all'interno delle cellule endocardico adiacenti miociti trabecolare (frecce). Tridimensionale di ricostruzione delle immagini ha rivelato ulteriori dettagli: singoli cardiomiociti sono stati più facilmente discernere, miofibrille all'interno di un cardiomiociti sono stati all'incirca parallele l'una all'altra, ma i singoli cardiomiociti sono state orientate ad angoli diversi tra loro (Figura 7C e D, Film 1, e Movie 2 ). La stretta approssimazione tra le cellule endocardico e cardiomiociti era meglio apprezzata nelle viste tridimensionali pure.
">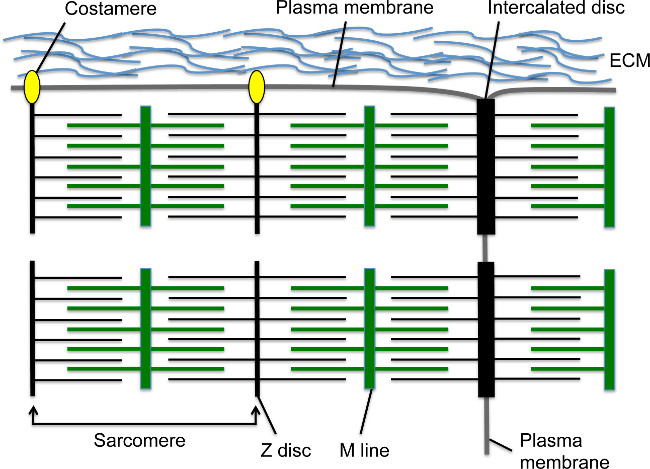
Figura 1. sarcomeri cardiomiociti, dischi intercalari, e costameres. La Z-disco ancore filamenti di actina, mentre la linea M ancore fibre miosina, che si sovrappongono i filamenti di actina. Il sarcomero è composto da una Z-disco - linea M - unità Z-disco. Più sarcomeri in serie creano miofibrilla. L'estremità laterale della miofibrilla inserisce nel bordo trasversale della cardiomiociti ad una struttura giunzionale cellula-cellula specializzata chiamato il disco intercalato. Miofibrille periferici collegano alla membrana plasmatica cardiomiociti longitudinale via costameres, che formano adesioni focali con la matrice extracellulare tra cardiomiociti. Clicca qui per vedere una versione più grande di questa figura.
PLOAD / 52.644 / 52644fig2.jpg "/>
Figura 2. s- α -actinin e β catenina immunofluorescenza al giorno embrionale 16.5. Il cuore è stato asportato, scatto congelato, cryosectioned, acetone-fisso, e immunostained con (A) monoclonale murino clone EA53 anticorpi contro s-α-actinina, che immagini cardiomiociti etichettato Z-dischi e dischi intercalari, e (B) coniglio anticorpi contro la proteina polycloncal adherens bivio β catenina. (C) Fusa mostrano s-α-actinina e β catenina colorazione. (D) ingrandita area di interesse dal pannello C ; mark asterischi presume dischi intercalari con co-localizzazione di s-α-actinina e β catenina. Le immagini sono state ottenute dalla parete ventricolare sinistra periferico o miocardio compatta, con lo strato epicardico in alto a sinistra di pannelli AC. Intensità istogramma gamma di visualizzazione 460-1600 (fuori of possibile 0-65535) per entrambi i nm e β catenina / 561 canali laser nm s-α-actinina / 488. Bar Scala 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
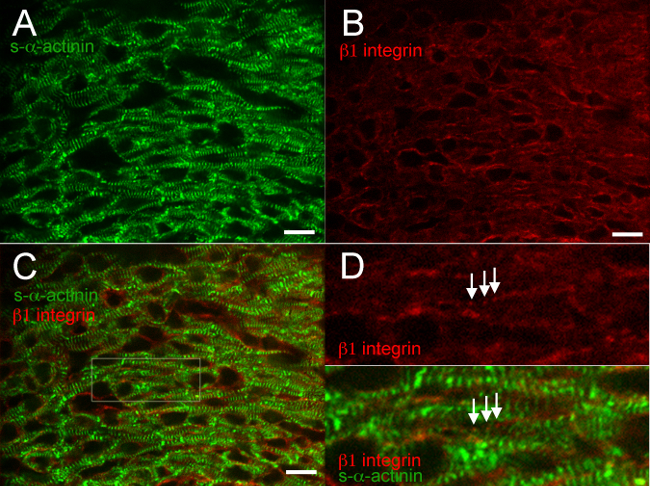
Figura 3. s- α -actinin e β 1 integrina immunofluorescenza al giorno embrionale 16.5. Il cuore è stato asportato, scatto congelato, cryosectioned, acetone-fisso, e immunostained con (A) monoclonale murino clone EA53 anticorpi contro s-α-actinina e immagini (B) di capra policlonale anticorpi contro la proteina di adesione focale β1 integrina. (C) Fusa mostrano integrina β1 in cardiomiociti e cellule non cardiomiociti. Nota sia diffusa epuntata β1 segnale integrina in cardiomiociti (D) area di interesse dal pannello C. nota puntata, β1 periodica integrina colorazione (frecce) con cadenza simile alla vicina s-α-actinina-colorazione in Z-dischi ingrandita.; queste strutture possono rappresentare costameres. Le immagini sono state ottenute dalla sinistra ventricolare miocardio compatto. Intensità istogramma gamma di visualizzazione 460-1200 (fuori possibili 0-65535) per il / 488 canali laser nm s-α-actinina e 460-600 per il canale laser nm β1 integrina / 561. Bar Scala 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
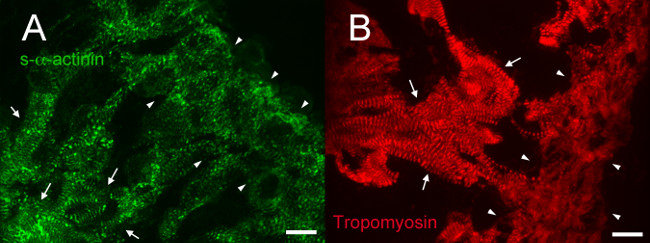
Figura 4. s- α -actinin e tropomyosin immunofluorescenza al giorno 12.5 embrionale: organizzazione myofibril in trabecolare e compatta miocardio. Cuori di embrioni littermate venivano asportate, a scatto congelato, cryosectioned, acetone-fisso, e immunostained con (A) monoclonale murino clone EA53 anticorpi contro s-α-actinina e (B) del mouse anticorpo monoclonale contro il filamento sottile miofibrilla proteine tropomiosina (Developmental Studies Ibridoma Bank CH1). Trabecolare (frecce) e miocardio compatto (punte di freccia) sono indicati. Nota s-α-actinina colorazione lineare con regolare periodicità nel miocardio trabecolare, rispetto ad una gamma di pattern di colorazione compreso puncta nonché colorazione lineare nello strato compatto (A). Nota anche la colorazione tropomyosin lineare con periodicità regolare nel miocardio trabecolare ma colorazione più diffusa nel miocardio compatto. Intensità istogramma gamma di visualizzazione 460-1,400 (di possibili 0-65535) per il canale s-α-actinina e 460-1,000 per il canale tropomyosin. Scale bar 10 micron.Target "https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
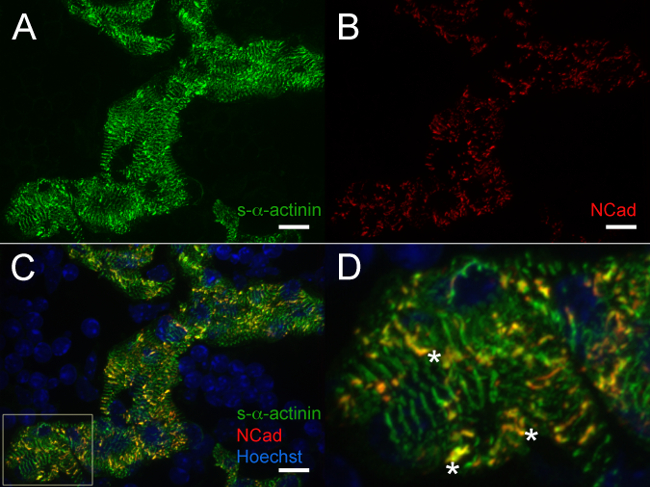
Figura 5. s- α -actinin e N-caderina immunofluorescenza al giorno embrionale 12.5:. Miofibrille e dischi intercalari in cardiomiociti trabecolare Il cuore è stato asportato, scatto congelato, cryosectioned, acetone-fisso, e immunostained con (A) monoclonale murino clone EA53 anticorpi contro s-α-actinina e (B) di coniglio policlonale anticorpi contro la proteina di adesione focale N-caderina. 0,2 micron fette ottici sono stati raccolti come pila az, yez pile erano appiattite per generare le immagini. (C) unite pile appiattite mostrano sia N-caderina e s-α-actinina colorazione all'interno cardiomiociti trabecolari come well come nuclei marcati con Hoechst dye (D) ingrandite area di interesse dal pannello C.; asterischi segnano dischi intercalari con co-localizzazione di s-α-actinina e N-caderina. Intensità istogramma gamma di visualizzazione 470-1,200 (di possibili 0-65535) per il / 405 canali laser nm Hoechst e 470-2,000 sia per il nm s-α-actinina / 488 e N-caderina / 561 canali laser nm. Bar Scala 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
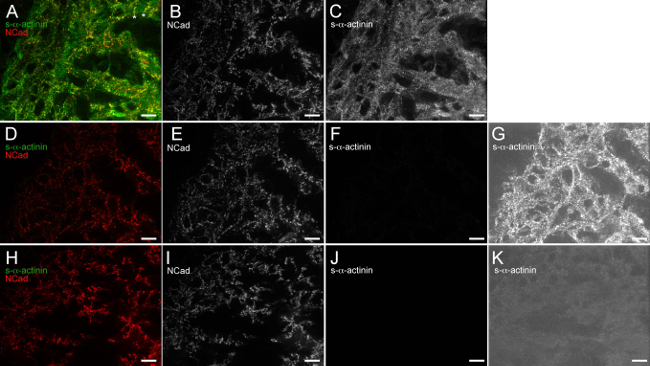
Figura 6. Anti-topo IgG (H + L) monovalente frammento Fab blocca efficacemente il mouse endogena vincolante da anticorpi secondari anti-topo IgG. Il E12.5 cuore embrionale è stato asportato, scatto congelato, cryosectioned, acetone-fisso, e immunostained. (AC) Le sezioni sono state bloccate con 1x tampone bloccante seguita da anti-topo IgG monovalenti Fab frammento, esposto a monoclonale clone EA53 anticorpo primario contro s-α-actinina e coniglio anticorpo primario policlonale contro N-caderina, lavato, ed esposto Alexa Fluor 488 anti-mouse e anticorpi secondari 586 anti-coniglio Alexa Fluor. (A) immagine a video utilizzando istogramma intensità gamma di visualizzazione 480-2500 (fuori possibile 0-65535). Regioni note asterischi in cui N-caderina segnale è limitato alla fine trasversale cardiomiociti trabecolare, che probabilmente rappresenta dischi intercalari nascenti. (B) N-caderina solo canale utilizzando istogramma intensità gamma di visualizzazione 480-2,500. (C) s-α -actinin solo canale utilizzando istogramma intensità gamma di visualizzazione 480-2,500. (DG) Le sezioni sono state bloccate con 1x tampone di bloccaggio solo (no anti-topo IgG monovalenti Fab frammento passo di blocco), esposto a policlonale di coniglioanticorpo primario contro N-caderina solo (nessun mouse anticorpo primario monoclonale), lavato, ed esposti a Alexa Fluor 488 anti-mouse e anticorpi secondari 586 anti-coniglio Alexa Fluor. (D) uniti dell'immagine usando istogramma intensità campo di visualizzazione 480-2500. canale con (E) N-caderina solo canale utilizzando istogramma intensità gamma di visualizzazione 480-2500. (F) canale tramite istogramma intensità campo di visualizzazione 480-2,500 s-α-sola-actinina. (G) solo s-α-actinina- alta sensibilità istogramma intensità campo di visualizzazione 480-530, che rivela sfondo determinazione di anticorpi IgG endogena del mouse in assenza di anti-topo IgG monovalenti Fab frammento passo di blocco. (HK) Sezioni sono state bloccate con 1x tampone bloccante seguita da anti-topo IgG monovalente frammento Fab, esposto policlonale di coniglio anticorpo primario contro N-caderina (nessun mouse anticorpo primario monoclonale), lavato, e esposta a Alexa Fluor 488 anti-topo e Alexa Fluor anticorpi secondari 586 anti-coniglio. (H) Fusa immagine usando gamma istogramma intensità 480-2,500. (I) N-caderina solo canale utilizzando istogramma intensità gamma di visualizzazione 480-2,500. (J) s-α-actinin- solo canale utilizzando istogramma intensità gamma di visualizzazione 480-2,500. (K) s solo-α-actinina-channel con alta sensibilità gamma visualizzazione istogramma di intensità 480-530, che dimostra la mancanza di sfondo endogena rilevamento IgG mouse quando il mouse anti-IgG monovalente frammento Fab passo di blocco viene utilizzato. Clicca qui per vedere una versione più grande di questa figura.
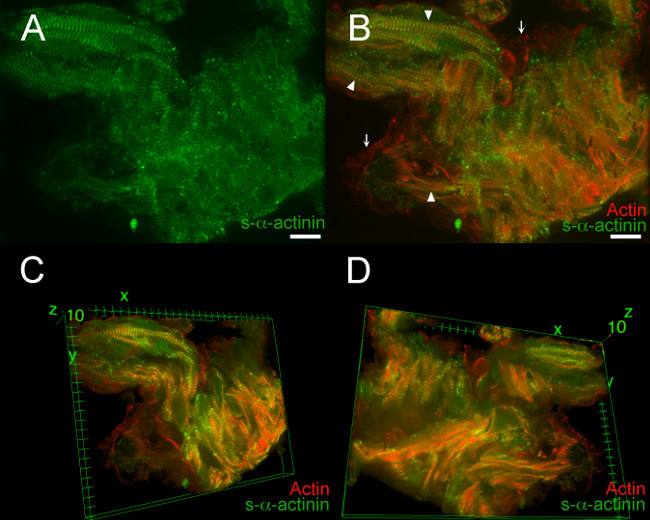
Figura 7. s- α -actinin e organizzazione actina in cardi trabecolareomyocytes al giorno embrionale 12.5. La linea di topi transgenici LifeAct-RFPruby è stato utilizzato per visualizzare actina filamentosa 19, mentre il mouse monoclonale clone EA53 anticorpi contro s-α-actinina è stato usato per etichettare Z-dischi e dischi intercalari. Gli embrioni sono stati PFA-fisse. 0,2 micron fette ottici sono stati raccolti come pila az (A) appiattito z pila mostra che s-α-actinina colorazione era più diffusa nel tessuto PFA-fisse che in snap-congelato e fissate in acetone sezioni (figure 2-5).. (B ) appiattito z pila mostra sia actina filamentosa e s-α-actinina. Filamentosa fluorescenza actina localizzato tra Z-dischi all'interno miofibrille (punte di freccia). Actina filamentosa fluorescenza è stata osservata anche in cellule endocardico che rivestono i miociti trabecolari (frecce). (C) vista tridimensionale dei cardiomiociti trabecolari, come visto dalla cima della pila. (D) vista tridimensionale dicardiomiociti trabecolare, come visto dal fondo della pila. Intensità istogramma campo di visualizzazione 470-900 (su possibili 0-65535) sia per il canale di laser 488 nm e per il canale laser 561 nm in A e B; intervallo di visualizzazione 460-800 per entrambi i canali in C e D. bar Scala 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
Movie 1. 360 ° di rotazione 3D di s- α -actinin e organizzazione actina in cardiomiociti trabecolare a giorno embrionale 12.5. La serie di immagini della Figura 6 è stata resa in tre dimensioni utilizzando il plug-J immagine 3D Viewer nell'ambito del programma di analisi delle immagini Fiji. Intensità istogramma gamma di visualizzazione 470-800 (di possibili 0-65535) per entrambi i canali di 488 nm e 561 nm laser.
Movie 2. Viste 3D selezionati di s- α -actinin e actina organizzazione in cardiomiociti trabecolare a giorno embrionale 12.5. La serie di immagini della Figura 6 è stata resa in tre dimensioni utilizzando il plug-J immagine 3D Viewer nell'ambito del programma di analisi delle immagini Fiji. Piccole rotazioni attorno x, y, e Z. mostrato relativamente allineati miofibrille all'interno cardiomiociti ma scarso allineamento tra la maggior parte dei cardiomiociti. Piccole rotazioni anche dimostrato l'approssimazione di cellule endocardico privi s-α-actinina intorno cardiomiociti. Intensità istogramma gamma di visualizzazione 470-800 (di possibili 0-65535) sia per il 488 nm e 561 nm canali laser.
Discussione
La tecnica di fissaggio del tessuto ottimale e diluizione devono essere determinati empiricamente per ciascun anticorpo. Nelle nostre mani, snap-congelamento è superiore alla fissazione PFA per diversi antigeni cardiomiociti, tra cui s-α-actinina, β-catenina, β1-integrina, tropomiosina, Talin (non mostrato) e N-caderina; in contrasto, fissazione PFA fornisce risultati superiori per focale chinasi aderenza (non mostrato). I legami crociati proteine formate da PFA possono mascherare epitopi e limite vincolante di anticorpi; recupero di un antigene può essere richiesto in questi casi, e metodi per il recupero antigene può essere trovata altrove 20. Concentrazione PFA o la lunghezza del fissaggio possono essere diminuiti per ridurre epitopo mascheramento, con condizioni ottimali empiricamente determinati per ogni anticorpo e in ogni fase dello sviluppo. Appropriati controlli negativi dovrebbero essere utilizzati nella caratterizzazione di un nuovo anticorpo o mutante cardiaca, compreso il siero pre-immune come controllo anticorpo primario e un co "no anticorpo primario"ntrol. L'uso di topi knockout è un controllo negativo ideale ma mortalità precoce impedisce l'uso per molti dei prodotti genici studiati qui.
L'uso di volumi adeguati per sommergere completamente i vetrini sperimentali e di controllo nello stesso blocco immunofluorescenza, anticorpi, e le soluzioni di lavaggio è stato importante come era dolce dondolio delle diapositive durante l'incubazione per garantire l'esposizione uniforme delle sezioni alle soluzioni. Questo approccio minimizzato la variabilità tecnica in colorazione tra le sezioni e diapositive all'interno di un esperimento. Quando il costo limita il volume della soluzione di anticorpi, utilizzare una penna Pap per limitare il flusso di soluzioni al di là delle sezioni di tessuto e di mantenere i vetrini in una camera umidificata durante lunghi incubazione. Se un monoclonale principale del mouse anticorpi - e quindi un anticorpo secondario anti-topo - è in uso, una seconda fase di blocco per coprire immunoglobuline endogene del mouse sarà necessario (punto 3.4) per ridurre non specifico segnale di fondo.
Appropriate tecniche di microscopia e di elaborazione delle immagini sono fondamentali per ottenere informazioni accurate biologicamente 21. L'istogramma intensità indica la distribuzione dei pixel per ogni livello di intensità (0-65.535 livelli per immagini a 16-bit) per ogni colore. Sfondo, la luminosità e il contrasto può essere regolato impostando una gamma di visualizzazione di intensità che costeggia il picco istogramma; per rendere validi confronti tra le condizioni, devono essere utilizzate le stesse impostazioni tra controllo e alle condizioni sperimentali.
Questo protocollo fornisce un metodo affidabile per analizzare la maturazione dei cardiomiociti e sviluppo nel nativo cuore embrionale del mouse. Mentre immunofluorescenza di proteine specifiche per cardiomiociti è spesso usato per marcare cardiomiociti durante lo sviluppo, pochi studi impiegano tecniche che consentono l'analisi ad alta risoluzione della struttura myofibril e l'emergere di dischi intercalari e costameres 12-14,22,23. Questa tecnica può essere utilizzata per in vla valutazione ivo di mutazioni che causano difetti cardiaci di sviluppo, come mezzo per identificare cambiamenti di cardiomiociti di maturazione che possono far luce sui meccanismi di anomalie strutturali.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Materiali
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Riferimenti
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon