Method Article
Анализ кардиомиоцитов развития с помощью иммунофлюоресценции в эмбриональных мыши Сердце
В этой статье
Резюме
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Аннотация
Во время развития сердца, поколение миокарда конкретных структурных и функциональных единиц, включая саркомеров, сократительной способности мышечных волокон, внедренных в дисках, и costameres требует скоординированной сборки нескольких компонентов во времени и пространстве. Нарушение в сборе этих компонентов приводит к развития пороков сердца. Методы иммунофлуоресцентного окрашивания обычно используются в культуре кардиомиоцитов, чтобы исследовать миофибрилла созревание, но это экс естественных подход ограничен, в какой степени миоциты полностью дифференцироваться в культуре, отсутствие нормальных механических входов в естественных условиях, и отсутствие эндокардиальных сигналов. Применение методов иммунофлюоресценции для изучения развития мыши сердце является желательным, но технически более сложным, и методы часто не хватает достаточной чувствительностью и разрешением для визуализации саркомеры на ранних стадиях развития сердца. Здесь мы опишем надежный и воспроизводимый метод для совместного immunostain муltiple белки или со-визуализации флуоресцентный белок с иммунофлуоресцентного окрашивания в эмбриональном сердце мыши и использовать этот метод для анализа развивающиеся миофибриллы, интерка- диски, а costameres. Этот метод может быть дополнительно применен для оценки кардиомиоцитов структурные изменения, вызванные мутаций, которые приводят к развития пороков сердца.
Введение
Во время разработки, сердечные сокращения начнутся в ближайшее время после кардиомиоциты мигрируют к средней линии и образуют линейную 1,2 сердечной трубки. Саркомер является основной единицей сократительной в кардиомиоциты; Это очень организованная структура цитоскелета содержит нити актина с привязкой к Z-диска с помощью саркомерного α-актинина (S-α-актинина) и миозиновых волокон прикрепленных к линии М (рис 1). Как кардиомиоциты созревает, саркомеров собрать последовательно с образованием миофибрилл, которые простираются по всей клетке. Миофибриллы закреплены на концах кардиомиоцитов путем интеркалированного диска, структура узловой клетка-клетка, который содержит переходный соединение с подмножеством элементов Z-дисков, таких как ы-α-актинина 3, Адгезионные контакты белки, такие как N-кадгерина и β катенин щелевых белки, и десмосомы (Рисунок 1) 4. По продольной мембраны, Z-дисков периферических мышечных волокон такжеприложите к клеточной мембране через costameres; эти специализированные фокальные адгезии обеспечить фиксацию между миофибрилле, плазматической мембраны, и внеклеточной матрицы, чтобы обеспечить дополнительную структурную поддержку кардиомиоцитов (фиг.1) 4. В начале развития сердца, кардиомиоциты расположены в пальцеподобных прогнозов, известных как трабекулы, которые выступают в желудочковой пространстве и содержат относительно зрелые миофибриллы 5. Как развития сердца доходов, кардиомиоциты в суб-эпикардиальная области размножаться, образуя компактный миокарда, которая включает стенки желудочка, но саркомера и миофибрилла сборка задержкой по сравнению с трабекулярной миокарда 5,6.
Модели саркомера и миофибрилл сборки приходят в основном из иммунофлюоресценции на культивируемых кардиомиоцитов 7-10, которые просто, но не имеют трехмерную среду, кровоток, и контактов с другими клеток сердцаš присутствует в естественных условиях. Структурные исследования высокого разрешения с использованием иммунофлюоресценции в мышиных эмбриональных сердце являются технически сложными, и несколько исследований изучили появление вставочных дисков и costameres во время мыши развития сердца. Адгезионные контакты белок β катенином по-видимому, локализуются в интеркалированных дисков эмбриональной день (E) 17,5 11, N-кадгерин локализуется в линейных сооружений, которые могут представлять интерка- диски от E18.5 12 по сравнению с послеродовой день 0 13, и costameres были обнаружены в E18.5 14, но эти белки отображения рассеянный и более непрерывное распределение мембраны на ранних развития временных точках 11-13.
Здесь мы опишем простой и воспроизводимый метод иммунного окрашивания и флуоресцентной микроскопии разборные мышиных эмбриональных сердцах, что позволяет для детального анализа миофибриллы и развития кардиомиоцитов, в том числе появление intercalaТед диски, как уже E12.5 и зарождающихся costameres на E16.5. Этот протокол может быть полезным для исследования влияния мутаций на формирование саркомера, а также миофибрилл и кардиомиоцитов созревания.
протокол
ПРИМЕЧАНИЕ: Все экспериментальные процедуры были одобрены Комитетом по UCSF Институциональные уходу и использованию животных мимо.
1. Криоконсервация и фиксация эмбриональных сердце мыши.
1.1) Snap-замораживания эмбрионов сердца
- Заполните 3,5 см чашку Петри и 7 мм cryomolds с оптимальными температуры резания (ОКТ) среды (см Материалы таблицу). В химической капот, охладить 2-метилбутан в жидком азоте.
- Разлить 30 мл забуференного фосфатом физиологического раствора (PBS) в 10 см чашки Петри, 10 мл PBS в 3,5 см чашках Петри, и поставить все чашки Петри на льду. Подготовьте 10 см блюдо и несколько 3,5 см блюда за беременной мыши.
- Изолировать эмбрионов, как описано выше 15, выполняя рассечение в ледяной PBS.
- Короче говоря, эвтаназии беременных женщин с использованием CO 2 наркоз и шейки дислокации.
- Сделайте надрез в брюшной полости, рассекать из матки за счет сокращения сосудов Алонг внутреннюю кривизну матки, а также передавать матку 10 см чашку Петри, содержащую ледяной PBS.
- Сокращение матки после каждого эмбриона и трансфер в индивидуальном 3,5 см чашку Петри, содержащую ледяной PBS. Изолировать каждого эмбриона, как описано 15.
- Откройте полости перикарда с использованием тонких щипцов, удалить сердце от легких и сосудов за счет сокращения на аорте, нижней полой вены и легочных вен, а также передавать в см чашки Петри 3,5, содержащего октября
- Пусть сердце в равновесие в ОСТ в течение нескольких секунд, а затем перенести сердце в 7 мм плесени, содержащей октября Расположите переднюю стенку сердца до дна формы.
- Аккуратно поместите форму в жидкий азот охлаждением 2-метилбутана. Позаботьтесь, чтобы не допустить 2-метилбутан жидкость на ощупь центра развертывания или сердце. Замораживание до ОКТ не станет чисто белой,, а затем перенести форму, чтобы ведерке со льдом, содержащих сухой лед. Переходите к следующему эмбриона.
- WrAP cryomolds в фольгу и хранить при температуре -80 ° С до готовности для cryosectioning.
1.2) Альтернатива: Параформальдегид (PFA) фиксация, cryoprotecting, и восьмеричные вложения эмбриональных сердца
- Заполните лунки тканевого культурального планшета 12-луночного с 4% PFA в 1x PBS.
- Рассеките из эмбриональных сердец, как описано в 1.1.3. Поместите каждое сердце в лунку, содержащую 4% PFA и исправить на 4 ° СО / N.
- Криозащиты: с помощью пластиковой пипетки передачи, перемещения каждого сердца к 1,5 мл микроцентрифужных пробирку, содержащую 1,5 мл 15% сахарозы в PBS и осторожно перемешивать при температуре 4 ° С до тех пор, сердце не опускается на дно пробирки (от нескольких часов до O / N ). Передача каждого сердца к 1,5 мл микроцентрифужных трубки, содержащей 1,5 мл 30% сахарозы в PBS и осторожно перемешивать при 4 ° С, пока сердце не опускается на дно пробирки (от нескольких часов до O / N).
- Использование пластиковых пипетки передачи, поместите криопротекции сердце в октября до пусть это равновесиев течение нескольких минут, чтобы удалить избыток сахарозы, а затем перенести сердце в 7 мм плесени, содержащей октября Расположите переднюю стенку сердца до дна формы.
- Замораживание сердце в октябре, поместив форму в любом жидкого азота охлаждением 2-метилбутана или сухого льда.
- обернуть cryomolds в фольгу и хранить при температуре -80 ° С до готовности для cryosectioning.
2. Cryosectioning
- Установите криостат температура до -17 ° C.
- Место cryomolds в криостат камеры и уравновешивают до температуры в течение 15-20 мин.
- Обратить cryomold и нежный давление изгнать сердечный блок из формы. Сориентируйте переднюю стенку сердца, чтобы в верхней части формованного ткани блока.
- Поместите большое падение ОКТ на патроне, и установите блок сердца на падение октября по заморозить на патроне. Хранить ориентацию таким образом, чтобы передняя стенка сердца наиболее удалена от зажима.
- Загрузите патрон и установлен онискусство блок на держатель объекта криостат. Регулировка таким образом, что угол лопатки 3-5 ° по отношению к образцу.
- Собирают 10 мкм секций на предметных стеклах, которые были предварительно обработаны с положительно заряженным покрытием (см Материалы таблицу). Дайте полностью высохнуть перед хранением при -80 ° С.
3. Иммунофлуоресценции
- Для оснастки замороженных срезов, исправить и проницаемыми ткани в ацетоне в течение 10 мин в вытяжном шкафу при комнатной температуре.
- Для быстро замораживают и PFA-неподвижных секций, инкубировать в PBS-0,1% Triton X-100 в течение 20 мин, чтобы удалить октября и проницаемыми PFA-фиксированные секции.
- Блок в течение 45 мин в 1X блокирующего буфера, разведенного в PBS.
- При использовании первичного антитела, генерируемого в мыши, инкубируют в осла или козы против мышиного IgG (H + L) одновалентной Fab-фрагмент разводили 1: 100 в PBS-0,1% Твин 20 в течение 45 мин при комнатной температуре (см обсуждение).
- Инкубируют в первичных антител или антител, разведенного в 1x блокирующего буфера в течение 2 ч при комнатной температуре илиO / N при 4 ° С (табл материалов / оборудования для конкретных разведения).
- Промыть секции в 1x PBS три раза в течение 10 мин при комнатной температуре.
- Инкубируют в Alexa Fluor-конъюгированного вторичного антитела, разбавленного 1: 500 в блокирующем буфере в течение 2 ч при комнатной температуре, в защищенном от света.
- Промыть секции в 1x PBS три раза в течение 10 мин при комнатной температуре, в защищенном от света.
- Дополнительно: Выдержите в Hoechst красителя разбавляют 1: 2000 в PBS при комнатной температуре (в защищенном от света) для обозначения ядра, затем смойте PBS.
- После исправления помечены секции в 1% PFA в течение 1 мин при комнатной температуре.
- Крепление скользит в анти-выцветанию среды (с DAPI, если ядра еще не помечены), поместив две капли среды на каждом конце ползуна, а затем покрытие с покровным. Печать покровные с лаком для ногтей. Магазин не защищенном от света месте при температуре 4 ° С до готовности к изображению.
4. конфокальной микроскопии и анализа изображений
- Включите соответствующих лазерных длинах волн, камеры и конфокальной микроскопии IncЛУДИНГ этап двигателем и г двигатель. Запустите программу для обработки изображений. Используйте 405, 488 и 561 лазерных длин волн для визуализации Hoechst-, Alexa 488- и Alexa 568-окрашенные срезы, соответственно.
ПРИМЕЧАНИЕ: См материалы Стол для наших аппаратных и программных спецификаций. - Установите ползунком (покровное вниз для инвертированного микроскопа) на этапе слайдов.
- Использование цели 4X (см Материалы таблицу), найти образец и область интересов. Захват изображения для использования в качестве карты при визуализации при большом увеличении.
- Удалить слайд, делая минимальные коррективы в стадии слайдов. Перейдите в 60x нефти погружения цели (см Материалы таблицу), поместите каплю масла на цели, и заменить слайд (покровное вниз) на этапе слайдов.
- Найти образец снова. Установите мощность лазера, время экспозиции, и биннинга до желаемого уровня для каждого канала.
ПРИМЕЧАНИЕ: Мы обычно используем мощность лазера 0,8, время экспозиции камеры 100 мс, и биннинга из 2 (SEе материалы Таблица аппаратных и программных спецификаций); оптимальные настройки должны быть определены эмпирически для каждого эксперимента.- После того, как оптимальные настройки определяются, используйте те же настройки для всех разделов ткани в эксперименте. Используйте гистограмму интенсивности отметить оптимальный диапазон интенсивности для каждого канала (эта информация будет использоваться для анализа).
- Создание аз стек с помощью функции приема: выбрать соответствующие лазерных каналов, а затем выберите верхний и нижний пределы стека г. Выберите аз размер шага стек, что составляет половину значение оптической толщины среза, предоставляемый программой. Нажмите кнопку "Выполнить", чтобы собрать изображения.
- Использование Фиджи 16 или сравнимое программу для анализа изображений. В Фиджи, откройте файл стека г с пользовательских цветовых варианта режима и каналов разделены на отдельные окна. Откройте "регулировать яркость / контраст" инструмент из изображения в выпадающем меню; в пределах каждого канала, Sи др оптимальный диапазон интенсивности гистограмма определяется в 4.5.1. Применить эти диапазоны каналов для всех г стеков анализируются.
- Слияние отдельных каналов в один составной изображение с помощью Снимок-> меню Color выпадающее.
- Создать плоский г стопку из композитного изображения с помощью Image-> Stacks-> Меню г проект. Этот образ будет значительно ярче, чем 3D-изображения; настроить диапазон интенсивности гистограмма контрольный образец, чтобы избежать перенасыщения, и применить те же настройки к г стек экспериментальной плоские.
- Для создания 3D-изображения сначала использовать Имидж> Stacks-> 3D меню Проект 17. Выберите либо ось х или у-ось вращения. Указан интервал среза как такое же количество мкм, как размер шага г стека. Выберите нужный общее вращение и установить угол поворота приращение 1. Затем откройте изображение J 3D Viewer от плагинов в выпадающем меню. Выберите составное изображение генерируется в 4,8, дисплей, как объем и установите Reвыборки фактор 1 или 2.
Результаты
Цифры 2 по 6 показаны типичные результаты для совместного окрашивания различных белков в быстро замораживают и ацетона фиксированной сердца. Антитело против с-α-актинина воспроизводимо меченых Z-дисков и интеркалированных дисков с высокой специфичностью и минимальным фоне (2а, 3а, 4а, 5а, 6а и 6в); фиг.6 показывает, что антитела против мышиного IgG (Н + L) одновалентной Fab фрагмент эффективно блокирует эндогенный мыши IgG связывания анти-мыши вторичных антител. Антитела против Адгезионные контакты белка β катенином связаны мембрану обоих кардиомиоцитов и некардиомиоцитов клеток, и совместная локализация с втор-α-актинина произошло в предполагаемых интеркалирован- дисков на E16.5 (рис 2С и D), как и ожидалось от β картина окрашивания катенином во взрослом сердце 18. β1 интегрин иммунофлюоресценции в эмбриональном сердце, особенно сложно и зачастую не позволяет выявить фокальные адгезии 14, но β1 интегрина окрашивание в этих исследованиях выявлено сигнал с той же периодичностью, как S-α-актинина меченных Z-дисков, возможно, отражает зарождающиеся costameres, образующихся при E16.5 (рис 3D).
В E12.5, втор-α-актинина и тропомиозин (саркомера тонкие нити белка) иммунофлуоресценции показали окрашиванием с регулярной периодичностью в трабекулярных кардиомиоцитов в соответствии со зрелыми миофибрилл в этих клетках (фиг.4А и 5А для S-α-актинина; фиг.4В для тропомиозином). N-кадгерина окрашивание в трабекулярных кардиомиоцитов на E12.5 сердца, как правило, локализуются в зонах интенсивного окрашивания S-α-актинина (фиг.5В - D и 6А - С), возможно, представляющих интеркалированных дисков. Вконтраста, чтобы трабекулярных миоцитов, втор-α-актинина в компактной зоне более точечный, чем линейный, и окрашивание тропомиозин было диффузным, а не линейный (фиг.4А и 4В). Таким образом, саркомера сборка может произойти позже в компактным по сравнению с трабекулярной миокарда. Кроме того, дифференциальные модели С-α-актинина и тропомиозином в компактной зоне показывают, что S-α-актинина организует в Puncta и незрелых Z-дисков начале, в то время как тропомиозином включение в тонкой нити может быть затем событие миофибрилл сборки.
Рисунок 7, Кино 1, а фильм 2 показаны типичные результаты из PFA-фиксированный E12.5 эмбриональных сердце. В этих примерах, LifeAct-RFPruby трансгенного эмбриона использовали для визуализации; LifeAct-RFPruby трансген 19 этикетки фибриллярного актина, но требует PFA фиксации. Z-диски, снабженные с-α-актинина было легко визуализировать в большинстве областей, но отношение сигнал-шум было decre Ased по сравнению с оснасткой замороженных срезов сердца (7А); Этот сигнал был характерен для S-α-актинина иммунофлуоресценции в ПФА-фиксированной ткани, в которой эпитопы могут быть замаскированы с помощью белковых сшивок. 7В показывает совместное визуализацию нитчатых актина и immunolabeled S-α-актинина течение миофибрилл (стрелок) и фибриллярного актина в эндокардиальных клеток, прилегающих к трабекулярных миоцитов (стрелки). Трехмерная реконструкция изображения показали дополнительные детали: отдельные кардиомиоциты были более легко различить, миофибрилл внутри кардиомиоцитов были примерно параллельны друг другу, но отдельные кардиомиоциты были ориентированы под разными углами друг к другу (фиг 7С и D, кино 1, 2 и кино ). Приближением между эндокардиальных клеток и кардиомиоцитов, лучше понимают в трехмерных видом, а также.
">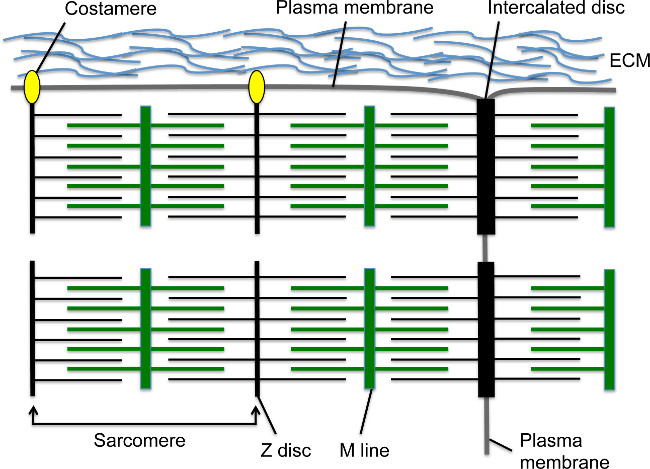
Рисунок 1. кардиомиоцитов саркомеры, интеркалированные диски и costameres. Z-диск якоря нити актина, в то время как M линия якоря миозиновых волокон, которые перекрывают нити актина. Саркомер включает в себя один Z-диск - M Line - блок Z-диска. Несколько саркомеры в серии создают миофибриллы. Боковое окончание миофибрилле вставляет в поперечном границы кардиомиоцитов на специализированной структуры соединительного клетка-клетка под названием интеркалированного диска. Периферийные миофибриллы подключения к продольной кардиомиоцитов плазматической мембраны через costameres, которые образуют координационные спайки с внеклеточного матрикса между кардиомиоцитов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
pload / 52644 / 52644fig2.jpg "/>
Рисунок 2. S- α -actinin и β катенин иммунофлюоресценции в эмбриональный день 16.5. Сердце вырезали, быстро замораживают, cryosectioned, ацетон фиксированной и иммунному окрашиванию с использованием (А) мышиное моноклональное клон EA53 антитело против с-α-актинина, которые помечены кардиомиоцитов Z-дисков и интеркалированные диски, и (B) кролик polycloncal антител против Адгезионные контакты белка β катенином. (C) Слияние изображения показывают S-α-актинин и окрашивание β катенина. (D) Увеличенная область интереса со стороны панели C ; звездочки знак Предполагается, интерка- диски с совместной локализации С-α-актинина и β катенином. Изображения были получены из периферической левой стене желудочка или компакт-миокарда, с эпикардиальной слоя на верхней левой части панели переменного тока. Интенсивность гистограмма дисплей Диапазон 460-1600 (из OF возможного 0-65535) для обоих нм и β катенином / 561 нм лазерных каналов S-α-актинин / 488. Масштабная линейка 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
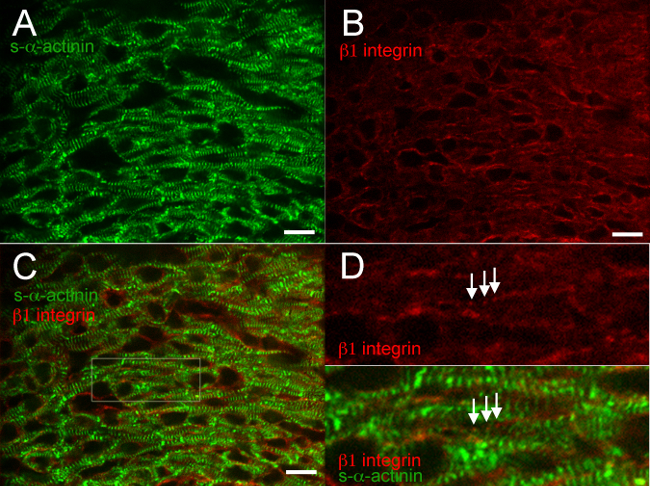
Рисунок 3. S- α -actinin и β 1 интегрина иммунофлюоресценции в эмбриональный день 16.5. Сердце вырезали, быстро замораживают, cryosectioned, ацетон фиксированной и иммунному окрашиванию с использованием (А) мышиное моноклональное клон EA53 антитело против с-α-актинина и (B) козьи поликлональные антитела против фокальной адгезии белка β1 интегрином. (C) Слияние изображения показывают β1 интегрина в кардиомиоциты, а также некардиомиоцитов клетки. Обратите внимание, как диффузный иточечный β1 интегрина сигнала в кардиомиоциты (D) Увеличенная область интереса со стороны панель C. Примечание пунктата, периодическая β1 интегрина окрашивания (стрелки) с периодичностью, подобной близлежащей α-актинин окрашивание в Z-дисках.; Эти структуры могут представлять costameres. Изображения были получены из левого желудочка компактного миокарда. Интенсивность гистограмма дисплей Диапазон 460-1200 (из возможных 0-65535) для S-α-актинина / 488 нм лазерного канала и 460-600 для нм лазерного канала β1 интегрина / 561. Масштабная линейка 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
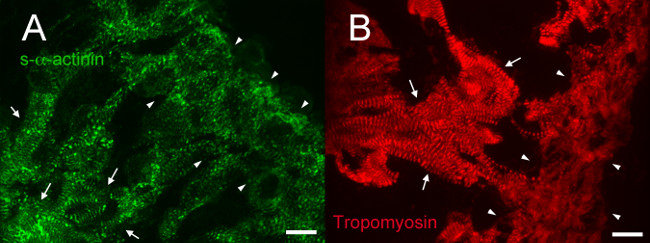
Рисунок 4. s- α -actinin и тропомиозин иммунофлюоресценции в день эмбрионального 12.5: организации миофибрилл в трабекулярной и компактной миокарда. Сердца из эмбрионов однопометница вырезали, замораживали, cryosectioned, ацетон фиксированной и иммунному окрашиванию с использованием (А) мышиное моноклональное клон EA53 антитело против с-α-актинина и (B) мышиного моноклонального антитела против миофибрилл тонкой нити белок тропомиозин (Развивающие Исследования Hybridoma Банк CH1). Trabecular (стрелки) и компактный миокарда (наконечники стрел) указываются. Обратите внимание, линейный S-α-актинина окрашивание обычной периодичности в трабекулярной миокарда, по сравнению с диапазоном окрашивания шаблонов, включая Puncta, а также линейный окрашивание в компактном слое (А). Отметим также, линейный окрашивание тропомиозин с регулярной периодичностью в трабекулярной миокарда, но более диффузного окрашивания в компактном миокарде. Интенсивность гистограммы диапазон отображения 460-1,400 (из возможных 0-65535) для канала S-α-актинина и 460-1,000 для тропомиозина канала. Масштабная линейка 10 мкм."Https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" TARGET = "_ пустое"> Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
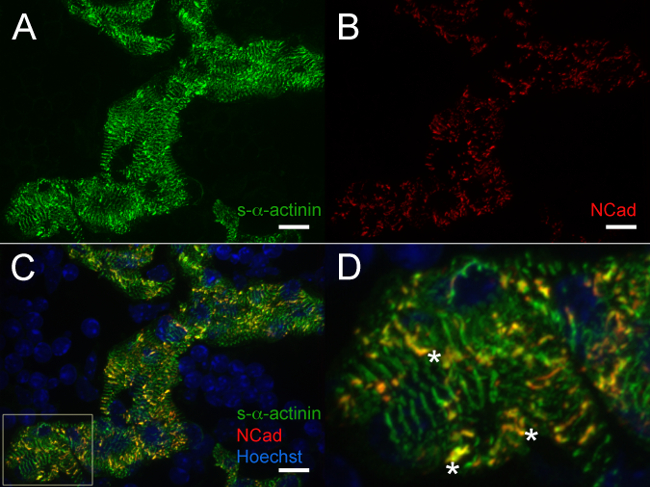
Рисунок 5. s- α -actinin и N-кадгерин иммунофлюоресценции в день эмбрионального 12,5:. Миофибриллы и интеркалированные диски в трабекулярных кардиомиоцитов сердца вырезали, быстро замораживают, cryosectioned, ацетон фиксированной и иммунному окрашиванию с использованием () мышиное моноклональное клон EA53 антитела против с-α-актинина и (б) кроличьих поликлональных антител против белка фокальной адгезии N-кадгерина. 0,2 мкм оптические срезы собирали в виде аз стека, и Z стеки были плоские для генерации изображения. (C) Объединенные уплощенные стеки показывают как N-кадгерин и окрашивание S-α-актинина течение трабекулярных кардиомиоцитов, шELL как ядер, меченных Hoechst красителя (D) Увеличенные области интересов панели C.; Звездочки отмечают интерка- диски с совместной локализации С-α-актинина и N-кадгерина. Интенсивность гистограмма дисплей Диапазон 470-1,200 (из возможных 0-65535) для / 405 нм лазерного канала Hoechst и 470-2,000 как для S-α-актинина / 488 нм и N-кадгерин / 561 нм лазерных каналов. Масштабная линейка 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
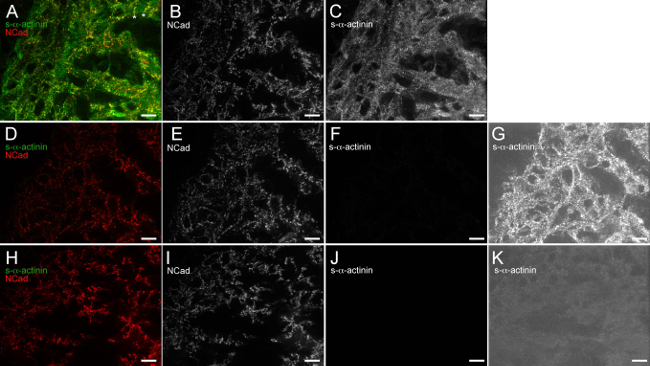
Рисунок 6. Anti-мышь IgG (H + L) одновалентной Fab фрагмент эффективно блокирует эндогенный мыши IgG связывания анти-мыши вторичных антител. E12.5 эмбриональных сердце вырезали, быстро замораживают, cryosectioned, ацетон фиксированной и иммуноокрашиванию. (AC) Срезы блокировали блокирующим буфером 1x с последующим анти-IgG мыши одновалентной Fab-фрагмента, воздействию мышиного моноклонального клона EA53 первичного антитела против с-α-актинина и кроличьи поликлональные антитела против первичного N-кадгерина, промывают и подвергается в Alexa Fluor 488 анти-мыши и Alexa Fluor 586 антикроличьими вторичными антителами. (A) объединенного изображения с помощью гистограммы интенсивности диапазон отображения 480-2500 (из возможных 0-65535). Звездочки примечание области, в которых N-кадгерина сигнал ограничен в поперечном конце трабекулярных кардиомиоцитов, которые, вероятно, представляет формирующиеся интеркалированных дисков. (В) N-кадгерин-единственный канал с использованием гистограммы интенсивности диапазон отображения 480-2,500. (С) с α- -actinin-единственный канал с использованием гистограммы интенсивности диапазон отображения 480-2,500. (DG) Срезы блокировали блокирующим буфером 1x только (не против мышиного IgG, Fab-фрагмент одновалентной блокирования этапе), воздействию кроличьего поликлональногоПервичное антитело против N-кадгерина только (не мышиные моноклональные первичные антитела), промывают и подвергается Alexa Fluor 488 анти-мыши и Alexa Fluor 586 анти-кроличьими вторичных антител. (D) объединенного изображения с помощью гистограммы интенсивности диапазон отображения 480-2500. (Е) N-кадгерин-единственный канал с использованием гистограммы интенсивности диапазон отображения 480-2500. (F), S-α-актинина-единственный канал с использованием гистограммы интенсивности диапазон отображения 480-2,500. (G), S-α-актинина-единственный канал, используя высокой чувствительности гистограммы интенсивности области отображения 480-530, который показывает фоновое обнаружение эндогенного IgG мыши в отсутствие анти-IgG мыши одновалентной Fab фрагмента стадии блокирования. (Hk) Срезы блокировали блокирующим буфером 1x с последующим анти-IgG мыши одновалентную Fab-фрагмент, подвергается кроличьих поликлональных антител против первичного N-кадгерина (не мышиные моноклональные первичные антитела), промывают и подвергается Alexa Fluor 488 анти-мышь иLexa Fluor 586 анти-кролик вторичные антитела. (H) объединенного изображения с использованием диапазона гистограммы интенсивности отображения 480-2,500. (I) N-кадгерина только для канала с использованием гистограммы интенсивности диапазон отображения 480-2,500. (J) S-α-actinin- Единственный канал с помощью гистограммы интенсивности диапазон отображения 480-2,500. (K) S-α-актинин-единственный канал, используя высокочувствительный диапазон 480-530 яркости дисплея Гистограмма, который демонстрирует отсутствие фонового эндогенного обнаружения мыши IgG, когда анти-мышь IgG моновалентную Fab фрагмент блокирования шаг используется. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
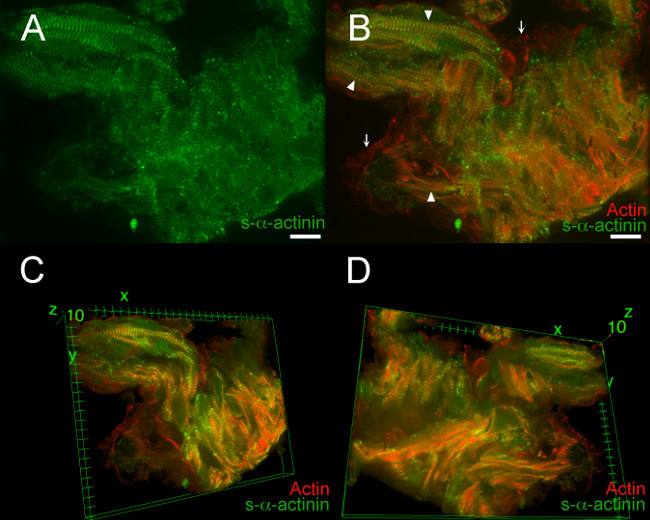
Рисунок 7. s- α -actinin и актин организация в трабекулярной Кардиomyocytes в эмбриональный день 12.5. LifeAct-RFPruby трансгенной мыши линии был использован для визуализации фибриллярного актина 19, в то время как мышиные моноклональные Клон EA53 антитела против с-α-актинина был использован для обозначения Z-дисков и интеркалированных дисков. Эмбрионы были PFA-фиксированный. 0,2 мкм оптические срезы собирали в стопку аз (А) Плоские стека г показывает, что S-α-актинина окрашивание было более диффузным в ПФА-фиксированной ткани, чем в быстро замораживали и ацетона фиксированной секций (фиг 2 - 5).. (В ) Плоские стек Z показывает, как нитчатые актин и S-α-актинин. Фибриллярного актина флуоресценции локализованной между Z-дисков в миофибриллы (наконечники стрел). Флуоресценции фибриллярного актина также видно на эндокардиальных клеток, выстилающих трабекулярной миоцитов (стрелки). (С) трехмерный вид трабекулярной кардиомиоцитов, если смотреть со стороны верхней части стека. (D) Трехмерный видтрабекулярной кардиомиоциты, если смотреть со стороны нижней части стека. Интенсивность гистограмма дисплей Диапазон 470-900 (из возможных 0-65535) как для лазерного канала 488 нм и для лазерного канала 561 нм в А и В; Диапазон отображения 460-800 для обоих каналов в C и D. Шкала расстояний 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Фильм 1. 360 ° вращения 3D вид s- α -actinin и актина организации в трабекулярных кардиомиоцитов в эмбриональном день 12.5. Стек изображений на рисунке 6 было вынесено в трех измерениях, используя образ плагин J 3D Viewer в рамках программы анализа изображений Фиджи. Интенсивность гистограмма дисплей Диапазон 470-800 (из возможных 0-65535) как для 488 нм и нм лазерных 561 каналов.
Фильм 2. Избранные 3D вид s-α -actinin и актина организации в трабекулярных кардиомиоцитов в эмбриональном день 12.5. Стек изображений на рисунке 6 было вынесено в трех измерениях, используя образ плагин J 3D Viewer в рамках программы анализа изображений Фиджи. Малые повороты вокруг х, у, г осей показали относительно выровнены миофибриллы в кардиомиоциты, но плохой центровке между большинством кардиомиоцитов. Малые повороты также продемонстрировали близкое приближение эндокардиальных клеток, лишенных S-α-актинина вокруг кардиомиоцитов. Интенсивность гистограмма дисплей Диапазон 470-800 (из возможных 0-65535) как для 488 нм и 561 нм лазерных каналов.
Обсуждение
Оптимальное методика фиксации ткани и разбавление должно быть эмпирически определено для каждого антитела. В наших руках, оснастку Замораживание превосходит PFA фиксации в течение нескольких антигенов кардиомиоцитов, в том числе с-α-актинина, β-катенина, β1-интегрина, тропомиозином, Талин (не показан) и N-кадгерина; В отличие от этого, PFA крепление дает превосходные результаты для фокальной адгезии киназы (не показан). Белковые поперечные сшивки, сформированные PFA может маскировать антигенные детерминанты и ограничить связывания антитела; Антиген поиска может потребоваться в таких случаях, и к способам извлечения антигенов можно найти в других местах 20. Концентрация PFA или длина фиксации может быть уменьшена, чтобы уменьшить эпитоп маскирование, при оптимальных условиях определены эмпирически для каждого антитела и на каждой стадии развития. Соответствующие отрицательные контроли должны использоваться при характеристике нового антитела или сердца мутант, в том числе до иммунной сывороткой в качестве контроля первичных антител и "не первичным антителом" COуправляете. Использование нокаутом мышей идеальным отрицательный контроль, но ранняя летальность предотвращает их использование для многих генных продуктов изученных здесь.
Использование адекватных объемов полностью погрузиться экспериментальной и контрольной слайдов в одной и той же блокировки иммунофлюоресценции, антитела и промывные растворы важно, как это было легкое качательное слайдов во время инкубации, чтобы обеспечить равномерное воздействие секциях к решениям. Такой подход к минимуму техническое изменчивость в окраске между разделами и слайдов в рамках эксперимента. При стоимости ограничивает объем раствора антител, использовать Pap ручку, чтобы ограничить поток решений за срезах тканей и сохранить слайды во влажной камере в течение длительного инкубации. Если Мышиные моноклональные первичные антитела - и, следовательно, анти-мыши вторичные антитела - используется, второй этап блокировки, чтобы покрыть эндогенные иммуноглобулины мыши будет необходимо (этап 3.4), чтобы уменьшить неспецифическую фоновый сигнал.
Соответствующие микроскопии и обработки изображений методы имеют решающее значение для получения биологически точную информацию 21. Гистограмма интенсивности указывает на распределение пикселей на каждом уровне интенсивности (0 - 65 535 уровней для 16-битного изображения) для каждого цвета. Фона, яркость и контрастность можно регулировать путем установки диапазона отображения интенсивности, что боковые поверхности пик гистограммы; чтобы сделать обоснованные сравнения между условиями, те же настройки между контрольной и экспериментальной условиях должны быть использованы.
Этот протокол обеспечивает надежный метод для анализа кардиомиоцитов созревание и развитие в родном эмбрионального сердца мыши. В то время как иммунофлюоресценции кардиомиоцитов-специфических белков часто используется для обозначения кардиомиоцитов в процессе разработки, несколько исследований используют методы, которые позволяют с высоким разрешением анализ миофибрилл структуры и появление вставочных дисков и costameres 12-14,22,23. Этот метод может быть использован для в vИво оценка мутаций, которые вызывают развития пороков сердца, как средство выявления изменений в кардиомиоциты созревания, которые могут пролить свет на механизмы структурных аномалий.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Материалы
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Ссылки
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены