Method Article
배아 마우스 마음에 면역 형광을 이용하여 심근 개발 분석
요약
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
초록
심장 개발하는 동안, 심근 고유의 구조 및 기능 sarcomeres, 수축 근원 섬유, 인터 디스크를 포함하여 단위 및 costameres의 생성 시간과 공간의 여러 구성 요소의 조정 조립이 필요합니다. 이러한 구성 요소의 조립에 중단 발달 심장 결함으로 이어집니다. 면역 염색 기술은 근원 섬유 성숙을 조사하기 위해 배양 심근 세포에 일반적으로 사용되지만,이 생체 접근 방식은 근육 세포가 완전히 내막 큐의 문화, 정상적인 생체 기계 입력의 부족, 부재에서 차별화 할 수있는 범위에 의해 제한된다. 마우스 심장을 개발하는 연구에 면역 형광 기술을 사용하는 것이 바람직하지만, 기술적으로 도전, 및 방법은 종종 심장 개발의 초기 단계에 sarcomeres을 시각화하기에 충분한 감도 및 해상도가 부족하다. 여기서 우리는 뮤 발현 사이의 공동 강력하고 재현 가능한 방법을 설명ltiple 단백질이나에 배아 마우스 마음에 면역 염색 형광 단백질을 공동으로 시각화하고 개발 근원 섬유, 인터 디스크, costameres을 분석하기 위해이 방법을 사용합니다. 이 방법은 더 발달 심장 결함으로 이어질 돌연변이에 의한 심근 세포의 구조적 변화를 평가하기 위해 적용될 수있다.
서문
심근 세포는 중간 선으로 마이그레이션 및 선형 심장 튜브 1, 2를 형성 한 후 개발하는 동안, 심장 수축 곧 시작합니다. 근절은 심근 내에서 기본 수축 단위; 이 고도의 조직 세포 골격 구조는 sarcomeric α-티닌 (S-α-티닌)와 M 라인에 고정 미오신 섬유 (그림 1)에 의해 Z 디스크에 고정 액틴 필라멘트를 포함하고 있습니다. 심근 세포가 성숙, sarcomeres는 셀을 가로 질러 연장 근원 섬유를 형성하기 위해 직렬로 조립한다. 근원 섬유는 인터 디스크에 의해 심근의 끝 부분에 고정되어, 같은 S-α-actinin의 3, adherens으로 Z-디스크 요소의 부분 집합을 과도 접합을 포함하는 세포 - 세포 접합부 구조 등 N-cadherin의 등의 접합 단백질 및 β 카테닌의, 간극 결합 단백질 및 데즈 모섬 (도 1) 4. 길이 막, 말초 근원 섬유의 Z-디스크 따라costameres 통해 세포막에 부착; 이러한 전문 초점 유착 (도 1) 4- 근원 섬유, 세포막 및 심근 추가적인 구조적지지를 제공하는 세포 외 기질 간의 앵커를 제공한다. 초기 심장 개발, 심근은 심실 공간으로 돌출 상대적으로 성숙 근원 섬유 (5)를 포함 trabeculae로 알려진 손가락 모양의 돌기에 배치되어있다. 심장 개발이 진행됨에 따라, 서브 외막 영역 심근 심실 벽을 포함하지만, 근절 및 근원 섬유 조립체 섬유주 심근 5,6- 비하여 지연되는 콤팩트를 형성하는 심근 증식.
근절 및 근원 섬유 조립체의 모델 배양 간단하지만 삼차원 환경 혈류 부족 심근 7-10, 및 기타 심장 세포와 접촉에 면역 연구는 크게 올생체에 존재에요. 배아의 중심부에 면역을 사용하여 고해상도 구조 연구는 기술적으로 도전이며, 몇몇 연구는 마우스 심장 개발하는 동안 인터 디스크와 costameres의 출현을 살펴 보았다. catenin의 β adherens 접합 단백질은 배아 하루 인터 디스크 (E) 17.5 (11), N-cadherin의 발현이 출생 후의 일 0 13 대 E18.5 (12)에 의한 인터 디스크를 나타낼 수있는 선형 구조 지역화 및 costameres이 검출 된 것으로 지역화 나타납니다 E18.5 (14)하지만, 이러한 단백질은 초기 개발 시점 11-13에서 확산 등을 지속적으로 막 분포를 표시합니다.
여기서 우리는 intercala의 출현을 포함하여 근원 섬유 및 심근 개발의 상세한 분석, 허용 면역 염색과 구분 마우스 배아 마음의 형광 현미경을위한 간단하고 재현성있는 방법을 설명테드는 초기 E12.5 및 E16.5에서 초기 costameres으로 디스크에 기록 할 수 있습니다. 이 프로토콜은 근절 형성뿐만 아니라 근원 섬유 및 심근 성숙에 돌연변이의 효과를 프로빙 유용 할 수 있습니다.
프로토콜
참고 : 모든 실험 절차는 UCSF 기관 동물 관리 및 사용위원회에 의해 승인되었습니다.
1. 냉동 보존 및 배아 마우스 마음의 고정.
1.1) 배아의 마음을 스냅 동결
- 최적의 절단 온도와 3.5 cm 페트리 접시와 7mm cryomolds 채우기 OCT () 매체 (재료 표 참조). 화학 후드, 액체 질소 2- 메틸 부탄 냉각.
- 10cm 배양 접시, 3.5 cm 배양 접시에 PBS 10 ㎖로 인산 완충 식염수 (PBS)의 30 ml에 분배하고, 얼음에 모든 배양 접시를 놓습니다. 한 10cm 접시와 임신 한 마우스 당 여러 개의 3.5 cm 요리를 준비합니다.
- 이전에 얼음처럼 차가운 PBS의 해부를 수행, 15 설명 된대로 배아를 분리합니다.
- 간단히, CO 2 마취 자궁 전위를 사용하여 임신 여성을 안락사.
- , 복부 절개를 무조건 혈관을 절단하여 자궁을 해부자궁의 내부 곡률 겨, 빙냉 PBS를 함유하는 페트리 접시 10cm 자궁 옮긴다.
- 얼음처럼 차가운 PBS를 포함하는 개인 3.5 cm 페트리 접시에 각각의 배아 및 전송 사이에 자궁을 잘라. 15 설명 된대로 각 배아를 분리합니다.
- 미세 집게를 사용하여 심낭 캐비티를 열고 대동맥, 하대 정맥, 폐 혈관에서 절단하여 멀리 폐와 혈관에서 심장을 제거하고 OCT를 포함하는 3.5 cm 페트리 접시에 전송합니다.
- 심장이 다음 OCT를 포함하는 7mm 금형에 마음을 전송, 몇 초 동안 OCT에서 평형을 보자. 금형의 바닥에 마음의 전벽의 방향을.
- 부드럽게 액체 질소 냉각 2- 메틸 부탄에 금형을 배치합니다. 주의 2- 메틸 부탄 액체 OCT의 심장에 닿지 않도록. OCT를 백색 고체가 될 때까지, 다음 드라이 아이스를 포함하는 얼음 양동이에 금형을 전송 동결. 다음 배아로 이동합니다.
- WRAP는 냉동 절편 전까지 -80 ° C에서 박 및 저장소에 cryomolds.
1.2) 대안 : 파라 포름 알데히드 (PFA)는 고정, cryoprotecting 및 빛 간섭 단층 배아의 마음을 포함
- 1X PBS에서 4 % PFA로 12 웰 조직 배양 판의 우물을 입력합니다.
- 1.1.3에 설명 된대로 배아 마음을 해부하다. 잘 포함 4 % PFA로 각 마음을 놓고 4 ° CO / N에 고정한다.
- Cryoprotection : 플라스틱 전송 피펫을 사용하여, PBS 1.5 ml의 15 % 자당을 함유하는 1.5 ml의 마이크로 원심 튜브에 각각의 마음을 이동하고 마음이 튜브의 바닥에 침몰 할 때까지 부드럽게 (4 ° C에서 O / N에 몇 시간을 선동 ). PBS의 30 % 자당의 1.5 ml의 microcentrifuge 관 포함 1.5 ㎖에 각각의 마음을 전송하고 마음 (O / N에 몇 시간) 튜브의 바닥에 침몰 할 때까지 부드럽게 다시 4 ℃에서 교반.
- 플라스틱 전송 피펫을 사용하여, 10월에 cryoprotected 마음을 배치하고 평형을 보자몇 분을 초과 크로스를 제거하려면 다음 OCT를 포함하는 7mm 금형에 마음을 전송합니다. 금형의 바닥에 마음의 전벽의 방향을.
- 액체 질소 냉각 2- 메틸 부탄 또는 드라이 아이스 중 하나의 금형을 배치하여 OCT의 마음을 동결.
- 냉동 절편을위한 준비가 될 때까지 -80 ° C에서 박 및 저장소에 cryomolds 랩.
2. 냉동 절편
- -17 ℃로 설정 저온 유지 온도.
- 장소는 저온 유지 챔버로 cryomolds 15 ~ 20 분 동안 온도 평형.
- cryomold 전환 및 금형에서 심장 블록을 추방 부드러운 압력을 사용합니다. 성형 조직 블록의 상단에 마음의 전벽의 방향을.
- 척 상의 OCT 큰 방울을 놓고 척에 고정하려면 OCT의 드롭에 심장 블록을 탑재합니다. 마음의 앞쪽 벽 척에서 멀리되도록 방향을 유지합니다.
- 척을로드하고 그 장착저온 유지 장치 개체 홀더 상 예술 블록. 블레이드의 각도가 샘플에 대해 3-5 °가되도록 조정한다.
- 양으로 대전 코팅으로 예비 처리 된 현미경 슬라이드 상에 10 ㎛의 섹션을 수집 (원료 표 참조). -80 ° C에서 저장하기 전에 완전히 건조시킵니다.
3. 면역 형광
- 스냅인 동결 절편의 경우, 수정하고 실온에서 흄 후드에서 10 분 동안 아세톤에 조직을 Permeabilize 하시려면.
- 스냅 냉동 및 PFA 고정 섹션의 경우, OCT를 제거하는 20 분 동안 PBS-0.1 % 트리톤 X-100에서 부화 및 PFA 고정 섹션을 Permeabilize 하시려면 할 수 있습니다.
- PBS에 희석 1X 차단 버퍼에 45 분, 대한 차단.
- RT에서 45 분 동안 PBS-0.1 % 트윈 20 (100) (설명 참조) : 마우스에서 발생한 차 항체를 사용하는 경우, 당나귀 또는 염소 항 - 마우스 IgG (H + L) (1) 희석 일가 Fab 단편에서 배양한다.
- RT 또는에서 2 시간 동안 1X 차단 버퍼에 희석 차 항체 또는 항체에 품어O / 4 ° C에서 N (특정 희석 용 재료 / 장비의 표 참조).
- 실온에서 10 분 동안 1X PBS 세 번 절을 씻으십시오.
- 1 희석 알렉사 플 루어 - 복합 이차 항체에 품어 : (500)를 빛으로부터 보호 실온에서 2 시간에 대한 버퍼를 차단합니다.
- 빛으로부터 보호 실온에서 10 분 동안 1X PBS 세 번 절을 씻으십시오.
- 옵션 : 다음, 핵 레이블을 PBS로 씻어 (빛으로부터 보호) RT에서 PBS에서 2000 : 훽스트 (Hoechst) 염료에 품어 1 희석.
- 후 수정 실온에서 1 분 1 % PFA 섹션을 표시.
- 커버 슬립와 취재 후 슬라이드의 각 끝에 매체의 두 방울을 배치에 의해 (핵이 이미 표시되어 있지 않은 경우 DAPI와) 마운트 안티 - 페이드 매체에 슬라이드. 인감 매니큐어 된 커버. 쇼핑몰 이미지에 준비가 될 때까지 4 ° C에서 빛으로부터 보호.
4. 공 촛점 이미징 및 이미지 분석
- 적절한 레이저 파장, 카메라, 및 공 초점 현미경 INC 켭니다무대 발동기 및 z 모터를 luding. 이미지 소프트웨어 프로그램을 실행합니다. 각각 Hoechst-, 알렉사 488-, 알렉사 568 - 스테인드 섹션을 영상화 405, 488, 및 561 레이저 파장을 사용합니다.
참고 : 우리의 하드웨어 및 소프트웨어 사양에 대한 자료 표를 참조하십시오. - 슬라이드 무대에서 제어 슬라이드 (거꾸로 현미경을 위해 아래로 커버 슬립)를 탑재합니다.
- 4X 목적 사용, (재료 표 참조) 시료와 관심의 영역을 찾을 수 있습니다. 높은 배율 이미징 때 맵으로 사용할 이미지를 캡처합니다.
- 슬라이드 단계로 최소한의 조정을 슬라이드를 제거합니다. 60 배 기름 침지 목표로 변경, (재료 표 참조) 목적에 기름의 작은 방울을 배치하고 슬라이드 무대에 (아래 커버 슬립) 슬라이드를 교체합니다.
- 다시 샘플을 찾을 수 있습니다. 각 채널에 대한 원하는 레벨까지, 레이저 파워, 노출 시간, 및 비닝을 설정한다.
참고 : 우리는 일반적으로 레이저 0.8의 힘, 100 밀리의 카메라 노출 시간, 2 비닝 (binning)을 사용 (자체전자 재료 표) 하드웨어 및 소프트웨어 사양; 최적의 설정은 각 실험에 대해 경험적으로 결정될 필요가있다.- 최적의 설정이 결정되면, 현재 실험에서 모든 조직 섹션에 대해 동일한 설정을 사용한다. (이 정보는 해석에 사용된다), 각 채널에 대한 최적의 강도 범위를 유의 크기 히스토그램을 사용한다.
- 다음 Z 스택의 상한값과 하한값을 선택 레이저 적절한 채널들을 선택 획득 기능을 사용하여 AZ 스택을 생성한다. 소프트웨어에 의해 제공되는 광학 슬라이스 두께의 절반 값 인 AZ 스택 스텝 사이즈를 선택한다. 이미지를 수집하기 위해 "실행"을 클릭합니다.
- 피지 (16) 또는 이미지 분석을위한 비교 프로그램을 사용하십시오. 피지 내에서 사용자 지정 색상 모드 옵션과 별도의 창으로 분할 채널 Z 스택 파일을 엽니 다. 풀다운 메뉴 이미지에서 "밝기 / 명암 대비를 조정합니다"도구를 엽니 다; 각 채널 내에서이야히스토그램 등 최적 강도 범위 4.5.1 결정. 모든 Z 스택에 이러한 채널의 범위를 적용하는 분석된다.
- 화상 -> 컬러 풀다운 메뉴를 사용하여 하나의 합성 이미지로 개별 채널을 병합합니다.
- 화상 -> Stacks-> Z 프로젝트 메뉴를 사용하여 합성 이미지에서 평평 Z 스택을 만듭니다. 이 이미지는 3D 이미지보다 훨씬 밝은 것입니다; 대조 시료는 과포화를 방지하고, 평탄 실험 Z 스택에 동일한 설정을 적용하는 히스토그램 강도 범위를 조정한다.
- 3D 이미지를 생성하려면 먼저 사용하는 화상 -> Stacks-> 3D 프로젝트 메뉴 (17). x 축 또는 회전의 y 축 중 하나를 선택합니다. Z 스택 스텝 사이즈 미크론의 수와 동일한 슬라이스 간격을 설정한다. 원하는 총 회전을 선택한 다음 플러그인 풀다운 메뉴에서 이미지 J 3D 뷰어를 열 1로 회전 각도 증분을 설정합니다. 볼륨과 복합 4.8에서 생성 된 이미지 표시를 선택하고 다시 설정1 또는 2로 샘플링 인자.
결과
스냅 냉동 및 아세톤 고정 마음에 다른 단백질의 공동 염색 6은 전형적인 결과를 통해 2도. 에 대한 항체 재현 표지 Z-디스크와 높은 특이성과 최소한의 배경 (그림 2A, 3A, 4A, 5A, 6A 및 6C)와 인터 디스크의-α는-티닌, 그림 6 보여주는 안티 - 마우스 IgG (H의 + L) 가의 Fab 단편 효과적으로 차단 내생 마우스 IgG는 항 마우스 이차 항체에 의해 결합. catenin의 β adherens 접합 단백질에 대한 항체는 심근 세포와 비 심근 세포 모두의 멤브레인을 결합하고,에서 예상대로 S-α-actinin의와 공동 지역화, E16.5 (그림 2C와 D)에서 추정 인터 디스크에서 발생 성인 심장 (18)의 β 카테닌 염색 패턴. β배아 마음에 1 인테그린 면역 특히 도전 종종 초점 유착 (14)를 식별하는 데 실패하지만, 이러한 연구에서 β1 인테그린 염색 가능성에 형성 초기 costameres을 반영하는 S-α-actinin의 표지 Z-디스크와 동일한 주기로 신호를 밝혀 E16.5 (그림 3D).
E12.5에서, S-α-actinin의 트로포 미오신 (근절 얇은 필라멘트 단백질) 면역이 S-α-actinin의 이러한 세포 (도 4A 및 5A에서 성숙한 근원 섬유와 일치 소주 심근 세포에서 일정한주기와 염색 패턴을 밝혀도 4B를 트로포)입니다. 아마도 인터 디스크를 나타내는 E12.5 마음에 소주 심근 세포에서 N-cadherin의 염색은 강렬한 S-α-actinin의 염색의 영역 (C - - D 그림 6A 그림 5B)와 colocalize 경향이 있었다. 에소주 심근 세포에 대비, 컴팩트 영역에서 S-α-actinin의 선형보다 더 작은 반점이 있었고, 트로포 미오신 염색 확산보다는 선형했다 (그림 4a 및도 4b). 따라서, 근절 어셈블리는 소주 심근에 비해 컴팩트 한 후에 발생할 수 있습니다. 또한, 컴팩트 한 영역에서의-α-actinin의 트로포 미오신의 차동 패턴은 얇은 필라멘트에 편입 트로포 미오신하는 근원 섬유 어셈블리 나중에 이벤트가 될 수 있지만 그 S-α-actinin의가, puncta의 초기 미숙 한 Z-디스크로 조직 좋습니다.
그림 7, 영화 1과 동영상 2는 PFA 고정 E12.5 배아 심장에서 전형적인 결과를 보여줍니다. 이들 예에서, 트랜스 제닉 RFPruby LifeAct - 배아가 촬상에 사용되었다; LifeAct-RFPruby 트랜스 (19)는 사상 굴지의 레이블하지만 PFA 고정이 필요합니다. S-α-티닌 표지 Z-디스크는 대부분의 영역에서 용이 시각화했지만 신호 대 잡음비가 decre이었다 스냅 냉동하는 마음 섹션 (그림 7A)를 비교 ased; 이 신호가 항원이 단백질 상호 링크에 의해 마스크 될 수있는 PFA - 고정 조직에서 S-α-actinin의 면역 형광 전형적인이었다. 그림 7b는 사상 굴지의 공동 시각화를 보여 근원 섬유 (화살촉) 내에서의-α-actinin의 immunolabeled 소주 근육 세포 (화살표)에 인접한 내막 세포 내부와 사상 말라. 입체 화상 재구성은 추가 정보를 공개 : 개별 심근 세포가보다 용이 심근 내 근원 섬유가 대략적으로 서로 평행하고, 분별하였으나, 개별 심근 세포들이 서로 (도 7C 및 D, 영화 1 및 무비 (2)에 다양한 각도로 배향되었다 ). 심 내막 세포와 심근 세포 사이의 근사치는 더 나은뿐만 아니라 입체 뷰에서 평가되었다.
">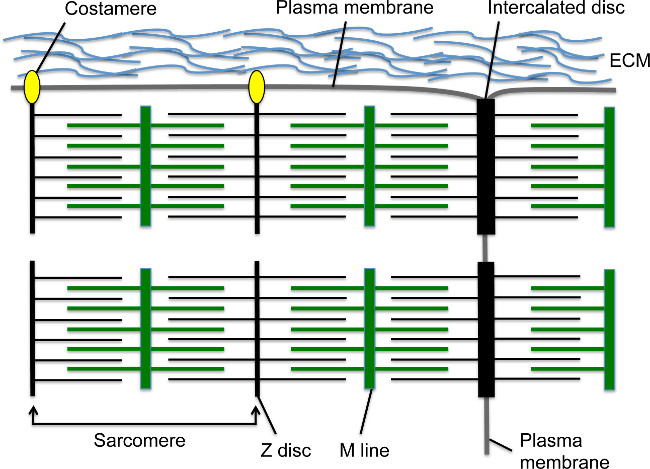
M 라인은 액틴 필라멘트 중첩 미오신 섬유 앵커하면서 그림 1. 심근 sarcomeres, 인터 디스크,이 costameres. Z-디스크 액틴 필라멘트 앵커. M 라인 - - Z 디스크 장치 근절은 하나의 Z-디스크를 포함한다. 시리즈의 여러 sarcomeres은 근원 섬유를 만들 수 있습니다. 근원 섬유의 측면 끝은 인터 디스크라는 특수 세포 - 세포 접합부 구조에서 심근의 가로 테두리에 삽입합니다. 주변 근원 섬유는 심근 세포의 세포 외 기질과 초점 유착을 형성 costameres를 통해 종 심근 세포막에 연결합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
PLOAD / 52644 / 52644fig2.jpg "/>
그림 2. S-α -actinin 및 배아 일 16.5에서 β 카테닌 면역. 심장이 적출, 스냅 냉동, 저온 절단, 아세톤 고정하고, S-α-actinin의 대한 (A) 마우스 단일 클론 클론 EA53 항체를 사용하여 면역 염색, 어떤 표시 심근 Z 디스크와 인터 디스크, 카테닌 β adherens 접합 단백질에 대한 (B) 토끼 polycloncal 항체. (C) 병합 된 이미지는 S-α-티닌 및 β의 카테닌 염색을 보여줍니다. (D) 확대 된 패널 C에서 관심의 영역을 ; 별표 (*) 표시는 S-α-티닌 및 β의 카테닌의 공동 현지화와 인터 디스크를 추정. 이미지는 AC 패널의 상부 좌측에서 외막 층과, 상기 주변 좌심실의 심근 벽 또는 콤팩트로부터 수득 하였다. 오 밖으로 강도 히스토그램 표시 범위 460-1600 (F 가능 65535) 모두 S-α-actinin의 / 488 nm의 β 카테닌 / 561 nm의 레이저 채널. 스케일 바 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
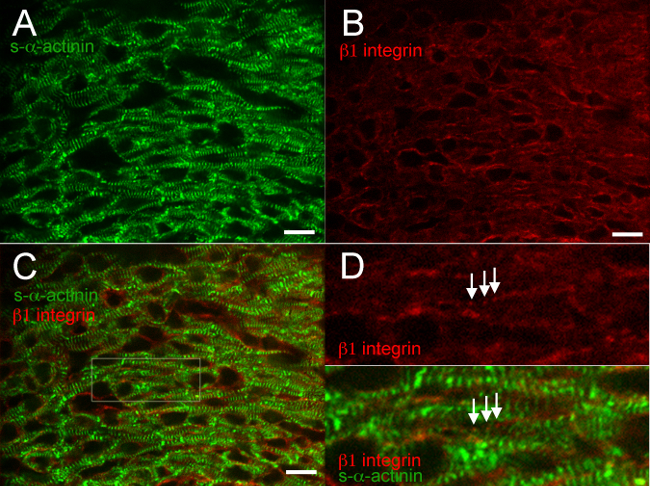
그림 3. S-α -actinin 및 배아 일 16.5에서 1 인테그린 면역을 β. 심장이 적출, 스냅 냉동, 저온 절단, 아세톤 고정하고, S-α-actinin의 대한 (A) 마우스 단일 클론 클론 EA53 항체를 사용하여 면역 염색과 인테그린 β1 초점 접착 단백질에 대하여 (B) 염소 폴리 클로 날 항체. (C) 병합 된 이미지는 심근의 β1 인테그린뿐만 아니라 비 심근 세포를 나타낸다. 참고 모두 확산 및심근 세포의 인테그린 신호 β1 반점 (D) Z-디스크에서 S-α-actinin의-염색 근처에 비슷한주기와 패널 C. 참고 반점,주기적인 β1 인테그린 염색 (화살표)에서 관심의 영역을 확대.; 이러한 구조는 costameres를 나타낼 수있다. 이미지는 컴팩트 좌심실 심근로부터 수득 하였다. β1 인테그린 / 561 nm의 레이저 채널의 S-α-actinin의 / 488 nm의 레이저 채널과 460-600에 대한 (수 65535 점 만점) 강도 히스토그램 표시 범위 460-1200. 스케일 바 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
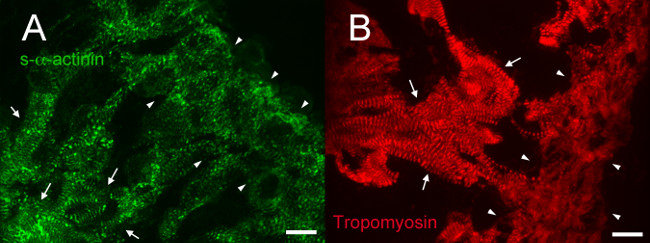
그림 4. S-α -actinin 및 배아 일 12.5에서 트로포 미오신 면역 : 근원 섬유 조직의 섬유주 컴팩트 심근. 한배 새끼 배아로부터 하트가 적출은, 냉동, 저온 절단, 아세톤 고정하고, 근원 섬유 얇은 필라멘트에 대해 S-α-티닌 및 (B)의 마우스 단일 클론 항체에 대해 (A) 마우스 모노클 클론 EA53 항체를 이용하여 면역 염색 스냅 단백질 트로포 (발달 연구 하이 브리 도마 은행 CH1). 소주 (화살표) 및 소형 심근 (화살촉)가 표시됩니다. 조밀 층 (A)에 puncta에뿐만 아니라 선형 염색을 포함한 염색 패턴의 범위와 비교할 때 해면골 심근 정규 주기성 선형 S-α-티닌 염색을 참고. 또한 컴팩트 한 심근의 소주 심근 정기적 주기성하지만 더 확산 염색 선형 트로포 미오신 염색을합니다. 트로포 미오신 채널의 S-α-actinin의 채널과 460-1,000에 대한 (수 65535 점 만점) 강도 히스토그램 표시 범위 460-1,400. 스케일 바 10 μm의."https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg"대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
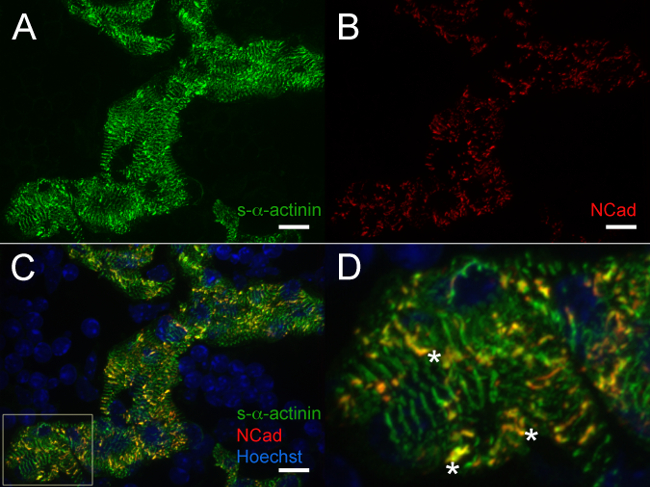
그림 5. S-α -actinin 및 배아 일 12.5에서 N-cadherin의 면역 형광 :. 소주 심근 세포의 근원 섬유와 인터 디스크 심장 적출, 스냅 냉동, 저온 절단, (A) 마우스 단일 클론 클론 EA53를 사용하여 아세톤 - 고정 및 면역 염색 S-α-티닌 및 초점 접착 단백질 N-cadherin에 대하여 (B) 토끼 폴리 클로 날 항체에 대한 항체. 0.2 μm의 광 슬라이스는 아리조나 스택으로 수집하고, Z 스택은 영상을 생성하도록 평탄화 하였다. (C) 병합 평탄화 스택 섬유주 심근 내에 N 카데 및 S-α-티닌 염색 양쪽을 표시 w로서엘 패널 C에서 관심의 훽스트 염료로 표지 핵 (D) 확대 된 지역.; 별표 S-α-티닌 및 N-cadherin의 공동 현지화와 인터 디스크를 표시합니다. S-α-actinin의 / 488 nm의 N-cadherin의 / 561 nm의 레이저 채널 모두에 대한 훽스트 (Hoechst) / 405 nm의 레이저 채널 (수 65535 점 만점)과 470-2,000 강도 히스토그램 표시 범위 470-1,200. 스케일 바 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
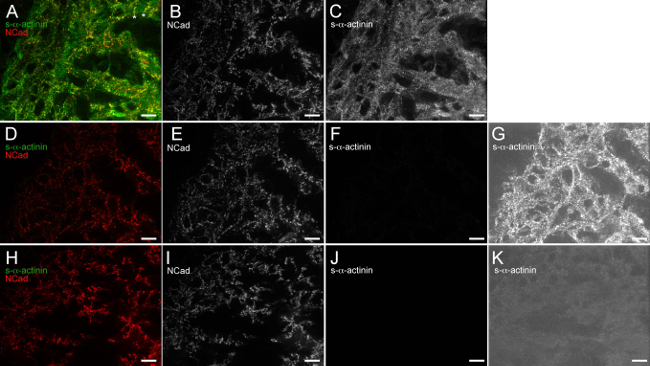
그림 6. 안티 - 마우스 IgG (H + 1) 가의 Fab 단편 효과적으로 차단 내생 마우스 항 - 마우스 이차 항체에 의해 결합의 IgG. 배아 심장이 적출 된 E12.5, 스냅 아세톤 고정, 저온 절단 및 면역 염색, 냉동. (AC) 섹션, N-cadherin에 대해 S-α-티닌의 토끼 폴리 클로 날 차 항체에 대해 마우스 단클론 클론 EA53 차 항체에 노출, 항 - 마우스 IgG 1가 Fab 단편이어서 1X 블로킹 완충액으로 차단 세정하고, 노출 알렉사 플 루어 488 항 - 마우스 알렉사 형석 586 항 - 토끼 보조 항체. 강도 히스토그램 표시 범위 480-2500를 이용하여 (A) 합병 이미지 (수 65535 점 만점). 별표 노트 영역이있는 N-cadherin의 신호. 가능성이 초기 인터 디스크를 대표하는 소주 심근의 가로 끝에 제한 (B) N-cadherin의 전용 강도 히스토그램 표시 범위 480-2,500을 사용하여 채널입니다. (C)의-α -actinin 전용 강도 히스토그램 표시 범위 480-2,500을 사용하여 채널입니다. (DG) 섹션은 토끼 다 클론에 노출, 1X 차단 버퍼 만 (앤티 - 마우스 IgG 1가 Fab 단편 차단 단계)로 차단되었습니다N-cadherin의 만 (NO 마우스 모노클 차 항체), 세정하고, 알렉사 형석 488 항 마우스 알렉사 형석 586 항 - 토끼 이차 항체에 노출. (D)에 대한 일차 항체 크기 히스토그램 표시 범위 480-2500을 이용하여 화상을 병합. (E) N-cadherin의 전용 강도 히스토그램 표시 범위 480-2500를 이용하여 채널입니다. (F) S-α-actinin의 전용 강도 히스토그램 표시 범위 480-2,500을 사용하여 채널입니다. (G) S-α-actinin의 전용 채널 사용 항 - 마우스 IgG 1가 Fab 단편 차단 단계의 부재 하에서 내인성 마우스 IgG의 배경 검출 밝혀 고감도 크기 히스토그램 표시 범위 480-530이. (HK) 절편을 항 - 마우스 IgG이어서 1X 블로킹 완충액으로 차단시켰다 일가 Fab 단편은, N-cadherin의 (NO 마우스 모노클 차 항체), 다중 클론 토끼 세정 대 차 항체에 노출하고, 형석 알렉사 488 항 - 마우스 및 노출LEXA 형석 586 안티 - 토끼 보조 항체. (H) 크기 히스토그램 표시 범위 480-2,500을 사용하여 이미지를 흡수 합병. (I) N-cadherin의 전용 강도 히스토그램 표시 범위 480-2,500을 사용하여 채널입니다. (J) S-α-actinin- 전용 채널은 크기 히스토그램 표시 범위 480-2,500을 사용. (K) S-α-티닌 전용 배경 내인성 마우스 IgG의 검출 부족을 보여 고감도 크기 히스토그램 표시 범위 480-530을 이용하여 채널 때 항 - 마우스 IgG 가의 Fab 단편 차단 단계가 사용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
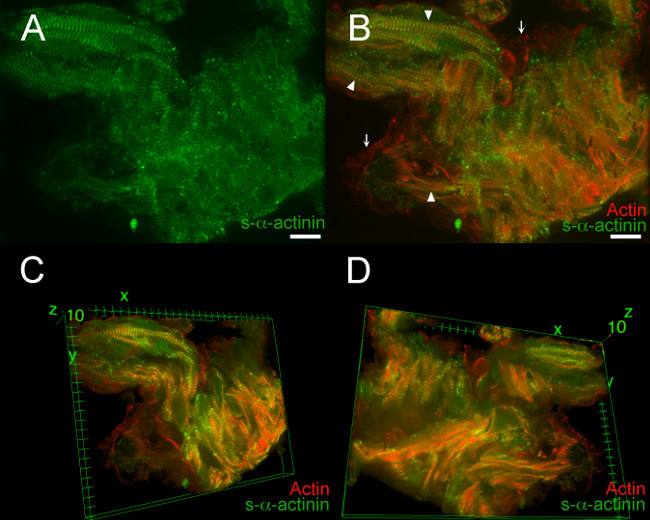
그림 7. S-α -actinin와 소주 CARDI에서 굴지의 조직S-α-티닌에 대한 마우스 단일 클론 클론 EA53 항체 Z-디스크와 인터 디스크에 라벨을 사용하는 동안 배아 일 12.5에서 omyocytes은. LifeAct-RFPruby 유전자 변형 마우스 라인은 사상 액틴 (19)를 시각화하는 데 사용되었다. 배아는 PFA 고정되었다. 0.2 μm의 광학 슬라이스 AZ 스택으로 수집 (A) 평평 Z 스택은 그 S-α-actinin의 얼룩은 스냅 냉동 및 아세톤 고정 부분 (그림 2-5)에 비해 PFA - 고정 조직에서 더 확산되었다 보여줍니다.. (B ) 평평 Z 스택은 사상 액틴과 모두의-α-actinin의 보여줍니다. 근원 섬유 (화살촉) 내에서 Z-디스크 사이에 국부적 인 사상 굴지의 형광. 필라멘트 액틴 형광도 해면골 근세포 (화살표) 라인 내막 세포에서 관찰되었다. (C) 적층 체의 상단에서 볼 때 해면골 심근의 3 차원도. (D)의 3 차원 도면해면골은 심근으로 스택의 바닥에서 볼. 강도 히스토그램 표시 범위 470-900 (수 65535 점 만점) 488 nm의 레이저 채널 A와 B의 561 nm의 레이저 채널 모두; C 및 D 스케일 바 10 μm의 두 채널의 표시 범위 460-800. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1. S-α -actinin 및 배아 일 12.5에서 소주 심근 세포의 액틴 조직의 360 ° 회전 3D 뷰. 그림 6에서 이미지 스택은 피지 이미지 분석 프로그램 내에서 이미지 J 3D 뷰어 플러그인을 사용하여 입체적으로 표현했다. 강도 히스토그램 표시 범위 470-800 (수 65535 점 만점) 488 nm에서 561 nm의 레이저 채널 모두.
영화 2. 배아 일 12.5에서 소주 심근 세포에 S-α -actinin과 액틴 조직의 선정 된 3D 뷰. 그림 6에서 이미지 스택은 피지 이미지 분석 프로그램 내에서 이미지 J 3D 뷰어 플러그인을 사용하여 입체적으로 표현했다. x, y, z 축 주위에 작은 회전이 비교적 심근 그러나 심근 세포 사이의 가장 열악한 내 근원 섬유 배향을 배향 하였다. 작은 회전도 심근 주위의-α-actinin의 부족 심 내막 세포의 근사치를 보여 주었다. 강도 히스토그램 표시 범위 470-800 488 nm에서 561 nm의 레이저 채널 모두 (수 65535 점 만점).
토론
최적의 조직 고정술 희석 경험적 각 항체에 대해 결정되어야한다. 우리의 손에, 스냅인 동결 S-α-티닌, β-catenin이, β1-인테그린, 트로포, talin (도시하지 않음)과 N-cadherin의 등 여러 심근 항원에 대한 PFA 고정 우수하다; 대조적으로, PFA 고정 초점이 부착 키나제 우수한 결과를 얻을 수 (도시 생략). PFA에 의해 형성된 가교 된 단백질은 항원과 항체의 결합 한계를 마스크 할 수있다; 항원 회수가 같은 경우에 요구 될 수 있고, 항원 및 검색을위한 방법은 다른 장소를 찾을 수있다 (20). PFA 농도 또는 고정 길이의 경험적 각 항체 각 발달 단계에서 결정된 최적의 조건으로, 에피토프 마스킹을 줄이기 위해 감소 될 수있다. 차 항체 제어와 같은 사전 면역 혈청과 "아니오 차 항체"공동을 포함하는 새로운 항체 또는 심장 돌연변이를 특성화 할 때 적절한 음성 대조군이 사용되어야한다ntrol. 녹아웃 마우스의 사용은 이상적인 음성 대조군하지만 초기 치사율은 여기에 연구 된 유전자 여러 제품의 사용을 방지 할 수 있습니다.
적당한 볼륨의 사용은 완전히 같은 면역 형광 차단, 항체 실험 및 제어 슬라이드를 잠수하고, 솔루션 섹션의 균일 한 노출을 보장하기 위해 배양시 슬라이드의 부드러운 락이었다로 세척 솔루션은 중요했다. 이 방식은 실험에서 섹션과 슬라이드 사이 염색 기술적 변동성을 최소화. 비용은 항체 용액의 부피를 제한하는 경우, 조직 절편을 넘어 용액의 유동을 제한하고 장시간 동안 인큐베이션 가습 챔버 내에서 슬라이드 유지 자궁암 펜을 사용. 모노클로 날 마우스 일차 항체 경우 -, 따라서 항 - 마우스 이차 항체 - 사용되고, 내인성 마우스 면역 글로불린을 덮도록 제 블로킹 단계는 비특이적 배경 신호를 감소시킬 필요가 (단계 3.4) 일 것이다.
적절한 현미경과 이미지 처리 기술은 생물학적으로 정확한 정보 (21)를 얻는 데 중요합니다. 각 색상 - (16 비트 이미지를위한 레벨 0 65535) 크기 히스토그램은 각각의 휘도 레벨에서의 픽셀들의 분포를 나타낸다. 배경, 밝기 및 콘트라스트 히스토그램 피크 의하여 측면 강도 표시 범위를 설정함으로써 조정될 수있다; 조건 사이의 유효한 비교를 위해, 제어 및 실험 조건과 동일한 설정을 사용해야합니다.
이 프로토콜은 기본 배아 마우스 심장에서 심근 세포의 성숙과 발전을 분석 할 수있는 신뢰할 수있는 방법을 제공합니다. 심근 세포 특이 단백질의 면역 형광은 종종 개발 중에 심근 세포를 표시하는 데 사용되지만, 몇몇 연구는 고해상도 근원 섬유 구조의 분석 및 인터 디스크 및 costameres 12-14,22,23의 출현을 허용 기법을 이용한다. 이 기술은 V에서 사용될 수있다구조적 이상 메커니즘을 밝혀있다 심근 성숙의 변화를 파악하는 수단으로서, 발달 심장 결함을 일으킬 돌연변이 IVO 평가.
공개
The authors have nothing to disclose.
감사의 말
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
자료
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
참고문헌
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유