Method Article
Embriyonik Fare Heart Immunofluorescence kullanarak kardiyomiyosit Geliştirme Analizi
Bu Makalede
Özet
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Özet
Kalp gelişimi sırasında, miyokard özgü yapısal ve işlevsel sarkomer, kasılma myofibrils, interkalasyonlu diskler dahil birimler ve costameres nesil zaman ve mekan içinde birden çok bileşenden koordineli birleşimi gerektirir. Bu bileşenlerin montajında bozulması gelişimsel kalp kusurları yol açar. Immunofluorescent boyama teknikleri myofibril olgunlaşmasını prob kültürlü kardiyomiyositlerde yaygın olarak kullanılan, ancak bu ex vivo yaklaşım myocytes tam endokardiyal ipuçları kültürünü, normal vivo mekanik girdilerin eksikliği ve yokluğu olarak ayırt edecek hangi ölçüde sınırlıdır. Fare kalp geliştirme çalışmaya immunofloresan tekniklerinin uygulanması arzu ama daha teknik açıdan zor ve yöntemler sıklıkla kalp gelişiminin erken dönemlerinde sarkomer görselleştirmek için yeterli hassasiyet ve çözünürlük eksikliği. Burada, biz mu-immunostain co sağlam ve tekrarlanabilir bir yöntem tarifltiple proteinler veya embriyonik fare kalbinde immunofluorescent boyama ile bir floresan proteini birlikte görselleştirmek ve gelişmekte Miyofibril, interkalasyonlu diskleri ve costameres analiz etmek için bu yöntemi kullanın. Bu yöntem ayrıca gelişimsel kalp kusurlarına yol mutasyonlar neden kardiyomiyosit yapısal değişiklikleri değerlendirmek için uygulanabilir.
Giriş
Kardiyomiyositler orta hatta göç ve doğrusal kalp tüpü 1,2 formu sonra gelişimi sırasında, kalp kasılmaları yakında başlayacak. sarkomer kardiyomiyosit içinde temel kasılma birimidir; Bu son derece organize iskelet yapısı sarkomerik α-aktinin (s-α-aktinin) ve M hattına demirlemiş miyozin lifleri (Şekil 1) Z-disk demirlemiş aktin filamentleri içerir. Kardiyomiyosit olgunlaştıkça, sarkomer hücrenin boyunca uzanan Miyofibril oluşturmak için seri araya. Miyofibril birleştirilmiş disk tarafından kardiyomiyosit uçlarına tespit edilir, örneğin s-α-aktinin 3 adherens Z-diski elemanlarının bir alt kümesi ile bir geçiş birleşme içeren hücre-hücre birleşim yapısı, örneğin N-kaderin olarak birleşme proteinleri ve β katenin, boşluk birleşme proteinleri ve dezmozomlar (Şekil 1) 4. Uzunlamasına zarının, aynı zamanda çevresel myofibrils Z-diskler boyuncacostameres yoluyla hücre membranına bağlanabilir; Bu özel fokal yapışmalarda (Şekil 1) 4 myofibril, plazma membranı, ve kardiyomiyosit yapıya ilave bir yapısal destek sağlamak için, hücre dışı matris arasındaki bir çapa sağlar. Erken kalp gelişiminde, kardiyomiyositlerde ventriküler boşluk içine çıkıntı yapan ve nispeten olgun Miyofibril 5 içeren, bağ olarak da bilinen parmak şeklinde çıkıntılar olarak düzenlenmiştir. Kalp geliştirme ilerledikçe, alt-epikardiyal bölgede kardiyomiyositler ventriküler duvarları içermektedir, ancak sarkomer ve myofibril montaj trabeküler miyokardın 5,6 ile karşılaştırıldığında gecikmiş olan kompakt miyokard oluşturmak için çoğalırlar.
Sarkomerinde ve myofibril montaj modelleri kültürlü basit ama bir üç boyutlu ortam, kan akışını eksikliği kardiyomiyositlerinde 7-10, ve diğer kardiyak hücre ile temas üzerine immunofloresan çalışmaları büyük ölçüde geliyorin vivo mevcut s. fare embriyonik merkezinde immünoflüoresans kullanarak Yüksek çözünürlüklü yapısal çalışmalar teknik olarak zorlu ve birkaç çalışma fare kalp gelişimi sırasında birleştirilmiş diskler ve costameres ortaya çıkmasını incelemiş bulunuyoruz. katenin β adherens kavşak proteini embriyonik gün birleştirilmiş diskler (E) 17.5 11, N-kaderin doğum sonrası gün 0 13 karşı E18.5 12 ile birleştirilmiş diskleri temsil edebilir lineer yapılara lokalize ve costameres tespit edilmiş lokalize görünüyor E18.5 14, ama bu proteinler önceki gelişimsel zaman noktalarında 11-13 de yaygın ve daha sürekli zar dağılımını gösterir.
Burada, biz intercala ortaya çıkması da dahil olmak üzere myofibril kardiyomyosit gelişimi ayrıntılı analizi, olanak immün ve kesitli fare embriyonik kalplerin floresan mikroskopi için basit ve tekrarlanabilir bir yöntem tarifted gibi erken E12.5 E16.5 ve de doğmakta olan costameres olarak diskler. Bu protokol, sarkomer oluşumu gibi myofibril kardiyomyosit olgunlaşması üzerindeki mutasyonlar etkilerini tarama için de yararlı olabilir.
Protokol
NOT: Tüm deneysel işlemler UCSF Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından kabul edildi.
1. Kriyoprezervasyon ve Embriyonik Fare Kalpler Fiksasyon.
1.1) embriyonik kalpleri Ek dondurma
- Optimal Kesme Sıcaklık 3,5 cm petri ve 7 mm'lik cryomolds doldurun (Ekim), orta (Malzeme Tablo). Kimyasal bir kaput, sıvı azot içinde bir 2-difluorobenzil bromür soğutun.
- 10 cm'lik petri kaplannın içinde, 3.5 cm'lik petri kaplarının içine, 10 ml PBS, fosfat tamponlu tuzlu su (PBS), 30 ml koyun, ve buz üzerinde her petri kapları yerleştirin. Bir 10 cm'lik çanak ve hamile fare başına birkaç 3,5 cm yemekler hazırlayın.
- Daha önce buz soğukluğunda PBS diseksiyon yapılması, 15 tarif edildiği gibi embriyolar izole edin.
- Kısaca, CO 2 narkoz ve servikal dislokasyon kullanarak hamile kadın euthanize.
- Karın bir kesi yapmak alo damarları keserek rahim teşrihrahim içi eğrilik ng ve buz soğukluğunda PBS içeren 10 cm'lik bir petri tabağına rahim aktarın.
- Buz soğukluğunda PBS içeren bağımsız bir 3.5 cm Petri için, her bir embriyonun transfer arasında rahim içinde kesilir. 15 anlatıldığı gibi, her embriyo izole edin.
- Ince forseps kullanılarak perikard boşluğu açın aorta, vena kava ve pulmoner venlerin de keserek uzak akciğer ve damar kalp kaldırmak ve OCT içeren 3,5 cm petri içine aktarın.
- Bundan sonra, kalp OCT içeren 7 mm'lik kalıba kalp transferi, birkaç saniye içinde Ekim muvazene edelim. Kalıbın dibine kalbin ön duvarını yönlendirin.
- Yavaşça, sıvı nitrojen soğutmalı 2-metilbütan içine kalıp yerleştirin. Kendine iyi bak 2-metilbütan sıvı Ekim veya kalp dokunmak için izin değil. Ekim beyaz katı kadar, sonra kuru buz içeren bir buz kovası için kalıp aktarmak dondurun. Bir sonraki embriyo üzerinde hareket ettirin.
- Wrap cryosectioning için hazır olana kadar -80 ° C 'de folyo ve mağaza cryomolds.
1.2) Alternatif: Paraformaldehit (PFA) sabitleme, soğukta koruyucu ve Ekim embriyonik kalpleri gömme
- 1x PBS içinde% 4 PFA ile 12-çukurlu bir doku kültür plakasının deliklerine doldurun.
- 1.1.3 açıklandığı gibi embriyonik kalpleri parçalara ayır. Iyi içeren% 4 PFA içine her kalp yerleştirin ve 4 ° CO / N ile sabitleyin.
- Donmaya karşı koruma sağlamak: plastik bir transfer pipeti kullanılarak, PBS içinde 1.5 ml% 15 sukroz ihtiva eden bir 1.5 ml mikrosantrifüj tüpü, her bir kalp hareket ve kalp tüpün dibine batar kadar yavaşça (4 ° C 'de O / N birkaç saat ajite ). PBS içinde% 30 sükroz, 1.5 ml mikrosantrifüj tüpü ihtiva eden 1.5 ml her kalp transfer ve kalp (O / N birkaç saat) tüpün dibine batar kadar yavaşça tekrar 4 ° C'de çalkalayın.
- Plastik bir transfer pipet kullanarak, Ekim içine Kriyo-korumalı kalp koyun ve muvazene edelimBirkaç dakika fazla sakaroz kaldırmak için, sonra OCT içeren 7 mm kalıp içine kalp aktarın. Kalıbın dibine kalbin ön duvarını yönlendirin.
- Sıvı azot içinde soğutulmuş 2-metilbütan veya kuru buz ya da kalıbı Ekim kalbin dondurun.
- Cryosectioning için hazır olana kadar -80 ° C 'de folyo ve mağaza cryomolds sarın.
2. Cryosectioning
- -17 ° C'ye ayarlayın kriyostat sıcaklığı.
- Talep kriyostat odasına cryomolds ve 15-20 dakika boyunca sıcaklığına gelmesini.
- Cryomold ters çevirin ve kalıp kalp bloğu çıkarmak için hafif baskı uygulayın. Kalıplı doku bloğu üstüne kalbin ön duvarını yönlendirin.
- Aynanın üzerine Ekim büyük bir damla yerleştirin ve aynasının üzerine dondurma Ekim damla üzerine kalp bloğu monte edin. Kalbin ön duvar aynası uzak olacak şekilde yönlendirmeyi tutun.
- Chuck yükleyin ve he monteKriyostat nesne tutucu üzerine sanat bloğu. Bıçağının açısı örnek 3-5 ° 'olacak şekilde ayarlayın.
- Pozitif yüklü bir kaplama ile önceden tedavi edilmiştir mikroskop lamı üzerine 10 um bölümler toplamak (Malzeme Tablo). -80 ° C'de saklamadan önce tamamen kurumasını bekleyin.
3. İmmünofloresan
- Ek Dondurulmuş kesitler için, tamir ve oda sıcaklığında bir çeker ocak içinde, 10 dakika boyunca aseton içinde doku geçirgenliği.
- Hızlı bir şekilde dondurulup PFA sabit bölümler için, Ekim ayrılması için 20 dakika süre ile, PBS% 0.1 Triton X-100 içinde inkübe ve PFA sabit bölümleri geçirgenliği.
- PBS içerisinde seyreltilmiş 1 x bloke edici tampon içinde 45 dakika için Blok.
- Oda sıcaklığında 45 dakika boyunca PBS% 0.1 Tween 20, 100 (Tartışma) farede üretilen bir birincil antikor kullanıldığında, eşek veya keçi anti-fare IgG (H + L): 1 seyreltilmiş, tek değerli Fab parçası içinde inkübe edilir.
- RT ya da 2 saat süre ile 1x bloke tamponu içinde seyreltilmiş birincil antikor veya antikorlar inkübeO / 4 ° C'de N (özel dilüsyonlarının için Malzemeleri / Ekipman Tablo).
- Oda sıcaklığında 10 dakika süre ile 1x PBS içinde üç kez bölümleri yıkayın.
- 1 seyreltilmiş Alexa Fluor-konjuge sekonder antikor inkübe: 500 ışıksız bir ortamda oda sıcaklığında 2 saat için bloke edici tampon içinde.
- Işıksız bir ortamda oda sıcaklığında 10 dakika boyunca 1 x PBS içinde üç kez bölümleri yıkayın.
- İsteğe bağlı: daha sonra, çekirdek etiket, PBS ile durulayın (ışıktan korunmuş olarak) oda sıcaklığında PBS içinde 2000: Hoechst boya inkübe 1 seyreltilmiştir.
- Sonrası düzeltme oda sıcaklığında 1 dakika boyunca,% 1 PFA bölümleri etiketli.
- Bir lamel ile kaplama daha sonra slayt her ucundaki orta iki damla yerleştirerek ve (çekirdekler zaten etiketli değilse DAPI ile) Dağı, anti-solmaya ortamında slaytlar. Mühür oje ile lamelleri. Mağaza görüntü hazır olana kadar 4 ° C'de ışıktan korunmuş bulunmaktadır.
4. Konfokal Görüntüleme ve Görüntü Analizi
- Uygun lazer dalga boylarında, kamera ve mikroskop konfokal inc açınsahne taşıyıcı ve z motoru luding. Görüntüleme yazılımı programı başlatın. Sırasıyla Hoechst-, Alexa 488- ve Alexa 568-boyanmış kesitler görüntülenmesi için 405, 488 ve 561 lazer dalga boylarını kullanarak.
NOT: Bizim donanım ve yazılım özellikleri için Malzeme Tablosu bakın. - Slayt sahnede kontrol slayt (ters mikroskop için aşağı lamel) monte edin.
- 4X objektif kullanılarak, (Malzeme Tablo) örnek ve ilgi alanını bulmak. Yüksek büyütme görüntüleme yaparken bir harita olarak kullanmak için görüntüyü yakalamak.
- Slayt sahneye az ayarlamalar yaparak, slayt çıkarın. 60x immersiyon yağı hedefi değiştirin, (Malzeme Tablo) objektif yağ küçük bir damla koyun ve slayt sahneye (aşağı lamel) slayt değiştirin.
- Yine örnek bulun. Her kanal için istenen seviyelere lazer gücü, pozlama süresini ve binning ayarlayın.
NOT: Biz genellikle lazer 0.8 gücünü, 100 msn kamera pozlama süresini ve 2 binning kullanın (see Malzemeleri Masa) donanım ve yazılım özellikleri için; Optimal ayarları ampirik her bir deney için tespit edilmesi gerekmektedir.- Optimal ayarları belirlendikten sonra, deney içinde tüm doku bölümleri için aynı ayarları kullanabilirsiniz. (Bu bilgi analizi için kullanılacak) Her kanal için optimum yoğunluk aralığını dikkat yoğunluk histogramı kullanın.
- Sonra z yığının üst ve alt sınırlarını seçin, uygun lazer kanalları seçin: edinim fonksiyonunu kullanarak az yığını oluşturun. Yazılım tarafından sağlanan optik dilim kalınlığı bir buçuk değer az yığın adım boyutunu seçin. Görüntüleri toplamak için "run" tıklayın.
- Fiji 16 veya görüntü analizi için benzer bir program kullanın. Fiji içinde, Özel renk modu seçeneği ve ayrı pencerelerde bölünmüş kanallar z yığın dosyasını açın. Menüsünden açılan Image "Parlaklık / Kontrast Ayarı" aracını açın; Her bir kanal içinde, sve optimum histogram yoğunluğu aralığı 4.5.1 belirledi. Tüm z yığınlarının bu kanal aralıkları uygulayın analiz edilir.
- Image-> Renk açılan menüsünü kullanarak tek bir kompozit görüntü içine tek tek kanalları Birleştirme.
- Tuşlayın-> Stacks-> z proje menüsü kullanılarak kompozit görüntü düzleştirilmiş z yığını oluşturun. Bu görüntü 3D görüntü önemli ölçüde daha parlak olacaktır; kontrol örneği doyma önlemek ve deneysel düzleşmiş z yığını aynı ayarları uygulamak için histogram yoğunluk aralığını ayarlayın.
- 3D görüntü oluşturmak için, önce kullanmak Image-> Stacks-> 3B proje menüsü 17. X ekseni veya dönme y-eksenini birini seçin. Z yığın adım büyüklüğü gibi mikron aynı sayıda olarak dilim aralığı ayarlayın. Istenen toplam rotasyon seçin ve sonra Eklentiler açılan menüden Image J 3D Görüntüleyici açmak 1. dönme açısı artışını ayarlamak. Cilt kompozit 4.8 oluşturulan görüntü, ekran seçin, ve Re set1 ya da 2 faktör örnekleme yapılmasıdır.
Sonuçlar
Bir çırpıda dondurulmuş ve aseton-sabit kalbinde farklı proteinlerin ortak boyama için 6 gösteri tipik sonuçlarla 2 Şekil. Söz konusu antikorun yeniden üretilebilir etiketli Z diskler, yüksek seçicilik ve en az bir arka plan (Şekiller 2A, 3A, 4A, 5A, 6A ve 6C) ile birleştirilmiş diskler s-α-aktinin Şekil 6 göstermektedir ki, anti-fare IgG (H + L), tek değerli Fab parçası etkili bir şekilde engeller, endojen fare IgG anti-fare ikincil antikorlar ile bağlanma. katenin β adherens birleşme proteinine karşı antikor kardiyomiyositlerde olmayan kardiyomiyosit hücrelerin hem de zara bağlı ve beklendiği gibi s-α-aktinin ile birlikte yeri, E16.5 (Şekil 2C ve D) olduğu varsayılan birleştirilmiş diskler oluştu Yetişkin kalp 18 β katenin boyama desen. βEmbriyonik merkezinde 1 integrini immünofloresan özellikle zordur ve çoğu zaman fokal yapışmalarda 14 tanımlamak için başarısız olur, ancak bu çalışmalarda β1 integrin boyama muhtemelen en oluşturucu oluşmakta olan costameres yansıtan s-α-aktinin etiketli Z diskler gibi eşit periyodikliğe sahip bir sinyal ortaya E16.5 (Şekil 3D).
E12.5, s-α-aktinin ve tropomiosin (sarkomer ince filaman proteini) imüno-s-α-aktinin bu hücreler (Şekil 4A ve 5A'da olgun myofibrils tutarlı trabeküler kardiyomiyositlerde normal periyodik bir boyama modeli ortaya koymuştur Şekil 4B tropomiyozin için). Muhtemelen interkalate diskleri temsil E12.5 kalpleri de trabeküler kardiyomiyositler N-kaderin boyama yoğun s-α-aktinin boyama alanlarında (C - - D ve Şekil 6A Şekil 5B) ile colocalize eğiliminde. Içindetrabeküler miyositlerine kontrast, kompakt bölgede s-α-aktinin doğrusal daha noktasal oldu, ve tropomiyozin boyama yaygın ziyade doğrusal oldu (Şekil 4A ve 4B). Böylece, sarkomer montaj trabeküler miyokarda göre kompakt daha sonra ortaya çıkabilir. Ayrıca, kompakt bölgesinde s-α-aktinin ve tropomiyozin ayırıcı desenler ince filament içine dahil edilmesine tropomiyozin myofibril mecliste bir sonraki olay olabilir iken bu s-α-aktinin, puncta ve erken olgunlaşmamış Z-diskler içine düzenler öneririz.
Şekil 7, Film 1 ve Film 2 PFA sabit E12.5 embriyonik kalp tipik sonuçları göstermektedir. Bu örneklerde, bir LifeAct-RFPruby transgenik embriyo görüntüleme için kullanıldı; LifeAct-RFPruby transgen 19 filamentli aktin etiketler ama PFC tespit gerektirir. S-α-aktinin ile etiketlenmiş Z diskler çok alanda görselleştirmek için kolay, ancak bir sinyal-gürültü oranı Decré oldu şekild dondurulmuş kalp bölümleri (Şekil 7A) göre ased; bu sinyal epitopların protein çapraz-bağlantılar tarafından maskelenebilir olan PFA sabit doku, s-α-aktinin imüno tipik. Şekil 7B, filamentli aktin'in eş canlandırılmasını göstermektedir miyofibril (ok uçları) içinde S-α-aktinin imüno trabeküler miyositlerde (oklar) bitişik endokardiyal hücreleri içinde ve ipliksi aktin. Üç boyutlu görüntü oluşturma ek ayrıntıları ortaya çıkarmıştır: tek tek kardiyomiyositlerde daha kolay kardiyomiyosit içinde Miyofibril kabaca birbirine paralel edildi ayırt edilmiştir, ancak tek tek kardiyomiyositlerde birbirinden (Şekil 7C ve D, film 1 ve Film 2 arasında değişen açılarda yönlendirilmiş ). endokardiyal hücreler ve kardiyomiyositlere arasındaki yakın yaklaşım iyi de üç boyutlu görünümler takdir edilmiştir.
">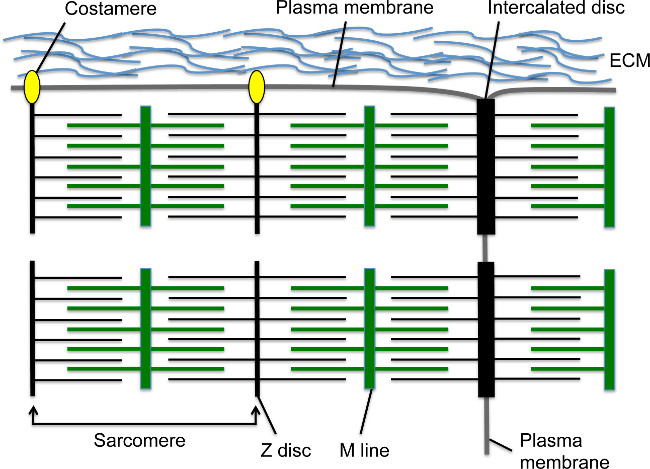
M serisi aktin filamentler üst üste miyozin lifleri, çapa yaparken Şekil 1. kardiyomiyosit sarkomer, interkalasyonlu diskler ve costameres. Z-disk, aktin filamentleri çapa. M serisi - - Z-disk ünitesi sarkomer bir Z-disk içerir. Seri olarak birden fazla sarkomer bir myofibril oluşturur. myofibril lateral ucu interkalasyonlu disk denilen özel bir hücre-hücre kavşak yapısına kardiyomiyosit enine sınırında içine ekler. Periferik kaslarında myofibriller kardiyomiyositlere arasındaki ekstraselüler matriks ile fokal yapışıklıklar oluşturan costameres aracılığıyla boyuna kardiyomiyosit plazma zarına bağlanır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
pload / 52.644 / 52644fig2.jpg "/>
Şekil 2. s-α -actinin ve embriyonik gün 16.5 β katenin immünofloresan. Kalp çıkarıldı, ek dondurulmuş, cryosectioned, aseton ile fikse edilmiş ve s-α-aktinin karşı (A), fare monoklonal klon EA53 antikoru kullanılarak immünohistokimyasal olarak boyanmış, burada etiketli kardiyomiyosit Z-disk ve birleştirilmiş diskler ve katenin β adherens birleşme proteinine karşı (B) tavşan polycloncal antikor. (C) Birleştirilmiş görüntüleri s-α-aktinin ve β katenin boyama gösterir. (D) Büyütülmüş paneli C ilgi alanı ; yıldızlarla işareti s-α-aktinin ve β katenin eş-lokalizasyonu ile birleştirilmiş diskleri tahmin. Görüntüler panelleri AC sol üst epikardiyal tabaka ile, periferik sol ventrikül duvar veya kompakt myokardda elde edilmiştir. O dışarı Yoğunluk histogram görüntü aralığı 460-1600 (f mümkün 0-65.535) hem s-α-aktinin / 488 nm ve β katenin / 561 nm lazer kanallar için. Ölçek çubuğu 10 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
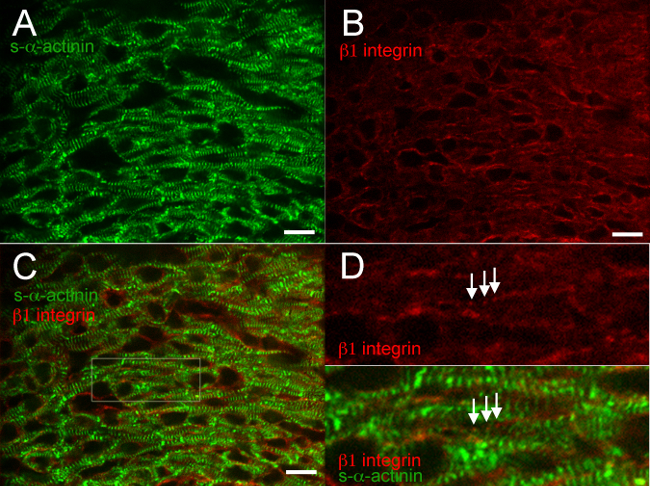
Şekil 3. s-α -actinin ve embriyonik gün 16.5 1 integrin immünofloresan β. Kalp çıkarıldı, ek dondurulmuş, cryosectioned, aseton ile fikse edilmiş ve s-α-aktinin karşı (A), fare monoklonal antikoru EA53 klonu kullanılarak immunosteyn ve integrin β1 fokal yapışma proteinine karşı (B), keçi poliklonal antikor. (C) birleştirilmiş ve görüntüler kardiyomiyosit olarak β1 integrini ve non-kardiyomiyosit hücreleri göstermektedir. Not hem yaygın vekardiyomiyositler integrin β1 sinyali noktalı (D) Z-diskler s-α-aktinin-boyama yakındaki benzer dönemsellik panel C. Not punktat, periyodik β1 integrin boyama (oklar) ilgi alanı Büyütülmüş.; Bu yapıların costameres temsil edebilir. Çıkan sol ventrikül kompakt miyokard elde edilmiştir. Β1 integrin / 561 nm lazer kanal için s-α-aktinin / 488 nm lazer kanal ve 460-600 için (mümkünse 0-65.535 dışarı) Yoğunluk histogram görüntüleme aralığı 460-1200. Ölçek çubuğu 10 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
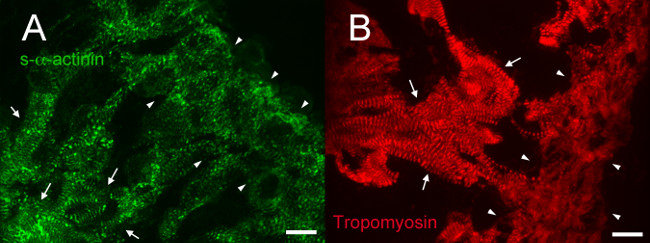
Şekil 4. s- α -actinin ve embriyonik gün 12.5 at tropomiyozin immünoflüoresans: myofibril organizasyonunda trabeküler ve kompakt miyokard. yavru embriyolardan Kalpler eksize edildi, dondurulmuş, cryosectioned, aseton ile fikse edilmiş ve myofibril ince filaman karşı s-α-aktinin ve (B) fare monoklonal antikora karşı (A), fare monoklonal klon EA53 antikoru kullanılarak immunosteyn oturmaktadır Protein tropomiyozin (Gelişim Çalışmaları Hibridoma Bankası CH1). Trabeküler (oklar) ve kompakt miyokard (ok başları) gösterilir. Sıkı tabakanın (A) puncta aynı zamanda lineer boyama dahil boyanma bir dizi kıyasla trabeküler miyokardiyumda normal periyodik doğrusal s-α-aktinin boyama, dikkat edin. Ayrıca kompakt miyokardiyumda trabeküler miyokardiyumda düzenli dönemsellik ama daha yaygın boyama ile doğrusal tropomiyozin boyama unutmayın. Tropomiyozin kanalı için s-α-aktinin kanalı ve 460-1,000 için (mümkünse 0-65.535 dışarı) Yoğunluk histogram görüntüleme aralığı 460-1,400. Ölçek çubuğu 10 mikron."Https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" target = "_ blank"> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
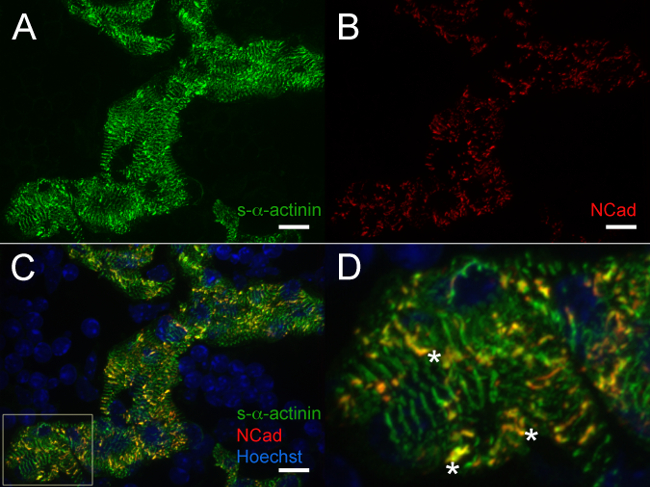
Şekil 5. s-α -actinin ve embriyonik gün 12.5 N-kadherin immünofloresan:. Trabeküler kardiyomiyositlerde Miyofibril ve araya diskler kalp çıkarıldı, ek dondurulmuş, cryosectioned, (A), fare monoklonal klon EA53 Aseton kullanılarak sabitlenmiş, ve immunosteyn s-α-aktinin ve fokal yapışma proteini, N-kaderin karşı (B), tavşan poliklonal antikora karşı antikor. 0.2 mikron optik dilim az yığını olarak toplandı ve z yığınları görüntüler oluşturmak için düzleştirilmiş edildi. (C) Birleştirilmiş basık yığınları trabeküler kardiyomiyositlere içinde N-kaderin ve s-α-aktinin boyama hem göstermek well Panel C ilgi Hoechst boyası ile etiketlenmiş çekirdekleri (D) Büyütülmüş alanı olarak.; yıldız s-α-aktinin ve N-kaderin ortak lokalizasyonu ile birleştirilmiş diskleri işaretleyin. S-α-aktinin / 488 nm ve N-kaderin / 561 nm lazer kanalları hem Hoechst / 405 nm lazer kanal için (mümkünse 0-65.535 dışarı) ve 470-2,000 Yoğunluk histogram görüntüleme aralığı 470-1,200. Ölçek çubuğu 10 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
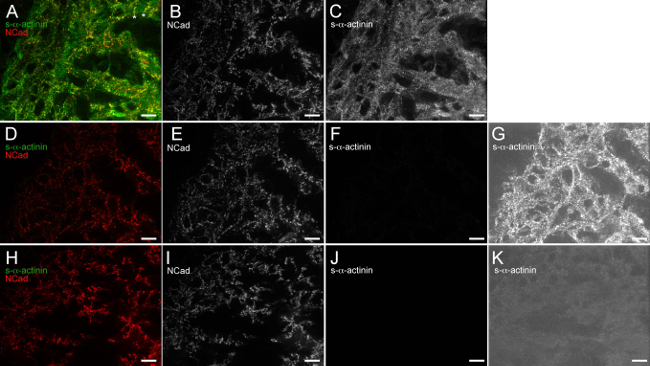
Şekil 6. Anti-fare IgG (H + L), tek değerli Fab parçası etkili bir şekilde bloke endojen fare anti-fare ikincil antikorlar ile bağlanma IgG. Embriyonik kalp çıkarıldı E12.5, ek aseton sabitlenmiş, cryosectioned ve immunosteyn, donduruldu. (AC) Bölümler, N-kaderin karşı s-α-aktinin ve tavşan poliklonal primer antikora karşı fare monoklonal klonu EA53 birincil antikor maruz, anti-fare IgG, tek değerli Fab fragmanı ve ardından 1 x bloke edici tampon ile bloke yıkandı ve maruz bırakıldı Alexa Fluor 488 anti-fare ve Alexa Fluor 586 anti-tavşan ikincil antikorlar. yoğunluk histogram görüntüleme aralığı 480-2500 kullanarak (A) Birleştirilmiş görüntünün (mümkünse 0-65.535 dışarı). Yıldızlarla notu bölgeler olan N-kaderin sinyali. Olasılıkla doğmakta interkalate diskleri temsil trabeküler kardiyomiyositlerinin, enine sonuna sınırlı (B) N-kaderin-tek yoğunluk histogram görüntüleme aralığı 480-2,500 kullanarak kanal edilir. (C) s-α -actinin sadece yoğunluk histogram görüntüleme aralığı 480-2,500 kullanarak kanal. (DG) Bölümler tavşan poliklonal maruz, 1x engelleme tampon sadece (hiçbir anti-fare IgG tek değerlikli Fab fragmanı engelleme adımı) ile bloke edildiN-kadherin, sadece (herhangi bir fare monoklonal birincil antikor) yıkandı ve Alexa Fluor 488, anti-fare ve Alexa Fluor 586 anti-tavşan sekonder antikor maruz bırakılmıştır. (D) karşı birincil antikor yoğunluğu histogram ekranı aralığı 480-2500 kullanarak görüntü birleştirilmiştir. (E) N-kaderin-tek yoğunluk histogram görüntüleme aralığı 480-2500 kullanarak kanal. (F) s-α-aktinin sadece yoğunluk histogram görüntüleme aralığı 480-2,500 kullanarak kanal. (G) s-α-aktinin-tek kanal kullanarak anti-fare IgG, tek değerli Fab parçası bloke aşamasının bulunmadığı ortamda, endojen fare IgG arka algılama ortaya yüksek hassasiyetli yoğunluk histogramı gösterge aralığı 480-530. (HK) Bölümler anti-fare IgG'si ve ardından 1 x bloke edici tamponu ile bloke edilmiştir tek değerli Fab parçası, N-kadherin (herhangi bir fare monoklonal birincil antikor) yıkandı karşı tavşan poliklonal birincil antikora maruz bırakılır ve Alexa Fluor 488, anti-fare ve A maruzlexa Fluor 586 anti-tavşan ikincil antikorlar. (H) yoğunluk histogram görüntüleme aralığı 480-2,500 kullanarak görüntü birleşti. (I) N-kaderin-tek yoğunluk histogram görüntüleme aralığı 480-2,500 kullanarak kanal. (J) s-α-actinin- sadece kanal yoğunluğu histogram görüntüleme aralığı 480-2,500 kullanarak. (K) s-α-aktinin sadece arka plan endojen fare IgG tespiti eksikliği gösterir, yüksek hassasiyet yoğunluğu histogram görüntüleme aralığı 480-530 kullanarak kanal zaman anti-fare IgG tek değerlikli Fab fragmanı engelleme adımı kullanılır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
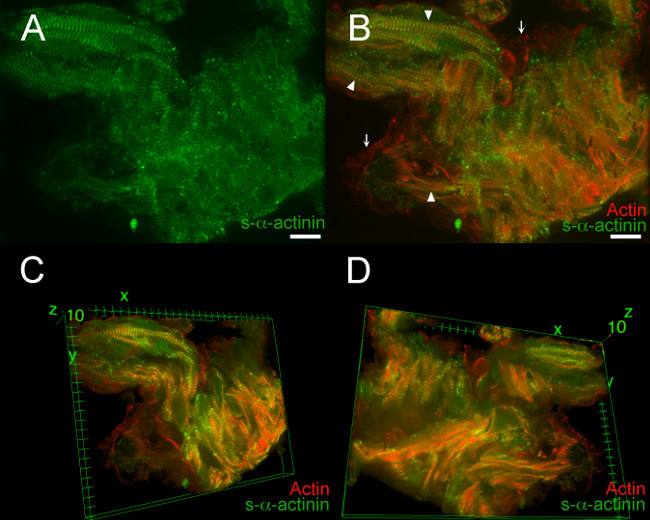
Şekil 7. s- α -actinin ve trabeküler Cardi aktin organizasyonus-α-aktinin karşı fare monoklonal klon EA53 antikor Z diskler ve birleştirilmiş diskler etiketlemek için kullanıldı olurken embriyonik gün 12,5 omyocytes. LifeAct-RFPruby transjenik fare soyu, lifli aktin 19 görselleştirmek için kullanılmıştır. Embriyolar PFA-tespit edildi. 0.2 um optik dilim az yığın olarak toplanmıştır (A) Düz z yığın s-α-aktinin boyama hızlı bir şekilde dondurulup aseton sabit bölümleri (Şekil 2-5) göre PFA sabit dokuda daha yaygın olduğunu gösteriyor.. (B ) Düz z yığın ipliksi aktin ve hem s-α-aktinin gösterir. Kaslarında myofibriller (ok uçları) içinde Z-diskler arasında lokalize İpliksi aktin floresan. İpliksi aktin floresan da trabeküler miyositleri (oklar) hat endokardiyal hücreler görüldü. (C) yığının üst bakıldığında trabeküler kardiyomiyositlerinin Üç boyutlu görünümü. (D) Üç boyutlu görünümtrabeküler kardiyomiyositler olarak yığının altından inceledi. Yoğunluk Histogram görüntüleme aralığı 470-900 (mümkün 0-65.535 dışarı) 488 nm lazer kanal ve A ve B 561 nm lazer kanal için hem; C ve D Ölçek bar 10 mikron her iki kanal için görüntü aralığı 460-800. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Film 1. S- α -actinin ve embriyonik günde 12.5 ile trabeküler kardiyomiyositlerde aktin örgütünün 360 ° dönme 3D görünümü. Şekil 6 görüntü yığını Fiji görüntü analiz programı dahilinde Resim J 3D Görüntüleyici eklentisi kullanarak üç boyutlu hale getirildi. Yoğunluk Histogram görüntüleme aralığı 470-800 (mümkün 0-65.535 dışarı) 488 nm ve 561 nm lazer kanalları hem.
Film 2. Embriyonik günde 12.5 ile trabeküler kardiyomiyositlerde s- α -actinin ve aktin örgütü Seçilmiş 3D görünümleri. Şekil 6 görüntü yığını Fiji görüntü analiz programı dahilinde Resim J 3D Görüntüleyici eklentisi kullanarak üç boyutlu hale getirildi. X, y ve z eksenleri etrafında küçük rotasyonlar nispeten kardiyomiyositlere ama çoğu kardiyomiyositlere arasındaki zayıf uyum içinde Miyofibril hizalanmış gösterdi. Küçük rotasyonlar da kardiyomiyositlere etrafında s-α-aktinin eksik endokardiyal hücrelerinin yakın yaklaşım gösterdi. Yoğunluk Histogram ekran aralığı 470-800 488 nm ve 561 nm lazer kanalları hem (mümkün 0-65.535 dışarı).
Tartışmalar
uygun doku fiksasyon tekniği ve seyreltme ampirik her bir antikor için belirlenmelidir. Elimizde olanlar, ek donma s-α-aktinin, β-katenin, β1-integrin, tropomiosin, Talin ™ (gösterilmemiştir) ve N-kaderin dahil olmak üzere birçok kardiyomiyosit antijenleri, PFA tespit üstündür; aksine, PFA tespit fokal yapışma kinaz için daha iyi sonuçlar elde edilir (gösterilmemiştir). PFA tarafından oluşturulan protein çapraz bağlarının epitopları ve sınır antikor bağlanma maskeleyebilir; antijen geri alma gibi durumlarda gerekli olabilir ve antijen alma yöntemleri başka 20 bulunabilir. PFA konsantrasyon veya Sabitleme uzunluğu ampirik her bir antikor için ve her bir gelişme aşamasında tespit edilen optimal şartlara epitop maskeleme azaltmak için azaltılabilir. Primer antikor kontrol olarak bağışıklık-öncesi serumun bir "birincil antikoru" co içeren yeni bir antikor ya da kardiyak mutantını karakterize ederken, uygun negatif kontrollere kullanılmalıdırntrol. Nakavt farelerin kullanılması ideal bir negatif kontrol ancak erken öldürücülüğü burada okudu gen ürünlerinin çoğu için kullanımını önler.
Yeterli hacimlerinin kullanımı tamamen aynı immunofloresan engelleme, antikor deney ve kontrol slaytlar batırmak için, ve çözümlere bölümlerin tek tip pozlama sağlamak için inkübasyon sırasında slaytlar nazik sallanan olarak yıkama çözümleri önemliydi. Bu yaklaşım, bir deney içinde bölümlere ve slaytlar arasında boyanarak teknik değişkenlik minimize. Maliyetli antikor çözeltisi hacmi sınırlar olduğunda, doku bölümleri dışında çözüm akışını sınırlandırmak ve uzun inkubasyon sırasında bir nemlendirilmiş oda içinde slaytlar tutmak için Pap kalem kullanın. Bir monoklonal fare birincil antikor - ve bu nedenle, bir anti-fare ikincil antikoru - kullanılıyor, endojen fare immünoglobülinleri kapsayacak şekilde ikinci bloke edici aşama, spesifik olmayan arka plan sinyali azaltmak için gerekli olan (adım 3.4) olur.
Uygun mikroskopi ve görüntü işleme teknikleri biyolojik doğru bilgi edinme 21 için kritik öneme sahiptir. Her renk için - (16-bit görüntü için 65535 seviyesi 0) yoğunluk histogramı her yoğunluk seviyesinde piksel dağılımını gösterir. Arka plan, parlaklık, kontrast ve Histogram tepe kuşatan bir yoğunluk görüntü aralığını ayarlayarak ayarlanabilir; koşulları arasında geçerli karşılaştırmalar yapmak, kontrol ve deney koşulları arasında aynı ayarları kullanılmalıdır.
Bu protokol, yerli embriyonik fare kalbinde kardiyomiyosit olgunlaşmasını ve gelişmesini analiz etmek için güvenilir bir yöntem sağlar. Kardiyomiyosit-spesifik proteinlerin immünofloresan sık sık gelişimi sırasında kardiyomiyositlerde işaretlemek için kullanılır iken, birkaç çalışmada yüksek çözünürlüklü myofibril yapının analizi ve birleştirilmiş diskler ve costameres 12-14,22,23 çıkışına izin tekniklerini kullanır. Bu teknik, v için kullanılabilirYapısal anormallikler mekanizmalarına ışık tutabilir kardiyomiyosit olgunlaşmasında değişikliklerin belirlenmesi bir aracı olarak, gelişimsel kalp kusurlarına neden mutasyonlar ivo değerlendirmesi.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Referanslar
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır