Method Article
Medición y Análisis de la producción de ácido extracelular para Determinar glicolítica Rate
En este artículo
Resumen
Glycolysis is a defining metabolic marker in multiple biological systems. Monitoring glycolysis by measuring the extracellular flux of H+ is common, but requires correction to be quantitative and unambiguous. Here, we demonstrate how to gather and correct extracellular flux data to distinguish between respiratory and glycolytic sources of extracellular acidification.
Resumen
Extracellular measurement of oxygen consumption and acid production is a simple and powerful way to monitor rates of respiration and glycolysis1. Both mitochondrial (respiration) and non-mitochondrial (other redox) reactions consume oxygen, but these reactions can be easily distinguished by chemical inhibition of mitochondrial respiration. However, while mitochondrial oxygen consumption is an unambiguous and direct measurement of respiration rate2, the same is not true for extracellular acid production and its relationship to glycolytic rate 3-6. Extracellular acid produced by cells is derived from both lactate, produced by anaerobic glycolysis, and CO2, produced in the citric acid cycle during respiration. For glycolysis, the conversion of glucose to lactate- + H+ and the export of products into the assay medium is the source of glycolytic acidification. For respiration, the export of CO2, hydration to H2CO3 and dissociation to HCO3- + H+ is the source of respiratory acidification. The proportions of glycolytic and respiratory acidification depend on the experimental conditions, including cell type and substrate(s) provided, and can range from nearly 100% glycolytic acidification to nearly 100% respiratory acidification 6. Here, we demonstrate the data collection and calculation methods needed to determine respiratory and glycolytic contributions to total extracellular acidification by whole cells in culture using C2C12 myoblast cells as a model.
Introducción
El objetivo general de este método es medir con exactitud la tasa glucolítica de células por medio de análisis de flujo extracelular. La medición cuantitativa de la tasa glucolítica utilizando acidificación extracelular es el punto final deseado de muchos experimentos. Sin embargo, la tasa total de la acidificación extracelular es la suma de dos componentes: la acidificación respiratoria, en forma de CO 2 (que hidrata a H 2 CO 3 y luego se disocia de HCO 3 - + H +), y la acidificación glicolítica, en forma de lactato - + H +.
Las contribuciones de CO 2 a la acidificación extracelular total de hasta hace poco han sido considerados insignificantes en la plataforma de medición utilizado aquí, el analizador XF24 7. Sin embargo, es evidente en otros múltiples sistemas que el CO2 puede ser un importante contribuyente a 04.05 acidificación extracelular. Múltiples documentos reconocen esta estafacontribución, pero no intente cuantificación directa de CO 2 -derivado 3,8,9 ácido. Recientemente hemos demostrado cuantitativamente que la producción de CO2 es una fuente importante de acidificación extracelular en este sistema 6. Por otra parte, aunque hay múltiples vías metabólicas que generan CO 2 del catabolismo de la glucosa, las realizadas por deshidrogenasas matriz en el ciclo del ácido cítrico son los contribuyentes abrumadoras y todas las demás fuentes generan cantidades de CO 2 que se encuentran dentro del error experimental 6.
Sin la corrección de producción de CO 2, la acidificación extracelular, por tanto, es un indicador de la tasa de ambigua glucolítica y no se puede utilizar cuantitativamente. Nuestra publicación anterior pone de manifiesto varios casos en que respiratoria CO 2 comprende la mayor parte de la señal total acidificación, incluso en las células en general se cree que utilizar principalmente la glucólisis 6. Además, elrespiratoria CO 2 contribución a la acidificación total varía ampliamente durante el curso de los experimentos de perfiles metabólicos comunes, lo que demuestra que la correcta comparación de la tasa glucolítica durante las diferentes partes de un experimento requiere corrección para el CO 2.
Para medir la tasa glucolítica de células por medio de la tasa de acidificación extracelular, es necesario convertir los cambios de pH a los cambios en total H + generados, y para restar la acidificación extracelular causada por CO 2 liberado durante el funcionamiento del ciclo del ácido cítrico. Aquí se describe un método sencillo para medir la tasa de producción de protones extracelular (de cambios extracelulares en el pH y la potencia calibrada tampón del medio de ensayo) y la producción de CO 2 (a partir de los cambios extracelulares en O 2 concentración), y demostrar cómo calcular la tasa glucolítica el uso de estas mediciones.
Esta fortaleza método ens la utilidad de la medición de la acidificación extracelular, al usarla para calcular correctamente tasa glicolítica tal como se define por la producción de lactato. Sin corrección para CO respiratoria 2 (o la medición directa de lactato), es imposible para determinar si y en qué medida la tasa total de la acidificación refleja tasa glucolítica, confundiendo la interpretación de los experimentos que utilizan la acidificación extracelular total como medida directa de la producción de lactato.
CÁLCULOS
CO 2 y el lactato son, dentro del error experimental, los dos únicos contribuyentes a la producción de ácido extracelular, basados en experimentos con células de mioblastos 6. Por lo tanto, la tasa de acidificación extracelular total de (PPR, la tasa de producción de protones) se puede definir como:
PPR tot = PPR resp + PPR Glyc Ecuación 1
. _content "> donde tot = total, resp = respiratoria; Glyc = glucolítica glicolítica PPR es así:PPR Glyc = PPR tot - PPR resp Ecuación 2
Aquí,
PPR tot = ECAR tot / BP Ecuación 3
donde ECAR = tasa de acidificación extracelular (mph / min), y BP = poder tampón (mph / pmol H + en 7 l), mientras que
PPR resp = (10 pH-pK 1 / (1 + 10 pH-pK 1)) (máx H + / S 2) (OCR tot - OCR rot / myx) Ecuación 4
donde K 1 = constante de equilibrio combinado de CO 2 de hidratación y la disociación de HCO 3 - + H +; max H + / S 2 = XXe CO 2 acidificación -derivado de una transformación metabólica particular, tales como la oxidación completa de la glucosa 6; OCR = tasa de consumo de oxígeno (O 2 pmol / min), y OCR rot / myx = no mitocondrial OCR.
Ecuación 4 aísla mitocondrial OCR restando cualquier OCR no mitocondrial (definido como OCR que es resistente a los venenos respiratoria rotenona y myxothiazol mitocondrial) y representa el máximo de H + generado por O 2 consumido para cada sustrato (max H + / O 2 ) (ver 6), así como la proporción de CO 2 dando lugar a H + a la temperatura experimental y pH (10 pH-pK 1 / (1 + 10 pH-pK 1). Para la oxidación completa de la glucosa, oxígeno mitocondrial Consumo Rate (OCR) es exactamente igual a la tasa de producción de CO 2. En el volumen de ensayo confinados de la medición de flujo extracelular, CO 2 productosd por la respiración permanece atrapado en el medio de ensayo. La mayoría de los atrapados CO 2 se hidrata a H 2 CO 3, que luego se disocia de HCO 3 - + H +. Una pequeña fracción permanece disuelto pero no hidratada, y otra pequeña fracción es hidratado pero no disociado, según lo dictado termodinámicamente por la constante de equilibrio combinado de CO 2 hidratación y la disociación de HCO 3 - + H + a temperatura experimental (37 ° C) y pH (~ 7,4).
Por lo tanto, la ecuación completa para el cálculo de PPR g restando PPR resp del PPR tot es:
PPR Glyc = ECAR tot / BP - (10 pH-pK 1 / (1 + 10 pH-pK 1)) (máx H + / S 2) (OCR tot - OCR rot / myx) Ecuación 5
yon esta manera, las tasas de respiración y la glucolisis, así como sus tasas de producción de ATP asociados, puede determinarse cuantitativamente a partir de mediciones directas (consumo de oxígeno, la acidificación extracelular, capacidad de tamponamiento) y la importación o el cálculo de otros valores requeridos (H + E / S 2 , P / O, y el equilibrio constante K 1) 6. El experimento descrito aquí se expande sobre las técnicas estándar para usar el extracelular Flux Analizador como Seahorse XF24 10,11; para otros formatos de medición de flujo extracelular (por ejemplo, XF e 96, o XFP), todos los volúmenes inferiores deben ser escalados apropiadamente.
El poder de tamponamiento del medio de ensayo se puede medir por la construcción de una curva estándar, ya sea directamente en la plataforma de flujo extracelular o por separado usando una sonda de pH calibrado. Aquí, se dan tres opciones para medir buffering por el medio de ensayo de flujo extracelular, incluyendo el uso de todos los injectien los puertos del analizador de flujo extracelular con pocillos de muestras libres de células, o usando sólo el último puerto de inyección en pozos que contiene células (sección 1) o mediante el uso de una medición de pH externo (sección 2). Consulte la hoja de cálculo adjunta para los cálculos completos de datos de ejemplo.
Para medir la potencia utilizando la capacidad amortiguadora del pH de detección del instrumento de flujo extracelular, lo más seguro es utilizar pozos sin células para minimizar la variación de la señal. Sin embargo, dentro del error, no existe diferencia estadística entre libre de células y los pozos cuando se realiza esta medición que contiene células (datos no presentados). NOTA: La variación descrito en la etapa 1.7 lleva la ventaja de dar cuenta de los cambios potenciales para el almacenamiento en búfer conferidos por compuestos añadidos o por la presencia de células, con la desventaja de señal más ruido. Sin embargo, como se ha indicado anteriormente, no se encontraron diferencias significativas en el poder tampón calculada entre el diseño libre de células se muestra en la Tabla 1 yel diseño post-experimento en la Tabla 2, en las condiciones experimentales descritas aquí.
Además, en rangos pequeños ΔpH (<0,4 unidades; experimentalmente mejor restringidas a 0,2 unidades), la pendiente lineal obtiene representando Δ MPH / pmol H + aproxima adecuadamente la relación logarítmica entre ΔpH y [H +]. La pendiente de esta curva estándar por lo tanto, representa el poder tampón del medio de ensayo bajo prueba en pH / nmol H + en 7 l, o mph / pmol H + en 7 l. Se recomienda aumentar el poder de tamponamiento medio o disminución de la densidad celular para las muestras que exceden un cambio unitario 0,2 pH durante el tiempo de medición. El tiempo de medición también se puede disminuir, pero esto puede reducir la tasa de acidificación estado estacionario e introducir error en el cálculo de la tasa.
Protocolo
1. Medición de búfer de energía en un flujo Instrumento extracelular: Dos Variaciones
NOTA: los cálculos y métodos descritos aquí se desarrollaron utilizando un extracelular Flux Analizador. Para otros instrumentos, el volumen de medición debe hacerse a escala adecuada.
- Preparar 0,1 M HCl estándar en agua usando HCl concentrado (ver Materiales y Equipos) de acuerdo con las instrucciones del fabricante.
Nota: Un ejemplo de cálculo para preparar las inyecciones de HCl para su uso en los cuatro puertos de inyección se muestra en la Tabla 1:

Tabla 1. consecutivos inyecciones de HCl en un ensayo de flujo extracelular así.
- Preparar diluciones del patrón HCl en el medio a ensayar como en la Tabla 1 para el número de repeticiones técnica siendo carrIED en un plato, más uno para permitir que para el error de pipeteo, por ejemplo, durante cuatro repeticiones técnica del puerto Una inyección, prepare un stock de (1,1 l x 5) HCl 0,1 M en (48,9 l x 5) medio de ensayo.
- Distribuir 50 l en cada puerto A del cartucho sonda de medición. Repita este procedimiento para el resto de los puertos B, C y D.
- Ejecutar un ensayo de flujo extracelular 10 con un ciclo de calibración estándar, seguido por dos ciclos de [mezcla 2 min, 1 min de espera, y la medición 5 min] para cada una de las cuatro adiciones de puerto (véase la Figura 2).
- Programar el experimento anterior en el software de instrumento de acuerdo con las instrucciones del software. Cargar el cartucho preparado en la máquina y realizar la calibración de acuerdo con las instrucciones de software.
- Cuando se le pregunte por el programa, quite la placa que contiene calibrante-e inserte la placa que contiene medio de ensayo en cada pocillo en el instrumento; continuar el programa.
- U cantar la media de 8-10 puntos de datos obtenidos en estado estacionario (típicamente los últimos 8-10 puntos) antes y después de cada adición puerto, calcular la diferencia (acumulativo) en el pH (ΔpH) causado por cada inyección de ácido estándar.
- Trazar ΔpH contra nmol H + contenido en el volumen 7 l atrapado por la sonda de medición. La pendiente lineal es el poder tampón (BP) en mph / pmol H +.
- Como alternativa a los pasos 1,2-1,3, llevar a cabo las mediciones ΔpH tras un ensayo en el que los puertos A, B y C se utilizan para la realización de un experimento, seguido de una inyección HCl en Puerto D. Como en la Tabla 2, cuatro repeticiones técnica son utilizado para generar cada punto de una curva estándar de 5 puntos en los 20 pozos experimentales (con exclusión de los pozos de corrección de temperatura de cuatro fondo) de la placa de ensayo de flujo extracelular.
53464table2.jpg "/>
Tabla 2. HCl sola inyección en un ensayo de flujo extracelular también.
2. Medición de búfer de energía El uso de un medidor de pH externo
NOTA: Para medir el poder de tamponamiento de un medio usando una sonda de pH externo, calibrar la sonda a 37 ° C y mantener esta temperatura durante todos los reactivos durante el experimento.
- Preparar 0,1 M HCl estándar en agua usando HCl concentrado de acuerdo con las instrucciones del fabricante.
- Sonda de pH caliente, las normas de pH, el medio de ensayo cuyo poder de tamponamiento se va a medir, y 0,1 M de HCl a 37 ° C en un baño de agua.
- Calibrar sonda de pH a 37 ° C de acuerdo con las instrucciones del fabricante. Mantener todos los reactivos a 37 ° C durante todo el ensayo utilizando una placa de calor o baño de agua.
- Alícuota de 10 ml del medio de ensayo en un pequeño vaso de precipitados o tubo cónico. Monitorear el pH de forma continua utilizando una sonda de pH sumergido.
- Añadir HCl 0,1 M a la comodecir medio en 10-20 alícuotas.
- Asegurar una mezcla mediante el uso de una barra de agitación o por agitación manualmente el recipiente después de cada adición de ácido.
- Espere unos segundos para la medición de pH se estabilice y luego grabar el pH después de cada adición.
- Como se demuestra en la Tabla 3, que un número suficiente de adiciones para asegurar cálculo de la pendiente correcta y para cubrir el rango de pH esperado durante el experimento.

Tabla 3. Medición de poder tampón utilizando un medidor de pH. Los datos representan un experimento típico con seis 20 mu l de HCl 0,1 adiciones M.
- Parcela ΔpH contra nmol H + añadido por 7 l, dando una pendiente lineal que representa el poder tampón (Figura 1).
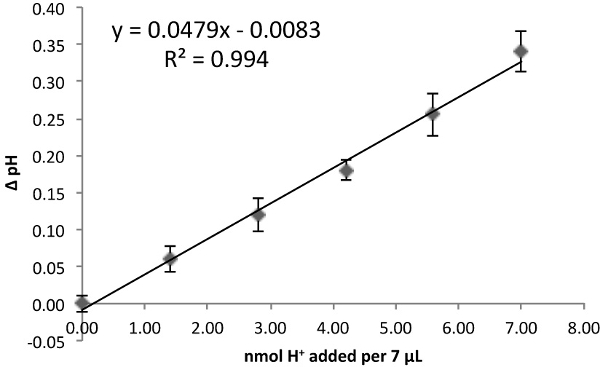
Figura 1. La determinación de poder tampón. Curva estándar HCl mide como en la Tabla 1, Tabla 2 o (aquí) como en la Tabla 3. La pendiente de la curva de ajuste lineal da el poder de tamponamiento (pH / nmol H + en 7 l). Cada punto representa la media ± SEM de n = 9 repeticiones técnica.
- Una vez que el poder tampón se conoce a través Método 1 o 2 anterior, convertir la señal ECAR (mph / min) para PPR (H + / proteína min / g pmol) dividiendo ECAR por la precarga de potencia (BP) (mph / pmol H +) y la ampliación del contenido de proteína de cada pocillo:
PPR tot (pmol H + / min / mg de proteína) = ECAR (mph / min) / BP (mph / pmol H + en 7 l) / proteína por pozo (g) La ecuación 6 - Como alternativa, utilice los mismos experimentos en Métodos 1 o 2 para calcular el (BC) Valor Buffering Capacidad utilizada por el software del instrumento para calcular automáticamente PPR durante la recolección de datos.
NOTA: El manual del usuario del instrumento 12 (página 107) proporciona información detallada sobre el cálculo y el uso de la capacidad amortiguadora, donde antes de Cristo se describe como
BC (mol / L) = moles H + / (ΔpH volumen de tampón x (L)) Ecuación 7
NOTA: La capacidad de tamponamiento tal como se define en la Ecuación 7 se puede calcular en los ensayos de instrumento o sonda de pH externo descritos anteriormente. Conversión entre el poder tampón y capacidad de amortiguación se hace fácilmente (ver hoja de cálculo adjunta):
BC = 1 x 10 -9 / BP ((mph / pmol H + en 7 l) / 7 l) La ecuación 8
NOTA: Si se conoce antes de realizar el ensayo, la capacidad de amortiguación se puede introducir directamente en el software del instrumento durante la configuración experimental. - Aplicar este procedimiento y los cálculos utilizados anteriormente para la mayoría de los sistemas tampón convencionales, como se describe en la publicación anterior 6.
NOTA: La Tabla 4 enumera el poder tampón y capacidad amortiguadora de varios medios de comunicación convencionales.
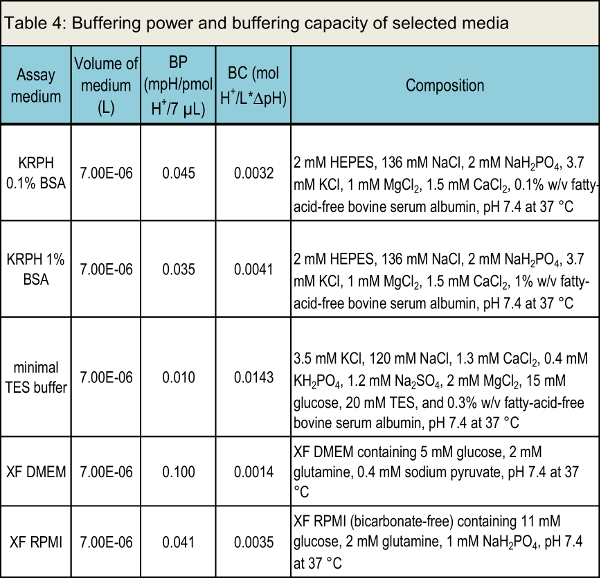
Tabla 4. poder tampón y capacidad de amortiguación de los medios seleccionados.
3. Realización de un Ensayo de flujo extracelular utilizando células C2C12 mioblastos
NOTA: En el paso 3.4.3, no hubo diferencias observadas en CO 2 -derivado dependiente de la producción de ácido en la presencia de la anhidrasa carbónica en la cultura C2C12, lo que sugiere que su presencia no es necesaria para la plena conversión de CO 2 a la HCO 3 - + H +. Sin embargo, la prueba empíricamente esto en diferentes sistemas experimentales se recomienda antes de omanhidrasa carbónica itting.
- Cultura del ratón C2C12 mioblastos 13 a 37 ° C bajo 95% de aire / 5% de CO2 en medio de Eagle modificado por Dulbecco (DMEM) con glucosa 11,1 mM, glutamina 2 mM, 10% v / suero bovino fetal v (FBS), 100 U / ml penicilina y 100 mg / ml de estreptomicina.
- 24 hr antes del ensayo, las células / placa de semillas en 100 l de medio de cultivo de la misma a 20.000 células / pocillo en una placa de ensayo de 24 pocillos de poliestireno extracelular de flujo (ver Materiales y Métodos) sin la capa adicional.
- Diluir oligomicina, FCCP, y la rotenona más myxothiazol, y HCl (opcional) a 10x concentración final de Krebs Ringer fosfato HEPES (KRPH) medio de ensayo (2 mM HEPES, NaCl 136 mM, 2 mM NaH 2 PO 4, 3,7 mM KCl, 1 2 mM de MgCl, 1,5 mM CaCl 2, 0,1% w / v albúmina de suero bovino graso libre de ácido, pH 7,4 a 37 ° C).
- Preparación celular
- 30 min antes del ensayo, las células adherentes lavar tres veces por aspiración a gently eliminar el medio del pozo y después añadiendo lentamente 500 l KRPH.
- Se incuban las células después de la tercera etapa de lavado a 37 ° C en el aire (no menos del 5% de CO 2, lo que altera el pH de este medio-bicarbonato gratis).
- Al inicio del ensayo, sustituir KRPH en pozos con 500 l KRPH fresco que contiene la anhidrasa carbónica 500 U / ml y, o bien glucosa (10 mM) o sólo medio, sin sustrato adicional.
- Carga del cartucho del sensor
- Pipetear 50 ml de alícuotas de cada compuesto 10x preparado en la etapa 3.3 en los puertos de cartucho de un cartucho extracelular flujo sensor de la siguiente manera (concentraciones finales en el ensayo así dan): Puerto A: 2 mg / ml oligomicina, Puerto B: 0,5 M FCCP, Port C : 1 rotenona mu M, 1 M myxothiazol, Port D: HCl (si se realiza una calibración de ácido en el ensayo como se describe anteriormente y en la Tabla 2).
NOTA: A los efectos de la inhibición completa de la cadena respiratoria se describe aquí, 1 mM misxothiazol se puede usar de forma intercambiable con 1 M de antimicina A.
- Pipetear 50 ml de alícuotas de cada compuesto 10x preparado en la etapa 3.3 en los puertos de cartucho de un cartucho extracelular flujo sensor de la siguiente manera (concentraciones finales en el ensayo así dan): Puerto A: 2 mg / ml oligomicina, Puerto B: 0,5 M FCCP, Port C : 1 rotenona mu M, 1 M myxothiazol, Port D: HCl (si se realiza una calibración de ácido en el ensayo como se describe anteriormente y en la Tabla 2).
- Ensayo de flujo extracelular:
- Realizar un ensayo de flujo extracelular estándar para determinar el control respiratorio como se describe en 10.
NOTA: Para cada segmento del experimento, determinar la mezcla, espera, y los tiempos de medición deseada, así como el número de ciclos por segmento.
NOTA: Los datos de la Tabla 5 se recogieron más de dos ciclos de ensayo de 2 mezcla min, 1 min esperar, y 5 min medida para cada segmento, con tres ciclos de ensayo que ocurre después de la adición Port D de diferentes cantidades de HCl (para la calibración de búfer de potencia como en la Tabla 2).

Tabla 5. configuración de ensayo de flujo extracelular.
4. Measuring Fin de punto de concentración de lactato
NOTA: Para validar el ensayo indirecto descrito aquí en algún sistema diferente, la concentración de lactato punto final al final de un experimento de flujo extracelular se puede determinar directamente en una placa de 96 pocillos convencional mediante la medición de la velocidad inicial (más de 2 min) de la reducción de NAD + NADH → catalizada por la lactato deshidrogenasa, descrito con detalle en nuestra publicación previa 6. Para los datos presentados en resultados representativos, la concentración de lactato punto final en los pocillos de ensayo que contienen glucosa era ~ 40 mM.
- Preparar medio de hidrazina 2x: 1 M Tris, EDTA 20 mM, hidracina 400 mM, pH 9,8 a 22 ° C). Inmediatamente antes del inicio del ensayo, agregar NAD + a 4 mM y lactato deshidrogenasa (LDH) a 40 U / ml. La composición del medio de ensayo final (1x): Tris 500 mM, EDTA 10 mM, 200 mM de hidrazina, 2 mM NAD +, 20 U / ml LDH.
- Inmediatamente después del ensayo de flujo extracelular, retirar 100l de medio de ensayo de cada pocillo de la placa de ensayo de flujo extracelular y la transferencia a un pocillo de una opaco (negro) placa de 96 pocillos.
- Para cada muestra bien, añadir 100 l 2x medio de hidracina.
- Cargar inmediatamente la placa en un lector de microplacas y comenzar a supervisar la fluorescencia de NADH a 340 nm de excitación / emisión a 460 nm.
- Registre la velocidad inicial de aproximadamente 2 min.
- Ejecutar un experimento similar para construir una curva estándar trazando velocidad inicial en contra de la concentración de lactato para las concentraciones de lactato añadido de 0 a 50 mM.
- Calcular la concentración de lactato en cada pocillo experimental usando la curva estándar.
5. La medición de contenido de proteínas
- Retire medio de ensayo restante de cada pocillo de la placa de ensayo.
- Lavar los pocillos tres veces con 250 l KRPH-BSA libre, teniendo cuidado de minimizar el desprendimiento de las células de la superficie del fondo del pozo.
- Añadir 25 l de lisis RIPAmedio (NaCl 150 mM, Tris 50 mM, 1 mM EGTA, EDTA 1 mM, 1% v / v Triton X-100, 0,5% w / v desoxicolato de sodio, 0,1% v / v SDS, pH 7,4 a 22 ° C) a cada pocillo de la placa de ensayo.
- Incubar la placa en hielo durante 30 min.
- Agite la placa en un agitador de placas a 1200 rpm durante 5 min.
- Medir la concentración de proteína por métodos estándar, por ejemplo, por ensayo BCA, asegurando que la composición de tampón de lisis es compatible con el método de medición. El contenido de proteína en el experimento en la figura 2 fue de ~ 4 mg / pocillo.
Resultados
La Figura 2 muestra los datos en bruto para un experimento típico. Los últimos 10 puntos de medición a partir de la grabación de punto a punto tanto de OCR y pH (sombreado barras verticales) se utilizaron para los cálculos. Las preocupaciones iniciales de que el valor medio (medición del punto medio) de cada ciclo de ensayo no proporcionarían suficiente resolución de tarifa para un cálculo preciso, especialmente en lo que parecía haber un ligero retraso entre Además puerto y velocidad de acidificación estado estacionario, no fueron confirmadas, ya que esto no parece contribuir significativamente a un error de cálculo (no mostrado). Alternativamente, si se introduce la capacidad de amortiguación correcta durante la instalación experimental, PPR se puede leer directamente de la lectura de la recopilación de datos de instrumentos, mostrando la salida de PPR en el software del instrumento o en el formato compatible con PC disponible como uno de los ajustes de salida de datos.
ftp_upload / 53464 / 53464fig2.jpg "/>
Figura 2. Representante rastros de flujo extracelular de O 2 y H +. OCR y pH traza para el experimento de ejemplo en la Tabla 5, que contiene glucosa 10 mM al inicio del ensayo. Port D tenía diferentes concentraciones de HCl para la calibración de la potencia de amortiguación (no se muestra en estas trazas promediados). Los datos de publicación anterior 6. Cada punto representa la media ± SEM de n = 8 repeticiones biológica. Por favor haga clic aquí para ver una versión más grande de esta figura.
Análisis de los datos de los resultados representativos
El uso de la hoja de cálculo se muestra en la Tabla 6 y proporcionado como un archivo adjunto, valores de los datos de los pozos individuales pueden ser introducidos en las columnas que se muestran con encabezados de color amarillo. Todos los seis columnas a el derecho se calcula a partir de estas entradas. El ejemplo en la Tabla 6 muestra los cálculos de PPR resp y PPR Glyc usando ECAR y datos OCR de los pozos individuales para las condiciones nativas, con o sin glucosa añadida, antes de la adición de Port A oligomicina. Técnico repeticiones en cada preparación biológica normalmente se promedian para dar valores individuales de las salidas en los últimos cuatro columnas, a continuación, los datos de diferentes preparaciones biológicas se promedian con la propagación adecuada de las estadísticas de error en BP y estos cuatro valores.
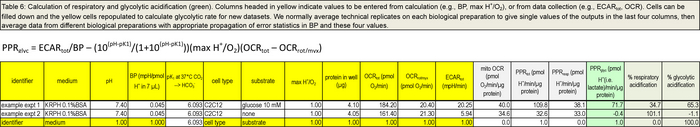
Tabla 6. Cálculo de las vías respiratorias y la acidificación glucolítica. Las columnas encabezadas en amarillo indican los valores que se introduzcan de cálculo (por ejemplo, BP, max H + / O 2), o de recopilación de datos (por ejemplo, tot ECAR, OCR). ps: //www.jove.com/files/ftp_upload/53464/53464table6.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta tabla. | Por favor haga clic aquí para descargar la tabla como una hoja de cálculo Excel .
Aportes de la glucólisis y respiración a PPR después de la corrección
La Figura 3 muestra la representación gráfica de los datos calculados como en la Tabla 6 para las tasas de nativos de la acidificación glucolítica y respiratorio, las tasas siguientes oligomicina adición (Puerto A), y las tasas siguientes FCCP adición (Puerto B). Estos datos demuestran claramente cómo (añadidos glucosa vs. control (ctl) con ninguno) las proporciones de cambio respiratorio y glicolítica acidificación con elección de sustrato y con el estado mitocondrial (función nativa vs. función farmacológicamente alterada).
">
Figura 3. protones tasa de producción (PPR) de fuentes glucolíticas y respiratorias. PPR de la respiración (porciones abiertas) y la glucólisis (porciones llenas) de las células C2C12 calculados utilizando la ecuación 5 con glucosa añadido (tres barras de la izquierda) o sin glucosa añadido (tres barras de la derecha). Los datos de 6. Todos los datos representan la media ± SEM de n = 8 repeticiones biológica.
Discusión
Acidificación extracelular es una indicación de fácil medición de la tasa metabólica celular. Para determinar correctamente la tasa de glucólisis celular (tal como se define por la producción de lactato) es fundamental para conocer el poder tampón del medio de ensayo, y para convertir las mediciones de flujo extracelulares de consumo de oxígeno y acidificación para protón tasas de producción. Mediante la realización de este cálculo, la acidificación resultante de CO 2 liberado en el ciclo del ácido cítrico se puede restar, dejando la acidificación que resulta de la producción de lactato.
Las múltiples formas diferentes dadas aquí para medir la potencia de amortiguación para esta corrección llevan diferentes ventajas y desventajas. Medición externa utilizando una sonda de pH es muy precisa y reproducible, pero puede no reflejar pequeñas diferencias en la detección de pH introducida por los fluoróforos contenidos dentro de la placa de ensayo, la adición de compuestos durante el ensayo, o la presencia de tél propias células. La mediciones de pH abordan en placa estas cuestiones, pero también introducen diversos grados de ruido experimental.
La corrección CO 2 a ECAR permite por primera vez el cálculo inequívoca y cuantitativa de la tasa de glucolítica, y revela variación de contribución respiratorio y glucolítica a ECAR total durante el curso de un experimento. Utilizando la ecuación 5 y las medidas de OCR, ECAR, y amortiguar la energía, la tasa glucolítica se puede calcular utilizando la simple hoja de cálculo proporcionada (Tabla 6). Esta tasa puede ser verificada mediante la medición de lactato post-hoc si se desea 6. En las células, donde la vía de las pentosas fosfato es altamente activo, el uso de inhibidores de la vía, tales como 6-aminonicotinamida puede ser útil para aislar tasa glucolítica. Cálculo de las contribuciones tanto de CO 2 - y el lactato derivado de H + del total miden extracelular acidificación tarifas y oxígeno Consumption El precio es una herramienta invaluable para el uso de los datos de flujo extracelular hacer declaraciones poderosas y cuantitativos sobre la actividad metabólica.
Usando los procedimientos descritos aquí, incluyendo diversas modificaciones para medir el poder tampón, y optimizando el experimento de flujo extracelular de las células bajo investigación y los datos deseados, la tasa de glucólisis en células intactas se puede cuantificar en una amplia gama de condiciones experimentales. Este método está limitado a células que pueden crecer en cultivo adherente sobre (o células u orgánulos que se puede adherir a) una superficie de poliestireno. Es más fiable cuando las células cultivadas son homogéneos y confluyentes, aunque los datos útiles aún se pueden obtener en un rango de estas condiciones. Los cálculos requieren algún conocimiento del metabolismo de las células, como max + H / O 2 rangos de 0,65 a 1,0 para la oxidación completa de los diferentes sustratos y más para la oxidación parcial 6, sin embargo, si las células son known para oxidar la glucosa, un valor de 1,0 se puede suponer.
Aunque pertinente para todos los caracterización metabólica, este método puede ser particularmente útil cuando se utiliza en sistemas en los que un cambio entre el metabolismo respiratorio y glicolítica para mantener el suministro de ATP celular es un fenotipo crítica, incluyendo la caracterización de las células madre y las células cancerosas derivadas de tumores. La comprensión de las alteraciones de control metabólico en estos y otros contextos permitirá un mayor grado de sofisticación y precisión en el diseño experimental y el análisis de estos tipos de células.
Divulgaciones
Dr. Shona Mookerjee declara que no tiene intereses financieros en competencia. Dr. Martin Brand ha consultado para Seahorse Biosciences, que produce instrumentos y reactivos utilizados en el presente artículo. Cuotas de acceso abierto para este artículo fueron pagados por Seahorse Biosciences.
Agradecimientos
We thank David A. Ferrick and David G. Nicholls for contributing to project conception and presentation, Renata L.S. Goncalves and Akos A. Gerencser for data not shown here and for helpful discussions, Barbara Liepe for XF24 consumables, and Andy Neilson for input in developing Eq. (5).
Materiales
| Name | Company | Catalog Number | Comments |
| Pherastar FS | BMG | n/a | microplate reader |
| Seahorse XF-24 | Seahorse Bioscience | n/a | extracellular flux instrument |
| Seahorse XF assay plate | Seahorse Bioscience | V7-PS | consumable |
| XF Calibrant | Seahorse Bioscience | 100840-000 | solution |
| HCl standard | Sigma | 38280 | chemical |
| oligomycin | Sigma | O4876 | chemical |
| FCCP | Sigma | C2920 | chemical |
| Rotenone | Sigma | R8875 | chemical |
| Myxothiazol | Sigma | T5580 | chemical |
| DMEM | Corning | 10-013-CV | medium component |
| FBS | Corning | 35-010-CV | medium component |
| penicillin/streptomycin | Corning | 30-002-CI | medium component |
| carbonic anhydrase | Sigma | C2624 | chemical |
| 96-well assay plate | Corning | CLS3991 | consumable |
| NAD+ | Sigma | N7004 | chemical |
| LDH | Sigma | L1254 | chemical |
Referencias
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochem. J. 435 (2), 297-312 (2011).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Anal. Chem. 81 (16), 6868-6878 (2009).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Meth. Enzymol. 547, 309-354 (2014).
- Renner, K., Jansen-Dürr, P., Gnaiger, E. Biphasic oxygen kinetics of cellular respiration and linear oxygen dependence of antimycin A inhibited oxygen consumption. Mol. Biol. Rep. 29 (1-2), 83-87 (2002).
- Helmlinger, G., Sckell, A., Dellian, M., Forbes, N. S., Jain, R. K. Acid production in glycolysis-impaired tumors provides new insights into tumor metabolism. Clin. Cancer Res. 8 (4), 1284-1291 (2002).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. G., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta. 1847, 171-181 (2015).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. Am. J. Physiol. 292 (1), C125-C136 (2006).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. J. Bioenerg. Biomembr. 44 (4), 421-437 (2012).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Meth. Enzymol. 542, 125-149 (2014).
- Nicholls, D. G., Darley-Usmar, V. M., Wu, M., Jensen, P. B., Rogers, G. W., Ferrick, D. A. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp. (46), 2511 (2010).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), e21746 (2011).
- Seahorse Biosciences. . F24 Extracellular Flux Analyzer and Prep Station Installation and Operation Manual. 1.7, (2010).
- Blau, H., Chiu, C., Webster, C. Cytoplasmic activation of human nuclear genes in human heterocaryons. Cell. 32, 1171-1180 (1983).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados