Method Article
Medição e Análise de Produção de Ácido Extracelular determinar Glicosidases Classificação
Neste Artigo
Resumo
Glycolysis is a defining metabolic marker in multiple biological systems. Monitoring glycolysis by measuring the extracellular flux of H+ is common, but requires correction to be quantitative and unambiguous. Here, we demonstrate how to gather and correct extracellular flux data to distinguish between respiratory and glycolytic sources of extracellular acidification.
Resumo
Extracellular measurement of oxygen consumption and acid production is a simple and powerful way to monitor rates of respiration and glycolysis1. Both mitochondrial (respiration) and non-mitochondrial (other redox) reactions consume oxygen, but these reactions can be easily distinguished by chemical inhibition of mitochondrial respiration. However, while mitochondrial oxygen consumption is an unambiguous and direct measurement of respiration rate2, the same is not true for extracellular acid production and its relationship to glycolytic rate 3-6. Extracellular acid produced by cells is derived from both lactate, produced by anaerobic glycolysis, and CO2, produced in the citric acid cycle during respiration. For glycolysis, the conversion of glucose to lactate- + H+ and the export of products into the assay medium is the source of glycolytic acidification. For respiration, the export of CO2, hydration to H2CO3 and dissociation to HCO3- + H+ is the source of respiratory acidification. The proportions of glycolytic and respiratory acidification depend on the experimental conditions, including cell type and substrate(s) provided, and can range from nearly 100% glycolytic acidification to nearly 100% respiratory acidification 6. Here, we demonstrate the data collection and calculation methods needed to determine respiratory and glycolytic contributions to total extracellular acidification by whole cells in culture using C2C12 myoblast cells as a model.
Introdução
O objetivo geral deste método é medir com precisão a taxa glicolítica de células usando a análise de fluxo extracelular. A medida quantitativa da taxa glicolítica usando acidificação extracelular é o ponto final desejado de muitos experimentos. No entanto, a taxa total de acidificação extracelular é a soma de dois componentes: a acidificação respiratória, sob a forma de CO2 (que hidrata a H 2 CO 3, em seguida, dissocia-se de HCO 3 - + H +), e acidificação glicolítica, sob a forma de lactato - + H +.
As contribuições de CO 2 a acidificação extracelular totais têm até recentemente foi considerado insignificante na plataforma de medição utilizado aqui, o analisador XF24 7. No entanto, é evidente em vários outros sistemas que CO 2 pode ser um dos principais contribuintes para a acidificação extracelular 4-5. Vários papéis reconhecer este contribuição, mas não tente a quantificação direta de CO 2 -derived 3,8,9 ácido. Nós recentemente demonstrado quantitativamente que a produção de CO 2 é uma fonte significativa de acidificação extracelular neste sistema 6. Além disso, apesar de existirem várias vias metabólicas que geram CO 2 a partir de catabolismo da glicose, os realizados por desidrogenases matriz no ciclo do ácido cítrico são os contribuintes esmagadora e todas as outras fontes de gerar quantidades de CO 2 que estão dentro do erro experimental 6.
Sem correcção para a produção de CO 2, a acidificação extracelular é, por conseguinte, um indicador de taxa de ambígua glicolítica e não pode ser utilizado quantitativamente. Nossa publicação anterior destaca vários casos em que respiratória CO 2 compreende a maior parte do sinal total acidificação, mesmo em células geralmente acredita-se usar principalmente glicólise 6. Além disso, orespiratório CO2 contribuição para a acidificação total varia amplamente durante o decorrer de experiências comuns perfis metabólicos, demonstrando que a correcta comparação da taxa glicolítica durante diferentes partes de um experimento requer correcção para o CO 2.
Para medir a taxa glicolítica de células utilizando a taxa de acidificação extracelular, é necessário converter as alterações de pH às mudanças no total gerados H +, e para subtrair o acidificação extracelular causada por CO2 libertado durante a operação do ciclo do ácido cítrico. Aqui, descrevemos um método simples para medir a taxa de produção de prótons extracelular (a partir de mudanças extracelulares em pH eo poder calibrado tamponamento do meio de ensaio) e produção de CO 2 (a partir de mudanças extracelulares em O 2 concentração), e demonstrar como calcular taxa glicolítica usando estas medições.
Este método força ens a utilidade da medida acidificação extracelular, utilizando-o para calcular corretamente taxa glicolítica tal como definido pela produção de lactato. Sem correcção para o CO respiratória 2 (ou medição directa do lactato), é impossível determinar se e em que medida a taxa de acidificação dadas reflecte taxa glicolítica, confundindo a interpretação de experiências que utilizam acidificação extracelular total, como uma medição directa da produção de lactato.
CÁLCULOS
CO 2 e lactato são, dentro do erro experimental, os dois únicos contribuintes para a produção de ácido extracelular, com base em experimentos com células mioblastos 6. Portanto, a taxa de acidificação extracelular total de (PPR, a taxa de produção de protões) pode ser definida como:
PPR tot = PPR resp + PPR Glyc Equação 1
. _content "> onde tot = total; resp = respiratória; Glyc = glycolytic Glicosidases PPR é assim:PPR Glyc = PPR tot - PPR resp Equação 2
Aqui,
PPR tot = ECAR tot / BP Equação 3
onde ECAR = taxa de acidificação extracelular (MPH / min) e BP = poder tampão (MPH / pmol H + em 7 ul), enquanto
PPR resp = (10 pH-pk 1 / (1 + 10 pH-pk 1)) (max H + / O 2) (OCR tot - OCR rot / myx) Equação 4
1 onde K = constante de CO2 de hidratação e de dissociação de equilíbrio para o HCO 3 combinado - + H +; max H + / O 2 = the CO 2 a acidificação -derived para uma transformação metabólica em particular tais como a oxidação completa de glicose-6; OCR = taxa de consumo de oxigênio (O 2 pmol / min), e OCR rot / myx = não-mitocondrial OCR.
Equação 4 isolados mitocondrial OCR subtraindo qualquer OCR não-mitocondrial (definida como o OCR que é resistente à mitocondrial respiratória venenos rotenona e myxothiazol) e representa a máxima H + gerada por O 2 consumido para cada substrato (max H + / O2 ) (ver 6), bem como a proporção de CO 2 dando origem a H + a uma temperatura experimental e pH (10 pH-PK 1 / (1 + 10 pH-PK 1). Para a oxidação completa de glucose, oxigénio mitocondrial Taxa de Consumo (OCR) é exactamente igual à taxa de produção de CO 2. No volume de ensaio de medição do fluxo confinado extracelular, CO 2 produtosd pela respiração permanece preso no meio de ensaio. A maior parte do CO2 é preso hidratado a H 2 CO 3, que, em seguida, dissocia-se de HCO 3 - + H +. Uma fracção pequena permanece dissolvido mas não hidratada, e uma outra fracção pequena é hidratado mas não dissociada, como ditado termodinamicamente pela constante de CO2 de hidratação e de dissociação de equilíbrio combinado de HCO 3 - + H + a temperatura experimental (37 ° C) e pH (~ 7,4).
Assim, a equação completa para o cálculo PPR g subtraindo PPR resp de PPR tot é:
PPR Glyc = ECAR tot / BP - (10 pH-pk 1 / (1 + 10 pH-pk 1)) (max H + / O 2) (OCR tot - OCR rot / myx) Equação 5
EuN deste modo, as taxas de respiração e a glicólise, assim como as suas taxas de produção de ATP associados, pode ser determinada quantitativamente a partir de medições directas (consumo de oxigénio, de acidificação extracelular, capacidade tampão) e de importação, ou cálculo de outros valores necessários (H + / O2 , P / S, e a constante de equilíbrio K 1) 6. O experimento descrito aqui se expande sobre as técnicas padrão para usar o Extracelular Flux Analyzer como Seahorse XF24 10,11; para outros formatos de medição de fluxo extracelular (por exemplo, XF e 96, ou XFP), todos os volumes abaixo devem ser dimensionados de forma adequada.
O poder de enchimento do meio de ensaio pode ser medido pela construção de uma curva padrão, quer directamente na plataforma de fluxo extracelular ou separadamente, utilizando uma sonda de pH calibrada. Aqui, três opções para medir a memória intermédia por meio de ensaio de fluxo extracelular são dadas, incluindo o uso de todos os injectinas portas do analisador de fluxo extracelular com poços de amostras livres de células, ou usando apenas a última porta de injeção em poços contendo células (seção 1) ou usando uma medição de pH externo (seção 2). Consulte a planilha em anexo para os cálculos completos de dados de exemplo.
Para medir a potência de buffer usando a capacidade do instrumento de fluxo extracelular de detecção de pH, é mais seguro usar poços livres de células para minimizar a variação do sinal. No entanto, dentro do erro, não existe nenhuma diferença estatística entre poços e quando se realiza esta medição contendo celular isento de células (dados não mostrados). NOTA: A variação descrito no passo 1.7 transporta a vantagem de contabilização de quaisquer potenciais alterações ao buffer conferidos por compostos adicionados ou pela presença de células, com a desvantagem de sinal mais barulhento. No entanto, como indicado acima, não foram encontradas diferenças significativas na potência tamponante calculada entre a concepção livre de células mostrados na Tabela 1 eo projeto de pós-experimento na Tabela 2, nas condições experimentais descritas aqui.
Além disso, sobre pequenos intervalos ΔpH (<0,4 unidades; experimentalmente melhor a 0,2 unidades), a inclinação linear obtido através da representação gráfica Δ MPH / pmol H + aproxima adequadamente a relação logarítmica entre ΔpH e [H +]. O declive desta curva padrão representa, portanto, o poder de enchimento do meio de ensaio em ensaio de pH / nmol de H + em 7 ul, ou MPH / pmol H + em 7 ul. Recomendamos aumento do poder de tamponamento médio ou diminuindo a densidade celular para as amostras que excedem a alteração da unidade de pH 0,2 durante o tempo de medição. O tempo de medida pode também ser diminuída, mas isto pode diminuir a taxa de acidificação estado estacionário e introduzir um erro no cálculo da taxa.
Protocolo
1. Medição de Energia em um buffer Flux Instrumento Extracelular: Duas Variações
NOTA: os cálculos e métodos descritos aqui foram desenvolvidos usando uma Extracelular Flux Analyzer. Para outros instrumentos, o volume de medição deve ser dimensionado apropriadamente.
- Prepare a 0,1 M de HCl em água padrão utilizando HCl concentrado (ver Materiais e equipamento) de acordo com as instruções do fabricante.
Nota: Um exemplo de cálculo para a preparação de injecções de HCl para utilização em todos os quatro orifícios de injecção é mostrado no Quadro 1:

Tabela 1. injecções HCl consecutivos em um ensaio de fluxo extracelular bem.
- Preparar diluições do padrão de HCl no meio a ser ensaiada como na Tabela 1 para o número de repetições técnicas sendo CarrIED em uma placa, além de um para permitir a pipetagem de erro, por exemplo, por quatro repetições técnicas do porto Uma injeção, preparar um estoque de (1,1 mL x 5) HCl 0,1 M em (48,9 ul x 5) meio de ensaio.
- Distribuir 50 ul em cada porta do cartucho A sonda de medição. Repita esse procedimento para portas restantes B, C e D.
- Executar um ensaio de fluxo extracelular de 10 com um ciclo de calibração padrão, seguido por dois ciclos de [2 min mistura, 1 min de espera, e 5 min de medição], para cada uma das quatro adições de porta (ver Figura 2).
- Programar a experiência acima no software do instrumento de acordo com as instruções de software. Carregar o cartucho preparado para a máquina e executar a calibragem de acordo com as instruções de software.
- Quando solicitado pelo programa, retire a placa contendo calibração e insira a placa contendo meio de ensaio em cada poço no instrumento; continuar o programa.
- vc cantar a média de 8-10 pontos de dados obtidos em estado estacionário (tipicamente os últimos 8-10) a partir de pontos, antes e depois de cada adição da porta, o cálculo da diferença (cumulativa) em pH (ΔpH) causada por cada injecção de ácido de referência.
- Traçar ΔpH contra nmol H + contido no volume 7 ul preso pela sonda de medição. A inclinação linear é o poder de tamponamento (BP) em mph / pmol H +.
- Como alternativa aos passos 1.2-1.3, efectuar as medições seguintes ΔpH um ensaio em que portas A, B, e C são usadas para a realização de uma experiência, seguida por uma injecção de HCl em Port D. Tal como na Tabela 2, quatro repetições são técnicas usado para gerar cada ponto de uma curva padrão de 5 pontos nos 20 poços experimentais (excluindo os poços quatro fundo) de correcção da temperatura da placa de ensaio de fluxo extracelular.
53464table2.jpg "/>
Tabela 2. HCl único injecção num ensaio de fluxo extracelular bem.
2. medição de energia Usando um buffer pH medidor externo
NOTA: Para medir o poder tamponante de um meio utilizando uma sonda de pH externo, calibrar a sonda a 37 ° C e manter esta temperatura durante todos os reagentes durante a experiência.
- Prepare a 0,1 M de HCl em água padrão utilizando HCl concentrado de acordo com as instruções do fabricante.
- Quente sonda de pH, os padrões de pH, o meio de ensaio cujo poder tamponante está a ser medido, e HCl 0,1 M a 37 ° C num banho de água.
- Calibrar sonda de pH a 37 ° C de acordo com as instruções do fabricante. Manter todos os reagentes a 37 ° C durante todo o ensaio, utilizando uma placa de aquecimento ou banho-maria.
- Alíquota de 10 ml do meio de ensaio para um pequeno copo ou tubo cónico. Monitorar continuamente pH utilizando uma sonda de pH mergulhados.
- Adicionar HCl 0,1 M para o quantodizer médio em 10-20 mL alíquotas.
- Assegurar a mistura usando uma vareta de agitação ou agitando manualmente o recipiente depois de cada adição de ácido.
- Aguarde alguns segundos para que a medição de pH para estabilizar, então gravar o pH após cada adição.
- Tal como demonstrado na Tabela 3, efectuar um número suficiente de adições para assegurar cálculo da inclinação exacta e para cobrir o intervalo de pH esperado durante a experiência.

Tabela 3. Medição poder tamponante usando um medidor de pH. Os dados representam uma experiência típica com seis adições de 20 ul de 0,1 M de HCl.
- Lote ΔpH contra nmol de H + por adicionado 7 ul, dando uma inclinação linear que representa o poder tamponante (Figura 1).
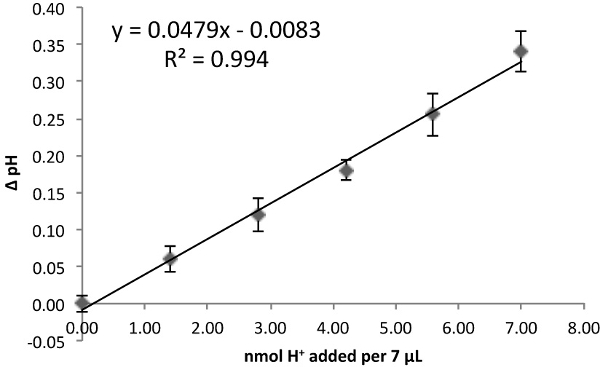
Figura 1. Determinar poder buffering. HCl curva padrão medido como na Tabela 1, a Tabela 2 ou (aqui) como na Tabela 3. O declive da curva de ajuste linear dá o poder tampão (pH / nmol de H + em 7 ul). Cada ponto representa a média ± SEM de n = 9 repetições técnicas.
- Uma vez que o poder tamponante é conhecido através Método 1 ou 2 acima, converter o sinal ECAR (MPH / min) para PPR (pmol H + / min / mg de proteína) pela divisão ECAR por poder tamponante (BP) (MPH / pmol H +) e escala para o teor de proteína de cada poço:
PPR tot (pmol H + / min / mg de proteína) = ECAR (MPH / min) / BP (MPH / pmol H + em 7 ul) / proteína por poço (g) Equação 6 - Como alternativa, use os mesmos experimentos em Métodos 1 ou 2, para calcular o valor de Capacidade Tampão (BC) usado pelo software do instrumento para calcular automaticamente PPR durante a recolha de dados.
NOTA: O manual do usuário instrumento 12 (página 107) fornece informações detalhadas sobre como calcular e utilizar a capacidade de tamponamento, onde BC é descrito como
BC (mol / L) = moles de H + / (ΔpH volume de tampão X (G)) Equação 7
NOTA: A capacidade de tamponamento, tal como definido na Equação 7 pode ser calculada no instrumento ou sonda de pH externo ensaios descritos acima. Conversão entre o poder tampão e capacidade tampão é feito facilmente (veja planilha em anexo):
BC = 1 x 10 -9 / BP ((MPH / pmol H + em 7 ul) / 7 ul) Equação 8
NOTA: Se for conhecida antes da realização do ensaio, a capacidade de tamponamento podem ser inseridos diretamente no software do instrumento durante a configuração experimental. - Aplicar esse procedimento e os cálculos utilizados anteriormente para a maioria dos sistemas tampão convencionais, como descrito na publicação anterior 6.
NOTA: A Tabela 4 lista o poder de tamponamento e de capacidade de buffer de vários meios de comunicação convencionais.
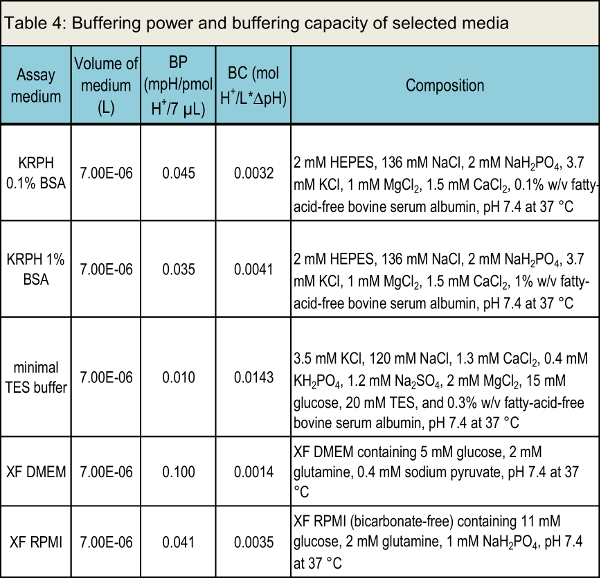
Tabela 4. Buffer poder e capacidade de tamponamento da mídia selecionada.
3. Realizar uma Extracelular Flux ensaio usando células C2C12 mioblastos
NOTA: No passo 3.4.3, não houve diferenças observadas na produção de CO 2 -derived ácido dependente da presença de anidrase carbónica na cultura C2C12, sugerindo que a sua presença não é necessária para a conversão completa de CO 2 a HCO 3 - + H +. No entanto, testando empiricamente esta em diferentes sistemas experimentais é recomendada antes omanidrase carbônica itting.
- Cultura rato C2C12 myoblasts 13 a 37 ° C sob 95% de ar / 5% de CO 2 em meio de Eagle modificado por Dulbecco (DMEM) com 11,1 mM de glicose, 2 mM de glutamina, 10% v v de soro / fetal de bovino (FBS), 100 U / ml de penicilina e 100 ug / ml de estreptomicina.
- 24 horas antes do ensaio, células / placa de semente em 100 mL do mesmo meio de cultura a 20000 células / cavidade em uma placa de ensaio de 24 poços de poliestireno fluxo extracelular (ver Materiais e Métodos) com nenhum revestimento adicional.
- Diluir oligomicina, FCCP, e rotenona mais myxothiazol, e HCl (opcional) para 10x a concentração final em Krebs Ringer Fosfato de HEPES (KRPH) meio de ensaio (HEPES 2 mM, NaCl 136 mM, 2 mM de NaH 2 PO 4, KCl 3,7 mM, 1 mM de MgCl2, 1,5 mM de CaCl2, 0,1% w / v de albumina de soro de bovino isenta de ácidos gordos, pH 7,4 a 37 ° C).
- Preparação de Células
- 30 min antes do ensaio, lavar as células aderentes três vezes por aspiração para GEntly remover a forma do poço e em seguida, adicionando-se lentamente 500 ul KRPH.
- Incubar as células a partir do terceiro passo de lavagem a 37 ° C sob ar (não menos de 5% de CO 2, o que vai alterar o pH deste meio isento de bicarbonato).
- No início do ensaio, substitui KRPH em poços com 500 ul KRPH fresco contendo anidrase carbónica 500 U / mL e qualquer glicose (10 mM) ou apenas meio, sem substrato adicional.
- Carregando o cartucho do sensor
- Pipetar 50 mL alíquotas de cada 10x composto preparado no passo 3.3 em portas de cartucho de um cartucho extracelular fluxo do sensor como se segue (as concentrações finais no ensaio bem determinada): Porta A: 2 ug / ml oligomicina, Porta B: 0,5 uM FCCP, Porta C : 1 rotenona uM, 1 uM myxothiazol, Port D: HCl (se realizar uma calibração em ácido-ensaio tal como descrito acima e na Tabela 2).
NOTA: com a finalidade de completa inibição da cadeia respiratória aqui descritos, 1 mM meusxothiazol pode ser utilizado intermutavelmente com 1 uM antimicina A.
- Pipetar 50 mL alíquotas de cada 10x composto preparado no passo 3.3 em portas de cartucho de um cartucho extracelular fluxo do sensor como se segue (as concentrações finais no ensaio bem determinada): Porta A: 2 ug / ml oligomicina, Porta B: 0,5 uM FCCP, Porta C : 1 rotenona uM, 1 uM myxothiazol, Port D: HCl (se realizar uma calibração em ácido-ensaio tal como descrito acima e na Tabela 2).
- Extracelular ensaio de fluxo:
- Realizar um ensaio de fluxo extracelular padrão para determinar controle respiratório, como descrito no 10.
NOTA: Para cada segmento da experiência, determinar a mistura, esperar, e tempos de medição desejada, bem como o número de ciclos por segmento.
NOTA: Os dados da Tabela 5 foram recolhidos ao longo de dois ciclos de ensaio de 2 minutos de mistura, 1 min de espera, e 5 min medida para cada segmento, com três ciclos de ensaio que ocorre após a adição porta D de diferentes quantidades de HCl (para a calibração de tamponamento poder como na Tabela 2).

Tabela 5. configuração ensaio de fluxo extracelular.
4. Measuring End-point concentração de lactato
NOTA: Para validar o ensaio indirecto descrito aqui em algum sistema diferente, ponto de concentração de lactato final, no final de uma experiência de fluxo extracelular pode ser determinada directamente numa placa de 96 poços convencionais, medindo a velocidade inicial (durante 2 minutos) de redução de NAD + → NADH catalisada pela desidrogenase de lactato, descrito em pormenor na nossa publicação anterior 6. Para os dados apresentados na Resultados representativos, a concentração de lactato no ponto final em poços de ensaio contendo glucose era ~ 40? M.
- Prepare forma hidrazina 2x: Tris 1 M, EDTA 20 mM, 400 mM hidrazina a pH 9.8 a 22 ° C). Imediatamente antes do início do ensaio, adicionar NAD + para 4 mM e lactato desidrogenase (LDH) a 40 U / mL. Composição do meio de ensaio final (1x): Tris 500 mM, EDTA 10 mM, 200 mM hidrazina, 2 mM NAD +, 20 U / mL de LDH.
- Imediatamente após o ensaio de fluxo extracelular, remover 100ul de meio de ensaio de cada poço da placa de ensaio de fluxo extracelular e transferir para um poço de uma placa opaca (preto) de 96 poços.
- Para cada poço de amostra, adicionar 100 mL 2x meio de hidrazina.
- Carregar imediatamente a placa para um leitor de microplacas e começar a monitorização de fluorescência de NADH a 340 nm de excitação / emissão a 460 nm.
- Grave a velocidade inicial de cerca de 2 min.
- Executar uma experiência similar para construir uma curva padrão através da representação gráfica da velocidade em função da concentração inicial de lactato para as concentrações de lactato adicionados entre 0 e 50 uM.
- Calcular a concentração de lactato em cada poço experimental usando a curva padrão.
5. Medição de conteúdo de proteína
- Remover o meio de ensaio remanescente de cada poço da placa de ensaio.
- Lavar os poços três vezes com 250 ul de BSA livre de KRPH, tomando cuidado para minimizar o desalojamento das células a partir da superfície de fundo bem.
- Adicionar 25 ul de lise RIPAmédio (NaCl 150 mM, Tris 50 mM, EGTA 1 mM, EDTA 1 mM, 1% v / v de Triton X-100, 0,5% w / v de desoxicolato de sódio, 0,1% v / v de SDS, pH 7,4 a 22 ° C) a cada poço da placa de ensaio.
- Incubar a placa em gelo durante 30 min.
- Agitar placa num agitador de placas a 1.200 rpm, durante 5 min.
- Medir a concentração de proteína através de métodos padrão, por exemplo, por ensaio BCA, assegurando que a composição do tampão de lise é compatível com o método de medição. O teor de proteína no ensaio na Figura 2 foi de ~ 4 ^ g / cavidade.
Resultados
A Figura 2 mostra os dados em bruto para uma experiência típica. Os últimos 10 pontos de medição a partir da gravação de ponto-a-ponto de tanto OCR e pH (sombreada barras verticais) foram utilizados para os cálculos. As preocupações iniciais de que o valor médio (medição ponto médio) de cada ciclo de ensaio não forneceria resolução suficiente de taxa para um cálculo preciso, nomeadamente no que parecia haver um ligeiro atraso entre a adição de porta e taxa de acidificação estado estacionário, não foram confirmadas, em que não se parecem contribuir significativamente para cálculo de erro (não mostrados). Como alternativa, se a capacidade de enchimento correto é inserido durante a configuração experimental, PPR pode ser lida directamente a partir da leitura do instrumento de coleta de dados, exibindo a saída PPR no software do aparelho ou no formato compatível com PC disponível como uma das definições de saída de dados.
ftp_upload / 53464 / 53464fig2.jpg "/>
Figura 2. vestígios de fluxo extracelulares representativos de O 2 e H +. OCR e traça o pH para o exemplo experiência na Tabela 5, contendo 10 mM de glucose no início do ensaio. Port D tinham diferentes concentrações de HCl para a calibração de potência de tamponamento (não apresentados nestes rastreios em média). Dados de publicação anterior 6. Cada ponto representa a média ± SEM de n = 8 repetições biológicas. Por favor clique aqui para ver uma versão maior desta figura.
A análise dos dados de resultados representativos
Usando a planilha mostrada na Tabela 6 e fornecida como um anexo, valores de dados de poços individuais podem ser inscritos nas colunas mostradas com cabeçalhos amarelas. Todos os seis colunas para à direita estão calculados a partir destas entradas. O exemplo na Tabela 6 mostra os cálculos de PPR e resp Glyc PPR usando ECAR e dados OCR a partir de poços individuais para as condições nativos com ou sem glucose adicionada, antes da Porta A adição de oligomicina. Repetições técnicas sobre cada preparação biológica são normalmente média para dar valores individuais das realizações nos últimos quatro colunas, em seguida, dados de diferentes preparações biológicas são calculados com a propagação adequada de estatísticas de erro no BP e destes quatro valores.
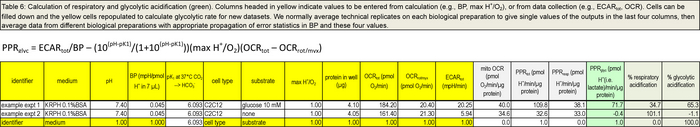
Tabela 6. Cálculo dos respiratório e acidificação glycolytic. Colunas intituladas em amarelo indicam valores a serem inseridos a partir de cálculo (por exemplo, BP, max H + / O 2), ou de coleta de dados (por exemplo, tot ECAR, OCR). ps: //www.jove.com/files/ftp_upload/53464/53464table6.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta tabela |. Por favor clique aqui para baixar esta tabela como uma planilha Excel .
Contribuições de glicólise e respiração para PPR após a correção
A Figura 3 mostra a saída gráfica de dados calculados como na Tabela 6 para as taxas de acidificação nativas glicolítica e respiratório, as taxas de adição seguintes oligomicina (Porta A), e as taxas de adição seguintes FCCP (Porta B). Estes dados demonstram claramente como as proporções de mudança acidificação respiratória e glycolytic com escolha de substrato (glicose vs. controle (CTL) com nenhum extra) e com o status mitocondrial (função nativa vs. função farmacologicamente alterada).
">
Figura 3. Proton taxa de produção (PPR) a partir de fontes glicolíticas e respiratórias. PPR da respiração (porções abertos) e glicólise (partes preenchidas) de células C2C12 calculado através da equação 5 com glicose adicionado (três barras da esquerda) ou sem glicose adicionado (três bares à direita). Os dados dos 6. Todos os dados representam a média ± SEM de n = 8 repetições biológicas.
Discussão
Acidificação extracelular é uma indicação facilmente medido da taxa metabólica celular. Para determinar correctamente a taxa de glicólise celular (tal como definido pela produção de lactato) é crítico saber o poder tamponante do meio de ensaio, e para converter as medições de fluxo extracelulares de consumo de oxigénio e a acidificação em protão taxas de produção. Ao realizar este cálculo, a acidificação resultante do CO2 libertado no ciclo do ácido cítrico pode ser subtraído, deixando a acidificação que resulta da produção de lactato.
As múltiplas formas diferentes dadas aqui para medir a potência de tamponamento para esta correcção transportar diferentes vantagens e desvantagens. Medição externa usando uma sonda de pH é altamente preciso e reprodutível, mas pode não reflectir pequenas diferenças na detecção de pH introduzido pelos fluoróforos contidos no interior da placa de ensaio, a adição de compostos durante o ensaio, ou a presença de tele próprias células. A in-placa medições de pH abordar estas questões, mas também apresentar vários graus de ruído experimental.
A correcção de CO 2 a ECAR permite pela primeira vez o cálculo inequívoca e quantitativa da taxa glicolítica, e revela uma variação na contribuição respiratória e glicolítico para ECAR total durante o decurso de uma experiência. Utilizando a Equação 5 e as medições de OCR, ECAR, e poder tamponante, taxa glicolítica pode ser calculada utilizando a folha de cálculo simples, desde que (Tabela 6). Esta taxa pode ser verificada por medição de lactato post-hoc, se desejado 6. Nas células em que a via da pentose fosfato é altamente activo, o uso de inibidores da via, tais como 6-aminonicotinamide pode ser útil para isolar taxa glicolítica. Cálculo das contribuições de ambos CO 2 - e derivados de lactato H + do total medido extracelular acidificação Taxa e oxigênio Consumption Taxa é uma ferramenta inestimável para a utilização de dados de fluxo extracelulares para fazer declarações poderosas e quantitativos sobre a atividade metabólica.
Utilizando os procedimentos descritos aqui, incluindo as várias modificações para a medição da potência de tamponamento, e optimizar o fluxo extracelular experimento para as células sob investigação e os dados desejados, a taxa de glicólise em células intactas podem ser quantificados sob uma ampla gama de condições experimentais. Este método está limitado a células que podem crescer em cultura aderente em (ou células ou organelas que podem ser aderidos a) uma superfície de poliestireno. É mais fiável quando as células cultivadas são homogéneos e confluentes, embora os dados úteis podem ainda ser obtidos ao longo de um intervalo de estas condições. Os cálculos requerem algum conhecimento do metabolismo das células, como Max H + / O 2 varia de 0,65 a 1,0 para a oxidação completa dos diferentes substratos e mais para a oxidação parcial 6, no entanto, se as células forem Known para oxidar glicose, um valor de 1,0 pode ser assumida.
Embora relevante para todos caracterização metabólica, este método pode ser particularmente útil quando utilizada em sistemas em que uma mudança entre o metabolismo respiratório e para manter a produção glicolítica do ATP celular é um fenótipo crítica, incluindo a caracterização de células estaminais e células de cancro derivadas de tumores. Compreender alterações controle metabólico desses e outros contextos permitirá um maior grau de sofisticação e precisão no desenho experimental e análise destes tipos de células.
Divulgações
Dr. Shona Mookerjee declara que ela não tem interesses financeiros concorrentes. Dr. Martin Marca consultou para Seahorse Biosciences, que produz instrumentos e reagentes utilizados no presente artigo. Taxas de acesso aberto para este artigo foram pagos pela Seahorse Biosciences.
Agradecimentos
We thank David A. Ferrick and David G. Nicholls for contributing to project conception and presentation, Renata L.S. Goncalves and Akos A. Gerencser for data not shown here and for helpful discussions, Barbara Liepe for XF24 consumables, and Andy Neilson for input in developing Eq. (5).
Materiais
| Name | Company | Catalog Number | Comments |
| Pherastar FS | BMG | n/a | microplate reader |
| Seahorse XF-24 | Seahorse Bioscience | n/a | extracellular flux instrument |
| Seahorse XF assay plate | Seahorse Bioscience | V7-PS | consumable |
| XF Calibrant | Seahorse Bioscience | 100840-000 | solution |
| HCl standard | Sigma | 38280 | chemical |
| oligomycin | Sigma | O4876 | chemical |
| FCCP | Sigma | C2920 | chemical |
| Rotenone | Sigma | R8875 | chemical |
| Myxothiazol | Sigma | T5580 | chemical |
| DMEM | Corning | 10-013-CV | medium component |
| FBS | Corning | 35-010-CV | medium component |
| penicillin/streptomycin | Corning | 30-002-CI | medium component |
| carbonic anhydrase | Sigma | C2624 | chemical |
| 96-well assay plate | Corning | CLS3991 | consumable |
| NAD+ | Sigma | N7004 | chemical |
| LDH | Sigma | L1254 | chemical |
Referências
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochem. J. 435 (2), 297-312 (2011).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Anal. Chem. 81 (16), 6868-6878 (2009).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Meth. Enzymol. 547, 309-354 (2014).
- Renner, K., Jansen-Dürr, P., Gnaiger, E. Biphasic oxygen kinetics of cellular respiration and linear oxygen dependence of antimycin A inhibited oxygen consumption. Mol. Biol. Rep. 29 (1-2), 83-87 (2002).
- Helmlinger, G., Sckell, A., Dellian, M., Forbes, N. S., Jain, R. K. Acid production in glycolysis-impaired tumors provides new insights into tumor metabolism. Clin. Cancer Res. 8 (4), 1284-1291 (2002).
- Mookerjee, S. A., Goncalves, R. L. S., Gerencser, A. G., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochim. Biophys. Acta. 1847, 171-181 (2015).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. Am. J. Physiol. 292 (1), C125-C136 (2006).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. J. Bioenerg. Biomembr. 44 (4), 421-437 (2012).
- Pelletier, M., Billingham, L. K., Ramaswamy, M., Siegel, R. M. Extracellular flux analysis to monitor glycolytic rates and mitochondrial oxygen consumption. Meth. Enzymol. 542, 125-149 (2014).
- Nicholls, D. G., Darley-Usmar, V. M., Wu, M., Jensen, P. B., Rogers, G. W., Ferrick, D. A. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp. (46), 2511 (2010).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), e21746 (2011).
- Seahorse Biosciences. . F24 Extracellular Flux Analyzer and Prep Station Installation and Operation Manual. 1.7, (2010).
- Blau, H., Chiu, C., Webster, C. Cytoplasmic activation of human nuclear genes in human heterocaryons. Cell. 32, 1171-1180 (1983).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados