Method Article
Una batería de pruebas de motor en un modelo de ratón neonatal de la parálisis cerebral
En este artículo
Resumen
Presented is a concise battery of mouse neonatal motor tests. Using these tests, neonatal motor deficits can be demonstrated in a variety of neonatal motor disorders. By having a standardized set of tests, results from different studies can be compared, allowing for better and accurate reporting between groups.
Resumen
As the sheer number of transgenic mice strains grow and rodent models of pediatric disease increase, there is an expanding need for a comprehensive, standardized battery of neonatal mouse motor tests. These tests can validate injury or disease models, determine treatment efficacy and/or assess motor behaviors in new transgenic strains. This paper presents a series of neonatal motor tests to evaluate general motor function, including ambulation, hindlimb foot angle, surface righting, negative geotaxis, front- and hindlimb suspension, grasping reflex, four limb grip strength and cliff aversion. Mice between the ages of post-natal day 2 to 14 can be used. In addition, these tests can be used for a wide range of neurological and neuromuscular pathologies, including cerebral palsy, hypoxic-ischemic encephalopathy, traumatic brain injury, spinal cord injury, neurodegenerative diseases, and neuromuscular disorders. These tests can also be used to determine the effects of pharmacological agents, as well as other types of therapeutic interventions. In this paper, motor deficits were evaluated in a novel neonatal mouse model of cerebral palsy that combines hypoxia, ischemia and inflammation. Forty-eight hours after injury, five tests out of the nine showed significant motor deficits: ambulation, hindlimb angle, hindlimb suspension, four limb grip strength, and grasping reflex. These tests revealed weakness in the hindlimbs, as well as fine motor skills such as grasping, which are similar to the motor deficits seen in human cerebral palsy patients.
Introducción
El desarrollo de nuevos modelos de lesión o enfermedad pediátrica usando roedores es a menudo difícil debido a la sorprendente capacidad de ratas y ratones a recuperarse rápidamente de la lesión neurológica. Por lo tanto, con el fin de validar cualquier nuevo modelo de enfermedad pediátrica, examinando a fondo los cambios celulares y moleculares deben ir mano a mano con los resultados conductuales. En muchos sentidos, la recuperación funcional de la conducta puede ser más importante que los cambios celulares subyacentes en términos de relevancia terapéutica o de traslación. A medida que los investigadores aprenden más sobre lesiones en el adulto y el recién nacido, es evidente que sus respuestas son muy diferentes y no se pueden extrapolar entre los dos. Por ejemplo, los ratones neonatales muestran diferentes niveles de factor de crecimiento nervioso, factor neurotrófico derivado del cerebro, neurotrofina-3 y el factor neurotrófico derivado de la línea celular glial después de una lesión de la médula espinal 1,2. Además, los recién nacidos tienen significativa permeabilidad de la barrera hematoencefálica después del accidente cerebrovascular 3, demonstrate reordenamiento neurona cortical después de la lesión del nervio periférico 4, y tienen una astrogliosis retrasado o desacelerado después de una lesión de la médula espinal y la hipoxia-isquemia 5,6. Por lo tanto, es importante que la investigación pediátrica de traslación utilizar modelos de desarrollo equivalentes y que esos modelos se evalúan para los cambios moleculares / celulares y pruebas de comportamiento apropiadas para la edad.
La parálisis cerebral (PC) es un trastorno motor que afecta a 3: 1000 nacidos vivos al año (NIH). Los niños con CP presentan una serie de síntomas y condiciones comórbidas, dependiendo de la gravedad de la enfermedad. Dificultad con el movimiento y la coordinación son los signos más comunes, junto con los retrasos en alcanzar los hitos del desarrollo motor. Otros signos incluyen tono muscular anormal (ya sea aumentado o disminuido), la reducción de las habilidades motoras finas, dificultad para caminar, tragar y babeo excesivo y retrasos en el habla (NIH). La causa subyacente de CP se cree que esuna falta de oxígeno y / o el flujo de sangre al cerebro durante el período de pre- o periparto, o hasta un año después del parto. Además, la inflamación es ahora cree que es un componente clave en el desarrollo de CP.
La mayoría de los casos de CP están asociados con daño de la sustancia blanca alrededor de los ventrículos, conocidas como leucomalacia periventricular (PVL). Este sello neurológica sugiere que la lesión inicial que conduce a CP se produce durante el período de desarrollo del cerebro cuando los oligodendrocitos son más vulnerables a los insultos. El período de crecimiento rápido de los oligodendrocitos en un ser humano, también el período en que los oligodendrocitos son los más susceptibles a las lesiones, es entre 24 - 32 semanas de gestación. En los roedores, el período equivalente es días postnatales 2 - 7 7, y es cuando se induce CP en este modelo.
El modelo de ratón neonatal de CP que se utilizó para realizar las pruebas descritos aquí combina la hipoxia e isquemia con la inflamación para crear un injUry que mejor imita la neurodegeneración ven en CP humano. Este modelo aborda algunas de las principales deficiencias observadas en otros modelos animales de CP, que carecen de los déficits distintos de motor que se asemeja a los pacientes con PC humanos, así como distintos daño de la materia blanca. Estudios previos realizados por un colaborador con el mismo modelo han demostrado que la adición de la inflamación aumenta el daño de la sustancia blanca, por lo tanto emular mejor el PVL visto en niños con parálisis cerebral 8. Sobre la base de los datos anteriores, este trabajo presenta una batería de pruebas de motor neonatales con el fin de evaluar los cambios en la conducta motora como las edades de los animales.
Protocolo
NOTA: Todas las cirugías animales se realizaron de acuerdo con el departamento de ULAR de la Universidad de Temple y las políticas y procedimientos del IACUC. C57BL / 6 presas y los toros fueron adquiridos de Charles River Laboratories y se alojaron en jaulas de cría con un / ciclo de luz de 12 horas de oscuridad (luz sobre 07:00-19:00) con acceso libre a comida y agua. Las parejas reproductoras producen camadas de entre 5 - 10 crías.
Cirugía 1. Parálisis Cerebral Inducción
- NOTA: La parálisis cerebral fue inducida mediante día postnatal (PND) 6 crías de ratón, como se ha descrito previamente 8,9 (http://www.jove.com/video/1951/mouse-models-of-periventricular-leukomalacia).
- Coloque un cachorro en un recipiente de vidrio en el hielo con un laboratorio trapo para proteger la piel del cachorro. Compruebe para el plano anestésico adecuado por pizca pie y la falta de movimiento. Mueva el cachorro a una bolsa de hielo acolchada para la cirugía.
- Esterilizar la piel del cachorro utilizando etanol al 70%. Una vez seco, utilizar un bla quirúrgico estéril # 11de y hacer una incisión de 1 cm en el cuello.
- El uso de un microscopio quirúrgico estereoscópico, aislar la arteria carótida común derecha con un pequeño gancho y cauterizar el uso de un cauterizador portátil de mano. confirmar visualmente que la arteria se ocluye. cirugía simulada incluye la visualización y el aislamiento de la arteria carótida común sin cauterización.
- Vuelva a alinear la piel y cerca usando sutura pegamento (n-butil cianoacrilato).
- Coloque el cachorro en una almohadilla térmica o 34 C durante 30 min para monitorizar la respiración espontánea y el movimiento normal.
- Devolver el cachorro (s) de la presa durante 30 minutos.
- Coloque los cachorros en una almohadilla eléctrica u otro dispositivo de calentamiento fijado en 34 ° C en el interior de una cámara de hipoxia fijado en el 6% de oxígeno durante 35 minutos. El oxígeno se sustituye por nitrógeno. Vigilar de cerca el nivel de cámara de oxígeno y la temperatura para obtener resultados consistentes de lesiones.
- Retire los cachorros de la cámara de hipoxia y devolverlos a la resistencia de calentamiento.
- Intraperitoneal inyectar lipopolysacárido diluye en solución salina estéril a 1 mg / kg y volver al cachorro a la presa. inyecciones simuladas son inyecciones de solamente solución salina.
2. Las pruebas de motor Neonatal
NOTA: El PND 8, 48 horas después de la inducción CP, crías de ratón se prueban para el desarrollo neuroconductual. Los cachorros se ponen a prueba dentro de un bloque de 4 horas antes del mediodía con el fin de eliminar el tiempo de las diferencias en el comportamiento del día. Los cachorros se eliminan de la presa por no más de 15 min a la vez para impedir la pérdida rápida de problemas de calor del cuerpo y el hambre / separación. Además, los cachorros se les permite descansar entre las pruebas para que los esfuerzos máximos se suscitó en cada prueba. La base de las pruebas de motor neonatales está adaptado usando la batería de pruebas de Fox 10,11 y adaptación de las pruebas de Fox 12 de Wahlsten, así como las publicaciones TREAT-NMD y otros comportamientos (como se señala en el texto para cada prueba). La batería del zorro de las pruebas son apropiadas para PND 2 - 21. De las pruebas de Fox, el bateadorY aquí presentes incluyen: reflejo de enderezamiento, agarrando reflejo, geotaxis negativos (llamados prueba de pantalla vertical en la batería de Fox) y la fuerza de prensión de cuatro extremidades (modificado a partir de pruebas de escalada pantalla de Fox y de Wahlsten). Aquí, la deambulación, la fuerza delante de las extremidades, y la fuerza de las extremidades posteriores también se prueban para distinguir el comportamiento motor reflexiva entre el simulacro y el ratón CP cachorros. Para eliminar las mejoras en las pruebas debido al aprendizaje, las pruebas se limitan a un máximo de 3 ensayos donde se indique. Todas las otras pruebas tuvieron sólo un ensayo por animal.
- Deambulación (Figura 1) (adaptado de un protocolo de rata 13):
NOTA: El rastreo es un comportamiento desarrollado a principios de la cría de ratón entre el PND a 0 - 5, en el que los ratones comienzan a punto de transición a caminar, a partir de 5 - 10 días de edad 14. En PND 8, la prueba de deambulación se aprovecha de esta evolución en el tiempo de transición. La locomoción puede, sin embargo, se anotó durante toda la vida de un ratón y se puede determinar a cualquier edad.Como no hay potencial para el aprendizaje, la prueba de la deambulación se puede repetir tantas veces como sea necesario a través del curso del experimento.- ratones lugar en un recinto claro que los ratones son visibles desde la parte superior, así como el lado. Utilice punzada suave al tocar la cola del cachorro para motivar al cachorro a caminar.
- Puntuación deambulación durante 3 minutos utilizando la siguiente escala: 0 = ningún movimiento, 1 = movimiento de las extremidades que se arrastra con asimétrica, 2 = rastreo lento movimiento de las extremidades, pero simétrica, y 3 = rastreo rápido / pie.
NOTA: Aquí, movimiento de las extremidades simétrico se describe en las patas traseras se encuentran frontpaws durante cada paso, y cada paso sin problemas las transiciones a la siguiente etapa. Un ratón se presentan movimiento de las extremidades asimétrica tiene la colocación de la pata errático y transiciones de una etapa a la siguiente no son suaves.
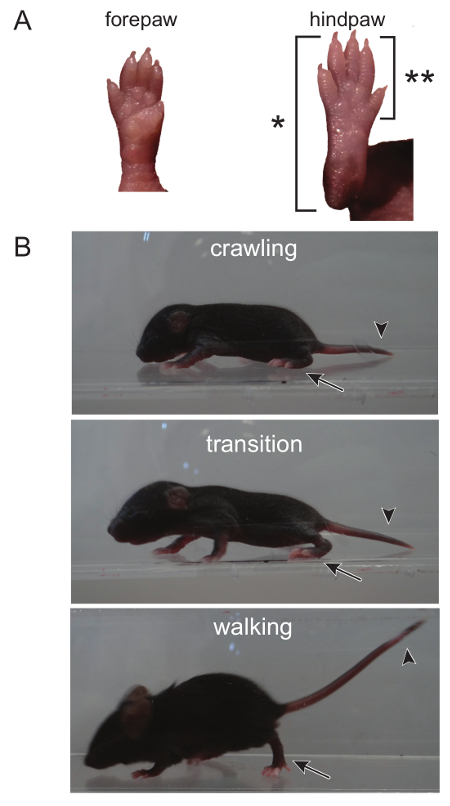
Figura 1. La transición deSe arrastra al caminar puede distinguirse mediante la observación de la pata trasera, así como la cabeza y la cola. (A) Durante el rastreo, la pata trasera entera, desde los dedos hasta el talón, toca el suelo al caminar, como se indica mediante (*). Una forma de andar de adultos sólo se ve cuando los dedos de los pies y la parte delantera de la pata trasera tocan el suelo (el talón es elevado, por deonoted [**]). (B) La cabeza y la cola de un ratón que se arrastra es bajo a la tierra. La cabeza empieza a subir durante la transición de gatear a caminar. La transición es completa cuando tanto la cabeza y la cola son elevados y sólo la parte delantera de la pata trasera toque el suelo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Del miembro posterior del pie de ángulo (Figura 2)
NOTA: Hay un cambio en el desarrollo de manifiesto en la postura de las extremidades posteriores como el mouse madura de gatear a caminar, en donde los miembros traseros están colocados debajo del cuerpo al caminar y el ángulo entre la patas traseras es menor que el ángulo se ve en el rastreo. A pesar de que el ángulo del pie del miembro posterior cambia con el tiempo, crías de ratón de la misma edad con diferentes lesiones o enfermedades pueden ser comparados. De manera similar a la prueba de deambulación (3.1), no hay potencial para el aprendizaje. Por lo tanto, la prueba de ángulo del pie del miembro posterior se puede repetir tantas veces como sea necesario a través del curso del experimento.- Ya sea en una caja de campo abierto claro o un área cerrada, montar una cámara de vídeo desde debajo o por encima, respectivamente, para registrar el cachorro medida que se mueve alrededor del campo. Utilice punzada suave al tocar la cola del cachorro para motivar al cachorro a caminar. Registro durante dos minutos.
- El uso de las grabaciones de vídeo, medir su ángulo de las crías al trazar una línea desde el extremo del talón / espinilla hasta la punta de los más largos del dedo del pie (en el centro). Sólo tomar la medición cuando el cachorro está realizando una zancada completaen una línea recta y los pies estén bien apoyados en el suelo. No tome mediciones, mientras que el cachorro está parado o mientras que el cachorro está girando.
- Medir tres a cinco series de ángulos para los pies y calcular el ángulo promedio para cada cachorro probado.
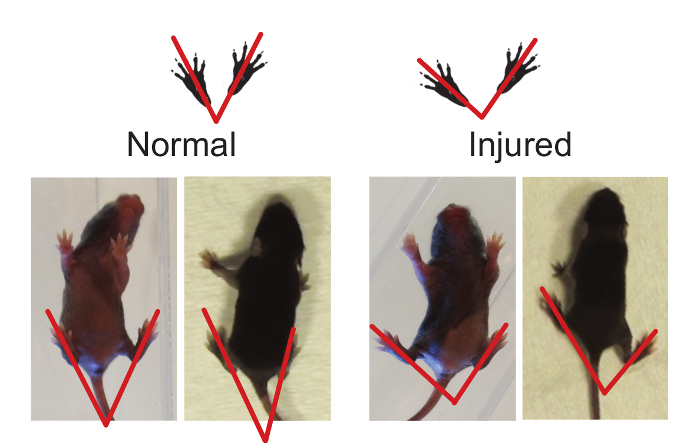
Figura 2. miembro posterior del pie en ángulo puede ser utilizado para determinar la marcha anormalidades. El ángulo del pie puede medirse trazando una línea desde mediados del talón a través del dígito medio (el más largo). Los animales heridos tienen un ángulo de pie mayor cuando se compara a la normalidad (ver resultados representativos, Pie de ángulo). Haga clic aquí para ver una versión más grande de esta figura.
- El enderezar la superficie (Figura 3):
NOTA: El reflejo de enderezamiento es la capacidad del motor para una cría de ratón para ser capaz de dar la vuelta en sus pies desde una posición supina. La edad media para el reflejo de enderezamiento a aparecer en roedores es PND 5 con un rango de PND 1 -. 10 15 Como esta prueba es un reflejo, no hay componente de aprendizaje y puede repetirse a lo largo del período de experimentación.- Coloque las crías a la espalda sobre una almohadilla de hoja de algodón o un banco y mantenga en su posición durante 5 segundos.
- Liberar las crías y registrar el tiempo que tarda el cachorro para volver a la posición en decúbito prono, así como la dirección de enderezamiento (izquierda o derecha). Se da un total de un minuto para cada ensayo, si es necesario.
- Repita para un total de tres ensayos.
Figura 3. superficial de enderezamiento. Esta prueba requiere el control del tronco y puede probar los desequilibrios posturales. los pacientes con PC humanos pueden tener déficits en su núcleo.e.com/files/ftp_upload/53569/53569fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Negativo geotaxis (Figura 4)
NOTA: La edad media de reflejo geotaxis negativa a aparecer en los roedores es PND 7 con un rango de PND 3 - 15 15 La prueba geotaxis negativo evalúa la coordinación motora en ratones jóvenes.. Los ratones se colocan mirando hacia abajo de una pendiente y, debido a las señales vestibulares de la gravedad, las crías se vuelven a enfrentar por la pendiente. La respuesta al estímulo, o los taxis, es un comportamiento innato.- Coloque el cachorro con su cabeza apuntando hacia abajo en una pendiente de 45º y mantenerla durante 5 seg.
- Liberar al cachorro y registrar el tiempo y la dirección que el cachorro se gira para mirar hacia arriba. El tiempo total de la prueba es de 2 min.
- Repita para un total de tres ensayos. Los ratones que caen por la pendiente o no se encienda puede ser re-probado, eliminado, o dado una puntuación de cero.
NOTA: Esta decisión es lEFT para el examinador, ya que ocasionalmente cachorros rodará por la pendiente, debido a la somnolencia y no de debilidad. Una vez que se toma la decisión sobre la forma de puntuación cachorros que caen por la pendiente, debe tenerse en cuenta en los métodos y debe ser consistente durante toda la prueba de todos los sujetos.

Figura 4. Negativo geotaxis. Motor y la entrada vestibular se requiere para el ratón para reconocer su orientación en una pendiente y dar la vuelta. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Suspensión delantera de las extremidades (Figura 5) 16; adaptado de 17, 18:
NOTA: Suspensión delantera de las extremidades a prueba la fuerza de la extremidad anterior de las crías, incluyendo la fuerza del brazo y la pata. Tsu prueba no se recomienda para cachorros menores de 10 PND 15. Los cachorros se les permite captar un alambre suspendidos encima de un objeto estable y colgar en el cable con las dos patas delanteras. El área de pruebas es a través de una zona de arrastre acolchada. La prueba puede detectar diferencias de fuerza lateral derecha / izquierda. El aprendizaje y la ausencia de refuerzo negativo puede conducir a un aumento de la no participación. Los ratones que caen inmediatamente si se suelta o el fracaso de comprender cuando se coloca en el cable son indicativos de la no participación.- Mantenga los cachorros con firmeza por el cuerpo y que puedan captar el hilo con las dos patas delanteras.
- Liberar al cachorro. El uso de un contador de tiempo o cronómetro, grabar el tiempo total a caer, así como la debilidad de la pata.
NOTA: debilidad de la pata se determina si un cachorro disminuye de forma del cable con una pata antes que el otro lugar de la liberación del cable con las dos patas al mismo tiempo. - Repita la prueba para un total de tres veces.
Figura 5. frontal del miembro de suspensión. Esta prueba de suspensión provoca tensión en las patas delanteras hasta que la fatiga muscular. Con este enfoque, se estableció la fuerza de línea de base en las extremidades anteriores. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Suspensión posterior (Figura 6):
NOTA: Esta prueba determina la fuerza de las extremidades posteriores de suspensión. Es una prueba diseñada específicamente para los recién nacidos y se utilizó inicialmente en animales entre PND 2-12 19,20, pero puede ser adaptado para ratones hasta PND 14. Esta prueba puede detectar diferencias derecha / izquierda de fuerza los miembros posteriores, así como la función neuromuscular. Se utiliza un estándar cónica 50 ml, rellena con toallitas de laboratorio. Al igual que en la prueba de suspensión delantera de las extremidades, esta prueba puede ser aprendido, sobre todo pecadoce no hay ninguna consecuencia negativa al caer. Por lo tanto, el aumento de la no participación, como se ve por los ratones que caen tan pronto como se presenta o el fracaso para alojarse cuando se coloca en el extremo del tubo, se puede notar.- El uso de un cónico de 50 ml, lugar cachorro suavemente boca abajo en el tubo con sus patas traseras colgaban por encima del borde.
- Liberar al cachorro. Observar la postura de las extremidades posteriores.
- Puntuación postura de acuerdo con los siguientes criterios.
NOTA: puntuación de 4 indica la separación normal de las extremidades posteriores con la cola levantada; puntuación de 3 significa debilidad es aparente y extremidades posteriores están más cerca juntos, pero que rara vez se tocan; puntuación de 2 indica extremidades posteriores están cerca unos de otros y, a menudo conmovedora; puntuación de 1 muestra una debilidad es aparente y los miembros posteriores son casi siempre en una posición entrelazadas con la cola levantada; una puntuación de 0 indica que abrocha constante de las patas traseras con la cola bajada o imposibilidad para mantener en el tubo para cualquier período de tiempo. - Conde tira si es necesario. Un tirón es qualified cuando el cachorro intenta levantar su cuerpo usando sus patas traseras mientras está suspendido en el lado del tubo cónico.
- El uso de un temporizador o cronómetro, registra la latencia a caer.
- Repetir todo el ensayo por triplicado.
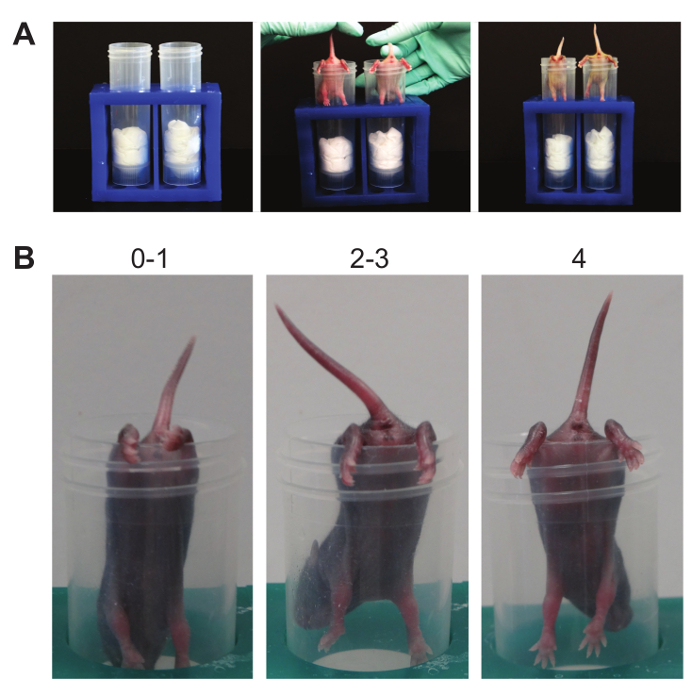
Figura 6. suspensión posterior. (A). Esta prueba de suspensión provoca tensión en los miembros posteriores hasta la fatiga muscular. La fuerza de línea de base y la postura de los miembros traseros son establecidas. (B). Scoring. Tenga en cuenta los números por encima de los ratones representativos que demuestran la puntuación posible postura. Haga clic aquí para ver una versión más grande de esta figura.
- La fuerza de prensión (Figura 7):
NOTA: Este ensayo examinará la pata strength de las cuatro patas al mismo tiempo. Se utiliza un cable de pantalla de 16 x 18 de fibra de vidrio. La edad media de un roedor que sea capaz de captar una pantalla horizontal es PND 8 con un rango de PND 5 - 15 15 Fox utilizó la prueba de la pantalla horizontal de cuatro extremidades del PND 2 -.. 21 10 Esta prueba es una modificación de la norma horizontal prueba de pantalla; aquí la pantalla se gira lentamente desde una posición horizontal a la posición vertical, para desafiar a la captación de las cuatro extremidades 21; adaptado de Corti S 16. Si el ratón se aferra a la pantalla de malla cuando se invierte a 180 °, grabar la latencia a caer. Además, tenga en cuenta el peso corporal. Un impulso de colgar puede ser calculada como [peso (g) x latencia a caer (sec)] que refleja la fuerza necesaria para resistir la gravedad.- El uso de un pedazo de tela metálica, coloque el cachorro en la pantalla. Deje que el cachorro a adaptarse a este ambiente durante aproximadamente 5 segundos.
- Invertir la pantalla lentamente a 180 grados. Registre el esp aproximadae de la pantalla cuando el cachorro se cae.
- Repita para un total de tres pruebas y el promedio de los ensayos.
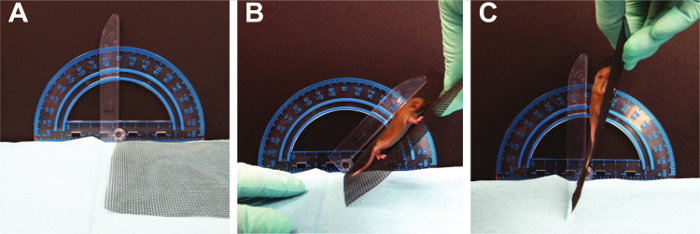
Se requiere la Figura 7. fuerza de agarre. Los ratones para mantener la tensión muscular en las cuatro extremidades como fuerza aumenta gravitacionales. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Aferramiento Reflex (Figura 8)
NOTA: El reflejo de agarre por lo general aparece en roedores con PND 7 con un rango de PND 3 - 15 15 Cada pata se prueba individualmente, por tanto, la prueba puede revelar problemas frontal o las extremidades posteriores, así como cuestiones parcialidad.. Como es un reflejo, esta prueba se puede repetir hasta que aparezca el reflejo. No es propenso a aprender. Como una advertencia importante, esta prueba no distingue la fuerza de agarre, única habilidad, y debe ser probado antes de 15 días de edad en ratones jóvenes comienzan a captar debido al temor de la respuesta.- Mantenga pulsado el ratón por la piel de su cuello, similar a la forma en que una cría de ratón se realiza por la presa. Esta posición hace que el cachorro se convierta en instintivamente inmóvil y relajado, lo que permite la facilidad de la prueba.
- Accidente cerebrovascular cada pata del perrito con el romo, redondeado lado de una hoja de afeitar.
- Pruebe cada pata individual y registrar la presencia o ausencia de agarre y una puntuación de 1 punto por cada pata con la que los agarra ratón.
NOTA: El marcador para el derecho de preferencia de la pata es de 100% para el derecho de preferencia de la pata, - - -100% para la preferencia de la pata izquierda, 50% para las dos patas de agarre, y 0% para no patas prensiles. La ecuación para determinar estos números es [(pata derecha - pata izquierda) / (pata derecha + izquierda + pata ambas patas)] x 100%.
/53569/53569fig8.jpg "/>
Figura 8. Grasping Reflex. Debido a ratones recién nacidos no tienen una fuerte respuesta de miedo, esta prueba determina estrictamente el reflejo plantar / palmar. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Acantilado Aversión (Figura 9):
NOTA: pruebas de aversión Cliff laberinto reflejos, así como la fuerza y la coordinación y se pueden utilizar para probar las crías de PND 1-14 22. Un cuadro de pre-perfumada (una caja donde se ha permitido un mínimo de 5 ratones para vagar libremente) con una repisa elevada plana se utiliza y el cachorro se coloca con los dígitos solamente de sus patas delanteras y su hocico colocada sobre el borde. La puntuación se realizó contando el tiempo total que tarda el cachorro a alejarse del acantilado y mover sus patas y el hocico fuera del borde. Si no se observa respuesta después de 30 segundos, se termina la prueba.Si el cachorro se cae del borde, un único ensayo adicional se puede realizar.- Usando una vista lateral, colocar el cachorro en el borde de la caja de pre-perfumado, asegurándose de que las patas delanteras, dígitos y el hocico son las únicas partes sobre el borde.
- Liberar las crías y comenzar temporizador.
- Una vez que tanto el hocico y las patas se han eliminado desde el borde, detener el tiempo del temporizador y registro.
- Repita la prueba para un total de 3 ensayos. Si el cachorro no se mueve lejos del acantilado dentro de 30 segundos, no se da una puntuación.
NOTA: La determinación de si el cachorro es un no-participante frente deteriorados se deja a la discreción del examinador. La altura del acantilado puede ser ajustada para la edad del cachorro para garantizar la seguridad del cachorro. A menor altura se puede utilizar con un "piso" negro de emular una altura mayor.
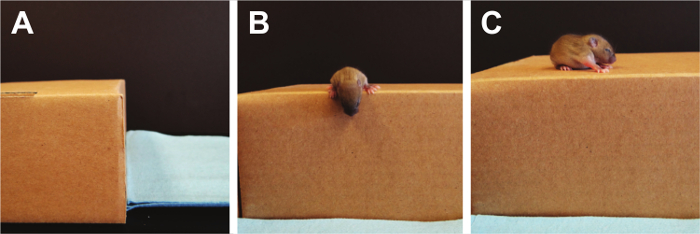
figur9. desequilibrios e acantilado Aversión. vestibulares se miden mediante la prueba de la aversión al acantilado. Aquí, los ojos del cachorro están todavía cerrados por lo que el miedo no es el factor que impulsa a alejarse de la orilla del acantilado. Por favor, haga clic aquí para ver una versión más grande de esta figura.
3. Significación estadística
- El uso de un software estadístico analizar los resultados. Expresar los datos como media ± error estándar de la media (SEM). Las pruebas son paramétricas y, por tanto, examinar los datos mediante análisis de la prueba t.
NOTA: Los experimentos no fueron diseñados para probar las diferencias de género. Las diferencias se consideraron estadísticamente significativas cuando p <0,05.
Resultados
Los ratones se pusieron a prueba de P7 (24 hr después de la cirugía) para P13 (1 semana después de la cirugía), utilizando ratones diferentes para cada punto de tiempo de manera que el aprendizaje de un paradigma de pruebas no era una variable de confusión. P8 fue seleccionado como resultados representativos, como los ratones mostraron los mayores déficits en este punto temporal.
La transición de gatear a caminar es retardado en ratones recién nacidos CP
los pacientes con PC humanos tienen alteraciones de la marcha, que van desde caminar de puntillas a una marcha en tijera. Como este modelo CP pantallas de la marcha y los déficits similares a los humanos, se evaluó la deambulación. Los ratones se obtuvieron de la uniformidad de la marcha y el movimiento de las extremidades-pata recta durante un paseo. A las 48 horas después de la cirugía (PND 8), los ratones tenían menos CP movimiento de las extremidades simétricas y un "rastreo" de la marcha, en comparación con sus homólogos sham (puntuación media deambulación: CP 1.083 ±0,6337, n = 12 vs simulacro 1,639 ± 0,4859, n = 9; p <0,05, Figura 10). Por una semana, tanto CP y ratones sham han hecho la transición a caminar (datos no mostrados).
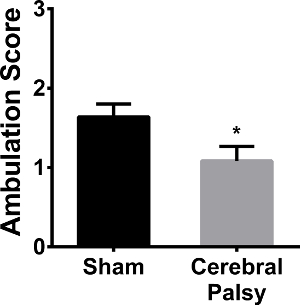
Figura 10. CP de ratón Los cachorros no Ambulate, así como Shams. Ratones Sham (barra de color negro) tienen una puntuación media de 1.639 ± 0.4859 (n = 9), es decir, su desarrollo se sitúa entre ambulatoria movimiento de las extremidades asimétricas y rastreo lento. ratones CP (barra gris) reciben una puntuación media de 1.083 ± 0.6337 (n = 12), es decir, su deambulación está menos desarrollada y tienden a tener movimiento de las extremidades asimétrica. Los datos se expresan como media ± SEM; * Es p <0,05. Haga clic aquí para ver una versión más grande de esta figura.
Hindlimb Pie de ángulo se incrementa en CP
Además de la deambulación, se evaluó extremidad posterior del pie de ángulo. Ocho días de edad, los cachorros ratón del impostor caminar con sus patas traseras hacia adelante, en comparación con los ratones HIL, que han extendidos patas traseras al caminar en una línea recta (Figura 2; ángulo medio: CP 77,48 ± 9,848, n = 9, vs simulacro 54.54 ± 8,043, n = 11; p <0,0001, Figura 11). Este aumento del ángulo se correlaciona con la inestabilidad de la marcha, en la que los cachorros necesitan para aumentar el ángulo de sus patas traseras con el fin de estabilizar su marcha y ayudar con el equilibrio y la coordinación.
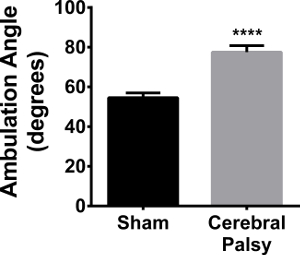
Figura 11. CP ratón Los cachorros Splay sus patas traseras al caminar. Ratones CP (barras negras) tienen un ángulo medio entre sus miembros traseros de 77,48 ± 8,043 (n = 11), mientras que los ratones sham (b gris ARS) tienen un ángulo promedio de 54,54 ± 9,848 (n = 9). Los datos se expresan como media ± SEM; **** Es p <0,0001. Haga clic aquí para ver una versión más grande de esta figura.
CP Los ratones no presentan déficit cuando superficial de enderezamiento
Se incluyó la prueba de enderezamiento superficie, ya que algunos pacientes con PC tienen problemas de control del tronco (Heyrman et al., 2013). Además, el sistema vestibular es necesario detectar la necesidad de corregir y hay déficit vestibular en algunos pacientes CP 23. ratones CP no muestran déficits significativos cuando enderezamiento en comparación con controles simulados (datos no mostrados).
Los ratones CP realizar la misma como Sham en negativo Prueba geotaxis
t "fo: keep-together.within-page =" 1 "> geotaxis negativo se utiliza para probar la coordinación motora en ratones jóvenes cachorros son desafiados por ser el lugar que va cuesta abajo sobre una superficie inclinada retraso o falta de orientar hacia arriba podría indicar déficits.. en coordinación, el equilibrio, o la entrada vestibular. ratones CP no muestran déficits cuando fueron estimulados con geotaxis negativos en comparación con los ratones sham (datos no mostrados). Además, los ratones CP no mostraron una preferencia a girar hacia un lado frente a otro cuando se re-orientación .Frente-Limb suspensión de ensayo es apropiado para ratones más viejos de 10 Días
los pacientes con PC han disminución del tono muscular y los déficits en las habilidades motoras finas, tales como agarrar. Para probar la debilidad en este modelo de ratón, se utilizó una prueba de suspensión delantera de las extremidades. Por otra parte, este modelo utiliza la lesión isquémica unilateral y bilateral-dad se pudo determinar el uso de esta prueba de suspensión. Esta pruebaes mejor para los ratones de más de 10 días 15. A los 8 días de edad, dos días después de la lesión, no había diferencias significativas entre CP y ratones sham (datos no mostrados).
La fuerza de las extremidades posteriores se reduce en ratones CP
los pacientes con PC humanos a menudo necesitan aparatos ortopédicos o dispositivos de soporte para caminar debido a la falta de control del motor y la fuerza. Con el fin de comparar el modelo CP de roedores a los seres humanos, la fuerza del miembro posterior se evaluó mediante la prueba de suspensión posterior. Cuando suspendido desde el lado de un tubo cónico, los ratones CP mostraron debilidad de las extremidades posteriores, como se demuestra por una disminución en colgando puntuación (miembro posterior puntuación colgando: CP 3,468 ± 0,5561, n = 13, vs sham 3,891 ± 0,1329, n = 13; p < 0,05, Figura 12). No se observó ninguna diferencia en el tiempo de suspensión de las extremidades posteriores (datos no mostrados). Por lo tanto, similar a los pacientes CP humanos, ratones CP demuestran hindlIMB (pierna) debilidad.
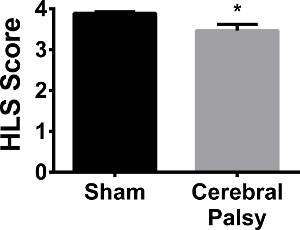
Figura 12. Los ratones Sham son ligeramente, pero significativamente más fuerte en sus patas traseras que los ratones CP. En una nota media que cuelga de 3,891 ± 0,1329 (n = 13), los ratones sham (barra de color negro) muestra una separación más extremidad posterior, y por lo tanto una postura más fuerte de las extremidades posteriores, al colgar en el borde de un tubo que los ratones CP (barra gris) con una puntuación media que cuelga de 3.468 ± 0.5561 (n = 13). Los datos se expresan como media ± SEM; * Es p <0,05. Haga clic aquí para ver una versión más grande de esta figura.
La fuerza de agarre se reduce después de una lesión CP
Agarrando con las cuatro patas es importante para un roedor entérminos de escalada y correr sobre superficies irregulares. Grip requiere fuerza sostenida significativa, en lugar de destreza o fuerza lineal, principalmente en los dígitos y las patas 24. Los ratones fueron requeridos para mantener su peso corporal en una pantalla de malla de alambre invertida. Ratones CP no fueron capaces de mantener su agarre y estos ratones cayeron en ángulos significativamente más bajos (cuatro extremidades ángulo medio: CP 75.627 ± 24.48, n = 11, vs sham 96,57 ± 10.836, n = 9; p <0,05, Figura 13). Estos datos muestran que hay un déficit significativo en la fuerza de agarre en ratones CP.
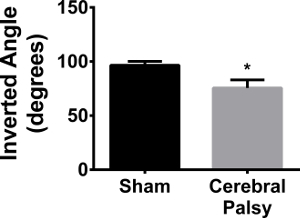
Figura 13. Los ratones tienen CP Grip Más débil que Shams. Ratones Sham (barra de color negro) puede captar un ángulo invertido promedio de 96.57 ± 10.836 (n = 9). ratones CP (barra gris) sólo pueden llegar a un ángulo invertido de 75.627 ± 24,48 (n = 11). Los datos se expresan como media ± SEM; * Es p0; 0.05. Haga clic aquí para ver una versión más grande de esta figura.
Los déficits aferramiento reflejas son evidentes en ratones CP
Junto con los déficits de motricidad gruesa, motricidad fina también se vean afectados en pacientes con PC 25,26. El reflejo de agarre en el ser humano está presente al nacer y desaparece alrededor de 5 - 6 En meses. Sin embargo, los cambios en el reflejo de agarre, tales como la velocidad exagerada o la fuerza de agarre, la falta de agarrar, o la reaparición del reflejo de agarre después de 6 meses de edad, todos indican daño en el sistema nervioso. Para comparar captar en el modelo de CP, se determinaron los déficit de agarre reflexivos.
A las 48 horas después de la lesión, los ratones CP demuestran una disminución de agarrar refleja (patas medias agarrarona las 48 horas: CP 2,429 ± 0,9376, n = 14, vs simulado 3.214 ± 0,8018, n = 14; p <0,05, Figura 14A). Hubo un aumento ligero, pero no significativo en la preferencia de la pata derecha en las patas delanteras (datos no mostrados). Hubo una preferencia pata derecha significativa en las patas traseras (CP 75.0 ± 42.74, n = 14, vs simulacro 17.86 ± 54.09, n = 14; p <0,005, Figura 14B). Una semana después de la lesión, los ratones CP muestran déficits de agarre (patas medias captados en la semana 1: CP 2,75 ± 1,035, n = 8, vs simulacro 3,80 ± 0,6325, n = 10; p <0,05, Figura 14C), sin preferencia pata notable .
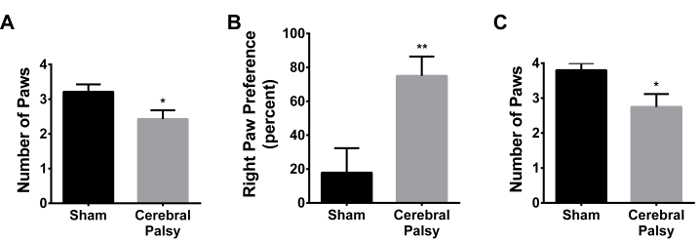
Figura 14. Los ratones CP tienen déficit agarrar, en la patas traseras, contralateral a la región del cerebro lesionado. (A) 48 horas después de la lesión (PND 8), los ratones CP (barra gris) agarrar un palo con, en promedio, un menor número de patas que anima farsals (barra de color negro). ratones (B) CP (barra gris) muestran una preferencia para agarrar con la pata trasera derecha (contralateral a la lesión) en lugar de utilizar la pata trasera izquierda (ipsilateral a la lesión). ratones Sham (barra de color negro) no muestran esta preferencia pata derecha. Preferencia pata derecha se calcula como ([pata derecha - izquierda pata] / [pata derecha + pata izquierda + ambas patas] * 100) (C) Una semana después de la lesión, los ratones CP (barra gris) muestran todavía agarrando déficit en comparación con. Shams (barra de color negro). Los datos se expresan como media ± SEM; * Es p <0,05, ** es p <0,005. Haga clic aquí para ver una versión más grande de esta figura.
Los ratones CP se alejan del borde del acantilado Durante Aversión
La prueba se basa en la aversión al precipicio del miedo inherente de los ratones para convertir awaY desde un acantilado y se dirigen hacia la seguridad. Aunque algunos pacientes con PC tienen dificultades vestibulares, así como problemas de control del motor, los ratones CP no mostraron ningún déficit en esta prueba.
Discusión
El uso de modelos animales para estudiar enfermedades humanas sólo es relevante si existe una superposición entre la respuesta celular y molecular entre humanos y roedores, y que las pruebas de comportamiento realizadas tienen relación directa con los síntomas humanos. Uno de los principales problemas con los estudios de enfermedades pediátricas es que muchos investigadores utilizan roedores adultos para crear el modelo, así como la evaluación del comportamiento de roedores adultos, sin tener en cuenta las diferencias de desarrollo que pueden ser importantes para el proceso de la enfermedad. Debido a estos problemas, es importante que la investigación sobre el uso de enfermedad pediátrica no sólo el ajustada desarrollo puntos de tiempo apropiado (por ejemplo, el desarrollo de CNS humano a las 28 - 32 semanas es equivalente a un día post-natal 2-7 días roedor) 7, sino también las pruebas de comportamiento que se examinarán de motor adecuada, los comportamientos del desarrollo sensorial o reflexivos. Por lo tanto, a medida que se desarrolla cada nuevo modelo de enfermedad neonatal, debe ser probado rigurosamente para asegurar que el celulary las respuestas de comportamiento proporcionarán los datos traducibles más adecuadas entre roedores y humanos.
La parálisis cerebral es un trastorno motor, que persisten en la edad adulta. Un problema con muchos de los modelos disponibles en la actualidad la parálisis cerebral es la falta de pruebas de motor repetible, estandarizada que puede correlacionarse con los déficits observados en los pacientes pediátricos. En este nuevo modelo, que combina la hipoxia, la isquemia y la inflamación en un ratón neonatal, el comportamiento motor se evaluó usando una batería de pruebas específicas para ratones neonatales. Con el fin de disminuir la subjetividad y aumentar la información cuantitativa, varias pruebas han sido modificados para incluir muy específico, pero fácil de evaluar las medidas que pueden ser estandarizados. Además, las evaluaciones delanteros y los miembros posteriores se pueden realizar por separado, y las diferencias de izquierda / derecha se pueden determinar. Esta batería de pruebas es específica para ratones recién nacidos hasta dos semanas de edad.
Este modelo demuestra CPdificultad para caminar (ambulación, ángulo del pie de las extremidades posteriores), así como la debilidad de las extremidades específica (suspensión de cuatro extremidades, suspensión posterior), y los déficit en los reflejos del desarrollo (agarrar reflejo). Aunque en este estudio se examinó sólo un punto de tiempo, estos déficits pueden ser rastreados a través del tiempo.
Hay otras series de pruebas que pueden utilizarse en el recién nacido, tales como la batería del Fox de pruebas o evaluación de hitos del desarrollo de 15 Heyser. Sin embargo, estas pruebas comparan el recién nacido al adulto, cuyas respuestas no son necesariamente lo mismo porque el recién nacido aún está en desarrollo. La batería de Fox y pruebas Assement de Heyser se basan en información subjetiva de observación con evaluación dicotómica (sí o no), en lugar de los datos objetivos (ángulo de la postura, sobre la base de la fuerza, etc). Debido a la subjetividad de estas pruebas, muchos científicos se han adaptado, añadido o eliminado criterios, con lo que sus resultados incomparables a los demás y límiteing la utilidad de los datos en términos de establecer un déficit línea de base para una enfermedad o trastorno particular. Mediante el establecimiento de un conjunto de pruebas de motor estandarizados que son cualitativa y específicamente diseñado para probar los recién nacidos, los resultados de los grupos de investigación individuales pueden ser precisa y fiable y se comparan.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
We would like to thank everyone at Shriners Hospital Pediatric Research Center, in particular Dr. Mickey Seltzer, of whom without his support, this work would not have been funded. In addition, we would like to thank Isha Srivastava, who contributed to early data collection and Amy He, who helped with the figures. This study was funded by Shriners Hospitals for Children. No funding source played a role in experimental design or decision to submit the paper for publication.
Materiales
| Name | Company | Catalog Number | Comments |
| C57BL/6 mice | Charles River Laboratories | STRAIN CODE: 027 | C57BL/6NCrl is the exact strain we use |
| Anesthesia Dish, PYREX™ Crystallizing Dish | Corning Life Sciences Glass | 3140125 | Capacity: 25.03 oz. (740ml); Dia. x H: 4.92 x 2.55 in. (125 x 65mm). However, any small round glass container will work. A 2 cup capacity pyrex food storage bowl with flat bottom will also work and is much cheaper (Pyrex model number: 6017399). |
| Covered lead ring | Fisher Scientific | S90139C | Lead ring for stablizing flasks in a water bath. It is used inside the anesthesia dish. |
| Scalpel Blade #11 | World Precision Instrucments, Inc. | 500240 | |
| Small Vessel Cauterizer | Fine Science Tools | 18000-00 | |
| Micro Hook | Fine Science Tools | 10064-14 | |
| Vetbond Suture Glue | 3M | 1469SB | n-butyl cyanoacrylate adhesive |
| Lipopolysaccharide | Sigma Life Science | L4391 | Lipopolysaccaride from E.coli 0111:B4, gamma irradiated |
| 12 x 12 inch opaque box | Acrylic Display Manufacturing: A division of Piasa Plastics | C4022 | Colored Acrylic 5-Sided Cube, 3/16" Colored Acrylic, 12"W x 12"D x 12"H; http://www.acrylicdisplaymfg.com/html/cubes_19.html |
| Camera/camcorder | JVC | GC-PX100BUS | Any camcorder that works well in low light and can be imported and edited. We use the JVC GC-PX100 Full HD Everio Camcorder. |
| Covidien Tendersorb™ Underpads | Kendall Healthcare Products Co | 7174 | |
| WypAll L40 | Kimberly-Clark Professional | 5600 | Any surface with moderate grip will do |
| Surface at 45 degree incline | We use a cardboard box. | ||
| Thin wire from a pipe cleaner | Creatology | M10314420 | Any pipe cleaner from any craft store will work. |
| 50mL conical tube | Falcon | 352070 | |
| Fiberglass Screen Wire | New York Wire www.lowes.com | 14436 | Any supplier can be used as long as their screen is 16 x 16 or 18 x 16 |
| Razor blade | Fisherbrand | 12-640 | A wooden stick applicator or wooden part of a cotton-tipped swab will also work. |
| OPTIX 24-in x 4-ft x 0.22-in Clear Acrylic Sheet to make Clear Acrylic Walkway | PLASKOLITE INC | 1AG2196A | Clear acrylic (1/8" thick) with sides and a top to limit exploration. We bought a sheet of acrylic from a local hardware store and had them cut it to size. (2) 2" x 2"; (3) 2" x 18"; (1) 2" x 15.5"; (1) 2" x 3". Using clear tape, tape all sides together, with the 15.5" piece on top. Tape the 3" piece to the end of the 15.5" piece to create a flap/entryway for the mice. Alternatively, part or all of the walkway can be glued together, and only taping on the top pieces. This design will allow for the walkway to be opened for easy cleaning. |
| Protractor | Westscott | ACM14371 |
Referencias
- Nakamura, M., Bregman, B. S. Differences in neurotrophic factor gene expression profiles between neonate and adult rat spinal cord after injury. Exp Neurol. 169 (2), 407-415 (2001).
- Widenfalk, J., Lundströmer, K., Jubran, M., Brene, S., Olson, L. Neurotrophic factors and receptors in the immature and adult spinal cord after mechanical injury or kainic acid. J Neurosci. 21 (10), 3457-3475 (2001).
- Fernández-Lòpez, D., Faustino, J., et al. Blood-brain barrier permeability is increased after acute adult stroke but not neonatal stroke in the rat. J Neurosci. 32 (28), 9588-9600 (2012).
- Cusick, C. G. Extensive cortical reorganization following sciatic nerve injury in adult rats versus restricted reorganization after neonatal injury: implications for spatial and temporal limits on somatosensory plasticity. Prog Brain Res. 108, 379-390 (1996).
- Barrett, C. P., Donati, E. J., Guth, L. Differences between adult and neonatal rats in their astroglial response to spinal injury. Exp Neurol. 84 (2), 374-385 (1984).
- Villapol, S., Gelot, A., Renolleau, S., Charriaut-Marlangue, C. Astrocyte Responses after Neonatal Ischemia: The Yin and the Yang. Neuroscientist. 14 (4), 339-344 (2008).
- Craig, A., Ling Luo, N., et al. Quantitative analysis of perinatal rodent oligodendrocyte lineage progression and its correlation with human. Exp Neurol. 181 (2), 231-240 (2003).
- Shen, Y., Liu, X. B., Pleasure, D. E., Deng, W. Axon-glia synapses are highly vulnerable to white matter injury in the developing brain. J Neurosci Res. 90 (1), 105-121 (2012).
- Shen, Y., Plane, J. M., Deng, W. Mouse models of periventricular leukomalacia. J Vis Exp. (39), (2010).
- Fox, W. M. Reflex-ontogeny and behavioural development of the mouse. Anim Behav. 13 (2), 234-241 (1965).
- Tremml, P., Lipp, H. P., Müller, U., Ricceri, L., Wolfer, D. P. Neurobehavioral development, adult openfield exploration and swimming navigation learning in mice with a modified beta-amyloid precursor protein gene. Behav Brain Res. 95 (1), 65-76 (1998).
- Wahlsten, D. A developmental time scale for postnatal changes in brain and behavior of B6D2F2 mice. Brain Res. 72 (2), 251-264 (1974).
- Balasubramaniam, J., Xue, M., Del Bigio, Long-term motor deficit following periventricular hemorrhage in neonatal rats: A potential model for human cerebral palsy. J Cerebr Blood F Met. , (2005).
- Williams, E., Scott, J. P. The Development of Social Behavior Patterns in the Mouse, in Relation to Natural Periods. Behaviour. 6 (1), 35-65 (1954).
- Heyser, C. J. Assessment of developmental milestones in rodents. Current protocols in neuroscience. Crawley, J. Q., et al. Chapter 8, (2004).
- Corti, S. Grip strength TREAT-NMD: Experimental protocols for SMA animal models. , http://www.treat-nmd.eu/research/preclinical/sma-sops/ (2014).
- Corti, S., Nizzardo, M., et al. Neural stem cell transplantation can ameliorate the phenotype of a mouse model of spinal muscular atrophy. J Clin Invest. 118 (10), 3316-3330 (2008).
- Grondard, C., Biondi, O., et al. Regular exercise prolongs survival in a type 2 spinal muscular atrophy model mouse. J Neurosci. 25 (33), 7615-7622 (2005).
- El-Khodor, B. F. Behavioral Phenotyping for Neonates. Experimental Protocols for SMA animal models. , (2011).
- El-Khodor, B. F., Edgar, N., et al. Identification of a battery of tests for drug candidate evaluation in the SMNDelta7 neonate model of spinal muscular atrophy. Exp Neurol. 212 (1), http://www.treat-nmd.eu/research/preclinical/sma-sops/ 29-43 (2008).
- Venerosi, A., Ricceri, L., Scattoni, M. L., Calamandrei, G. Prenatal chlorpyrifos exposure alters motor behavior and ultrasonic vocalization in CD-1 mouse pups. Environ Health. 8 (12), (2009).
- Hill, J. M., Lim, M. A., Stone, M. M. Developmental milestones in the newborn mouse. Neuromethods 39: Neuropeptide Techniques. , Humana Press. New Jersey. (2008).
- Visual dependence influences postural responses to continuous visual perturbation in adults with spastic cerebral palsy. Yu, Y., Keshner, A. E., Tucker, C. A., Thompson, E. D., Lauer, R. T. Combined Sections Meeting of American Physical Therapy Association, Anaheim, CA, USA, , (2016).
- Carlson, G. The use of four limb hanging tests to monitor muscle strength and condition over time. Experimental Protocols for SMA animal models. , http://www.treat-nmd.eu/downloads/file/sops/dmd/MDX/DMD_M.2.1.005.pdf (2011).
- Gordon, A. M., Duff, S. V. Relation between clinical measures and fine manipulative control in children with hemiplegic cerebral palsy. Dev Med Child Neurol. 41 (9), 586-591 (1999).
- Futagi, Y., Toribe, Y., Suzuki, Y. The grasp reflex and moro reflex in infants: hierarchy of primitive reflex responses. Int J Pediat. , (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados