Method Article
뇌성 마비의 신생아 마우스 모델에서 모터 테스트의 배터리
요약
Presented is a concise battery of mouse neonatal motor tests. Using these tests, neonatal motor deficits can be demonstrated in a variety of neonatal motor disorders. By having a standardized set of tests, results from different studies can be compared, allowing for better and accurate reporting between groups.
초록
As the sheer number of transgenic mice strains grow and rodent models of pediatric disease increase, there is an expanding need for a comprehensive, standardized battery of neonatal mouse motor tests. These tests can validate injury or disease models, determine treatment efficacy and/or assess motor behaviors in new transgenic strains. This paper presents a series of neonatal motor tests to evaluate general motor function, including ambulation, hindlimb foot angle, surface righting, negative geotaxis, front- and hindlimb suspension, grasping reflex, four limb grip strength and cliff aversion. Mice between the ages of post-natal day 2 to 14 can be used. In addition, these tests can be used for a wide range of neurological and neuromuscular pathologies, including cerebral palsy, hypoxic-ischemic encephalopathy, traumatic brain injury, spinal cord injury, neurodegenerative diseases, and neuromuscular disorders. These tests can also be used to determine the effects of pharmacological agents, as well as other types of therapeutic interventions. In this paper, motor deficits were evaluated in a novel neonatal mouse model of cerebral palsy that combines hypoxia, ischemia and inflammation. Forty-eight hours after injury, five tests out of the nine showed significant motor deficits: ambulation, hindlimb angle, hindlimb suspension, four limb grip strength, and grasping reflex. These tests revealed weakness in the hindlimbs, as well as fine motor skills such as grasping, which are similar to the motor deficits seen in human cerebral palsy patients.
서문
소아 부상이나 설치류를 사용하여 질병의 새로운 모델을 개발하는 것은 인해 급속하게 신경 부상에서 회복 모두 쥐와 생쥐의 놀라운 능력을 종종 어렵다. 따라서, 새로운 소아 질병 모델, 철저하게 행동 결과와 함께 손에 손을 이동해야하는 세포 및 분자 변경 검사의 유효성을 검사하기 위해있다. 여러 가지면에서 기능적인 행동 복구는 치료 또는 번역 관련성의 관점에서 기본 세포 변화보다 더 중요 할 수있다. 연구자는 성인 및 신생아 손상에 대한 자세한 내용으로서, 자신의 응답은 매우 상이하고, 둘 사이에 추정 할 수없는 것이 명백하다. 예를 들어, 마우스는 신생아 신경 성장 인자, 뇌 유래 신경영 양인자, 뉴로 트로 핀 -3 및 척수 손상 1,2- 다음 아교 세포주 유래 신경 영양성 인자의 상이한 레벨을 표시. 또한 신생아 뇌졸중 3 D 후 상당한 혈뇌 장벽 누설이말초 신경 손상 사 후 대뇌 피질의 신경 세포의 재 배열을 emonstrate 및 척수 손상 및 저산소증 - 허혈 5,6 다음의 지연 또는 둔화 astrogliosis 있습니다. 따라서 번역 소아 연구가 발달 해당하는 모델을 사용하는 것이 그 모델은 셀룰러 / 분자 변화와 연령에 적합한 행동 검사에 대해 평가하는 것이 중요하다.
1000 출산 매년 (NIH) : 뇌성 마비 (CP)는 3에 영향을 미치는 모터 질환이다. CP 어린이는 질병의 심각도에 따라 증상과 병적 조건의 범위를 나타낸다. 이동 및 조정 어려움 모터 발달 이정표 도달 지연과 함께 가장 흔한 증상이다. 다른 증상은 비정상적인 근육 톤을 (증가 또는 감소 중), 미세 운동 능력, 어려움 산책, 과도한 기뻐 날뛰는과 삼키는 및 음성 지연 (NIH)을 감소 있습니다. CP의 근본 원인으로 여겨진다또는 일년 산후까지 사전 또는 산기 기간 동안 산소 및 / 또는 뇌 혈류량 부족. 또한, 염증 이제 CP의 개발에 중요한 요소가 될 것으로 생각된다.
CP 사례의 대부분은 뇌실 주위 백질 연화증 (PVL)로 알려진 심실 주위 백질 손상과 연관된다. 이 신경 학적 특징은 CP로 이어지는 초기 모욕은 희소 돌기 아교 세포가 모욕에 가장 취약한 뇌 발달의 기간 동안 발생하는 것을 의미한다. 32주 임신 - 희소 돌기 아교 세포가 손상에 가장 민감한 인간의 급속한 희소 돌기 아교 세포 성장의 기간도 기간은 24 사이입니다. 설치류에 해당하는 기간은 산후 일 2 - 7 7 및 CP는이 모델에서 유도되는 경우이다.
여기에 설명 된 테스트를 수행하는 데 사용 된 CP의 신생 마우스 모델은 INJ를 만들 염증 저산소 허혈 결합더 나은 모방은 신경 퇴행 인간의 CP에서 본 것을 URY. 이 모델은 인간 환자 CP 유사한 별개의 모터 결손뿐만 아니라 별개의 백질 손상이없는 CP의 다른 동물 모델에서 관찰 된 주요 결점 중 일부를 해결한다. 동일한 모델을 사용하여 공동 작업자 이전 연구 염증 첨가 따라서 더 CP 8에서 보이는 아이들 PVL 에뮬레이션, 백질 손상을 개선하는 것이 증명 하였다. 이전 데이터를 구축,이 논문은 동물의 나이와 같은 모터 행동의 변화를 평가하기 위해 신생아 모터 테스트의 포괄적 인 배터리를 제공한다.
프로토콜
참고 : 모든 동물 수술이 템플 대학의 울라 부서 및 IACUC 정책 및 절차에 따라 수행 하였다. C57BL / 6 댐 및 아비는 찰스 리버 연구소에서 구입하고 (7시에 빛 - 19시) 12 시간 빛 / 어둠주기와 번식 케이지에 보관 된 음식과 물을 무료로 액세스 할 수있는. 10 새끼 - 번식 쌍 (5) 사이에 쓰레기 크기를 생산했다.
1. 뇌성 마비 유도 수술
- 참고 : 이전 8,9 설명 된대로 뇌성 마비가, 산후 일 (PND) 6 마우스 새끼를 사용하여 유도 하였다 (http://www.jove.com/video/1951/mouse-models-of-periventricular-leukomalacia).
- 실험실은 강아지의 피부를 보호하기 위해 닦아 얼음에 유리 그릇에 강아지를 놓습니다. 발 핀치와 운동 부족으로 적절한 마취 비행기를 확인합니다. 수술 패딩 얼음 팩에 강아지를 이동합니다.
- 70 % 에탄올을 사용하여 강아지의 피부를 소독. 때 건조하는 # 11 무균 수술 즐을 사용드와 목에 1cm 절개를합니다.
- 입체 수술 현미경을 사용, 작은 후크 우측 경동맥을 분리하고, 휴대용 핸드 헬드를 사용 cauterizer 소작. 시각적으로 동맥이 폐색되어 있는지 확인합니다. 위장 수술은 소작없이 시각화 및 경동맥의 분리를 포함한다.
- 피부와 가까운 사용하여 봉합 접착제 (n- 부틸 시아 노 아크릴 레이트)를 다시 정렬합니다.
- 자연 호흡과 정상적인 움직임을 모니터링하기 위해 30 분 동안 34 O를 C 가열 패드에있는 강아지를 놓습니다.
- 30 분 동안 댐하기 위해 강아지 (들)을 돌려줍니다.
- 가열 패드 또는 35 분 동안 6 %의 산소로 설정된 저산소 챔버 내에서 34 ℃로 설정 한 다른 온난화 장치의 새끼를 놓습니다. 산소는 질소로 대체됩니다. 밀접하게 일치 상해 결과에 대한 챔버 산소 레벨과 온도를 모니터링 할 수 있습니다.
- 저산소증 실에서 새끼를 제거하고 가열 패드로 돌아갑니다.
- 복강 lipopoly 주입당 1 μg의 / kg에서 멸균 식염수에 희석하여 댐에 강아지를 반환합니다. 가짜 주사는 생리 식염수를 주사한다.
2. 신생아 모터 테스트
참고 : PND 8 일, 48 시간 CP 유도 한 후, 마우스 새끼가 신경 행동 개발을위한 시험한다. 새끼는 행동의 날 차이의 시간을 제거하기 위해 정오 전에 4 시간 블록 내에서 시험한다. 새끼 체온 기아 / 분리 문제의 신속한 손실을 방지하기 위해 한 번에 15 개 이하의 분 댐으로부터 제거된다. 또한, 새끼는 최대한의 노력이 각 시험에서 도출 될 수 있도록 테스트 사이에 휴식을 사용할 수 있습니다. (각 시험 본문에서 언급 한 바와 같이) 신생아 모터 테스트의 기초는 시험 10, 11의 폭스의 배터리와 폭스의 검사 (12)의 Wahlsten의 적응뿐만 아니라, 취급-NMD와 다른 행동 출판물을 사용하여 구성된다. 폭스의 테스트의 (21), 타자 - 테스트 폭스의 배터리는 PND 2에 적합y를 본 여기에 포함 반사를 잡고, 반사를 바로 잡고, 4 사지 악력 (수직 폭스의 배터리에 스크린 테스트라고도 함) 부정적인 geotaxis이 (폭스와 Wahlsten의 화면 등반 시험에서 수정). 여기서, 보행, 전면 사지 강도 및 뒷다리의 강도는 가짜와 CP 마우스 새끼 사이의 재귀 모터의 동작을 구별하는 시험한다. 때문에 학습에 대한 테스트에 개선을 제거하기 위해, 시험은 지적 (3) 시험의 최대 제한되었다. 다른 모든 테스트는 동물 당 하나의 시험이 있었다.
- (쥐 프로토콜 13에서 적응) 보행 (그림 1)
참고 : 14 세 십일 - - 포인트 마우스 (5)에서 도보로 전환하기 시작하는 5, 크롤링는 PND 0 사이의 마우스 강아지 초기에 개발 된 동작입니다. PND 8에서, 보행 시험이 이행 시간 과정을 활용합니다. 보행하지만, 마우스의 수명에 걸쳐 획득 할 수 있고, 모든 연령에서 결정될 수있다.학습에 대한 가능성이 없기 때문에, 실험의 과정을 통해 필요에 따라 보행 검사는 여러 번 반복 될 수있다.- 마우스는 상단과 측면에서 볼 수 있습니다 투명한 케이스에 넣어 마우스. 산책하는 강아지 동기를 부여하기 위해 강아지의 꼬리를 만져 부드러운 괴롭히는을 사용합니다.
- 0 = 없음 운동, 비대칭 사지 운동 크롤링 1 = 2 = 느린 크롤링하지만 대칭 사지 운동, 3 = 빠른 크롤링 / 도보 : 다음 스케일을 사용하여 3 분 동안 보행 점수.
주 : hindpaws 각 단계 동안 frontpaws을 만나는 여기서, 대칭 사지의 움직임을 설명하고, 다음 단계로 원활하게 전환 단계. 비대칭 사지의 움직임을 표시하는 마우스가 부드럽게되지 않는 한 단계에서 다음에 엉뚱한 발 배치 및 전환이 있습니다.
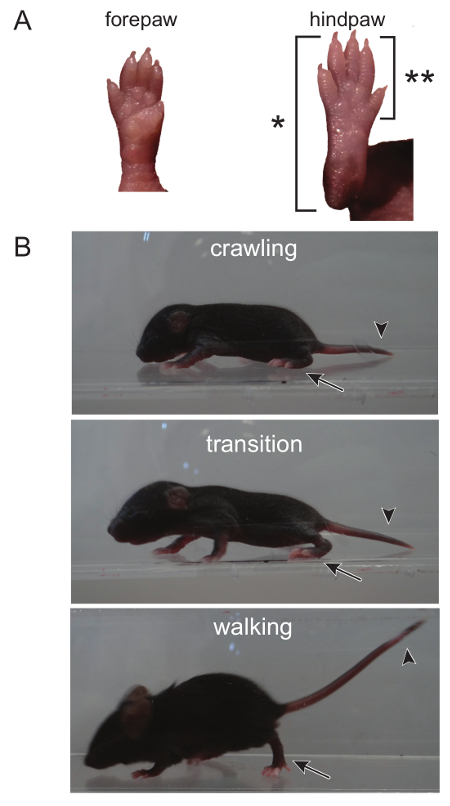
의 전환 1. 그림ambulating 때 붙이고 같이 워킹 크롤링하면 뒷발뿐만 아니라 머리와 꼬리를 관찰함으로써 구별 될 수있다. (A) 크롤 동안 전체 다시 발은 뒤꿈치 발가락에서 접지 접촉 (*). 의 만 발가락 앞부분이 땅에 터치 뒷발 때 성인의 보행 패턴은. (B) 머리와 크롤링 마우스의 꼬리 (발 뒤꿈치가 [**]에 의해 deonoted, 상승) 땅에 낮은 볼 수있다. 머리는 도보에 크롤링에서 전환하는 동안 상승하기 시작한다. 머리와 꼬리가 모두 상승하고 뒷발의 전면이지면에 닿을 때 전환이 완료되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 뒷다리 발 각도 (그림 2)
참고 : MOUS와 뒷다리 자세 명백한 발달 변화가있다전자는 걷기와 뒷다리 사이의 각도가 크롤링에서 볼 수있는 각도보다 작은 경우 뒷다리가 몸 아래에 위치 도보에 크롤링 성숙. 뒷다리 다리 각도 경시 변화해도, 다른 부상이나 질병과 같은 연령의 마우스 새끼는 비교 될 수있다. 보행 시험 (3.1)와 유사하게, 학습에 대한 가능성은 없다. 실험 과정을 통해 필요에 따라서, 뒷다리 발 각 검사는 여러 번 반복 될 수있다.- 어느 맑은 오픈 필드 상자 또는 닫힌 영역에서는, 필드 주위로 이동 강아지를 기록하기 위해, 아래 또는 위의 각각의 비디오 카메라를 탑재. 산책하는 강아지 동기를 부여하기 위해 강아지의 꼬리를 만져 부드러운 괴롭히는을 사용합니다. 두 분 녹음.
- 비디오 레코딩을 사용하여, 최장 (중간) 발가락의 선단에 발 뒤꿈치 / 정강이의 끝에서 선 드로잉하여 새끼의 다리 각도를 측정한다. 강아지 전체 보폭을 수행 할 때 만 측정을직선에 두 발은 바닥에 평평. 강아지가 정지 상태에서 측정을하지 않거나 강아지가 회전된다.
- 발 각도의 3 ~ 5 세트를 측정하고 각 시험 강아지의 평균 각도를 계산한다.
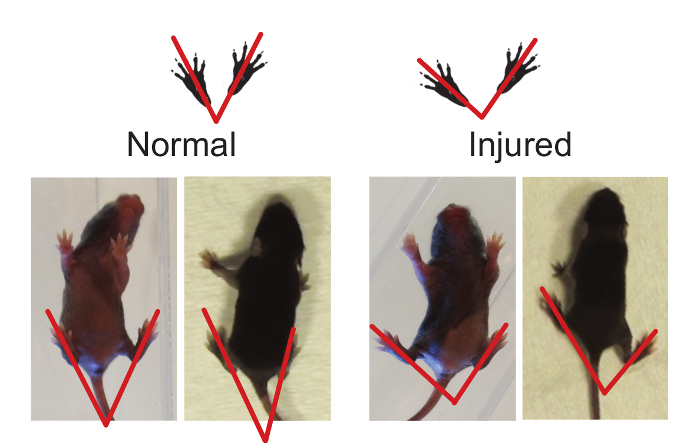
뒷다리 발 각도 보행 이상 유무를 확인하는 데 사용할 수 있습니다 그림 2.. 풋 각도는 중간 (긴) 자리를 통해 중간 발 뒤꿈치에서 선 그리기에 의해 측정 될 수있다. (, 발 각도를 대표 결과를 참조) 정상에 비해 부상 동물은 큰 발 각도를 가지고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 표면 바로 잡고 (그림 3)
주 : 복원력 반사가의 모터 기능입니다 마우스 강아지는 앙와위에서 그것의 발에 플립 할 수 있습니다. 설치류에 표시 할 수있는 복원력 반사의 평균 연령은 PND 1의 범위와 PND 5 -. 10 (15)이 시험은 반사이기 때문에, 거기에는 학습 구성 요소가 아닙니다하고는 실험 기간 동안 반복 될 수있다.- 코튼 시트 또는 벤치 패드에 자신의 허리에 새끼를 놓고 5 초 동안 위치에 유지.
- 새끼를 해제하고 발생하기 쉬운 위치로 돌아갑니다 강아지 걸리는 시간뿐만 아니라 바로 잡고 방향 (왼쪽 또는 오른쪽)를 기록. 필요한 경우 한 분의 총, 각 시험에 대해 설명한다.
- 세 가지 시험의 총 반복합니다.
그림 3. 표면 바로 잡고.이 테스트는 트렁크 제어를 필요로하며, 자세 불균형을 테스트 할 수 있습니다. 인간의 CP 환자는 자신의 핵심에 적자를 가질 수있다.e.com/files/ftp_upload/53569/53569fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 음 Geotaxis (그림 4)
참고 : 부정적인 geotaxis 반사의 평균 연령 설치류에 표시 할 수는 PND 3의 범위와 PND 7 - 15 15 부정적인 geotaxis 테스트는 젊은 쥐에서 모터 조정을 평가합니다.. 마우스는 중력의 전정 단서로, 새끼는 기울기를 얼굴을 돌려, 경사를 아래로 향하게하고 배치됩니다. 응답은 자극하거나, 택시, 타고난 동작입니다.- 머리는 45 오 경사 아래쪽으로 가리키는으로 강아지를 놓고 5 초 동안 유지.
- 강아지를 놓고 강아지가 위쪽으로 향하도록 회전 시간과 방향을 기록합니다. 총 시험 시간은 2 분이다.
- 세 가지 시험의 총 반복합니다. 경사 아래로 떨어지거나 설정하지 마우스는 수 중, 재 테스트 제거, 또는 0 점수를 부여 할 수 있습니다.
참고 :이 결정 리터입니다심사관에 EFT는 등 가끔 새끼 인해 졸음이 아닌 약점에 경사면을 굴러 것입니다. 결정이 경사를 넘어 새끼를 득점하는 방법에 이루어지면, 그것은 방법에 주목해야한다 모든 과목의 시험을 통해 일치해야합니다.

그림 4. 부정적인 Geotaxis. 모터 및 전정 입력이 경사면에 방향을 인식하고 돌아 할 수있는 마우스가 필요합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 전면 사지 서스펜션 (그림 5) (16) 18, 17에서 적응 :
참고 : 전면 사지 서스펜션은 팔과 발 강도를 포함하여 강아지의 앞다리 강도를 테스트합니다. 티그의 시험은 PND (10) 15 세 미만의 새끼하지 않는 것이 좋습니다. 새끼들까지 잔치는 안정적인 객체를 통해 중독 와이어를 잡고 두 앞발과 와이어에 걸어 사용할 수 있습니다. 시험 영역은 패딩 놓기 영역에 걸쳐있다. 시험은 왼쪽 / 오른쪽 강도 차이를 감지 할 수 있습니다. 학습과 부정적인 강화의 부재는 증가 비 참여로 이어질 수 있습니다. 해제 또는 전선에 배치 할 때 오류가 파악되면 즉시 떨어지는 마우스가 아닌 참여를 표시합니다.- 몸에 단단히 새끼를 잡고 두 앞발로 와이어를 파악 할 수 있도록.
- 강아지를 놓습니다. 타이머 또는 스톱워치를 사용하여, 낙하하는 총 시간을 기록 할뿐만 아니라, 발 약점.
참고 : 강아지가 지속적으로 오히려 동시에 두 발과 함께 선에서 방출보다 다른 전에 한 발과 함께 선에서 떨어지는 경우 발 약점이 결정된다. - 세 번 총 테스트를 반복합니다.
그림 5. 전면 사지 서스펜션.이 서스펜션 테스트는 근육 피로까지 앞발에 긴장을 야기한다. 이 방법으로, 앞다리의 기준 강도가 설정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 사지 서스펜션 (그림 6) :
참고 :이 서스펜션 테스트는 뒷다리의 강도를 결정한다. 그것은 신생아를 위해 특별히 설계된 테스트하고 처음 PND (2) 사이에 동물을 사용 하였다 - 12 19, 20, 그러나 PND (14) 왼쪽 / 오른쪽 뒷다리 강도의 차이뿐만 아니라 신경 근육 기능을 감지 할 수있는이 테스트까지 마우스에 대해 적용 할 수 있습니다. 표준 50 ML 원뿔 실험실 와이프 채워 사용된다. 전면 사지 서스펜션 테스트와 마찬가지로,이 시험은, 특히 죄를 배울 수 있습니다CE 마크는 하락에 부정적인 결과가 없습니다. 해제 실패를 튜브의 가장자리에 배치 될 때, 기록 될 수있다 요지 자마자 떨어지는 쥐가 본 즉, 비 참가 증가.- 뒷다리가 림 숙취로 50 ML 원뿔을 사용하여, 장소 강아지 부드럽게 튜브에 아래에 직면하고 있습니다.
- 강아지를 놓습니다. 사지의 자세를 관찰한다.
- 기준에 따라 자세 점수.
참고 : 4의 점수가 제기 꼬리 정상 사지 분리를 나타냅니다; (3)의 점수는 약점이 분명하고 뒷다리 가까이 함께하지만 그들은 거의 서로 접촉 없음을 의미합니다; (2)의 점수는 뒷다리가 서로 자주 접촉에 가까운 나타냅니다; 1의 점수는 약점이 분명하고 뒷다리가 제기 꼬리와 함께 푹 위치에 거의 항상 보여줍니다; 0의 점수는 낮아 꼬리 또는 시간의 기간 동안 튜브에 개최 실패와 뒷다리의 일정 물림쇠를 나타냅니다. - 필요한 경우 카운트 가져옵니다. 끌어 오기는 QUAL입니다원추형 튜브의 측면에 현탁하면서 강아지가 뒷다리를 사용하여 몸을 올리려고 할 때 지정한 본.
- 타이머 나 스톱워치를 사용하여 대기 시간이 떨어 기록한다.
- 세중의 전체 테스트를 반복합니다.
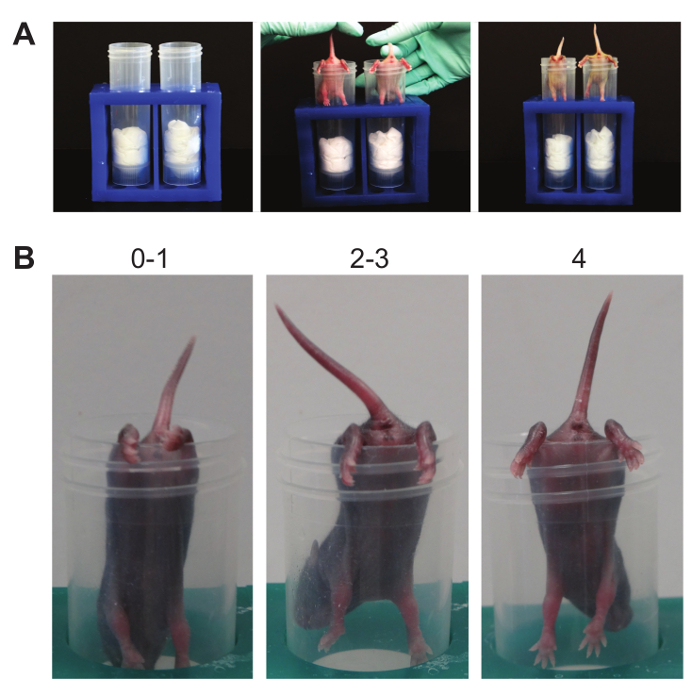
그림 6. 뒷다리 서스펜션. (A). 이 서스펜션 테스트는 근육 피로까지 뒷다리에 긴장을 야기한다. 뒷다리의 기준 강도와 자세 (B). 채점. 설정됩니다. 가능한 자세 점수를 보여주는 대표적인 마우스 위의 번호를합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 그립의 강도 (그림 7)
참고 :이 테스트는 발의를 검사합니다동시에 모든 네 발의 trength. 16 X 18 유리 섬유 화면 와이어가 사용됩니다. 15 15 폭스 PND 2에서 4 개의 사지 수평 스크린 테스트를 사용 - - 설치류가 가로 화면을 파악 할 수의 평균 연령은 PND 5의 범위와 PND 8입니다.. (21) (10)이 시험은 수평 표준에서 수정 스크린 테스트; 여기에 화면이 모든 사지 (21)의 파지에 도전하는 수직 위치로 수평에서 천천히 회전; 코르티 S (16)에서 적응. 180 ° 반전 할 때 마우스가 메시 스크린에 보유하고있는 경우, 대기 시간은 가을에 기록합니다. 또한, 체중 참고. 매달려 임펄스은 다음과 같이 계산 될 수있다 낙하 중량 (g) × 대기 시간 (초) 중력에 저항하기 위해 필요한 힘을 반영.- 철망의 조각을 사용하여, 화면의 새끼 장소. 강아지가 약 5 초 동안이 환경에 적응하도록 허용합니다.
- 180도 서서히 화면 전환. 대략 Ang1을을 기록화면의 전자는 강아지가 꺼 떨어질 때.
- 세 가지 시험의 총 반복하고 시험 평균.
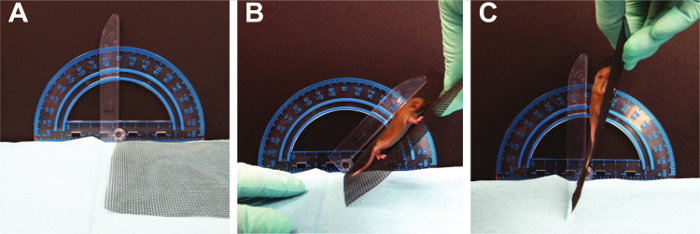
그림 7. 그립 강도. 마우스는 중력이 증가함에 따라 모든 사지의 근육 긴장을 유지해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 파악하는 반사 (그림 8)
참고 : 파악 반사는 일반적으로 PND 3의 범위와 PND (7)에서 설치류에 나타납니다 - 15 15 각 발 따라서 테스트가 전면 또는 뒷다리 문제뿐만 아니라 일면성의 문제를 드러 낼 수 개별적으로 시험한다.. 이 반사 그대로 반사가 나타날 때까지,이 테스트는 반복 될 수있다. 그것은 학습하는 경향이 없습니다. 중요한주의로,이 테스트 파악 강도 만 능력을 구분하지 않고, 청소년 마우스는 반응을 두려워하기 때문에 이해하기 시작할 때 나이 15 일 이전에 테스트해야합니다.- 마우스 강아지가 댐에 의해 수행되는 방식과 유사 목의 목덜미에 의해 마우스를 잡으십시오. 이 보류은 강아지 테스트의 용이성을 허용, 본능적으로 움직이지하고 편안하게됩니다.
- 스트로크 무딘와 강아지의 각 발은 면도날의 측면을 반올림.
- 개별적으로 발을 테스트하고 파악의 유무를 기록하고와 마우스 파악한다 발 당 1 포인트 점수.
참고 : 오른쪽 발 환경에 대한 점수는 오른쪽 발을 기본 설정으로 100 % - - 왼쪽 발을 기본 설정으로 -100 %, 두 발 50 %는 파악하고, 파악없이 발 0 %. X 100 % -이 숫자를 결정하는 방정식은 [/ (오른쪽 발 + 왼쪽 발 + 모두 발) (왼쪽 발을 오른쪽 발)]입니다.
/53569/53569fig8.jpg "/>
신생아 마우스는 강력한 공포 반응을하지 않기 때문에 그림 8. 파악하는 반사가.이 테스트가 엄격하게 발바닥 / 손바닥의 반사를 결정한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 절벽 회피 (그림 9)
주 : 클리프 회피 시험 반사뿐만 아니라, 강도 조정 미로 PND 1-14 22 새끼를 테스트하는데 사용될 수있다. 평면 높은 선반에 사전 향수 상자 (자유롭게 로밍 5 마우스의 최소 허용 된 상자)를 사용하고, 강아지는 그들의 앞발과 가장자리에 위치한 자신의 주둥이의 자리 배치됩니다. 점수는 멀리 절벽에서 회전 멀리 에지로부터 발 및 주둥이를 이동 강아지 걸리는 총 시간을 계산함으로써 수행된다. 응답이 30 초 후 보지 않으면, 테스트를 종료한다.강아지에이 에지 떨어지 경우 하나의 추가 시험이 수행 될 수있다.- 측면도을 사용하여, 앞발, 숫자 및 주둥이 가장자리에 걸쳐있는 유일한 부분이 있는지 확인하고, 사전 향수 상자의 가장자리에 강아지를 놓습니다.
- 강아지를 놓고 타이머를 시작합니다.
- 주둥이와 발 모두 가장자리에서 제거 된 후, 타이머 및 기록 시간을 중지합니다.
- (3) 시험의 총 테스트를 반복합니다. 강아지가 30 초 이내에 멀리 절벽에서 움직이지 않는 경우에는 점수가 주어지지 않습니다.
참고 : 강아지는 심사관의 재량에 달려 감액 손실 대 비 참가자 여부를 결정. 절벽의 높이가 강아지의 안전을 보장하기 강아지의 나이에 대해 조정될 수있다. 작은 높이보다 큰 높이를 에뮬레이트 검정색 "바닥"으로 사용될 수있다.
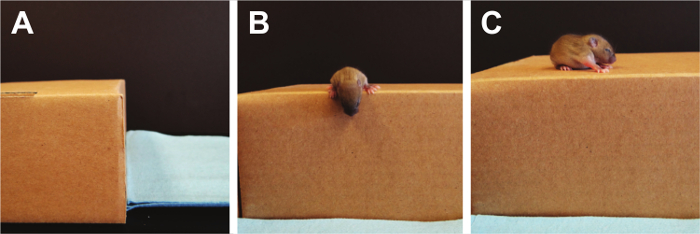
Figur전자 9. 클리프 혐오감. 전정 불균형은 절벽 회피 테스트를 사용하여 측정한다. 여기서, 강아지의 눈은 여전히 두려움 멀리 절벽의 가장자리에서 설정하는 구동 요인이되지 않도록 닫혀있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 통계 학적으로 유의
- 통계 소프트웨어를 사용하여 결과를 분석한다. 평균 (SEM)의 평균 ± 표준 오차로 데이터를 표현한다. 테스트 파라미터이며, 따라서 t 테스트 분석을 이용하여 상기 데이터를 조사한다.
참고 : 실험은 성별 차이를 테스트 할 수 있도록 설계되지 않았다. 차이 경우 p <0.05 통계적으로 유의 한 것으로 간주된다.
결과
마우스마다 점에 대해 서로 다른 마우스를 사용 P7 P13에 (24 시간 다음 수술) (수술 후 일주)에서 시험 하였다 그래서 테스트 패러다임을 학습하는 것은 혼란 변수가 아니었다. 마우스는이 시점에서 가장 큰 결손을 켰을 때, P8은 대표적인 결과로서 선택 하였다.
걷기에 크롤링에서 전환은 CP 신생아 마우스에서 지연된다
인간의 CP 환자는 발가락 걷기에서 scissored 걸음 걸이에 이르기까지, 걸음 걸이 이상을 가지고있다. 모델 디스플레이는 인간과 비슷한 적자를 보행이 CP로, 보행을 평가 하였다. 마우스는 직선 산책하는 동안 걸음 걸이 대칭 및 사지 발 운동 득점했다. CP 1.083 ± : 48 시간 다음 수술 (PND 8)에서, CP 마우스는 덜 대칭 사지 운동과 가짜 대응에 비해는 "크롤링"보행 (평균 보행 점수를했다가짜 1.639 ± 0.4859 대 0.6337, N = 12, N = 9; P <0.05, 그림 10). 일주하여 CP 및 마우스 모두 가짜 (데이타 미기재) 도보로 전환했다.
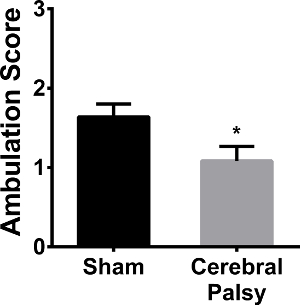
그림 10. CP 마우스 새끼 샴스뿐만 아니라 Ambulate하지 않습니다. 가짜 마우스 (검은 막대) 1.639 ± 0.4859 (N = 9), 그들의 외래 개발을 의미하는 비대칭 사지의 움직임과 느린 크롤링 사이에 폭포의 평균 점수가 있습니다. CP 마우스 (회색 막대)는 자신의 보행을 의미하는 것은 덜 개발하고, 1.083 ± 0.6337 (N = 12)의 평균 점수를 받고 비대칭 사지 운동을하는 경향이있다. 데이터는 평균 ± SEM으로 표현된다; * P <0.05이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
힌dlimb 발 각도 CP 증가된다
보행 외에도 뒷다리 발 각 평가 하였다. CP 77.48 ± 9.848, N = 9 대 가짜 54.54 ± : 평균 각도를, 8 일간짜리 가짜 마우스 새끼는 hindpaws 직선 (그림 2 걸을 때 hindpaws을 스플레이 한 HIL 마우스에 비해, 앞으로 직면 함께 산책 8.043, N = 11, P <0.0001, 그림 11). 새끼가 자신의 걸음 걸이를 안정시키고 균형과 조정을 지원하기 위해 자신의 뒤쪽 발의 각도를 증가시킬 필요가 있다는 점에서이 증가 각도, 보행 불안정과 상관.
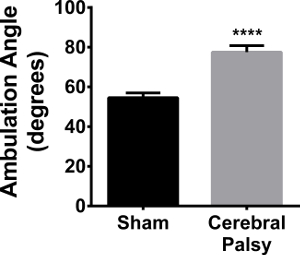
그림 11. CP 마우스 새끼들까지 잔치 스플레이 자신의 Hindpaws 산책. CP 마우스 (검은 막대), 77.48 ± 8.043 (N = 11)의 자신의 뒷다리 사이의 평균 각도가 가짜 마우스 (회색 B 동안 ARS)는 54.54 ± 9.848 (평균 각도가 N = 9). 데이터는 평균 ± SEM으로 표현된다; **** p <0.0001이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CP 마우스는 적자를 표시하지 않는 경우 표면 바로 잡고
일부 CP 환자 트렁크 제어 장애 것처럼 표면 복원력 시험 (Heyrman 외., 2013)에 포함 하였다. 또한, 시스템은 바로 잡고 전정의 필요성을 검출 할 필요가 일부 환자 CP 23 전정 결손이있다. 허위 대조군과 비교시 바로 잡고 CP 마우스는 현저한 결손을 보이지 않는다 (데이터는 보이지 않음).
CP 마우스는 제외 Geotaxis 테스트에서 위장과 동일하게 수행
"FO : 유지-together.within 페이지 ="을 t.. 1 "> 부정적인 geotaxis은 경 사진 표면에 내리막에 직면 장소 인에 의해 마우스에 도전하는 젊은 새끼 모터 조정을 테스트하는 데 사용 적자를 나타낼 수 동양 오르막에 지연 또는 실패한다 (데이터 미도시) 가짜 마우스에 비해 마이너스 geotaxis와 도전 때 조정, 밸런스, 전정 입력한다. CP 마우스가 더 결손을 표시하지 않는다. 또한, CP 마우스 다시 배향 서로 비교 한쪽으로 설정하는 선호를 보이지 않았다 .전면 사지 서스펜션 테스트는 10 일 이상 마우스에 적합하다
CP 환자는 파악 미세 운동 능력, 근육의 톤과 적자 감소했다. 이 마우스 모델에서 약점을 테스트하기 위해, 우리는 전면 사지 서스펜션 테스트를 사용했다. 또한,이 모델은 일방적 인 허혈 손상 및 양면 - 다움이 정지 테스트를 사용하여 측정 할 수 사용합니다. 이 테스트십일 15 세 이상 마우스에 대한 더 낫다. 팔일 이전에, 부상으로 다음과 같은 두 가지 일, CP와 가짜 쥐 사이에 유의 한 차이가 없었다 (데이터는 도시하지 않음).
뒷다리 힘 CP 마우스에 감소
인간의 CP 환자는 종종 인해 모터 제어와 힘의 부족으로 중괄호 또는 보조 산책 장치가 필요합니다. 인간 설치류 CP 모델과 비교하기 위해, 뒷다리 강도는 뒷다리 현탁액 시험을 사용하여 평가 하였다. CP 3.468 ± 0.5561, N = 13 대 가짜 3.891 ± 0.1329, N = 13, P는 <: 원뿔 튜브의 측면에서 정지 할 때 점수를 걸려에서 감소에 의해 입증 된 바와 같이, CP 마우스는 뒷다리 매달려 점수 (사지 약점을 보였다 0.05,도 12). 차이가 뒷다리 정지 시간에 관찰되지 않았다 (데이터는 보이지 않음). 따라서, CP 인간 환자와 마찬가지로, CP 생쥐 hindl을 보여IMB (다리) 약점.
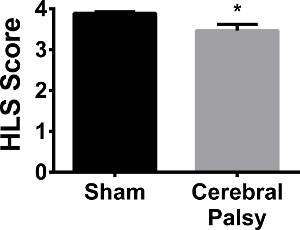
그림 12. 위장 마우스는 가짜 마우스 (검은 색 막대) 더 사지 분리, 따라서 강한 뒷다리 자세를 보여 3.891 ± 0.1329의 평균 매달려 점수에서. 약간 있지만 (N = 13) CP 마우스보다 자신의 뒷발에 크게 강화된다 3.468 ± 0.5561 (N = 13)의 평균 매달려 점수와 CP 마우스 (회색 막대)보다 튜브의 가장자리에 매달려 때. 데이터는 평균 ± SEM으로 표현된다; * P <0.05이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그립의 강도 다음은 CP 부상 감소
네 발에 파악하는 것은 설치류에서 중요하다등반 및 평평하지 않은 표면에 걸쳐 실행의 측면. 그립 주로 자릿수 오히려 손재주 또는 선형 힘보다 현저한 지속적인 힘이 필요하며 24 발. 마우스를 반전 와이어 메쉬 스크린 상에 자신의 체중을 유지하도록 요구되었다. CP 마우스는 자신의 그립을 유지하지 못한 이들 마우스는 상당히 낮은 각도로 떨어졌다 (사 사지 평균 각도 : CP 75.627 ± 24.48, N = 11 대 가짜 96.57 ± 10.836, N = 9; P <0.05, 그림 13). 이 데이터는 CP 생쥐 악력이 크게 부족이 있다는 것을 나타낸다.
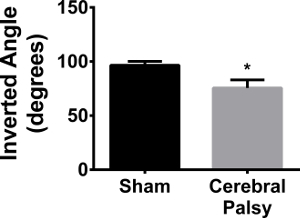
그림 13. CP 마우스는 샴스보다 약한 그립이 있습니다. 96.57 ± 10.836의 평균 반전 각도로 파악할 수 가짜 마우스 (검은 막대) (N = 9). CP 마우스 (회색 표시 줄) 만 75.627 ± 24.48 (N = 11)의 반전 각도에 도달 할 수 있습니다. 데이터는 평균 ± SEM으로 표현된다; * 페이지입니다0; 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
파지 반사의 적자는 CP 마우스에 명백한 있습니다
총 모터 적자와 함께, 미세 운동의 움직임 또한 CP 환자 25, 26에 손상됩니다. 인간의 파악 반사는 출생시 존재하고 약 5 사라 - 6개월. 그러나, 과장 속도 또는 파지의 강도, 파악 실패, 또는 생후 6 개월 후 파악 반사의 재 출현으로 파악 반사의 변화는 모두 신경계에 손상을 나타냅니다. 공산당 모델에 쥐고 비교하기 위해 재귀 파지 적자가 결정되었다.
손상 후 48 시간에서, CP의 마우스 파지 반사의 감소를 입증 (평균 발을 파악48 시간에서 : CP 2.429 ± 0.9376, N = 14 대 3.214 ± 0.8018 가짜, N = 14; p <0.05,도 14A). 앞발에 오른쪽 발 환경 설정에 약간 있지만 중요하지 증가가 발생했습니다 (데이터는 도시하지 않음). 거기 hindpaws에 상당한 오른쪽 발 선호했다 (CP 75.0 ± 42.74는 N = 14, 가짜 17.86 ± 54.09 대, N = 14, P <0.005, 그림 14B). 더 주목할만한 발 바람직하다; : 일주일 손상 후, CP 마우스는 파악 적자 (그림 14C, P <0.05 CP 2.75 ± 1.035을, N = 8, 가짜 3.80 ± 0.6325 대, N = 10 평균 발 1 주에 파악) 표시 .
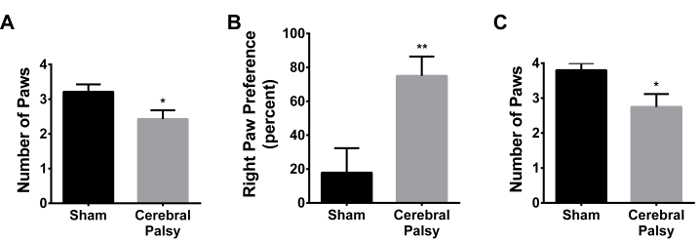
그림 14. CP 마우스는 부상 뇌 지역에 반대쪽 Hindpaws에서 파악하는 적자를 보유하고 있습니다. (A) 48 시간 다음의 부상 (PND 8), CP 마우스 (회색 막대) 평균과 막대기를 파악, 가짜 애니 마보다 적은 발LS (검은 색 막대). (B) CP 마우스 (회색 막대가) 왼쪽 뒷발 (상해 동측)을 사용하는 것이 아니라 (부상 반대측) 오른쪽 뒷발로 파악하기위한 환경 설정을 표시합니다. 가짜 마우스 (검은 색 막대)이 오른쪽 발 환경 설정을 표시하지 않습니다. 오른쪽 발 기본 설정은 다음과 같이 계산된다 ([오른쪽 발 - 발 왼쪽] / [오른쪽 발 + 왼쪽 발 + 모두 발] * 100) (C) 1 주에 다음과 같은 부상, CP 마우스 (회색 막대)에 비해 여전히 적자를 파악 보여줍니다. 가짜 (검은 막대). 데이터는 평균 ± SEM으로 표현된다; * ** p <0.005, P <0.05이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CP 마우스는 절벽 회피 동안 떨어져 가장자리에서 설정
절벽 회피 시험은 아를 설정하는 쥐의 고유 두려움에 의존안전을 향해 가파른 절벽과 머리에서 y를. 일부 CP 환자 전정 장애,뿐만 아니라 손상된 모터 제어가되지만, CP 마우스는이 시험의 모든 결핍을 보여주지 않았다.
토론
인간과 설치류 사이에 수행 된 행동 검사는 인간의 증상에 직접 관련이 그 세포 및 분자 응답 사이에 중복이있는 경우 인간의 질병을 연구하는 동물 모델을 사용하면에만 관련이 있습니다. 소아 질환 연구와 주요 이슈 중 하나는 많은 연구자는 질병 과정에 중요 할 수있다 발달 차이를 고려하지 않고, 상기 모델뿐만 아니라 성체 설치류 행동 평가를 만들 성인 쥐를 사용한다. 7 (7 일 설치류 - - 32주 후 산후 2 일에 해당 (28)의 예를 들면, 인간 CNS 개발) 이러한 문제 때문에, 소아 질환의 사용에 대한 연구뿐만 아니라 적절한 조정 발달 시간 포인트가 중요하다 뿐만 아니라 행동 테스트는 적절한 모터, 감각 또는 재귀 발달 행동을 검토 것이다. 각각의 새로운 신생아 질병 모델 개발로 따라서, 엄격하게 휴대 것을 보장하기 위해 테스트해야및 행동 반응은 설치류와 인간 사이의 가장 적절한 번역 데이터를 제공 할 것입니다.
뇌성 마비는 성인으로 지속 모터 질환이다. 오늘날 사용 가능한 뇌성 많은 모델의 한가지 문제점은 소아 환자에서 볼 수 결손과 상관 반복 표준화 모터 테스트의 부족이다. 신생아 마우스에서 저산소증, 허혈 및 염증을 결합한 새로운 모델에서, 모터의 동작은 신생 생쥐의 특정 테스트의 전지를 사용하여 평가 하였다. 정량적보고 주관성을 감소 및 증가시키기 위해 여러 테스트를 표준화 할 수 측정을 평가하는 매우 구체적인 쉬우나 포함하도록 변형되었다. 또한, 전면 및 뒷다리 평가는 별도로 수행 될 수 있고, 왼쪽 / 오른쪽 차이가 결정될 수있다. 시험이 배터리는 나이 2 주까지 신생아 쥐에 대한 구체적인이다.
이 CP 모델을 보여줍니다발달 반사에 (보행, 뒷다리 발 각도) 걷기의 어려움뿐만 아니라 사지 고유의 약점 (사 사지 서스펜션, 뒷다리 서스펜션) 및 적자 (반사를 잡고). 본 연구에서 하나의 평가시기가 검토되었지만, 이러한 결핍은 시간을 추적 할 수있다.
이러한 테스트의 폭스의 배터리 또는 발달 이정표 (15)의 Heyser의 평가와 신생아에서 사용할 수있는 테스트의 다른 배터리가있다. 그러나 이러한 테스트는 그 응답 신생아는 아직 개발되어 있기 때문에 동일하지 않을 수 있습니다 성인에 신생아를 비교합니다. 폭스의 배터리와 Heyser의 Assement 테스트는 오히려 (강도에 따라 각도, 자세 등) 객관적인 데이터보다, 이분법 (예 또는 아니오) 평가와 관찰 주관적인 정보에 의존합니다. 때문에 이러한 테스트의 subjectiveness, 많은 과학자들은 따라서 다른 사람과 한계 비교할 수없는 결과를 만드는 기준을 적용, 추가 또는 삭제했다특정 질병 또는 장애에 대한 기준을 확립 부족의 관점에서 데이터의 유용성을 보내고. 질적 구체적 신생아를 시험하기위한 표준화 된 모터 시험 한 세트를 구축함으로써, 개별 그룹 연구 결과를 정확하고 확실하게보고되고 비교 될 수있다.
공개
The authors declare that they have no competing financial interests.
감사의 말
We would like to thank everyone at Shriners Hospital Pediatric Research Center, in particular Dr. Mickey Seltzer, of whom without his support, this work would not have been funded. In addition, we would like to thank Isha Srivastava, who contributed to early data collection and Amy He, who helped with the figures. This study was funded by Shriners Hospitals for Children. No funding source played a role in experimental design or decision to submit the paper for publication.
자료
| Name | Company | Catalog Number | Comments |
| C57BL/6 mice | Charles River Laboratories | STRAIN CODE: 027 | C57BL/6NCrl is the exact strain we use |
| Anesthesia Dish, PYREX™ Crystallizing Dish | Corning Life Sciences Glass | 3140125 | Capacity: 25.03 oz. (740ml); Dia. x H: 4.92 x 2.55 in. (125 x 65mm). However, any small round glass container will work. A 2 cup capacity pyrex food storage bowl with flat bottom will also work and is much cheaper (Pyrex model number: 6017399). |
| Covered lead ring | Fisher Scientific | S90139C | Lead ring for stablizing flasks in a water bath. It is used inside the anesthesia dish. |
| Scalpel Blade #11 | World Precision Instrucments, Inc. | 500240 | |
| Small Vessel Cauterizer | Fine Science Tools | 18000-00 | |
| Micro Hook | Fine Science Tools | 10064-14 | |
| Vetbond Suture Glue | 3M | 1469SB | n-butyl cyanoacrylate adhesive |
| Lipopolysaccharide | Sigma Life Science | L4391 | Lipopolysaccaride from E.coli 0111:B4, gamma irradiated |
| 12 x 12 inch opaque box | Acrylic Display Manufacturing: A division of Piasa Plastics | C4022 | Colored Acrylic 5-Sided Cube, 3/16" Colored Acrylic, 12"W x 12"D x 12"H; http://www.acrylicdisplaymfg.com/html/cubes_19.html |
| Camera/camcorder | JVC | GC-PX100BUS | Any camcorder that works well in low light and can be imported and edited. We use the JVC GC-PX100 Full HD Everio Camcorder. |
| Covidien Tendersorb™ Underpads | Kendall Healthcare Products Co | 7174 | |
| WypAll L40 | Kimberly-Clark Professional | 5600 | Any surface with moderate grip will do |
| Surface at 45 degree incline | We use a cardboard box. | ||
| Thin wire from a pipe cleaner | Creatology | M10314420 | Any pipe cleaner from any craft store will work. |
| 50mL conical tube | Falcon | 352070 | |
| Fiberglass Screen Wire | New York Wire www.lowes.com | 14436 | Any supplier can be used as long as their screen is 16 x 16 or 18 x 16 |
| Razor blade | Fisherbrand | 12-640 | A wooden stick applicator or wooden part of a cotton-tipped swab will also work. |
| OPTIX 24-in x 4-ft x 0.22-in Clear Acrylic Sheet to make Clear Acrylic Walkway | PLASKOLITE INC | 1AG2196A | Clear acrylic (1/8" thick) with sides and a top to limit exploration. We bought a sheet of acrylic from a local hardware store and had them cut it to size. (2) 2" x 2"; (3) 2" x 18"; (1) 2" x 15.5"; (1) 2" x 3". Using clear tape, tape all sides together, with the 15.5" piece on top. Tape the 3" piece to the end of the 15.5" piece to create a flap/entryway for the mice. Alternatively, part or all of the walkway can be glued together, and only taping on the top pieces. This design will allow for the walkway to be opened for easy cleaning. |
| Protractor | Westscott | ACM14371 |
참고문헌
- Nakamura, M., Bregman, B. S. Differences in neurotrophic factor gene expression profiles between neonate and adult rat spinal cord after injury. Exp Neurol. 169 (2), 407-415 (2001).
- Widenfalk, J., Lundströmer, K., Jubran, M., Brene, S., Olson, L. Neurotrophic factors and receptors in the immature and adult spinal cord after mechanical injury or kainic acid. J Neurosci. 21 (10), 3457-3475 (2001).
- Fernández-Lòpez, D., Faustino, J., et al. Blood-brain barrier permeability is increased after acute adult stroke but not neonatal stroke in the rat. J Neurosci. 32 (28), 9588-9600 (2012).
- Cusick, C. G. Extensive cortical reorganization following sciatic nerve injury in adult rats versus restricted reorganization after neonatal injury: implications for spatial and temporal limits on somatosensory plasticity. Prog Brain Res. 108, 379-390 (1996).
- Barrett, C. P., Donati, E. J., Guth, L. Differences between adult and neonatal rats in their astroglial response to spinal injury. Exp Neurol. 84 (2), 374-385 (1984).
- Villapol, S., Gelot, A., Renolleau, S., Charriaut-Marlangue, C. Astrocyte Responses after Neonatal Ischemia: The Yin and the Yang. Neuroscientist. 14 (4), 339-344 (2008).
- Craig, A., Ling Luo, N., et al. Quantitative analysis of perinatal rodent oligodendrocyte lineage progression and its correlation with human. Exp Neurol. 181 (2), 231-240 (2003).
- Shen, Y., Liu, X. B., Pleasure, D. E., Deng, W. Axon-glia synapses are highly vulnerable to white matter injury in the developing brain. J Neurosci Res. 90 (1), 105-121 (2012).
- Shen, Y., Plane, J. M., Deng, W. Mouse models of periventricular leukomalacia. J Vis Exp. (39), (2010).
- Fox, W. M. Reflex-ontogeny and behavioural development of the mouse. Anim Behav. 13 (2), 234-241 (1965).
- Tremml, P., Lipp, H. P., Müller, U., Ricceri, L., Wolfer, D. P. Neurobehavioral development, adult openfield exploration and swimming navigation learning in mice with a modified beta-amyloid precursor protein gene. Behav Brain Res. 95 (1), 65-76 (1998).
- Wahlsten, D. A developmental time scale for postnatal changes in brain and behavior of B6D2F2 mice. Brain Res. 72 (2), 251-264 (1974).
- Balasubramaniam, J., Xue, M., Del Bigio, Long-term motor deficit following periventricular hemorrhage in neonatal rats: A potential model for human cerebral palsy. J Cerebr Blood F Met. , (2005).
- Williams, E., Scott, J. P. The Development of Social Behavior Patterns in the Mouse, in Relation to Natural Periods. Behaviour. 6 (1), 35-65 (1954).
- Heyser, C. J. Assessment of developmental milestones in rodents. Current protocols in neuroscience. Crawley, J. Q., et al. Chapter 8, (2004).
- Corti, S. Grip strength TREAT-NMD: Experimental protocols for SMA animal models. , http://www.treat-nmd.eu/research/preclinical/sma-sops/ (2014).
- Corti, S., Nizzardo, M., et al. Neural stem cell transplantation can ameliorate the phenotype of a mouse model of spinal muscular atrophy. J Clin Invest. 118 (10), 3316-3330 (2008).
- Grondard, C., Biondi, O., et al. Regular exercise prolongs survival in a type 2 spinal muscular atrophy model mouse. J Neurosci. 25 (33), 7615-7622 (2005).
- El-Khodor, B. F. Behavioral Phenotyping for Neonates. Experimental Protocols for SMA animal models. , (2011).
- El-Khodor, B. F., Edgar, N., et al. Identification of a battery of tests for drug candidate evaluation in the SMNDelta7 neonate model of spinal muscular atrophy. Exp Neurol. 212 (1), http://www.treat-nmd.eu/research/preclinical/sma-sops/ 29-43 (2008).
- Venerosi, A., Ricceri, L., Scattoni, M. L., Calamandrei, G. Prenatal chlorpyrifos exposure alters motor behavior and ultrasonic vocalization in CD-1 mouse pups. Environ Health. 8 (12), (2009).
- Hill, J. M., Lim, M. A., Stone, M. M. Developmental milestones in the newborn mouse. Neuromethods 39: Neuropeptide Techniques. , Humana Press. New Jersey. (2008).
- Visual dependence influences postural responses to continuous visual perturbation in adults with spastic cerebral palsy. Yu, Y., Keshner, A. E., Tucker, C. A., Thompson, E. D., Lauer, R. T. Combined Sections Meeting of American Physical Therapy Association, Anaheim, CA, USA, , (2016).
- Carlson, G. The use of four limb hanging tests to monitor muscle strength and condition over time. Experimental Protocols for SMA animal models. , http://www.treat-nmd.eu/downloads/file/sops/dmd/MDX/DMD_M.2.1.005.pdf (2011).
- Gordon, A. M., Duff, S. V. Relation between clinical measures and fine manipulative control in children with hemiplegic cerebral palsy. Dev Med Child Neurol. 41 (9), 586-591 (1999).
- Futagi, Y., Toribe, Y., Suzuki, Y. The grasp reflex and moro reflex in infants: hierarchy of primitive reflex responses. Int J Pediat. , (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유