Method Article
Heterotópico renal autotrasplante en un modelo porcino: Un Protocolo de Paso a Paso
En este artículo
Resumen
Porcine models of organ transplantation provide an important platform to study mechanisms of organ preservation. This article describes a heterotopic porcine renal autotransplantation model, which allows investigating new approaches to improve the outcome of transplantation using marginal kidney grafts.
Resumen
Kidney transplantation is the treatment of choice for patients suffering from end-stage renal disease. It offers better life expectancy and higher quality of life when compared to dialysis. Although the last few decades have seen major improvements in patient outcomes following kidney transplantation, the increasing shortage of available organs represents a severe problem worldwide. To expand the donor pool, marginal kidney grafts recovered from extended criteria donors (ECD) or donated after circulatory death (DCD) are now accepted for transplantation. To further improve the postoperative outcome of these marginal grafts, research must focus on new therapeutic approaches such as alternative preservation techniques, immunomodulation, gene transfer, and stem cell administration.
Experimental studies in animal models are the final step before newly developed techniques can be translated into clinical practice. Porcine kidney transplantation is an excellent model of human transplantation and allows investigation of novel approaches. The major advantage of the porcine model is its anatomical and physiological similarity to the human body, which facilitates the rapid translation of new findings to clinical trials. This article offers a surgical step-by-step protocol for an autotransplantation model and highlights key factors to ensure experimental success. Adequate pre- and postoperative housing, attentive anesthesia, and consistent surgical techniques result in favorable postoperative outcomes. Resection of the contralateral native kidney provides the opportunity to assess post-transplant graft function. The placement of venous and urinary catheters and the use of metabolic cages allow further detailed evaluation. For long-term follow-up studies and investigation of alternative graft preservation techniques, autotransplantation models are superior to allotransplantation models, as they avoid the confounding bias posed by rejection and immunosuppressive medication.
Introducción
Kidney transplantation is the treatment of choice for patients with end-stage renal disease, due to associated lower rates of morbidity and mortality when compared to dialysis 1-3. Despite major improvements in patient outcomes following kidney transplantation, graft shortage still poses a severe challenge worldwide. The number of patients waiting for a kidney transplant by far exceeds the number of organs available 4-6. To increase the number of kidneys available for transplantation and to reduce patient waiting times, further sources of kidney grafts are needed.
Commonly, standard criteria donor (SCD) and extended criteria donor (ECD) kidney grafts from donation after brain death (DBD) as well as kidneys recovered from live donors (LDKT) are utilized. Since the 1990s, an increasing number of kidney grafts have been recovered in a donation after circulatory death (DCD) scenario, to further expand the donor pool 7,8. However, DCD and ECD kidney grafts demonstrate acceptable but decreased outcomes after transplantation, depending on different factors, such as donor age, warm and cold ischemia times, and the preservation technique used 9-11. Thus, additional research is required to improve the outcome of patients receiving marginal kidney grafts and to further increase the donor pool.
The porcine model of renal transplantation is well established and provides a clinical important scenario to investigate innovative approaches for the improvement of marginal kidney graft outcomes. In contrast to rodent and canine kidneys, which are unilobular, porcine and human kidneys are multilobular and are anatomically similar, particularly in regard to the arterial, venous, and urinary collecting systems 12,13. In addition, porcine and human kidneys demonstrate similarities in the pathophysiology of ischemia reperfusion injury (IRI), biochemistry, and immunological parameters 14. Thus, porcine renal transplantation is well-suited to investigate new organ preservation methods for marginal kidney grafts 15-17, model human IRI 18, study immunological pathways and allograft tolerance 19, provide surgical training 20-22, test new pharmacological therapies 23, implement new medical devices, and study new immunological mechanisms in xenotransplantation 24-26.
The renal porcine and human transplantation settings are not completely analogous. This article focuses on important technical details that will facilitate successful establishment of a renal autotransplantation model. Species-adapted pre- and postoperative housing, administration of anesthesia with close monitoring, and matched surgical techniques are described in the protocol and demonstrated in the video. Resection of the contralateral native kidney provides the opportunity to assess the function of the transplanted kidney. The placement of venous and urinary catheters and the use of metabolic cages allow more in-depth assessment. For studies aimed at investigating alternative graft preservation methods and mechanisms of IRI, autotransplantation models are superior to allotransplantation models, as they avoid the complications and confounding bias associated with rejection and use of immunosuppressive medications.
Protocolo
Todos los animales recibieron cuidado humano y todos los estudios que llevamos a cabo de conformidad con las políticas y directrices del Consejo Canadiense de Protección de los Animales. Todos los procedimientos se llevaron a cabo en condiciones de uso animal Protocolos que fueron aprobados por el Cuidado de la Salud de la Universidad Red Institucional Animal.
Nota: Una vista general esquemática del protocolo de estudio se presenta en la Figura 1.
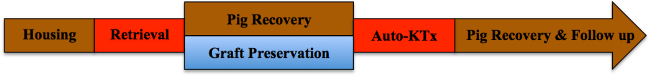
Figura 1. Protocolo del estudio. Haga clic aquí para ver una versión más grande de esta figura.
1. Los animales
- Utilice cerdos Yorkshire machos (30 kg) en este protocolo.
2. Recuperación del injerto renal
- Procedimiento preoperatorio
- Casa del macho Yorkshire cerdos en un centro de investigación durante al menos una semana para aclimatarse ellos. Utilice la inyección intramuscular de una cefalosporina de tercera generación, tales como ceftiofur, durante 3 días para reducir el riesgo potencial de infecciones con Streptococcus suis y Salmonella. Fast los cerdos durante un mínimo de 6 horas antes de la inducción de la anestesia para evitar la aspiración.
- Iniciar la anestesia del cerdo por una inyección intramuscular de ketamina (20 mg / kg), atropina (0,04 mg / kg), y midazolam (0,3 mg / kg). Posteriormente, el transporte de los animales de la instalación de la vivienda a la sala de operaciones (OR).
- Coloque el cerdo en una posición supina sobre la mesa de quirófano. Deje que el cerdo para respirar 2 L de oxígeno con un 5% de isoflurano espontáneamente. Exponer las cuerdas vocales con un laringoscopio y rociarlas con una solución tópica de lidocaína al 2% para evitar la intubación laringoespasmo inducida. Después de la intubación con un tubo de 6,5 mm, bloquear el manguito con 3-5 ml de aire.
Nota: capnometría confirma la correcta position del tubo traqueal. - Disminuir el gas isoflurano al 2,5%. Ajuste el ventilador a 14-16 respiraciones / min y el volumen corriente a 10-15 ml / kg peso corporal. Seguir de cerca el cerdo. La frecuencia cardíaca y la saturación de oxígeno se registran por pulsioximetría. Confirmar la anestesia adecuada por la frecuencia cardíaca reducida (por debajo de 150 latidos / min) y la presión arterial (sistólica por debajo de los valores de 100 mm de Hg), así como la ausencia de movimientos de porcinos (sin el uso de relajantes musculares).
- En condiciones estériles, introducir un 9,5 P. solo lumen de catéter permanente en la vena yugular interna mediante Seldinger técnica 27. En pocas palabras, usar una aguja para pinchar la vena. Después de la introducción de la guía-hilo, vuelva a colocar la aguja con el introductor de desprendimiento, seguida de una sustitución del cable con el catéter vascular. Fijar el catéter a la piel utilizando una seda 3-0 o sutura monofilamento no absorbible.
- Administrar 500 mg de metronidazol, 1 g de cefazolina, y 20 mg de pantoprazol. Anuncioministro de 200 ml de solución de Ringer con lactato con dextrosa al 5% (D5W) y 1 ml de citrato de fentanilo por vía intravenosa horas durante toda la cirugía. Aplique un ungüento oftálmico veterinario en los ojos para evitar la sequedad, mientras que bajo anestesia.
- Procedimiento quirúrgico
- Después de la desinfección estéril y la cobertura del campo quirúrgico, realizar una incisión en la línea media de 25 cm de longitud. Insertar un retractor. Cubrir los intestinos grandes y pequeños con una toalla y la posición de ellos en el lado izquierdo para el acceso óptimo al riñón derecho.
- Liberar el uréter y el riñón derecho propio de los tejidos adherentes utilizando el cauterio.
- Diseccionar la vena renal derecha y la arteria usando el cauterio hasta su origen a partir de la vena cava inferior y la aorta, respectivamente, son gratuitas. Para evitar el vasoespasmo arterial, la administración de 30 a 65 mg de papaverina debe ser considerado.
- Después de la disección completa renal, lazo (seda, 3-0) y cortar el uréter distal. Preparea tazón de hielo y una bolsa estéril de órganos.
- En primer lugar, sujetar la arteria renal cerca de la aorta y segundo, sujetar la vena renal cerca de la vena cava utilizando abrazaderas de los vasos. A continuación, resecar el injerto renal y canular inmediatamente la arteria renal con una cánula de la arteria renal. Utilizar 500 ml de solución enfriada con hielo de histidina-triptófano-cetoglutarato (HTK) para eliminar la sangre. Almacenar el riñón en hielo hasta el trasplante.
- In situ, cerrar la arteria renal restante con una ligadura (seda, 2-0) y la vena renal con una sutura continua (prolene, 6-0).
- Después de comprobar el área diseccionada para el sangrado, cerrar la pared abdominal con una sutura continua (monofilamentos, 1) y la piel con una seda 3-0 o sutura monofilamento no absorbible ..
- Procedimiento postoperatorio
- Fijar la vía subcutánea catéter venoso con una sutura (seda, 3-0) y el túnel a la espalda del cerdo para prevenir la manipulación no deseada. Después de colocar el cerdo propensos, suture (seda 3-0) del catéter firmemente a la piel.
- Independizar el cerdo del ventilador y deje que se recupere en su área de vivienda después de la extubación. Administrar lactato de Ringer por vía intravenosa durante la expansión de volumen y administración de 0,3 mg de buprenorfina para la analgesia. No deje un animal sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal.
3. Injerto Trasplante de Riñón
- Procedimiento preoperatorio
- Anestesiar al cerdo utilizando inyección intravenosa de propofol (1-2 mg / kg de peso corporal), seguido de una infusión continua de propofol a una velocidad de 50 a 100 mg / hr. Vuelva a intubar al cerdo como se describe en el paso 2.1.3 y 2.1.4 y establecer el gas isoflurano al 3-4%.
- Administrar 1 g de cefazolina y 20 mg de pantoprazol iv Durante la cirugía, usar el mismo protocolo anestésico como se describe en 2.1.4.
- Después de la desinfección estéril, hacer un corte de 4 cm al lado de la tráquea. Diseccionar la TIN ú mero para exponer la arteria carótida. Pasar unas pinzas sobre-Holt y una corbata de seda (2-0) alrededor de la arteria. Utilice la técnica de Seldinger para introducir un catéter de plástico para medir continuamente la presión arterial durante la cirugía. Por otra parte, las técnicas de medición de presión arterial no invasiva pueden ser utilizados.
- Procedimiento quirúrgico
- Después de la desinfección estéril, vuelva a abrir la cavidad abdominal mediante la reducción de los puntos de las suturas de la piel y la fascia, reintroducir el retractor quirúrgico para exponer la cavidad abdominal, y la posición del intestino hacia el lado izquierdo para permitir un mejor acceso a los vasos infrarrenal.
- Trasplante de extremo a lado del injerto renal conservada hasta la vena cava infrarrenal y la aorta. Por lo tanto, la disección de la vena cava y la aorta durante 5-8 cm por encima de la bifurcación ilíaca usando camionetas y cauterio. Si es posible, no molestar a los vasos linfáticos; si no es posible, cierre con suturas de prolene 5-0.
- Después de completar la disección, comprobar for sangrado y eliminar el tejido restante de los vasos. Asegúrese de que de sujeción completa de la vena cava y la aorta con una abrazadera Satinsky es factible.
- A continuación, una resección del riñón contralateral (izquierda). Para ello, coloque el intestino hacia la derecha; diseccionar el uréter, el riñón en sí, la vena renal, y la arteria renal a partir de tejido adherente. Atar los uréteres y los vasos sanguíneos y resecar el riñón. Compruebe si hay sangrado.
- Volver a colocar el intestino hacia la izquierda para exponer la aorta infrarrenal y la vena cava. Se inyecta heparina (100 UI / kg de peso corporal) y espere al menos 2 minutos.
- Anastomosis venosa:
- Usar una abrazadera de Satinsky para sujetar completamente la vena cava y hacer una incisión ranura que coincide con el tamaño de la abertura de la vena renal, utilizando una cuchilla 11. tijeras Pott se pueden utilizar para ampliar aún más la rendija.
- Después de terminar el riñón en un paño estéril que contenga hielo, sacarlo de la hielo y colocarlo en el campo quirúrgico. Utilice dos de doble brazo 6-0prolene suturas para realizar una craneal y un punto de ángulo caudal.
- Aproximar el riñón, atar el extremo superior y realizar una sutura continua de prolene 6-0 usando, a partir de la pared del fondo. Después de haber terminado 2/3, utilizar el otro extremo de la atadura para completar la sutura en el lado frontal. Después de atar las suturas craneales, atar los puntos de sutura en la esquina caudal.
- Coloque una pinza bulldog en la vena renal y abrir la pinza de Satinsky. Compruebe la anastomosis de sangrado.
- La anastomosis arterial:
- Utilice la abrazadera Satinsky de nuevo para sujetar completamente la aorta. Utilice una cuchilla 11 para hacer una incisión de hendidura, a juego de la abertura de la arteria renal. Use un punzón redondo de 4,0 mm para asegurar una apertura limpia.
- Utilice una sutura de prolene 6-0 para realizar la anastomosis arterial, comenzando en el lado receptor. Asegúrese de que el endotelio arterial está incluido en cada sutura para evitar una disección. Mientras tanto, iniciar un goteo continuo de 10 ml norepinephrine (16 mg / 250 ml) diluido en 500 ml de lactato de Ringer y se valora para mantener la presión sistólica por encima de 100 mmHg.
- Inyectar verapamil intra-arterial antes de la finalización de la anastomosis arterial y administrar papaverina tópicamente al exterior del recipiente para prevenir el vasoespasmo.
- Coloque una pinza bulldog en la arteria renal y abra la pinza Satinksy. Compruebe las anastomosis de sangrado.
- Desenvolver el riñón de la tela y eliminar el hielo. Abra la pinza bulldog venosa primero, seguido por la pinza bulldog arterial. Después de la reperfusión, la producción de orina debe comenzar inmediatamente.
- Utilice un paño para asegurar una posición favorable para el injerto trasplantado y mantener una reperfusión homogénea.
- La anastomosis ureteral:
- Con unas tijeras Pott para abrir el uréter del injerto y el receptor en una longitud longitudinal de 0,5 cm.
- Utilice dos 6.0 poliéster, poli (p-dioxanona) para la sutura Ure de lado a ladoanastomosis enteral. Stich realizar una esquina en cada lado, a continuación, ejecutar la pared posterior de una manera continua en primer lugar, seguido de la pared frontal.
- Después de verificar si el sangrado, retire la tela y envolver algo del intestino delgado que rodea el riñón para mantenerlo en su posición. Cerrar la pared abdominal con dos suturas monofilamento 1. Cierre la piel con seda 3-0 o una sutura monofilamento no absorbible.
- Mantener la presión sistólica por encima de 100 mmHg de forma continua mediante titulación cuidadosamente la infusión de norepinefrina hasta que el cerdo se ha colocado en posición prona.
- Procedimiento postoperatorio
- Después del cierre abdominal como se ha mencionado anteriormente, mantener el cerdo caliente utilizando una almohadilla caliente y una manta de circulación de calor. Retire la línea arterial, cerrar el orificio de punción en la arteria con un Stich prolene 6-0 y cerrar el lugar de la incisión.
- Girar el cerdo en posición de decúbito prono, detener el goteo de la norepinefrina y dejar de depender del cerdo del ventilador. Alabamabajo el cerdo se recupere en su área de vivienda y vigilar de cerca para asegurar su recuperación sin problemas del procedimiento. Tomar muestras de gases en sangre cada hr a través del catéter yugular implantado. Proporcionar lactato de Ringer al volumen sustituto y administrar 0,3 mg de buprenorfina para la analgesia.
- Después de la extubación, vigilar estrechamente el cerdo hasta que es capaz de beber de forma espontánea. No deje un animal sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal. No devuelva un animal que ha sido sometido a una cirugía para la compañía de otros animales hasta que esté completamente recuperado.
4. Seguimiento posquirúrgico
- Administrar 0,3 mg de buprenorfina por vía intravenosa cada 8 horas durante al menos 2 días después de la cirugía o más si es necesario. Rutinariamente administrar una sola dosis profiláctica de antibióticos durante la cirugía. En el caso de signos de infección, administrar cefazolina 1 g iv dos veces por día y metronidazol iv una vez por día hastamejoría clínica se produce. Administrar lactato de Ringer hasta que el cerdo bebe suficiente agua. 1.000 UI de heparina se puede utilizar para bloquear el catéter para prevenir la coagulación.
- Recoger muestras de sangre venosa a través del catéter yugular y las muestras de orina para evaluar el estado clínico del cerdo y la función renal.
- Para la eutanasia, inducir la anestesia del cerdo con propofol IV (5-10 ml) y mantenerla con isoflurano 5%. Intubate el cerdo como se describe anteriormente. Después de relaparatomy y la recogida de muestra de tejido renal, inducir la parada cardiaca por inyección intravenosa de KCl 40 mval.
Resultados
A continuación, los resultados de los experimentos autotrasplante renal (n = 4) se ponen de manifiesto. Después de la recuperación inicial del injerto, los cerdos recuperados en su área de vivienda. Mientras tanto, los injertos renales se almacenaron en hielo durante un tiempo medio de 7 h 35 min (± 18 min). Después de reinducción de la anestesia y laparotomía repetida, los riñones contralaterales fueron resecados y los injertos trasplantados almacenados en frío heterotópica como se ha descrito. Después de la retirada del respirador, los cerdos se recuperan de la cirugía y seguidos durante 10 días (véase la Figura 1). Todos los días (1-4 días post-operatorio; vaina) o cada dos días se recogieron (6-10) de la vaina muestras de sangre para realizar análisis de gases en sangre; para evaluar la función renal, la creatinina sérica y el nitrógeno de urea en sangre se calcularon los valores (BUN). Para la comparación, se presentan los resultados de un injerto renal allotransplanted. Para la inmunosupresión, este cerdo recibió ciclosporina 100 mg por vía oral y cortisone 250 mg ivbid La técnica quirúrgica utilizada fue la misma que en el protocolo de autotrasplante; no se aplicó tiempo de isquemia caliente.
Todos los cerdos estaban en buenas condiciones clínicas durante el período de seguimiento. Los creatinina y BUN valores séricos revelaron el mayor aumento en el primer día después de la cirugía (CREA 2,8 ± 0,7 mg / dl, urea 25,3 ± 7 mg / dl) y disminuyeron hasta aerodinámico 10 (CREA 1,7 ± 0,4 mg / dl, urea 10,7 ± 4 mg / dl) cerca de los valores iniciales de referencia. El injerto renal allotransplanted demostró valores de creatinina y BUN más altos después de una buena función inicial del injerto, en comparación con los autoinjertos, muy probablemente debido al rechazo (Figura 2 y 3). Hemostasis ácido-base (Figura 4) y los niveles de electrolitos (Figura 5) fueron estables sin intervención. El examen histológico mostró tubulointerstitium conservado en el riñón autotransplantado (Figure 6), y difundir la inflamación intersticial, tubulitis y glomerulitis en el riñón allotransplanted (Figura 7).
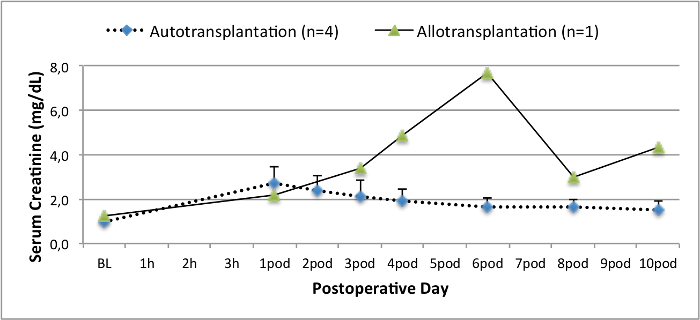
Los valores Figura 2. Valores de creatinina sérica. Séricos de creatinina (media y desviación estándar) para la línea de base y 10 después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
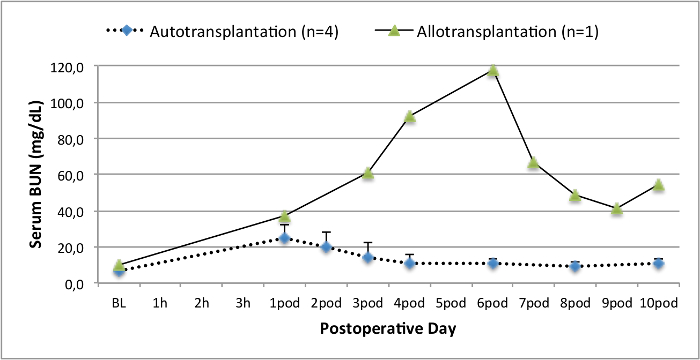
Figura 3. Los valores séricos de moño. Los valores séricos de BUN (media y desviación estándar) para la línea de base y 10 días después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
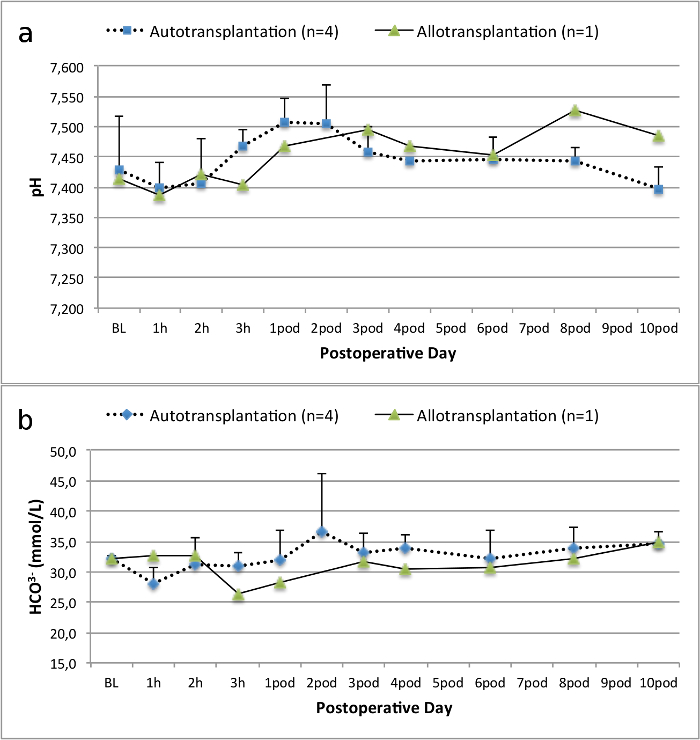
Figura 4. hemostasia ácido-base. Hemostasis ácido-base (media y desviación estándar) para la línea de base y 10 días después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
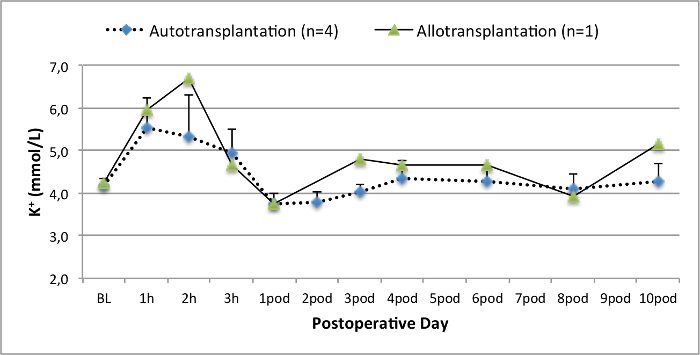
Figura 5. niveles de electrolitos. Los niveles de electrolitos (media y desviación estándar) para la línea de base y 10 días después de la cirugía. Por favor, haga clic aquí para ver una versión más grande de esta figura.
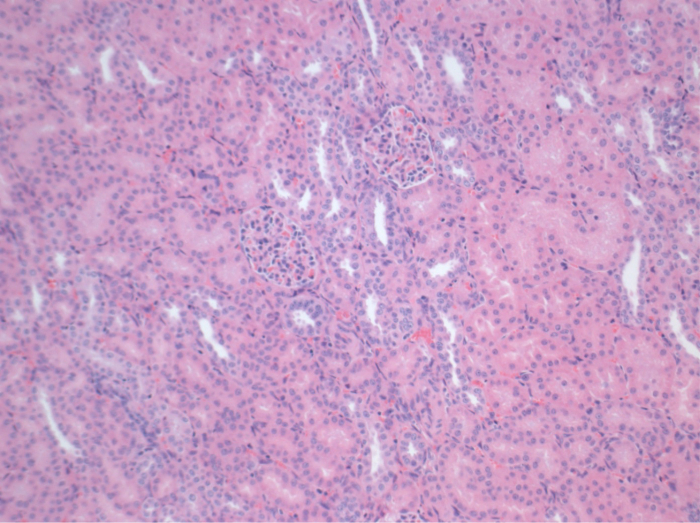
Figura 6. Histología (H &# 38;.. E), 100X tubulointerstitium normal en el riñón autotransplantado 10 días después de la cirugía Haga clic aquí para ver una versión más grande de esta figura.
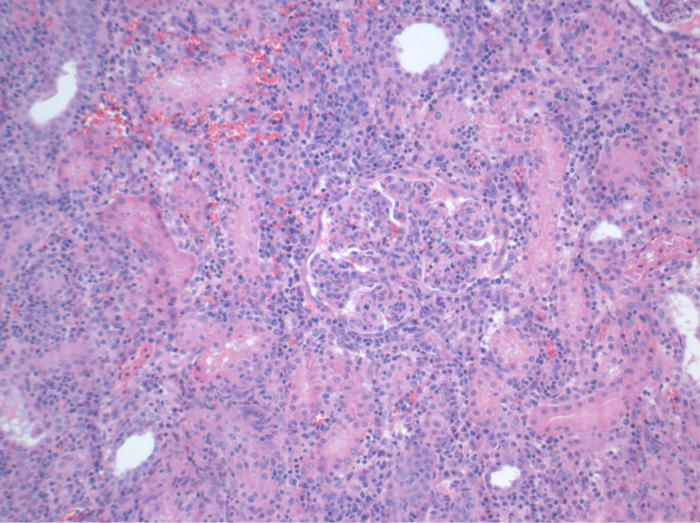
Figura 7. Histología (H & E), 100X. Amplia inflamación intersticial, tubulitis y Glomerulitis, en consonancia con el rechazo, en el riñón allotransplanted 10 días después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El modelo de trasplante de riñón porcino ofrece una oportunidad única para avanzar en el campo del trasplante humano debido a las similitudes en los aspectos quirúrgicos, la fisiología, la bioquímica, la inmunología y 14.
Dependiendo del propósito del estudio experimental, el modelo de autotrasplante renal tiene varias ventajas en comparación con el modelo de alotrasplante. Aunque varios grupos dan cuenta de la buena función del injerto renal tras alotrasplante 28, inmunosupresión en los cerdos es un reto, especialmente en el trasplante renal. Muestra de sangre preoperatoria analiza para garantizar la compatibilidad para el antígeno leucocitario porcino (SLA) son factibles, pero es caro y poco práctico 14. Después de la operación, los agentes inmunosupresores propuestas tales como tacrolimus y ciclosporina (inhibidores de la calcineurina, CNI) se administran por vía oral o intravenosa 28. La administración oral es poco práctico, como cerdos generalmente se niegan a ingerir medicamentos por vía oralción. Por otra parte, las obstrucciones intestinales podrían obviar la absorción suficiente de medicamentos inmunosupresores y mantenimiento de los niveles de fármacos terapéuticos. La infusión continua de iv del CNI en animales activos es técnicamente exigente. la administración en bolo iv conduce a altos valores de pico, que causan toxicidad. Por lo tanto, para la investigación de nuevas técnicas de conservación, el modelo de autotrasplante renal tiene varias ventajas. En los resultados representativos del injerto renal allotransplantated ha demostrado más arriba, un pico de retraso y un aumento de la creatinina y BUN indicar rechazo, lo que fue demostrado por la evaluación histológica.
El modelo porcino de autotrasplante anteriormente se ha utilizado para investigar nuevas técnicas de preservación 14,18,29. Sin embargo, los comunicados de creatinina y BUN valores séricos postoperatoria de cerdos autotransplantadas en un escenario a corazón parado varían considerablemente dependiendo del sistema experimental 22,30 . El protocolo de donantes a corazón parado aquí presentamos se traduce en un bajo pico de creatinina sérica postoperatoria de 2,8 mg / dl (± 0,7) y BUN pico de 25,3 mg / dl (± 7,4). Estos resultados son comparables con los valores de pico bajos presentados por Hanto y colegas 28 y Snoeijs y colegas 31.
Para asegurar un resultado exitoso después del trasplante renal en un modelo porcino autotrasplante, hemos identificado varios factores técnicos clave que reduzcan al mínimo la tasa de ciertas complicaciones. El uso de la solución de histidina-triptófano-cetoglutarato (HTK) reduce el riesgo de vasoespasmo debido a su menor contenido de potasio en comparación con la Universidad de Wisconsin solución (UW). Para reducir aún más el riesgo de vasoespasmo en el punto de la reperfusión, verapamil se puede inyectar en la arteria renal, y papaverina se puede administrar por vía tópica durante la recuperación y después de la reperfusión. Además, un goteo continuo de la norepinefrina titula para mantenerla presión arterial sistólica por encima de 100 mmHg garantiza una reperfusión homogénea. Es útil para mantener esta presión arterial al menos hasta que el cerdo se coloca boca abajo. Además, la colocación del injerto trasplantado es importante para evitar el retorcimiento de los vasos sanguíneos recién anastomosados. Por lo tanto, es útil para resecar el riñón contralateral izquierdo antes de coser la anastomosis del injerto para evitar una extensa manipulación mecánica. Después de terminar la anastomosis ureteral, envolviendo el intestino delgado alrededor del injerto trasplantado asegura su posición después del cierre de la pared abdominal. Las complicaciones como obstrucciones intestinales debido a la formación de cocas en el intestino, pero rara vez se observan pueden dar lugar a complicaciones graves, incluyendo íleo, perforación intestinal, y la muerte. En general, la técnica quirúrgica precisa, la anestesia atento y una vigilancia estrecha durante el seguimiento a asegurar una buena función del injerto y el resultado clínico.
Arterial y venoso anastomosis pueden performó el uso de diferentes técnicas. ortotópico la colocación del injerto permite anastomosis de extremo a extremo de la arteria y la vena renal. En el caso del trasplante heterotópico, el injerto puede ser posicionado en la fosa renal contralateral para la anastomosis de extremo a extremo, en los vasos ilíacos, o de la aorta distal directamente. Trasplante heterotópico con anastomosis de aorta y cava directamente en la técnica de extremo a lado se prefieren en este modelo ya que puede reducir el riesgo de trombosis y vasoespasmo 32. Las variaciones anatómicas con bifurcaciones venosas muy tempranas pueden conducir a la necesidad de coser dos anastomosis venosas separadas. Si la arteria o vena son relativamente cortas, el injerto se puede girar 180 ° para obtener la longitud de los vasos. Ureteral anastomosis de lado a lado puede lograr buenos resultados experimentales sin complicar estenosis o fuga urinaria.
En general, el modelo porcino de trasplante renal ofrece ventajas en comparación con otros modelos animales. como described anteriormente, existen ciertas similitudes entre el porcino y el entorno humano, lo que permite la traducción relativamente rápido de nuevas técnicas en la práctica clínica. La técnica de trasplante es técnicamente más fácil en comparación con modelos de roedores. Además, mediante la colocación de catéteres venosos, muestras de sangre periférica pueden recogerse fácilmente y se procesaron para análisis adicionales. La recogida de la orina permite una nueva evaluación de la lesión renal y la función. Para recoger las muestras de orina, un catéter percutáneo puede ser insertado en la vejiga urinaria. Para evitar la manipulación por el cerdo, el extremo distal debe ser tunelizado por vía subcutánea en la parte posterior del animal. Otra opción para la recolección de orina es el uso de jaulas metabólicas, que permiten a los períodos de recogida prolongados para estimar la depuración de creatinina y la concentración de los biomarcadores adicionales en la orina. De ecografía, tomografía computarizada, resonancia magnética y las imágenes son posibles. Donación después de la muerte protocolos circulatorio puede ser imitado mediante la aplicación de tibiaisquemia antes de la recuperación. Además, los cerdos son relativamente fáciles de manejar si castrado para limitar su comportamiento agresivo.
Las desventajas son el alto costo de la compra de los animales, la vivienda, materiales médicos y quirúrgicos y otra, y mano de obra. Estos factores hacen que no es posible incluir un gran número de animales en cada grupo de estudio. Además, en comparación con modelos de roedores, un número limitado de referencias están disponibles en la literatura para el cerdo datos biológicos normativos. Como una alternativa para la evaluación de nuevas técnicas desarrolladas, tales como nuevos métodos de conservación, otros grupos han descrito la normotérmica reperfusión ex vivo como una alternativa al trasplante renal 33,34. Esta técnica es fácil de realizar y menos costoso. Sin embargo, estandarizado trasplante de injerto renal proporciona un modelo más similar a la práctica clínica y permite un seguimiento más largo períodos de seguimiento. Por lo tanto, sirve para evaluar un injerto más realistaambiente.
En conclusión, el modelo porcino de autotrasplante renal heterotópico proporciona un escenario clínico importante investigar nuevos enfoques innovadores para la mejora de los resultados del injerto renal. En particular, este protocolo cuenta con importantes detalles técnicos que faciliten el establecimiento exitoso de un modelo de autotrasplante renal y permite la rápida traducción de los nuevos resultados a los ensayos clínicos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank the Sorin Group (Milano, Italy), XVIVO Perfusion Inc. (Goteborg, Sweden), and Braun AG (Melsungen, Germany) for their support. We highly appreciate the support of the John David and Signy Eaton Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| Anesthesia Equipment | |||
| Anesthesia Machine, Optimax | Moduflex Anesthesia Equipment | SN5180 | |
| Infusion Pump 3,000 | SIMS Graseby LTD. | SN300050447 | |
| Infusion Pump Line | Smith Medical ASD Inc. | 21-0442-25 | |
| Intravenous permanent catheter (9.5 Fr) | Cook Medical Company | G01865 | |
| Isoflurane Vapor 19.1 | Draeger Medical Canada Inc. | N/A | |
| Mallinckrodt, Tracheal Tube, 6.5 mm | Covidien Canada | 86449 | |
| Temperature Therapy Pad | Gaymar Industries Inc | TP26E | |
| Ventilator, AV 800 | DRE Medical Equipment | 40800AVV | |
| Warm Touch, Patient Warming System | Nellcor/ Covidien Canada | 5015300A | |
| Name | Company | Catalog Number | Comments |
| Surgical Equipment | |||
| Abdominal Retractor | Medite GmbH | 07-0001-00 | |
| Aorta/vein punch 4.0 mm, round | Scanlan International Inc. | 1001-602 | |
| De Bakey, Atraumatic Peripheral, Clamp | Aesculap Inc. | FB463R | |
| De Bakey-Beck, Atraumatic Vena Cava, Clamp | Aesculap Inc. | FB519R | |
| De Bakey, Atraumatic Mini-Bulldog, Straight | Aesculap Inc. | FB422R | |
| De Bakey, Atraumatic Mini-Bulldog, Curved | Aesculap Inc. | FB423R | |
| De Bakey, Atraumatic Coarctation Clamp, Angled | Aesculap Inc. | FB453R | |
| Dissection Blade #11 | Feather Safety Razor Co. | 089165B | |
| Connector (1/4") with male luer lock | Sorin Group Inc. | AB1452 | |
| Liver Admin Set (flush line) | CardioMed Supplies Inc | 17175 | |
| Maxon, 1 | Covidien Canada | 606173 | |
| Med-Rx Suction Connecting Tube | Benlan Inc. | 70-8120 | |
| Organ Bag | CardioMed Supplies Inc | 2990 | |
| Potts – De Martel, Scissors | Aesculap Inc. | BC648R | |
| Renal artery cannula, 1.6" | Sorin Group Inc. | VC-11000 | |
| Sofsilk, 2-0 | Covidien Canada | S405 | |
| Sofsilk, 3-0 | Covidien Canada | S404 | |
| Satinsky, Suprahepatic Cava Clamp | Aesculap Inc. | FB605R | |
| Suction Tip | Tyco Healthcare Group LP | 8888501023 | |
| Surgipro II, 6-0 | Covidien Canada | VP733X | |
| Valleylab, Cautery Pencil | Covidien Canada | E2515H | |
| Valleylab, Force Tx | Valleylab Inc. | 216151480 | |
| Valleylab, Patient Return Electrode | Covidien Canada | E7507 | |
| Name | Company | Catalog Number | Comments |
| Medication | |||
| Atropine Sulfate 15 mg/30 ml | Rafter 8 Products | 238481 | |
| Buprenorphine 0.3 mg/ml | RB Pharmaceuticals LDT | N/A | |
| Ceftiofur 3 mg/ml | Pfizer Canada Inc. | 11103 | |
| Cefazolin 1 g | Pharmaceutical Partners of Canada Inc. | 2237138 | |
| Fentanyl Citrate 0.25 mg/5 ml | Sandoz Canada Inc. | 2240434 | |
| Heparin 10,000 iU/10 ml | Sandoz Canada Inc. | 10750 | |
| Histidine-tryptophan-ketoglutarate (HTK) solution | Methapharm | CU001LBG | |
| Isoflurane 99.9%, 250 ml | Pharmaceutical Partners of Canada Inc. | 2231929 | |
| Ketamine Hydrochloride 5,000 mg/50 ml | Bimeda-MTC Animal Health Inc. | 612316 | |
| Lactated Ringer’s + 5% Dextrose 1 L | Baxter Corporation | JB1064 | |
| Lactated Ringer’s 1 L | Baxter Corporation | JB2324 | |
| Metronidazole 500 mg/100 ml | Baxter Corporation | 870420 | |
| Midazolam 50 mg/10 ml | Pharmaceutical Partners of Canada Inc. | 2242905 | |
| Norepinephrine 16 mg/250 ml Dextrose 5% | Baxter Corporation | N/A | |
| Pantoprazole 40 mg | Sandoz Canada Inc. | 2306727 | |
| Papaverine 65 mg/2 ml | Sandoz Canada Inc. | 9881 | |
| Propofol 1,000 mg/100 ml | Pharmascience Inc. | 2244379 | |
| Saline 0.9%, 1 L | Baxter Corporation | 60208 | |
| Solu-Medrol 500 mg | Pfizer Canada Inc. | 2367963 | |
| Verapamil | Sandoz Canada Inc. | 2166739 | |
| Xylocaine Endotracheal 10 mg/50 ml | AstraZeneca | 2003767 |
Referencias
- Wolfe, R. A., Ashby, V. B., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 341 (23), 1725-1730 (1999).
- Ingsathit, A., Kamanamool, N., Thakkinstian, A., Sumethkul, V. Survival advantage of kidney transplantation over dialysis in patients with hepatitis C: a systematic review and meta-analysis. Transplantation. 95 (7), 943-948 (2013).
- Tonelli, M., Wiebe, N., et al. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am J Transplant. 11 (10), 2093-2109 (2011).
- Matas, A. J., et al. OPTN/SRTR Annual Data Report 2012: Kidney. Am J Transplant. 14, (2014).
- . Annual Report 2013 - Eurotransplant International Foundation. Available from: https://www.eurotransplant.org/cms/mediaobject.php?file=AR20135.pdf (2013)
- Morrissey, P. E., Monaco, A. P. Donation after circulatory death: current practices, ongoing challenges, and potential improvements. Transplantation. 97 (3), 258-264 (2014).
- Maggiore, U., Oberbauer, R., et al. Strategies to increase the donor pool and access to kidney transplantation: an international perspective. Nephrol Dial Transplant. 30 (2), 217-222 (2014).
- Summers, D. M., Johnson, R. J., Hudson, A., Collett, D., Watson, C. J., Bradley, J. A. Effect of donor age and cold storage time on outcome in recipients of kidneys donated after circulatory death in the UK: a cohort study. Lancet. 381 (9868), 727-734 (2013).
- Wadei, H. M., Heckman, M. G., et al. Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation. Transplantation. 96 (3), 274-281 (2013).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J. S., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., Favreau, F., Chatauret, N., Thuillier, R., Maiga, S., Hauet, T. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Gallinat, A., Paul, A., et al. Role of oxygenation in hypothermic machine perfusion of kidneys from heart beating donors. Transplantation. 94 (8), 809-813 (2012).
- Thuillier, R., Allain, G., et al. Benefits of active oxygenation during hypothermic machine perfusion of kidneys in a preclinical model of deceased after cardiac death donors. J Surg Res. 184 (2), 1174-1181 (2013).
- Hosgood, S. A., Barlow, A. D., Yates, P. J., Snoeijs, M. G. J., van Heurn, E. L. W., Nicholson, M. L. A pilot study assessing the feasibility of a short period of normothermic preservation in an experimental model of non heart beating donor kidneys. J Surg Res. 171 (1), 283-290 (2011).
- Delpech, P. O., Thuillier, R., et al. Effects of warm ischaemia combined with cold preservation on the hypoxia-inducible factor 1α pathway in an experimental renal autotransplantation model. Br J Surg. 101 (13), 1739-1750 (2014).
- Kirk, A. D. Crossing the bridge: large animal models in translational transplantation research. Immunol Rev. 196, 176-196 (2003).
- Golriz, M., Hafezi, M., et al. Do we need animal hands-on courses for transplantation surgery. Clin Transplant. 27, 6-15 (2013).
- He, B., Musk, G. C., Mou, L., Waneck, G. L., Delriviere, L. Laparoscopic surgery for kidney orthotopic transplant in the pig model. JSLS. 17 (1), 126-131 (2013).
- Faure, A., Maurin, C., et al. An experimental porcine model of heterotopic renal autotransplantation. Transplant Proc. 45 (2), 672-676 (2013).
- Hosgood, S. A., Yates, P. J., Nicholson, M. L. 1400W reduces ischemia reperfusion injury in an ex-vivo porcine model of the donation after circulatory death kidney donor. World J Transplant. 4 (4), 299-305 (2014).
- Ghanekar, A., Mendicino, M., et al. Endothelial induction of fgl2 contributes to thrombosis during acute vascular xenograft rejection. J Immunol. 172 (9), 5693-5701 (2004).
- Ghanekar, A., Lajoie, G., et al. Improvement in rejection of human decay accelerating factor transgenic pig-to-primate renal xenografts with administration of rabbit antithymocyte serum. Transplantation. 74 (1), 28-35 (2002).
- Cowan, P. J., Cooper, D. K. C., d'Apice, A. J. F. Kidney xenotransplantation. Kidney Int. 85 (2), 265-275 (2014).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography; a new technique. Acta radiol. 39 (5), 368-376 (1953).
- Hanto, D. W., Maki, T., et al. Intraoperative administration of inhaled carbon monoxide reduces delayed graft function in kidney allografts in Swine. Am J Transplant. 10 (11), 2421-2430 (2010).
- Maathuis, M. -. H. J., Manekeller, S., et al. Improved kidney graft function after preservation using a novel hypothermic machine perfusion device. Ann Surg. 246 (6), 982-991 (2007).
- Gallinat, A., Paul, A., et al. Hypothermic reconditioning of porcine kidney grafts by short-term preimplantation machine perfusion. Transplantation. 93 (8), 787-793 (2012).
- Snoeijs, M. G., Matthijsen, R. A., et al. Autologous transplantation of ischemically injured kidneys in pigs. J Surg Res. 171 (2), 844-850 (2011).
- Golriz, M., Fonouni, H., Nickkholgh, A., Hafezi, M., Garoussi, C., Mehrabi, A. Pig kidney transplantation: an up-to-date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
- Hosgood, S. A., Bagul, A., Yang, B., Nicholson, M. L. The relative effects of warm and cold ischemic injury in an experimental model of nonheartbeating donor kidneys. Transplantation. 85 (1), 88-92 (2008).
- Hoyer, D. P., Gallinat, A., et al. Influence of oxygen concentration during hypothermic machine perfusion on porcine kidneys from donation after circulatory death. Transplantation. 98 (9), 944-950 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados