Method Article
Heterotope Renal Autotransplantation in einem Schweine-Modell: Eine Schritt-für-Schritt-Protokoll
In diesem Artikel
Zusammenfassung
Porcine models of organ transplantation provide an important platform to study mechanisms of organ preservation. This article describes a heterotopic porcine renal autotransplantation model, which allows investigating new approaches to improve the outcome of transplantation using marginal kidney grafts.
Zusammenfassung
Kidney transplantation is the treatment of choice for patients suffering from end-stage renal disease. It offers better life expectancy and higher quality of life when compared to dialysis. Although the last few decades have seen major improvements in patient outcomes following kidney transplantation, the increasing shortage of available organs represents a severe problem worldwide. To expand the donor pool, marginal kidney grafts recovered from extended criteria donors (ECD) or donated after circulatory death (DCD) are now accepted for transplantation. To further improve the postoperative outcome of these marginal grafts, research must focus on new therapeutic approaches such as alternative preservation techniques, immunomodulation, gene transfer, and stem cell administration.
Experimental studies in animal models are the final step before newly developed techniques can be translated into clinical practice. Porcine kidney transplantation is an excellent model of human transplantation and allows investigation of novel approaches. The major advantage of the porcine model is its anatomical and physiological similarity to the human body, which facilitates the rapid translation of new findings to clinical trials. This article offers a surgical step-by-step protocol for an autotransplantation model and highlights key factors to ensure experimental success. Adequate pre- and postoperative housing, attentive anesthesia, and consistent surgical techniques result in favorable postoperative outcomes. Resection of the contralateral native kidney provides the opportunity to assess post-transplant graft function. The placement of venous and urinary catheters and the use of metabolic cages allow further detailed evaluation. For long-term follow-up studies and investigation of alternative graft preservation techniques, autotransplantation models are superior to allotransplantation models, as they avoid the confounding bias posed by rejection and immunosuppressive medication.
Einleitung
Kidney transplantation is the treatment of choice for patients with end-stage renal disease, due to associated lower rates of morbidity and mortality when compared to dialysis 1-3. Despite major improvements in patient outcomes following kidney transplantation, graft shortage still poses a severe challenge worldwide. The number of patients waiting for a kidney transplant by far exceeds the number of organs available 4-6. To increase the number of kidneys available for transplantation and to reduce patient waiting times, further sources of kidney grafts are needed.
Commonly, standard criteria donor (SCD) and extended criteria donor (ECD) kidney grafts from donation after brain death (DBD) as well as kidneys recovered from live donors (LDKT) are utilized. Since the 1990s, an increasing number of kidney grafts have been recovered in a donation after circulatory death (DCD) scenario, to further expand the donor pool 7,8. However, DCD and ECD kidney grafts demonstrate acceptable but decreased outcomes after transplantation, depending on different factors, such as donor age, warm and cold ischemia times, and the preservation technique used 9-11. Thus, additional research is required to improve the outcome of patients receiving marginal kidney grafts and to further increase the donor pool.
The porcine model of renal transplantation is well established and provides a clinical important scenario to investigate innovative approaches for the improvement of marginal kidney graft outcomes. In contrast to rodent and canine kidneys, which are unilobular, porcine and human kidneys are multilobular and are anatomically similar, particularly in regard to the arterial, venous, and urinary collecting systems 12,13. In addition, porcine and human kidneys demonstrate similarities in the pathophysiology of ischemia reperfusion injury (IRI), biochemistry, and immunological parameters 14. Thus, porcine renal transplantation is well-suited to investigate new organ preservation methods for marginal kidney grafts 15-17, model human IRI 18, study immunological pathways and allograft tolerance 19, provide surgical training 20-22, test new pharmacological therapies 23, implement new medical devices, and study new immunological mechanisms in xenotransplantation 24-26.
The renal porcine and human transplantation settings are not completely analogous. This article focuses on important technical details that will facilitate successful establishment of a renal autotransplantation model. Species-adapted pre- and postoperative housing, administration of anesthesia with close monitoring, and matched surgical techniques are described in the protocol and demonstrated in the video. Resection of the contralateral native kidney provides the opportunity to assess the function of the transplanted kidney. The placement of venous and urinary catheters and the use of metabolic cages allow more in-depth assessment. For studies aimed at investigating alternative graft preservation methods and mechanisms of IRI, autotransplantation models are superior to allotransplantation models, as they avoid the complications and confounding bias associated with rejection and use of immunosuppressive medications.
Protokoll
Alle Tiere erhielten humane Pflege und alle Studien, die wir im Einklang mit der Politik und den Richtlinien des Canadian Council on Animal Care durchgeführt. Alle Verfahren wurden unter Einsatz von Tieren Protokolle durchgeführt, die von der University Health Network Institutional Animal Care Committee genehmigt.
Hinweis: Eine schematische Übersicht des Studienprotokolls in Abbildung 1 dargestellt.
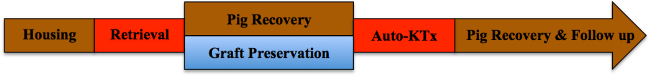
Abbildung 1. Studienprotokoll. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
1. Tiere
- Verwenden männlich Yorkshire Schweine (30 kg) in diesem Protokoll.
2. Nierentransplantat Retrieval
- Die präoperative Verfahren
- Haus der männliche Yorkshire Schweine in einer Forschungseinrichtung für sie mindestens eine Woche zu akklimatisieren. Verwenden intramuskuläre Injektion eines Cephalosporin der dritten Generation, wie Ceftiofur, für 3 Tage das potentielle Risiko von Infektionen mit Streptococcus suis und Salmonella zu reduzieren. Schnell die Schweine für mindestens 6 Stunden vor Einleitung der Narkose Aspiration zu verhindern.
- Initiieren Betäubung des Molches durch eine intramuskuläre Injektion von Ketamin (20 mg / kg), Atropin (0,04 mg / kg) und Midazolam (0,3 mg / kg). Anschließend transportieren das Tier aus dem Gehäuse Anlage in den Operationssaal (OR).
- Legen Sie das Schwein in Rückenlage auf dem OP-Tisch. Lassen Sie das Schwein 2 l Sauerstoff spontan mit 5% Isofluran zu atmen. Expose die Stimmbänder mit einer Kehlkopfspiegel und sprühen sie mit 2% Lidocain topische Lösung Intubation-induzierte Laryngospasmen zu verhindern. Nach der Intubation mit einem 6,5-mm-Rohr, blockieren die Manschette mit 3-5 ml Luft.
Hinweis: Kapnometrie bestätigt die korrekte position des Trachealtubus. - Verringern Sie die Isofluran-Gas auf 2,5%. Stellen Sie den Ventilator auf 14-16 Atemzügen / min und dem Atemvolumen zu 10-15 ml / kg Körpergewicht. Überwachen Sie die Schweine eng. Die Herzfrequenz und Sauerstoffsättigung durch Pulsoxymetrie aufgenommen. Bestätigen richtige Betäubung durch verminderte Herzfrequenz (unter 150 Schläge / min) und der Blutdruck (systolisch unter Werte von 100 mmHg) sowie Abwesenheit von Schweine-Bewegungen (keine Verwendung von Muskelrelaxantien).
- Unter sterilen Bedingungen einführen einen 9,5 P. Single-Lumen Dauerkatheter in die innere Halsschlagader mit Seldingertechnik 27. verwenden Kurz gesagt, eine Nadel in die Vene zu durchstechen. Nach dem Führungsdraht einzuführen, ersetzen Sie die Nadel mit dem Peel-away-Einführungs, gefolgt von Ersatz des Drahtes mit der Gefäßkatheter. Befestigen Sie den Katheter in die Haut ein 3-0 Seide oder nicht resorbierbaren monofile Faden verwenden.
- Verwalten 500 mg Metronidazol, 1 g Cefazolin, und 20 mg Pantoprazol. AnzeigeMinister 200 ml Ringer-Lactat-Lösung mit 5% Dextrose (D5W) und 1 ml Fentanyl Citrat pro Stunde intravenös in der gesamten Operation. Übernehmen Veterinäraugensalbe auf die Augen Trockenheit während der Narkose zu verhindern.
- Chirurgische Prozedur
- Nach Steril Desinfektion und Berichterstattung über das Operationsfeld, führen Sie einen Mittellinienschnitt von 25 cm in der Länge. Legen Sie eine Rückziehvorrichtung. Cover gross und Dünndarm mit einem Handtuch und positionieren sie auf der linken Seite für einen optimalen Zugang zu der rechten Niere.
- Befreien Sie die Harnleiter und die rechte Niere selbst von anhaftendem Gewebe mit dem Brenneisen.
- Präparieren Sie die rechte Nierenvene und Arterie die Brenneisen, bis ihre Herkunft aus der unteren Hohlvene und die Aorta mit jeweils frei. Um arterieller Vasospasmus zu vermeiden, sollte die Verabreichung von 30-65 mg Papaverin betrachtet werden.
- Nach vollständigem Nieren Dissektion, Krawatte (Seide, 3-0) und den Harnleiter distal schneiden. VORBEREITUNGea Schüssel mit Eis und eine sterile Orgel Tasche.
- Erstens, klemmen die Nierenarterie nahe der Aorta und der zweite, klemmen die Nierenvene Nähe der Hohlvene Schiff Schellen. Als nächstes Resektion der Nierentransplantate und sofort kanülieren die Nierenarterie mit einer Kanüle Nierenarterie. Verwenden Sie 500 ml eiskaltem Histidin-Tryptophan-Ketoglutarat (HTK) Lösung, die das Blut zu spülen. Bewahren Sie die Niere auf Eis bis zur Transplantation.
- In situ, schließen Sie die restlichen Nierenarterie mit einer Ligatur (Seide, 2-0) und der renalen Vene mit einer fortlaufenden Naht (Prolene, 6-0).
- Nach dem Einchecken für Blutungen der sezierten Bereich, schließen Sie die Bauchdecke mit einer fortlaufenden Naht (Monofil, 1) und die Haut mit einem 3-0 Seide oder nicht resorbierbaren monofile Faden ..
- Die postoperative Verfahren
- Befestigen Sie den Katheter subkutan mit einer Naht (Seide, 3-0) und Tunnel es zu dem Rücken des Schweins unerwünschte Manipulationen zu verhindern. Nachdem das Schwein anfällig platzieren, sukunft (Seide, 3-0) der Katheter fest an der Haut.
- Wean das Schwein vom Beatmungsgerät und lassen Sie ihn in seiner Wohnanlage nach Extubation erholen. Verwalten Ringerlaktat intravenös zur Volume-Erweiterung und zu verwalten, 0,3 mg Buprenorphin zur Analgesie. Sie haben noch kein Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedererlangt hat.
3. Nieren-Transplantation Transplantation
- Die präoperative Verfahren
- Anesthetize das Schwein mit intravenöser Injektion von Propofol (1-2 mg / kg Körpergewicht), gefolgt von einer kontinuierlichen Infusion von Propofol in einer Menge von 50-100 mg / hr. Re-intubieren das Schwein wie in Schritt 2.1.3 und 2.1.4 und stellen Sie die Isofluran-Gas zu 3-4%.
- Verwalten 1 g Cefazolin und 20 mg Pantoprazol iv Während der Operation, verwenden das gleiche Narkoseprotokoll, wie in 2.1.4 beschrieben.
- Nach Steril Desinfektion, machen einen Schnitt von 4 cm neben der Luftröhre. Präparieren Sie die tiUSGABE die Halsschlagader freizulegen. Fahren Sie über-holt Pinzette und eine Seidenkrawatte (2-0) um die Arterie. Verwenden Sie die Seldinger-Technik ein Kunststoffkatheter einzuführen kontinuierlich Druck des arteriellen in der gesamten Operation zu messen. Alternativ können nicht-invasive Blutdruckmessverfahren verwendet werden.
- Chirurgische Prozedur
- Nach Steril Desinfektion, öffnen Sie die Bauchhöhle durch die Maschen der Haut und Faszie Nähte Schneiden, Wiedereinführung der Wund-Spreizer in die Bauchhöhle, und positionieren den Darm auf die linke Seite zu belichten besseren Zugang zu den infra Schiffen zu ermöglichen.
- Verpflanzen die erhaltenen Nierentransplantat End-to-Seite auf die infra Hohlvene und Aorta. Daher Hohlvene und Aorta über 5-8 cm über der iliakalen Bifurkation mit Pickups und Kauter sezieren. Wenn möglich, nicht stören die Lymphgefäße; falls nicht möglich, schließen Sie diese mit 5-0 Prolene Fäden.
- Nach der Präparation Abschluss überprüfen for Blutungen und Gewebereste aus den Gefäßen zu entfernen. Stellen Sie sicher, dass eine vollständige Klemmung der Vena Cava und Aorta mit einem Satinsky Klemme möglich ist.
- die Gegenseite (links) Nieren nächstes resezieren. Dazu positionieren Sie, den Darm nach rechts; sezieren den Harnleiter, die Niere selbst, die Nierenvene, und die Nierenarterie von anhaftendem Gewebe. Binden Sie die Harnleiter und die Blutgefäße und Resektion der Niere. Überprüfen Sie für Blutungen.
- Positionieren Sie den Darm auf der linken Seite die infra Aorta freizulegen und Hohlvene. Injizieren Heparin (100 IU / kg Körpergewicht) und warten Sie mindestens 2 Minuten.
- Venöse Anastomose:
- Verwenden Sie einen Satinsky Klemme vollständig die Hohlvene klemmen und einen Schlitz Einschnitt machen, die die Größe der Öffnung des Nierenvenenübereinstimmt, eine 11-Klinge. Pott Schere kann verwendet werden, um den Schlitz erstreckt.
- die Niere in ein Tuch mit steriler Eis nach dem Wickeln, es aus dem Eis zu entfernen und in das Operationsfeld zu positionieren. Verwenden Sie zwei zweiarmigen 6-0Prolene Nahtmaterial eine Schädel- und eine Schwanz Ecke Stich durchzuführen.
- Approximieren Sie die Niere, die obere Ecke binden und eine fortlaufende Naht mit 6-0 Prolene durchführen, mit der Rückwand beginnen. Nach 2/3 beendet haben, das andere Ende des Verbindungs verwenden, um die Naht an der Vorderseite zu vervollständigen. Nach der Schädel Stiche zu binden, an der Schwanz Ecke die Maschen binden.
- Positionieren Sie eine Bulldogge Klemme an der Nierenvene und öffnen Sie die Satinsky Klemme. Schauen Sie sich die Anastomose für Blutungen.
- Arterielle Anastomose:
- Verwenden Sie die Satinsky wieder spannen, um vollständig die Aorta klemmen. Verwenden Sie ein 11 Messer einen Schlitz Einschnitt zu machen, um die Öffnung der Nierenarterie entspricht. Verwenden Sie ein 4,0 mm Rundstempel eine saubere Öffnung zu sichern.
- Verwenden Sie einen 6-0 Prolene Naht die arterielle Anastomose durchzuführen, bei der Empfängerseite beginnen. Stellen Sie sicher, dass die arterielle Endothel ist in jeder Naht enthalten eine Dissektion zu verhindern. Inzwischen einen kontinuierlichen Tropf von 10 ml beginnen norepinephrine (16 mg / 250 ml) in 500 ml Ringer-Laktat verdünnt und titriert den systolischen Druck über 100 mmHg zu halten.
- Injizieren Verapamil intraarteriell vor Beendigung des arteriellen Anastomose und Verwalten Papaverin topisch auf die Außenseite des Gefäßes Vasospasmus zu verhindern.
- Positionieren Sie eine Bulldogge Klemme an der Nierenarterie und öffnen Sie die Satinksy Klemme. Schauen Sie sich die Anastomosen für Blutungen.
- Packen Sie die Niere aus dem Tuch und entfernen Sie das Eis. Öffnen Sie die Venen Bulldog Klemme zum einen durch die arterielle Bulldog Klemme gefolgt. Nach Reperfusion, sollten Urinproduktion sofort beginnen.
- Verwenden Tuch eine günstige Position für die Transplantat zu sichern und eine homogene Reperfusion halten.
- Harnleiter-Anastomose:
- Verwenden Pott Schere den Harnleiter aus dem Transplantat zu öffnen und den Empfänger über eine Länge von 0,5 cm.
- Verwenden zwei 6.0 Polyester, Poly (p-Dioxanon) -Nahtmaterial für die Seite-an-Seite ureTeral Anastomose. Führen Sie eine Ecke stich auf jeder Seite, dann die Rückwand zunächst in kontinuierlicher Weise ausgeführt werden, durch die Vorderwand gefolgt.
- das Tuch Nach Blutung Überprüfung, zu entfernen und einige des Dünndarms im Bereich der Nieren wickeln Sie es in Position zu halten. Schließen Sie die Bauchdecke mit zwei monofile ein Nähten. Schließen Sie die Haut mit 3-0 Seide oder nicht resorbierbaren monofile Faden.
- Pflegen Sie den systolischen Druck über 100 mmHg kontinuierlich durch sorgfältig die Noradrenalin-Infusion titriert, bis das Schwein in Bauchlage gebracht worden ist.
- Die postoperative Verfahren
- Nach Bauchdeckenverschluss, wie oben erwähnt, warm halten das Schwein ein Heizkissen und Wärmezirkulation Decke verwenden. Entfernen Sie die arterielle Leitung, schließen Sie das Einstichloch in der Arterie mit einem 6-0 Prolene stich und schließen Sie die Einschnittstelle.
- Schalten Sie das Schwein auf Bauchlage, stoppen Sie den Noradrenalin-Tropf und entwöhnen das Schwein vom Beatmungsgerät. alNieder das Schwein in ihrer Wohnanlage zu erholen und überwachen es eng seine glatte Erholung von der Vorgehensweise zu gewährleisten. Nehmen Blutgasproben jede Stunde über die Vena Katheter implantiert. Geben Ringer-Laktat zu Ersatzvolumen und zu verwalten, 0,3 mg Buprenorphin zur Analgesie.
- Nach Extubation, zur Überwachung der Schweine eng, bis es spontan zu trinken kann. Sie haben noch kein Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedererlangt hat. Nicht ein Tier zurück, die Operation an die Firma von anderen Tieren unterzogen wurde, bis sie vollständig erholt.
4. Postoperative Follow Up
- Verwalten 0,3 mg Buprenorphin iv alle 8 Stunden für mindestens 2 Tage nach der Operation oder länger, wenn nötig. Routinemäßig eine einzige prophylaktische Dosis von Antibiotika während der Operation zu verwalten. Im Falle Anzeichen einer Infektion, Cefazolin 1 g iv zweimal pro Tag und Metronidazol iv einmal täglich verabreichen, bisklinische Besserung eintritt. Verwalten Ringerlaktat, bis das Schwein ausreichend Wasser trinkt. 1.000 IU Heparin kann verwendet werden, um den Katheter zu verriegeln Gerinnung zu verhindern.
- Sammeln Sie Blutproben über die Vena Katheter und Urinproben des Schweins klinischen Zustands und die Nierenfunktion zu beurteilen.
- Für Euthanasie, induzieren Anästhesie des Schweins mit Propofol iv (5-10 ml) und halten es mit Isofluran 5%. Intubate das Schwein, wie oben beschrieben. Nach relaparatomy und Sammlung Nierengewebeprobe, Herzstillstand durch intravenöse Injektion von 40 mval KCl induzieren.
Ergebnisse
Im Folgenden werden die Ergebnisse der Nierenautotransplantation Experimenten (n = 4) gezeigt. Nach der anfänglichen Transplantat Retrieval, erholten sich die Schweine in ihrem Wohngebiet. Inzwischen wurden die Nierentransplantate für einen Durchschnittszeit von 7 h 35 min (± 18 min) auf Eis gelagert. Nach Reinduktion der Anästhesie und wiederholen Laparotomie wurden die kontralateralen Nieren reseziert und die Kalt gespeichert Transplantate heterotop transplantiert, wie beschrieben. Nach der Entwöhnung vom Ventilator, wurden Schweine von der Operation erholt und für 10 Tage (siehe Abbildung 1) verfolgt. Täglich (1-4 postoperativen Tag; pod) oder jeden zweiten Tag (6-10 pod) wurden Blutproben gesammelt Blutgasanalysen durchzuführen; zu beurteilen, wurden die Nierenfunktion, Serum-Kreatinin und Blutharnstoffstickstoff (BUN) -Werte geschätzt. Zum Vergleich sind die Ergebnisse eines allotransplanted Nierentransplantat dargestellt. Zur Immunsuppression, erhielt dieses Schwein Cyclosporin 100 mg po und Cortisone 250 mg ivbid Die Operationstechnik verwendet wurde, war das gleiche wie in dem Autotransplantat-Protokoll; keine Zeit wurde warme Ischämie angewendet.
Alle Schweine waren in gutem klinischen Zustand während des Follow-up-Periode. Die Serum-Kreatinin und BUN-Werte ergeben, den höchsten Anstieg an Tag eins nach der Operation (Crea 2,8 ± 0,7 mg / dl, BUN 25,3 ± 7 mg / dl) und verringerte sich bis pod 10 (Crea 1,7 ± 0,4 mg / dl, BUN 10,7 ± 4 mg / dl) in der Nähe zu den ursprünglichen Ausgangswerten. Die allotransplanted Nierentransplantate zeigten höhere Kreatinin und BUN-Werte nach guten Anfangstransplantatfunktion, wenn sie auf die Autotransplantate verglichen, höchstwahrscheinlich auf Ablehnung (Abbildung 2 und 3). Säure-Base-Hämostase (Abbildung 4) und Elektrolyt-Niveau (Abbildung 5) waren stabil ohne Intervention. Die histologische Untersuchung zeigte bewahrt Tubulointerstitium im autotransplanted Niere (Figure 6), und interstitielle Entzündung diffundieren, Tubulitis und glomerulitis im allotransplanted Niere (Abbildung 7).
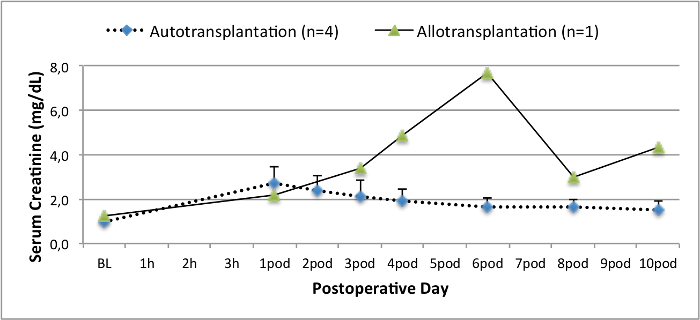
Abbildung 2. Serum-Kreatinin-Werte. Serum-Kreatinin-Werte (Mittelwert und Standardabweichung) für Grundlinie und 10 nach der Operation. Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
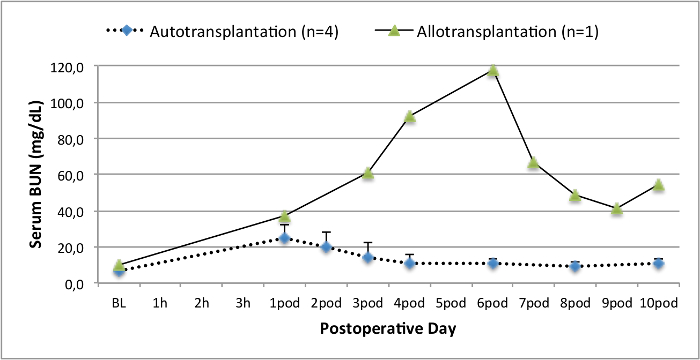
Abbildung 3. Serum BUN-Werte. Serum BUN-Werte (Mittelwert und Standardabweichung) für Grundlinie und 10 Tage nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
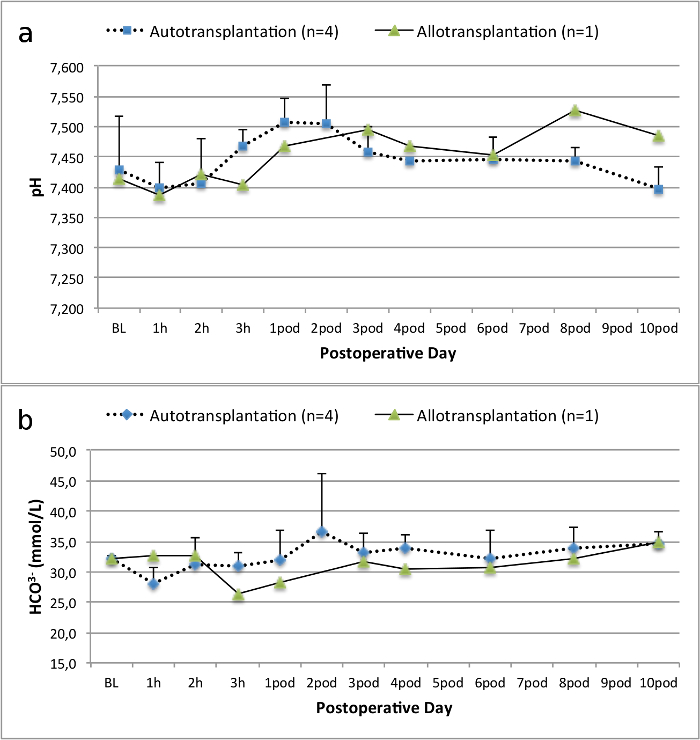
Abbildung 4. Säure-Base-Blutstillung. Säure-Base-Hämostase (Mittelwert und Standardabweichung) für Grundlinie und 10 Tage nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
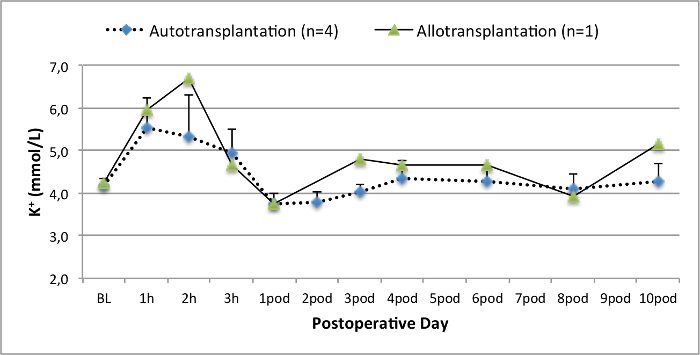
Abbildung 5. Elektrolyt-Niveau. Elektrolyt-Niveau (Mittelwert und Standardabweichung) für Grundlinie und 10 Tage nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
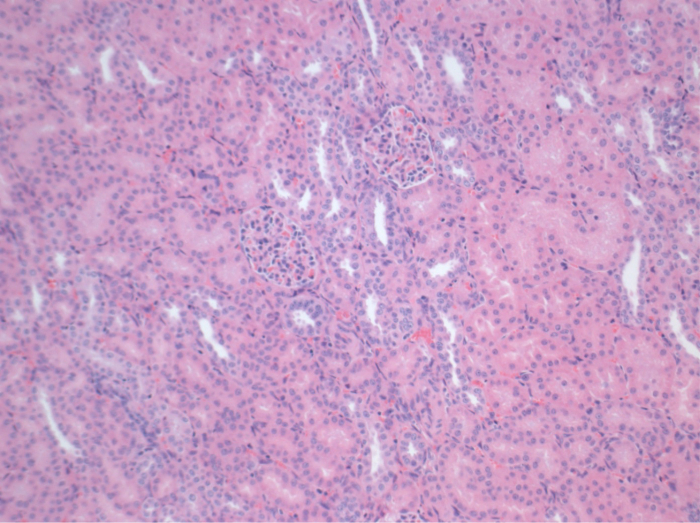
Abbildung 6. Histologie (H &# 38;.. E), 100-facher Vergrößerung Normale Tubulointerstitium im autotransplanted Niere 10 Tage nach der Operation Bitte klicken Sie hier eine größere Version dieser Figur zu sehen.
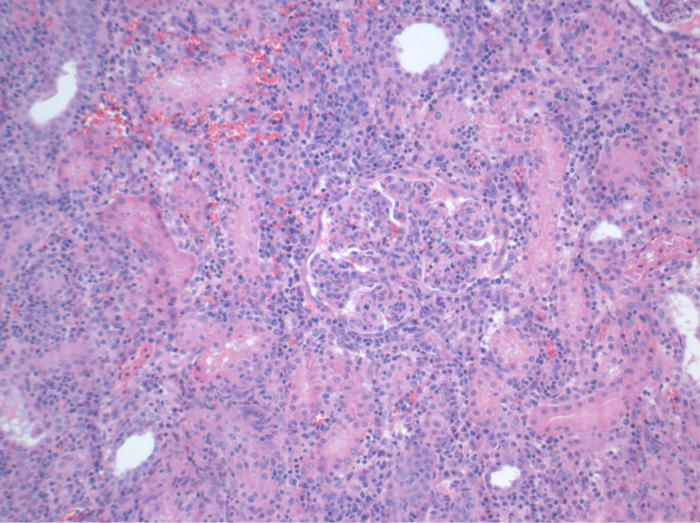
Abbildung 7. Histologie (H & E), 100-facher Vergrößerung. Umfangreiche interstitiellen Entzündung, Tubulitis und glomerulitis, im Einklang mit Ablehnung, in der allotransplanted Niere 10 Tage nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Das Modell der Schweinenieren-Transplantation bietet eine einzigartige Gelegenheit, 14 in den Bereich der menschlichen Transplantation wegen Ähnlichkeiten in der chirurgischen Aspekte, Physiologie, Biochemie und Immunologie zu fördern.
Je nach Zweck der experimentellen Studie hat das Modell der Nierenautotransplantation mehrere Vorteile gegenüber der Allotransplantation Modell. Obwohl mehrere Gruppen gute Funktion des Nierentransplantats nach 28 Allotransplantationen berichten, Immunsuppression bei Schweinen ist eine Herausforderung, vor allem in der Nierentransplantation. Die präoperative Blutprobe analysiert Kompatibilität für Schweine-Leukozyten-Antigen (SLA), um sicherzustellen, sind machbar, aber teuer und unpraktisch 14. Postoperativ vorgeschlagen Immunsuppressiva wie Tacrolimus und Cyclosporin (Calcineurin-Inhibitoren, CNI) oral verabreicht oder iv 28. Die orale Verabreichung ist unpraktisch, da in der Regel Schweine verweigern oral medica zu schluckention. Darüber hinaus könnte Darm Hindernisse ausreichende Absorption von immunsuppressiven Medikamenten und Wartung von therapeutischen Wirkstoffspiegel vermeiden. Die kontinuierliche Infusion von CNI des iv in aktiven Tieren ist technisch anspruchsvoll. Iv Bolus-Gabe führt zu hohen Spitzenwerten, die Toxizität führen. So ist für die Untersuchung neuer Konservierungstechniken hat das Modell der Nierenautotransplantation mehrere Vorteile. In den repräsentativen Ergebnissen der oben gezeigt Nierentransplantat allotransplantated, verzögert und erhöhte Spitzen von Kreatinin und BUN zeigen Ablehnung, die durch histologische Begutachtung nachgewiesen.
Die Schweine-Modell der Autotransplantation hat vorher benutzt worden 14,18,29 neue Konservierungstechniken zu untersuchen. Allerdings variieren die berichteten postoperativen Serum-Kreatinin und BUN-Werte von autotransplanted Schweine in einem Heart-Beating-Szenario stark je nach Versuchsanordnung 22,30 . Der Heart-Beating-Donor-Protokoll wir hier präsentieren, ergibt sich eine geringe postoperative Serum-Kreatinin-Spitzenwert von 2,8 mg / dl (± 0,7) und BUN Spitze von 25,3 mg / dl (± 7,4). Diese Ergebnisse sind vergleichbar mit den niedrigen Spitzenwerte präsentiert von Hanto und Kollegen 28 und Snoeijs und Kollegen 31.
Um ein erfolgreiches Ergebnis nach Nierentransplantation in einem Schweine-Autotransplantation Modell gewährleisten, haben wir mehrere wichtige technische Faktoren identifiziert, die die Geschwindigkeit bestimmter Komplikationen zu minimieren. Die Verwendung von Histidin-Tryptophan-Ketoglutarat-Lösung (HTK) reduziert das Risiko von Vasospasmus aufgrund seiner geringeren Gehalt an Kalium wenn University of Wisconsin (UW) Lösung verglichen. Um die Gefahr von Vasospasmen am Punkt der Reperfusion zu verringern, können Verapamil in die Nierenarterie injiziert werden, und Papaverin kann während der Wiedergewinnung und nach Reperfusion topisch verabreicht werden. Darüber hinaus titriert eine Dauertropf von Noradrenalin zu haltender systolische Blutdruck über 100 mm Hg gewährleistet eine homogene Reperfusion. Es ist sinnvoll, diese Blutdruck zumindest zu halten, bis das Schwein anfällig positioniert ist. Darüber hinaus ist das Positionieren des Transplantat transplantiert wichtig Knicken der neu anastomosiert Blutgefäße zu verhindern. Daher ist es hilfreich, die kontralateralen linken Niere vor dem Vernähen der Anastomosen des Transplantats zu resezieren umfangreiche mechanische Manipulation zu vermeiden. die Harnleiter-Anastomose, Packdünndarms um die Transplantat sichert seine Position nach dem Verschluss der Bauchdecke Nach Abschluss. Komplikationen wie Darmbehinderungen durch Abknicken des Darms sind selten beobachtet, kann aber zu schweren Komplikationen, darunter Ileus, Darmperforation und zum Tod führen. Insgesamt genaue Operationstechnik, aufmerksam Anästhesie und eine engmaschige Überwachung während sich gute klinische Ergebnis und die Organfunktion gewährleisten folgen.
Arterielle und venöse Anastomose kann perfomit verschiedenen Techniken RMED. Orthotope Platzierung des Transplantats ermöglicht End-zu-End-Anastomosen der Nierenarterie und Vene. Im Falle von heterotope Transplantation kann das Transplantat in das kontralaterale Nieren fossa für End-to-End-Anastomosen positioniert werden, auf dem Beckenbehälter oder direkt die distale Aorta. Heterotope Transplantation mit Anastomosen Aorta und cava direkt in End-to-Side-Technik sind in diesem Modell bevorzugt, da sie das Risiko von Thrombosen und Vasospasmus 32 verringern kann. Anatomische Variationen mit sehr frühen venösen Verzweigungen könnte auf die Notwendigkeit von Nähen zwei getrennten venösen Anastomosen führen. Wenn die Arterie oder Vene relativ kurz sind, kann das Transplantat 180 ° gedreht werden Länge der Gefäße zu erhalten. Harnleiter-Seite-an-Seite-Anastomose kann gute experimentelle Ergebnisse zu erzielen, ohne Verengungen oder Urinleck zu komplizieren.
Im Allgemeinen bietet das Schweinemodell der Nierentransplantation Vorteile im Vergleich zu anderen Tiermodellen. als described oben gibt es gewisse Ähnlichkeiten zwischen der Schweine- und menschlichen Einstellung, die relativ schnell Übersetzung neuer Techniken in die klinische Praxis ermöglicht. Die Technik der Transplantation ist technisch einfacher im Vergleich zu Nagetiermodellen. Zusätzlich kann durch Platzierung von Kathetern kann peripheren Blutproben einfach und für weitere Untersuchungen gesammelt werden verarbeitet. Die Sammlung von Urin erlaubt eine zusätzliche Beurteilung von Nierenversagen und Funktion. Zu Urinproben, eine perkutane Katheter Sammeln in die Harnblase eingelegt werden. Um zu vermeiden, Manipulation durch den Schwein, sollte das distale Ende subkutan auf den Rücken des Tieres werden getunnelt. Eine weitere Option für Urinsammlung ist die Verwendung von Stoffwechselkäfigen, die längeren Erhebungszeiträume ermöglichen die Kreatinin-Clearance und Konzentration zusätzlicher Biomarker im Urin zu schätzen. Sonographie, CT-Scans und MRI-Bilder sind möglich. Spende nach Kreislauf Tod Protokolle können durch die Anwendung warmen nachgeahmt werdenIschämie vor der Wiederherstellung. Darüber hinaus sind Schweine relativ einfach, wenn kastriert zu handhaben ihr aggressives Verhalten zu begrenzen.
Nachteile sind die hohen Kosten der Tierkauf, Wohnungswesen, chirurgische und andere medizinische Geräte und Arbeitskräfte. Diese Faktoren können dazu führen, dass es nicht möglich ist, eine große Zahl von Tieren in jeder Arbeitsgruppe zu gehören. Ferner, im Vergleich zu Nagermodellen, gibt eine begrenzte Anzahl von Referenzen in der Literatur für Schweine normative biologischen Daten zur Verfügung. Als Alternative zur Bewertung der neu entwickelte Techniken, wie neuartige Konservierungsverfahren haben andere Gruppen die Normothermie ex vivo Reperfusion als Alternative zu Nierentransplantation 33,34 beschrieben. Diese Technik ist einfacher durchzuführen und weniger teuer. Allerdings sieht standardisiert Nierentransplantat-Transplantation ein Modell mehr ähnlich der klinischen Praxis und ermöglicht einen längeren Zeitraum verfolgen. Daher dient es für eine realistischere Transplantats beurteilenment.
Zusammenfassend stellt die Schweinemodell heterotoper Nierenautotransplantation eine klinische Bedeutung Szenario innovative neue Ansätze zur Verbesserung der Nierentransplantat Ergebnisse zu untersuchen. Insbesondere bietet dieses Protokoll wichtige technische Details, die erfolgreiche Etablierung eines Nierenautotransplantation Modell erleichtert und ermöglicht die schnelle Umsetzung neuer Erkenntnisse in die klinische Studien.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank the Sorin Group (Milano, Italy), XVIVO Perfusion Inc. (Goteborg, Sweden), and Braun AG (Melsungen, Germany) for their support. We highly appreciate the support of the John David and Signy Eaton Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Anesthesia Equipment | |||
| Anesthesia Machine, Optimax | Moduflex Anesthesia Equipment | SN5180 | |
| Infusion Pump 3,000 | SIMS Graseby LTD. | SN300050447 | |
| Infusion Pump Line | Smith Medical ASD Inc. | 21-0442-25 | |
| Intravenous permanent catheter (9.5 Fr) | Cook Medical Company | G01865 | |
| Isoflurane Vapor 19.1 | Draeger Medical Canada Inc. | N/A | |
| Mallinckrodt, Tracheal Tube, 6.5 mm | Covidien Canada | 86449 | |
| Temperature Therapy Pad | Gaymar Industries Inc | TP26E | |
| Ventilator, AV 800 | DRE Medical Equipment | 40800AVV | |
| Warm Touch, Patient Warming System | Nellcor/ Covidien Canada | 5015300A | |
| Name | Company | Catalog Number | Comments |
| Surgical Equipment | |||
| Abdominal Retractor | Medite GmbH | 07-0001-00 | |
| Aorta/vein punch 4.0 mm, round | Scanlan International Inc. | 1001-602 | |
| De Bakey, Atraumatic Peripheral, Clamp | Aesculap Inc. | FB463R | |
| De Bakey-Beck, Atraumatic Vena Cava, Clamp | Aesculap Inc. | FB519R | |
| De Bakey, Atraumatic Mini-Bulldog, Straight | Aesculap Inc. | FB422R | |
| De Bakey, Atraumatic Mini-Bulldog, Curved | Aesculap Inc. | FB423R | |
| De Bakey, Atraumatic Coarctation Clamp, Angled | Aesculap Inc. | FB453R | |
| Dissection Blade #11 | Feather Safety Razor Co. | 089165B | |
| Connector (1/4") with male luer lock | Sorin Group Inc. | AB1452 | |
| Liver Admin Set (flush line) | CardioMed Supplies Inc | 17175 | |
| Maxon, 1 | Covidien Canada | 606173 | |
| Med-Rx Suction Connecting Tube | Benlan Inc. | 70-8120 | |
| Organ Bag | CardioMed Supplies Inc | 2990 | |
| Potts – De Martel, Scissors | Aesculap Inc. | BC648R | |
| Renal artery cannula, 1.6" | Sorin Group Inc. | VC-11000 | |
| Sofsilk, 2-0 | Covidien Canada | S405 | |
| Sofsilk, 3-0 | Covidien Canada | S404 | |
| Satinsky, Suprahepatic Cava Clamp | Aesculap Inc. | FB605R | |
| Suction Tip | Tyco Healthcare Group LP | 8888501023 | |
| Surgipro II, 6-0 | Covidien Canada | VP733X | |
| Valleylab, Cautery Pencil | Covidien Canada | E2515H | |
| Valleylab, Force Tx | Valleylab Inc. | 216151480 | |
| Valleylab, Patient Return Electrode | Covidien Canada | E7507 | |
| Name | Company | Catalog Number | Comments |
| Medication | |||
| Atropine Sulfate 15 mg/30 ml | Rafter 8 Products | 238481 | |
| Buprenorphine 0.3 mg/ml | RB Pharmaceuticals LDT | N/A | |
| Ceftiofur 3 mg/ml | Pfizer Canada Inc. | 11103 | |
| Cefazolin 1 g | Pharmaceutical Partners of Canada Inc. | 2237138 | |
| Fentanyl Citrate 0.25 mg/5 ml | Sandoz Canada Inc. | 2240434 | |
| Heparin 10,000 iU/10 ml | Sandoz Canada Inc. | 10750 | |
| Histidine-tryptophan-ketoglutarate (HTK) solution | Methapharm | CU001LBG | |
| Isoflurane 99.9%, 250 ml | Pharmaceutical Partners of Canada Inc. | 2231929 | |
| Ketamine Hydrochloride 5,000 mg/50 ml | Bimeda-MTC Animal Health Inc. | 612316 | |
| Lactated Ringer’s + 5% Dextrose 1 L | Baxter Corporation | JB1064 | |
| Lactated Ringer’s 1 L | Baxter Corporation | JB2324 | |
| Metronidazole 500 mg/100 ml | Baxter Corporation | 870420 | |
| Midazolam 50 mg/10 ml | Pharmaceutical Partners of Canada Inc. | 2242905 | |
| Norepinephrine 16 mg/250 ml Dextrose 5% | Baxter Corporation | N/A | |
| Pantoprazole 40 mg | Sandoz Canada Inc. | 2306727 | |
| Papaverine 65 mg/2 ml | Sandoz Canada Inc. | 9881 | |
| Propofol 1,000 mg/100 ml | Pharmascience Inc. | 2244379 | |
| Saline 0.9%, 1 L | Baxter Corporation | 60208 | |
| Solu-Medrol 500 mg | Pfizer Canada Inc. | 2367963 | |
| Verapamil | Sandoz Canada Inc. | 2166739 | |
| Xylocaine Endotracheal 10 mg/50 ml | AstraZeneca | 2003767 |
Referenzen
- Wolfe, R. A., Ashby, V. B., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 341 (23), 1725-1730 (1999).
- Ingsathit, A., Kamanamool, N., Thakkinstian, A., Sumethkul, V. Survival advantage of kidney transplantation over dialysis in patients with hepatitis C: a systematic review and meta-analysis. Transplantation. 95 (7), 943-948 (2013).
- Tonelli, M., Wiebe, N., et al. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am J Transplant. 11 (10), 2093-2109 (2011).
- Matas, A. J., et al. OPTN/SRTR Annual Data Report 2012: Kidney. Am J Transplant. 14, (2014).
- . Annual Report 2013 - Eurotransplant International Foundation. Available from: https://www.eurotransplant.org/cms/mediaobject.php?file=AR20135.pdf (2013)
- Morrissey, P. E., Monaco, A. P. Donation after circulatory death: current practices, ongoing challenges, and potential improvements. Transplantation. 97 (3), 258-264 (2014).
- Maggiore, U., Oberbauer, R., et al. Strategies to increase the donor pool and access to kidney transplantation: an international perspective. Nephrol Dial Transplant. 30 (2), 217-222 (2014).
- Summers, D. M., Johnson, R. J., Hudson, A., Collett, D., Watson, C. J., Bradley, J. A. Effect of donor age and cold storage time on outcome in recipients of kidneys donated after circulatory death in the UK: a cohort study. Lancet. 381 (9868), 727-734 (2013).
- Wadei, H. M., Heckman, M. G., et al. Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation. Transplantation. 96 (3), 274-281 (2013).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J. S., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., Favreau, F., Chatauret, N., Thuillier, R., Maiga, S., Hauet, T. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Gallinat, A., Paul, A., et al. Role of oxygenation in hypothermic machine perfusion of kidneys from heart beating donors. Transplantation. 94 (8), 809-813 (2012).
- Thuillier, R., Allain, G., et al. Benefits of active oxygenation during hypothermic machine perfusion of kidneys in a preclinical model of deceased after cardiac death donors. J Surg Res. 184 (2), 1174-1181 (2013).
- Hosgood, S. A., Barlow, A. D., Yates, P. J., Snoeijs, M. G. J., van Heurn, E. L. W., Nicholson, M. L. A pilot study assessing the feasibility of a short period of normothermic preservation in an experimental model of non heart beating donor kidneys. J Surg Res. 171 (1), 283-290 (2011).
- Delpech, P. O., Thuillier, R., et al. Effects of warm ischaemia combined with cold preservation on the hypoxia-inducible factor 1α pathway in an experimental renal autotransplantation model. Br J Surg. 101 (13), 1739-1750 (2014).
- Kirk, A. D. Crossing the bridge: large animal models in translational transplantation research. Immunol Rev. 196, 176-196 (2003).
- Golriz, M., Hafezi, M., et al. Do we need animal hands-on courses for transplantation surgery. Clin Transplant. 27, 6-15 (2013).
- He, B., Musk, G. C., Mou, L., Waneck, G. L., Delriviere, L. Laparoscopic surgery for kidney orthotopic transplant in the pig model. JSLS. 17 (1), 126-131 (2013).
- Faure, A., Maurin, C., et al. An experimental porcine model of heterotopic renal autotransplantation. Transplant Proc. 45 (2), 672-676 (2013).
- Hosgood, S. A., Yates, P. J., Nicholson, M. L. 1400W reduces ischemia reperfusion injury in an ex-vivo porcine model of the donation after circulatory death kidney donor. World J Transplant. 4 (4), 299-305 (2014).
- Ghanekar, A., Mendicino, M., et al. Endothelial induction of fgl2 contributes to thrombosis during acute vascular xenograft rejection. J Immunol. 172 (9), 5693-5701 (2004).
- Ghanekar, A., Lajoie, G., et al. Improvement in rejection of human decay accelerating factor transgenic pig-to-primate renal xenografts with administration of rabbit antithymocyte serum. Transplantation. 74 (1), 28-35 (2002).
- Cowan, P. J., Cooper, D. K. C., d'Apice, A. J. F. Kidney xenotransplantation. Kidney Int. 85 (2), 265-275 (2014).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography; a new technique. Acta radiol. 39 (5), 368-376 (1953).
- Hanto, D. W., Maki, T., et al. Intraoperative administration of inhaled carbon monoxide reduces delayed graft function in kidney allografts in Swine. Am J Transplant. 10 (11), 2421-2430 (2010).
- Maathuis, M. -. H. J., Manekeller, S., et al. Improved kidney graft function after preservation using a novel hypothermic machine perfusion device. Ann Surg. 246 (6), 982-991 (2007).
- Gallinat, A., Paul, A., et al. Hypothermic reconditioning of porcine kidney grafts by short-term preimplantation machine perfusion. Transplantation. 93 (8), 787-793 (2012).
- Snoeijs, M. G., Matthijsen, R. A., et al. Autologous transplantation of ischemically injured kidneys in pigs. J Surg Res. 171 (2), 844-850 (2011).
- Golriz, M., Fonouni, H., Nickkholgh, A., Hafezi, M., Garoussi, C., Mehrabi, A. Pig kidney transplantation: an up-to-date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
- Hosgood, S. A., Bagul, A., Yang, B., Nicholson, M. L. The relative effects of warm and cold ischemic injury in an experimental model of nonheartbeating donor kidneys. Transplantation. 85 (1), 88-92 (2008).
- Hoyer, D. P., Gallinat, A., et al. Influence of oxygen concentration during hypothermic machine perfusion on porcine kidneys from donation after circulatory death. Transplantation. 98 (9), 944-950 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten