Method Article
Hétérotopique rénale Autotransplantation dans un modèle porcin: Un protocole Step-by-Step
Dans cet article
Résumé
Porcine models of organ transplantation provide an important platform to study mechanisms of organ preservation. This article describes a heterotopic porcine renal autotransplantation model, which allows investigating new approaches to improve the outcome of transplantation using marginal kidney grafts.
Résumé
Kidney transplantation is the treatment of choice for patients suffering from end-stage renal disease. It offers better life expectancy and higher quality of life when compared to dialysis. Although the last few decades have seen major improvements in patient outcomes following kidney transplantation, the increasing shortage of available organs represents a severe problem worldwide. To expand the donor pool, marginal kidney grafts recovered from extended criteria donors (ECD) or donated after circulatory death (DCD) are now accepted for transplantation. To further improve the postoperative outcome of these marginal grafts, research must focus on new therapeutic approaches such as alternative preservation techniques, immunomodulation, gene transfer, and stem cell administration.
Experimental studies in animal models are the final step before newly developed techniques can be translated into clinical practice. Porcine kidney transplantation is an excellent model of human transplantation and allows investigation of novel approaches. The major advantage of the porcine model is its anatomical and physiological similarity to the human body, which facilitates the rapid translation of new findings to clinical trials. This article offers a surgical step-by-step protocol for an autotransplantation model and highlights key factors to ensure experimental success. Adequate pre- and postoperative housing, attentive anesthesia, and consistent surgical techniques result in favorable postoperative outcomes. Resection of the contralateral native kidney provides the opportunity to assess post-transplant graft function. The placement of venous and urinary catheters and the use of metabolic cages allow further detailed evaluation. For long-term follow-up studies and investigation of alternative graft preservation techniques, autotransplantation models are superior to allotransplantation models, as they avoid the confounding bias posed by rejection and immunosuppressive medication.
Introduction
Kidney transplantation is the treatment of choice for patients with end-stage renal disease, due to associated lower rates of morbidity and mortality when compared to dialysis 1-3. Despite major improvements in patient outcomes following kidney transplantation, graft shortage still poses a severe challenge worldwide. The number of patients waiting for a kidney transplant by far exceeds the number of organs available 4-6. To increase the number of kidneys available for transplantation and to reduce patient waiting times, further sources of kidney grafts are needed.
Commonly, standard criteria donor (SCD) and extended criteria donor (ECD) kidney grafts from donation after brain death (DBD) as well as kidneys recovered from live donors (LDKT) are utilized. Since the 1990s, an increasing number of kidney grafts have been recovered in a donation after circulatory death (DCD) scenario, to further expand the donor pool 7,8. However, DCD and ECD kidney grafts demonstrate acceptable but decreased outcomes after transplantation, depending on different factors, such as donor age, warm and cold ischemia times, and the preservation technique used 9-11. Thus, additional research is required to improve the outcome of patients receiving marginal kidney grafts and to further increase the donor pool.
The porcine model of renal transplantation is well established and provides a clinical important scenario to investigate innovative approaches for the improvement of marginal kidney graft outcomes. In contrast to rodent and canine kidneys, which are unilobular, porcine and human kidneys are multilobular and are anatomically similar, particularly in regard to the arterial, venous, and urinary collecting systems 12,13. In addition, porcine and human kidneys demonstrate similarities in the pathophysiology of ischemia reperfusion injury (IRI), biochemistry, and immunological parameters 14. Thus, porcine renal transplantation is well-suited to investigate new organ preservation methods for marginal kidney grafts 15-17, model human IRI 18, study immunological pathways and allograft tolerance 19, provide surgical training 20-22, test new pharmacological therapies 23, implement new medical devices, and study new immunological mechanisms in xenotransplantation 24-26.
The renal porcine and human transplantation settings are not completely analogous. This article focuses on important technical details that will facilitate successful establishment of a renal autotransplantation model. Species-adapted pre- and postoperative housing, administration of anesthesia with close monitoring, and matched surgical techniques are described in the protocol and demonstrated in the video. Resection of the contralateral native kidney provides the opportunity to assess the function of the transplanted kidney. The placement of venous and urinary catheters and the use of metabolic cages allow more in-depth assessment. For studies aimed at investigating alternative graft preservation methods and mechanisms of IRI, autotransplantation models are superior to allotransplantation models, as they avoid the complications and confounding bias associated with rejection and use of immunosuppressive medications.
Protocole
Tous les animaux ont reçu des soins humains et de toutes les études que nous avons menées en conformité avec les politiques et les lignes directrices du Conseil canadien de protection des animaux. Toutes les procédures ont été réalisées dans l'utilisation des animaux protocoles qui ont été approuvés par le Réseau de santé Comité de protection des animaux dans les institutions de l'Université.
Remarque: Un aperçu schématique du protocole de l'étude est présentée dans la figure 1.
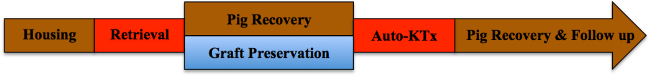
Figure 1. protocole de l'étude. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
1. Les animaux
- Utilisez masculins porcs Yorkshire (30 kg) dans ce protocole.
2. rein greffé Retrieval
- procédure préopératoire
- Maison mâle Yorkshire porcs dans un centre de recherche pour au moins une semaine pour les acclimater. Utilisez injection intramusculaire d'une céphalosporine de troisième génération, tels que ceftiofur, pendant 3 jours afin de réduire le risque potentiel d'infections par Streptococcus suis et Salmonella. Jeûner les porcs pendant au moins 6 heures avant l'induction de l'anesthésie pour éviter l'aspiration.
- Initier anesthésie du cochon par une injection intramusculaire de kétamine (20 mg / kg), l'atropine (0,04 mg / kg), et de midazolam (0,3 mg / kg). Par la suite, le transport de l'animal à partir de l'installation du logement à la salle d'opération (OR).
- Placer le porc dans une position couchée sur le dos sur la table d'opération. Laisser le cochon de respirer 2 L d'oxygène avec 5% d'isoflurane spontanément. Exposer les cordes vocales avec un laryngoscope et les pulvériser avec 2% de lidocaïne solution topique pour prévenir laryngospasme induite intubation. Après l'intubation avec un tube de 6,5 mm, bloquer le brassard avec 3-5 ml d'air.
Remarque: Capnométrie confirme la bonne position du tube trachéal. - Diminuer le gaz isoflurane à 2,5%. Régler le ventilateur de 14 à 16 respirations / min et le volume courant de 10 à 15 ml / kg de poids corporel. Suivre de près le cochon. La fréquence cardiaque et la saturation en oxygène sont enregistrées par oxymétrie de pouls. Confirmez anesthésie appropriée par la fréquence cardiaque réduite (en dessous de 150 battements / min) et la pression artérielle (systolique en dessous des valeurs de 100 mm Hg) ainsi que l'absence de mouvements de porcins (pas d'utilisation de relaxants musculaires).
- Dans des conditions stériles, introduire un 9,5 Fr. lumière unique cathéter permanent dans la veine jugulaire interne en utilisant la technique Seldinger 27. En bref, utiliser une aiguille pour percer la veine. Après l'introduction du guide-fil, remplacer l'aiguille avec l'introducteur pelable, suivie du remplacement du fil avec le cathéter vasculaire. Fixer le cathéter à la peau en utilisant une soie 3-0 ou non résorbable monofilament suture.
- Administrer 500 mg de métronidazole, 1 g de céfazoline et 20 mg de pantoprazole. Un dministre 200 ml d'une solution lactate de Ringer à 5% de dextrose (D5W) et 1 ml de citrate de fentanyl par voie intraveineuse heures pendant toute la chirurgie. Appliquer une pommade ophtalmique vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie.
- Opération chirurgicale
- Après la désinfection stérile et la couverture du champ opératoire, effectuer une incision médiane de 25 cm de longueur. Insérez un enrouleur. Couvrir grandes et petites entrailles avec une serviette et placez-les sur le côté gauche pour un accès optimal au rein droit.
- Libérer l'uretère et le rein droit lui-même de tous les tissus adhérents utilisant le cautère.
- Disséquer la veine rénale droite et l'artère en utilisant le cautère jusqu'à leur origine de la veine cave inférieure et l'aorte, respectivement, sont libres. Pour éviter un vasospasme artériel, l'administration de 30-65 mg de papavérine doit être envisagée.
- Après dissection complète rénale, cravate (soie, 3-0) et couper l'uretère distal. Preparea bol de glace et un sac d'organes stérile.
- Tout d'abord, serrer l'artère rénale à proximité de l'aorte et d'autre part, serrer la veine rénale à proximité de la veine cave à l'aide des pinces de vaisseau. Ensuite, réséquer la greffe de rein et cathétériser immédiatement l'artère rénale avec une canule de l'artère rénale. Utiliser 500 ml d'histidine-tryptophane-cétoglutarate (HTK) solution glacée pour débusquer le sang. Stocker le rein sur la glace jusqu'à la transplantation.
- In situ, fermer l'artère rénale restante avec une ligature (soie, 2-0) et la veine rénale avec un surjet (de prolene, 6-0).
- Après avoir vérifié la zone disséquée de saignement, fermer la paroi abdominale par un surjet (monofil, 1) et la peau avec une soie 3-0 ou non absorbable suture monofilament ..
- procédure postopératoire
- Fixer la voie sous-cutanée d'un cathéter veineux avec une suture (soie, 3-0) et le tunnel pour le dos du porc pour éviter la manipulation indésirable. Après avoir placé le cochon sujettes, sAVENIR (soie, 3-0) du cathéter fermement à la peau.
- Sevrer le porc du ventilateur et le laisser récupérer dans sa zone d'habitation après l'extubation. Administrer le lactate de Ringer par voie intraveineuse pour l'expansion de volume et administrer 0,3 mg de buprénorphine pour l'analgésie. Ne pas laisser un animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale.
3. rein greffé Transplantation
- procédure préopératoire
- Anesthésier le porc en utilisant une injection intraveineuse de propofol (1-2 mg / kg de poids corporel) suivie d'une perfusion continue de propofol à une vitesse de 50 à 100 mg / h. Re-intuber le porc comme décrit dans l'étape 2.1.3 et 2.1.4 et mettre le gaz isoflurane à 3-4%.
- Administrer 1 g de céfazoline et 20 mg de pantoprazole iv Pendant l'opération, utiliser le même protocole anesthésique tel que décrit au point 2.1.4.
- Après la désinfection stérile, faire une coupe de 4 cm à côté de la trachée. Disséquer le tissu pour exposer l'artère carotide. Passez forceps sur-Holt et une cravate en soie (2-0) autour de l'artère. En utilisant la technique de Seldinger pour introduire un cathéter en plastique pour mesurer en continu la pression artérielle tout au long de l'opération. En variante, des techniques de mesure de pression artérielle non invasive peuvent être utilisés.
- Opération chirurgicale
- Après la désinfection stérile, rouvrir la cavité abdominale en coupant les points de sutures de la peau et le fascia, réintroduire l'écarteur chirurgical pour exposer la cavité abdominale, et repositionner l'intestin vers le côté gauche pour permettre un meilleur accès aux navires-rénale.
- Transplanter la greffe rénale préservée fin à l'autre à la veine cave et de l'aorte sous-rénale. Par conséquent, disséquer la veine cave et l'aorte sur 5-8 cm au-dessus de la bifurcation iliaque utilisant micros et cautérisation. Si possible, ne pas déranger les vaisseaux lymphatiques; si pas possible, fermez-les avec 5-0 sutures prolène.
- Après avoir terminé la dissection, consultez for hémorragie et retirer restant tissus par les vaisseaux. Faire en sorte que le serrage complet de la veine cave et l'aorte avec une pince Satinsky est réalisable.
- Ensuite, la résection de la controlatéral (à gauche) rein. Pour ce faire, placez l'intestin vers la droite; disséquer l'uretère, le rein lui-même, la veine rénale et l'artère rénale à partir de tissu adhérent. Attachez l'uretère et les vaisseaux sanguins et la résection du rein. Vérifiez les saignements.
- Repositionner l'intestin vers la gauche pour exposer l'aorte et la veine cave. Injecter de l'héparine (100 UI / kg de poids corporel) et attendre au moins 2 min.
- Anastomose veineuse:
- Utiliser un dispositif de serrage pour serrer Satinsky complètement la veine cave et de faire une incision en forme de fente qui correspond à la taille de l'ouverture de la veine rénale, en utilisant une lame 11. ciseaux Pott peuvent être utilisés pour étendre la fente.
- Après avoir enveloppé le rein dans un tissu contenant de la glace stérile, le retirer de la glace et le positionner dans le champ opératoire. Utilisez deux à deux bras 6-0prolene sutures pour effectuer un crâne et un point d'angle caudal.
- Rapprocher le rein, attacher le coin supérieur et effectuer un surjet en utilisant 6-0 prolene, en commençant par le mur du fond. Après avoir terminé 3.2, utiliser l'autre extrémité de l'attache pour effectuer la suture au niveau du côté avant. Après avoir attaché les points crâniens, lier les points de suture au coin caudale.
- Placez un collier de bouledogue sur la veine rénale et ouvrir la pince Satinsky. Vérifiez l'anastomose de saignement.
- Anastomose artérielle:
- Utilisez le Satinsky serrer à nouveau pour bloquer complètement l'aorte. Utilisez une lame 11 à faire une incision en forme de fente, correspondant à l'ouverture de l'artère rénale. Utilisez un poinçon rond 4.0 mm pour garantir une ouverture propre.
- Utilisez un 6-0 suture prolene pour effectuer l'anastomose artérielle, en commençant par le côté du destinataire. Faire en sorte que l'endothélium artériel est présent dans chaque fil de suture pour empêcher une dissection. Pendant ce temps, commencer une perfusion continue de 10 ml norepinephrine (16 mg / 250 ml) dilué dans 500 ml de Ringer lactate et titrer pour maintenir la pression systolique supérieure à 100 mmHg.
- Injecter le vérapamil intra-artérielle avant l'achèvement de l'anastomose artérielle et administrer par voie topique papaverine à l'extérieur de la cuve pour empêcher le vasospasme.
- Placez une pince bulldog sur l'artère rénale et ouvrir la pince Satinksy. Vérifiez les anastomoses de saignement.
- Déroulez le rein de la toile et enlever la glace. Ouvrez le bulldog veineuse pince en premier, suivi par la pince artérielle bulldog. Après la reperfusion, la production d'urine devrait commencer immédiatement.
- Utilisez un chiffon pour obtenir une position favorable pour le greffon transplanté et maintenir une reperfusion homogène.
- Urétéral anastomose:
- Pott utiliser des ciseaux pour ouvrir l'uretère du greffon et le receveur sur une longueur longitudinale de 0,5 cm.
- Utiliser deux 6,0 polyester, le poly (p-dioxanone) pour la suture ure côte à côteanastomose Teral. Effectuer un Stich coin de chaque côté, puis exécutez le mur arrière d'une manière continue en premier, suivi par la paroi avant.
- Après vérification des saignements, retirer le linge et envelopper une partie de l'intestin grêle dans le rein pour le maintenir en position. Fermer la paroi abdominale avec deux monofils 1 sutures. Fermez la peau avec 3-0 soie ou non résorbable monofilament suture.
- Maintenir la pression systolique supérieure à 100 mmHg en continu en titrant attentivement la perfusion noradrénaline jusqu'à ce que le porc a été placé en position couchée.
- procédure postopératoire
- Après la fermeture abdominale comme mentionné ci-dessus, garder le cochon chaud à l'aide d'un coussin chauffant et une couverture thermique à circulation. Retirer la ligne artérielle, fermer le trou de perforation dans l'artère avec un prolene Stich 6-0 et fermer le site d'incision.
- Tourner le cochon sur position couchée, arrêter la perfusion de noradrénaline et de sevrer le porc du ventilateur. albas le cochon de récupérer dans sa zone d'habitation et de surveiller de près pour assurer la reprise en douceur de la procédure. Prélever des échantillons de gaz de sang chaque heure via le cathéter jugulaire implanté. Fournir du lactate de Ringer au volume substitut et administrer 0,3 mg de buprénorphine pour l'analgésie.
- À la suite de l'extubation, surveiller étroitement le porc jusqu'à ce qu'il soit capable de boire spontanément. Ne pas laisser un animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale. Ne retournez pas un animal qui a subi une intervention chirurgicale à la compagnie d'autres animaux jusqu'à guérison complète.
4. Suivi postopératoire
- Administrer 0,3 mg de buprénorphine IV toutes les 8 heures pour la chirurgie de poste au moins 2 jours ou plus si nécessaire. Régulièrement administrer une dose prophylactique unique d'antibiotique pendant la chirurgie. En cas de signes d'infection, l'administration iv céfazoline 1 g deux fois par jour et le métronidazole iv fois par jour jusqu'à ce queamélioration clinique. Administrer le lactate de Ringer jusqu'à ce que le porc boit suffisamment d'eau. 1000 UI d'héparine peut être utilisée pour verrouiller le cathéter pour empêcher la coagulation.
- Prélever des échantillons de sang veineux via le cathéter jugulaire et des échantillons urinaires pour évaluer l'état clinique du porc et de la fonction rénale.
- Pour l'euthanasie, induire une anesthésie du porc avec du propofol iv (5-10 ml) et de le maintenir à l'isoflurane 5%. Intuber le porc comme décrit ci-dessus. Après relaparatomy et la collecte de l'échantillon de tissu rénal, de provoquer un arrêt cardiaque par injection intraveineuse de KCl 40 mval.
Résultats
Dans ce qui suit, les résultats des expériences de autotransplantation rénale (n = 4) sont mises en évidence. Après la récupération de greffage initial, les porcs récupérés dans leur zone de logement. Pendant ce temps, les greffes de rein ont été stockés sur de la glace pendant une durée moyenne de 7 h 35 min (± 18 min). Après réinduction de l'anesthésie et la laparotomie répétition, les reins controlatéraux ont été réséquées et les greffes froid stocké transplantées comme décrit hétérotopique. Après le sevrage de la ventilation, les porcs ont été récupérés de la chirurgie et suivis pendant 10 jours (voir la figure 1). Daily (1-4 journée post-opératoire; pod) ou tous les deux jours (6-10 pod) des échantillons de sang ont été prélevés pour effectuer des analyses des gaz du sang; d'évaluer la fonction rénale, de la créatinine sérique et de l'urée sanguine (BUN) les valeurs ont été estimées. A titre de comparaison, les résultats d'une greffe de rein une allogreffe sont présentés. Pour immunosuppression, ce cochon a reçu cyclosporine 100 mg par voie orale et cortisone 250 mg ivbid La technique chirurgicale utilisée était la même que dans le protocole d'autogreffe; pas le temps d'ischémie chaude a été appliquée.
Tous les porcs étaient en bon état clinique au cours de la période de suivi. Les créatinine et BUN valeurs sériques ont révélé la plus forte hausse au premier jour après la chirurgie (Crea 2,8 ± 0,7 mg / dl, BUN 25,3 ± 7 mg / dl) et une diminution jusqu'à ce pod 10 (Crea 1,7 ± 0,4 mg / dl, BUN 10,7 ± 4 mg / dl) proches des valeurs de référence initiales. La greffe de rein une allogreffe démontré des valeurs de créatinine et BUN plus élevés après une bonne fonction initiale du greffon, par rapport aux autogreffes, probablement due à un rejet (Figure 2 et 3). Hémostase acide-base (figure 4) et les niveaux d'électrolyte (figure 5) sont stables sans intervention. L'examen histologique a montré tubulo-interstitiel préservé dans le rein autotransplanted (Figure 6), et une inflammation interstitielle diffuse, tubulite et glomérulite une allogreffe du rein (figure 7).
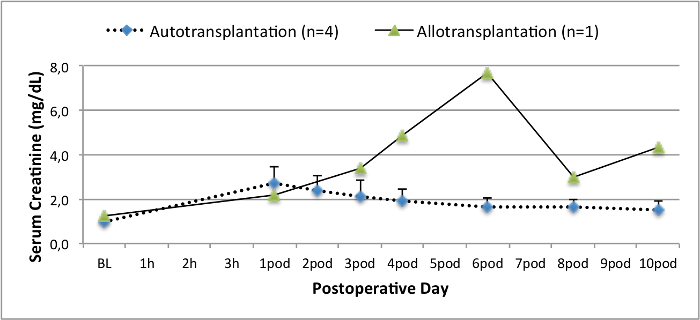
Figure 2. Les valeurs sériques de créatinine. Valeurs sériques de créatinine (moyenne et écart type) pour la ligne de base et 10 après la chirurgie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
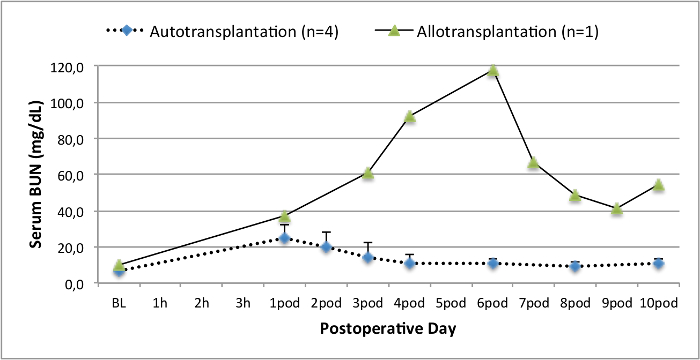
Figure 3. Valeurs Sérum chignon. Valeurs Sérum BUN (moyenne et écart-type) pour la ligne de base et 10 jours après la chirurgie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
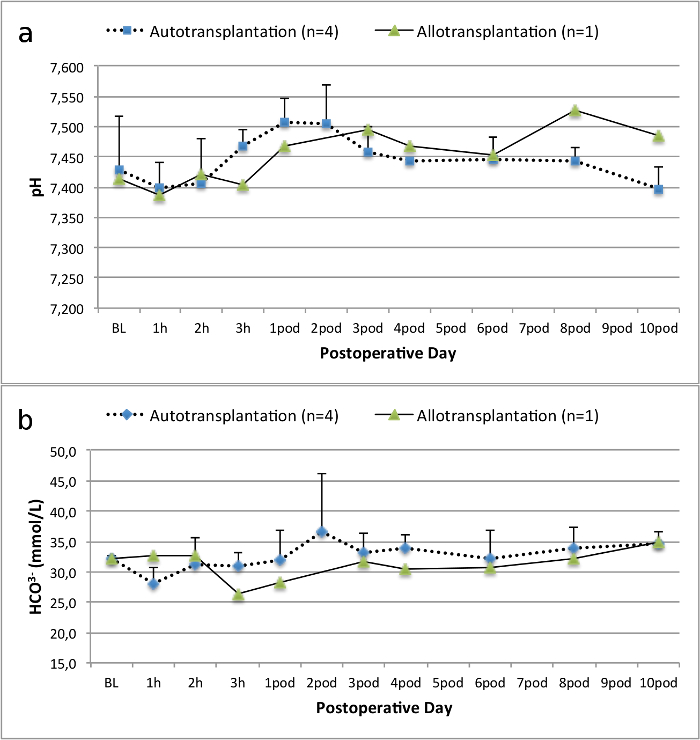
Figure 4. hémostase acido-basique. Hémostase acide-base (moyenne et écart type) pour la ligne de base et 10 jours après la chirurgie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
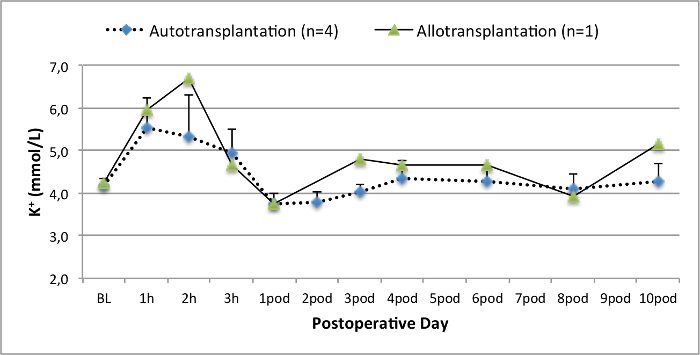
Figure 5. niveaux d'électrolytes. Les taux d'électrolytes (moyenne et écart-type) pour la ligne de base et 10 jours après la chirurgie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
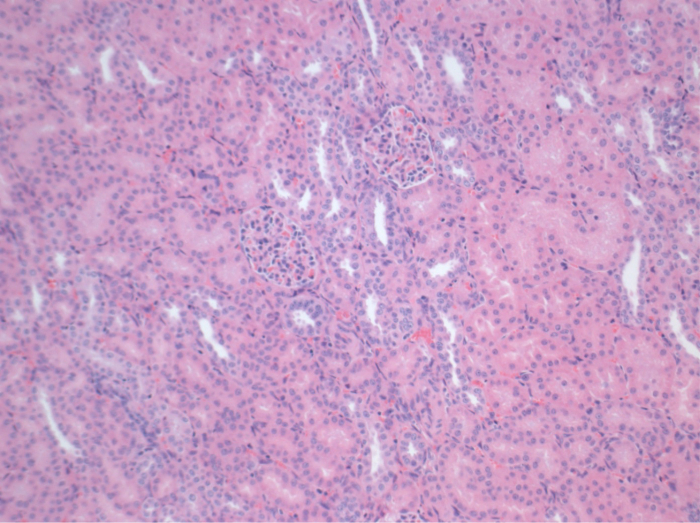
Figure 6. histologie (H &# 38;.. E), 100X tubulo-interstitiel normal dans le rein autotransplanted 10 jours après la chirurgie S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
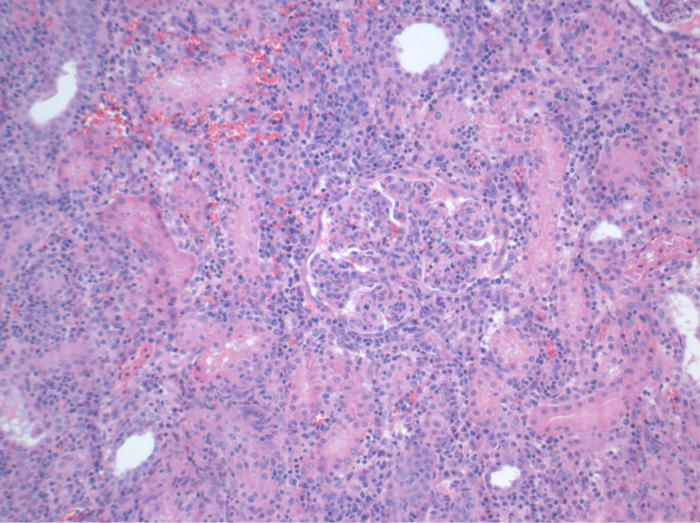
Figure 7. histologie (H & E), 100X. Vaste interstitielle inflammation, tubulite et glomérulite, compatible avec le rejet, dans le rein une allogreffe 10 jours après la chirurgie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le modèle de porc transplantation rénale offre une occasion unique pour faire avancer le domaine de la transplantation humaine en raison de similitudes dans les aspects chirurgicaux, la physiologie, la biochimie et l'immunologie 14.
Selon le but de l'étude expérimentale, le modèle d'auto-transplantation rénale a plusieurs avantages par rapport au modèle d'allotransplantation. Bien que plusieurs groupes indiquent une bonne fonction du greffon rénal après allotransplantation 28, immunosuppression chez les porcs est difficile, en particulier dans la transplantation rénale. Analyses d'échantillons de sang préopératoire pour assurer la compatibilité de l'antigène leucocytaire porcine (SLA) sont réalisables, mais cher et peu pratique 14. Après l'opération, les agents immunosuppresseurs proposés tels que le tacrolimus et la ciclosporine (inhibiteurs de la calcineurine, CNI) sont administrés par voie orale ou intraveineuse 28. L'administration orale est impossible, que les porcs refusent généralement à avaler medica oraletion. En outre, les obstructions intestinales pourraient éviter une absorption suffisante de médicaments immunosuppresseurs et le maintien des niveaux de médicaments thérapeutiques. La perfusion continue de l'iv de CNI chez les animaux actifs est techniquement exigeant. Iv administration en bolus conduit à des valeurs de crête élevés, qui provoquent une toxicité. Ainsi, pour la recherche de nouvelles techniques de conservation, le modèle de autotransplantation rénale présente plusieurs avantages. Dans les résultats représentatifs de la greffe rénale allotransplantated démontré ci-dessus, un pic retardé et augmenté de créatinine et BUN indiquer rejet, qui a été mise en évidence par une évaluation histologique.
Le modèle porcin de autotransplantation a déjà été utilisé pour étudier de nouvelles techniques de conservation 14,18,29. Cependant, les créatinine et BUN valeurs rapportées sérum post-opératoire de porcs autotransplanted dans un scénario de cœur arrêté varient considérablement selon le système expérimental 22,30 . Le protocole de donneur à cœur arrêté que nous présentons ici se traduit par une faible postopératoire pic de la créatinine sérique de 2,8 mg / dl (± 0,7) et BUN pic de 25,3 mg / dl (± 7,4). Ces résultats sont comparables aux faibles valeurs de pointe présentés par Hanto et collègues Snoeijs 28 et 31 et ses collègues.
Pour assurer le succès après la transplantation rénale dans un modèle de autotransplantation porcine, nous avons identifié plusieurs facteurs clés techniques qui réduisent au minimum le taux de certaines complications. L'utilisation d'une solution d'histidine-tryptophane-cétoglutarate (HTK) réduit le risque de vasospasme en raison de sa faible teneur en potassium par rapport à Université du Wisconsin (UW) solution. Pour diminuer encore le risque de vasospasme au moment de la reperfusion, le vérapamil peut être injecté dans l'artère rénale et la papaverine peut être administré par voie topique pendant la récupération et après la reperfusion. En outre, une perfusion continue de norepinephrine titré à maintenirla pression artérielle systolique supérieure à 100 mmHg assure une reperfusion homogène. Il est utile de maintenir cette pression dans le sang au moins jusqu'à ce que le racleur est disposé à plat ventre. En outre, le positionnement du greffon transplanté est important d'éviter le vrillage des vaisseaux sanguins nouvellement anastomosés. Par conséquent, il est utile de réséquer le rein controlatéral gauche avant de coudre les anastomoses du greffon afin d'éviter une manipulation mécanique très étendue. Après avoir terminé l'anastomose urétérale, enveloppant intestin grêle autour de la greffe transplantée sécurise sa position après la fermeture de la paroi abdominale. Les complications telles que des obstructions intestinales dues à vrillage de l'intestin sont rarement observés, mais peut entraîner des complications graves, y compris iléus, perforation de l'intestin, et la mort. Dans l'ensemble, la technique chirurgicale précise, l'anesthésie attentive et une surveillance étroite pendant le suivi d'assurer une bonne fonction des résultats et de la greffe clinique.
Artériel et veineux anastomoses peuvent être Performée en utilisant différentes techniques. orthotopique placement du greffon permet anastomose de l'artère rénale et la veine de bout en bout. Dans le cas de la transplantation hétérotopique, le greffon peut être placée dans la fosse du rein controlatéral pour anastomoses bout-en-bout, sur les vaisseaux iliaques, ou l'aorte distale directement. La transplantation hétérotopique avec anastomoses à l'aorte et cave directement dans la technique extrémité à l'autre sont préférés dans ce modèle car elle peut réduire le risque de thrombose et 32 vasospasme. variations anatomiques avec bifurcations veineux très précoces pourraient conduire à la nécessité de coudre deux anastomoses veineuses distinctes. Si l'artère ou une veine sont relativement courts, le greffon peut être tourné de 180 ° pour obtenir la longueur des vaisseaux. anastomose urétérale côté à l'autre peut obtenir de bons résultats expérimentaux sans compliquer les sténoses ou fuites urinaires.
En général, le modèle porcin de la transplantation rénale offre des avantages par rapport à d'autres modèles animaux. comme described ci-dessus, certaines similitudes existent entre le porc et le milieu humain, ce qui permet la traduction relativement rapide de nouvelles techniques dans la pratique clinique. La technique de transplantation est techniquement plus facile par rapport aux modèles de rongeurs. En outre, par le placement d'un cathéter veineux, des échantillons de sang périphérique peuvent être collectées et traitées facilement pour complément d'enquête. La collecte de l'urine permet une évaluation plus poussée de la blessure et de la fonction rénale. De prélever des échantillons d'urine, un cathéter percutané peut être insérée dans la vessie urinaire. Pour éviter la manipulation par le porc, l'extrémité distale doit être tunnel sous-cutanée à l'arrière de l'animal. Une autre option pour la collecte d'urine est l'utilisation de cages métaboliques, qui permettent des périodes prolongées de collecte pour estimer la clairance de la créatinine et de la concentration de biomarqueurs supplémentaires dans l'urine. Échographie, tomodensitométrie et d'IRM images sont possibles. Don après protocoles de mort circulatoires peut être imité par l'application de chaleurischémie avant la récupération. En outre, les porcs sont relativement faciles à gérer si castrés pour limiter leur comportement agressif.
Les inconvénients sont les coûts élevés de l'achat des animaux, le logement, l'équipement chirurgical et médical, et la main-d'oeuvre. Ces facteurs font qu'il est impossible de comprendre un grand nombre d'animaux dans chaque groupe d'étude. En outre, par rapport aux modèles de rongeurs, un nombre limité de références sont disponibles dans la littérature pour porcs données biologiques normatives. Comme une alternative pour l'évaluation des nouvelles techniques développés, tels que de nouvelles méthodes de conservation, d'autres groupes ont décrit la normothermique ex vivo reperfusion comme une alternative à la transplantation rénale 33,34. Cette technique est plus facile à réaliser et moins coûteux. Cependant, normalisé transplantation de greffe de rein fournit un modèle plus proche de la pratique clinique et permet de suivre plus haut périodes. Par conséquent, il sert pour une greffe plus réaliste d'évaluerment.
En conclusion, le modèle porcin de autotransplantation rénale hétérotopique fournit un scénario clinique important d'étudier de nouvelles approches innovantes pour l'amélioration des résultats de greffe de rein. En particulier, ce protocole présente des détails techniques importants qui faciliteront mise en place réussie d'un modèle de autotransplantation rénale et permet la traduction rapide des nouvelles découvertes à des essais cliniques.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank the Sorin Group (Milano, Italy), XVIVO Perfusion Inc. (Goteborg, Sweden), and Braun AG (Melsungen, Germany) for their support. We highly appreciate the support of the John David and Signy Eaton Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Anesthesia Equipment | |||
| Anesthesia Machine, Optimax | Moduflex Anesthesia Equipment | SN5180 | |
| Infusion Pump 3,000 | SIMS Graseby LTD. | SN300050447 | |
| Infusion Pump Line | Smith Medical ASD Inc. | 21-0442-25 | |
| Intravenous permanent catheter (9.5 Fr) | Cook Medical Company | G01865 | |
| Isoflurane Vapor 19.1 | Draeger Medical Canada Inc. | N/A | |
| Mallinckrodt, Tracheal Tube, 6.5 mm | Covidien Canada | 86449 | |
| Temperature Therapy Pad | Gaymar Industries Inc | TP26E | |
| Ventilator, AV 800 | DRE Medical Equipment | 40800AVV | |
| Warm Touch, Patient Warming System | Nellcor/ Covidien Canada | 5015300A | |
| Name | Company | Catalog Number | Comments |
| Surgical Equipment | |||
| Abdominal Retractor | Medite GmbH | 07-0001-00 | |
| Aorta/vein punch 4.0 mm, round | Scanlan International Inc. | 1001-602 | |
| De Bakey, Atraumatic Peripheral, Clamp | Aesculap Inc. | FB463R | |
| De Bakey-Beck, Atraumatic Vena Cava, Clamp | Aesculap Inc. | FB519R | |
| De Bakey, Atraumatic Mini-Bulldog, Straight | Aesculap Inc. | FB422R | |
| De Bakey, Atraumatic Mini-Bulldog, Curved | Aesculap Inc. | FB423R | |
| De Bakey, Atraumatic Coarctation Clamp, Angled | Aesculap Inc. | FB453R | |
| Dissection Blade #11 | Feather Safety Razor Co. | 089165B | |
| Connector (1/4") with male luer lock | Sorin Group Inc. | AB1452 | |
| Liver Admin Set (flush line) | CardioMed Supplies Inc | 17175 | |
| Maxon, 1 | Covidien Canada | 606173 | |
| Med-Rx Suction Connecting Tube | Benlan Inc. | 70-8120 | |
| Organ Bag | CardioMed Supplies Inc | 2990 | |
| Potts – De Martel, Scissors | Aesculap Inc. | BC648R | |
| Renal artery cannula, 1.6" | Sorin Group Inc. | VC-11000 | |
| Sofsilk, 2-0 | Covidien Canada | S405 | |
| Sofsilk, 3-0 | Covidien Canada | S404 | |
| Satinsky, Suprahepatic Cava Clamp | Aesculap Inc. | FB605R | |
| Suction Tip | Tyco Healthcare Group LP | 8888501023 | |
| Surgipro II, 6-0 | Covidien Canada | VP733X | |
| Valleylab, Cautery Pencil | Covidien Canada | E2515H | |
| Valleylab, Force Tx | Valleylab Inc. | 216151480 | |
| Valleylab, Patient Return Electrode | Covidien Canada | E7507 | |
| Name | Company | Catalog Number | Comments |
| Medication | |||
| Atropine Sulfate 15 mg/30 ml | Rafter 8 Products | 238481 | |
| Buprenorphine 0.3 mg/ml | RB Pharmaceuticals LDT | N/A | |
| Ceftiofur 3 mg/ml | Pfizer Canada Inc. | 11103 | |
| Cefazolin 1 g | Pharmaceutical Partners of Canada Inc. | 2237138 | |
| Fentanyl Citrate 0.25 mg/5 ml | Sandoz Canada Inc. | 2240434 | |
| Heparin 10,000 iU/10 ml | Sandoz Canada Inc. | 10750 | |
| Histidine-tryptophan-ketoglutarate (HTK) solution | Methapharm | CU001LBG | |
| Isoflurane 99.9%, 250 ml | Pharmaceutical Partners of Canada Inc. | 2231929 | |
| Ketamine Hydrochloride 5,000 mg/50 ml | Bimeda-MTC Animal Health Inc. | 612316 | |
| Lactated Ringer’s + 5% Dextrose 1 L | Baxter Corporation | JB1064 | |
| Lactated Ringer’s 1 L | Baxter Corporation | JB2324 | |
| Metronidazole 500 mg/100 ml | Baxter Corporation | 870420 | |
| Midazolam 50 mg/10 ml | Pharmaceutical Partners of Canada Inc. | 2242905 | |
| Norepinephrine 16 mg/250 ml Dextrose 5% | Baxter Corporation | N/A | |
| Pantoprazole 40 mg | Sandoz Canada Inc. | 2306727 | |
| Papaverine 65 mg/2 ml | Sandoz Canada Inc. | 9881 | |
| Propofol 1,000 mg/100 ml | Pharmascience Inc. | 2244379 | |
| Saline 0.9%, 1 L | Baxter Corporation | 60208 | |
| Solu-Medrol 500 mg | Pfizer Canada Inc. | 2367963 | |
| Verapamil | Sandoz Canada Inc. | 2166739 | |
| Xylocaine Endotracheal 10 mg/50 ml | AstraZeneca | 2003767 |
Références
- Wolfe, R. A., Ashby, V. B., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 341 (23), 1725-1730 (1999).
- Ingsathit, A., Kamanamool, N., Thakkinstian, A., Sumethkul, V. Survival advantage of kidney transplantation over dialysis in patients with hepatitis C: a systematic review and meta-analysis. Transplantation. 95 (7), 943-948 (2013).
- Tonelli, M., Wiebe, N., et al. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am J Transplant. 11 (10), 2093-2109 (2011).
- Matas, A. J., et al. OPTN/SRTR Annual Data Report 2012: Kidney. Am J Transplant. 14, (2014).
- . Annual Report 2013 - Eurotransplant International Foundation. Available from: https://www.eurotransplant.org/cms/mediaobject.php?file=AR20135.pdf (2013)
- Morrissey, P. E., Monaco, A. P. Donation after circulatory death: current practices, ongoing challenges, and potential improvements. Transplantation. 97 (3), 258-264 (2014).
- Maggiore, U., Oberbauer, R., et al. Strategies to increase the donor pool and access to kidney transplantation: an international perspective. Nephrol Dial Transplant. 30 (2), 217-222 (2014).
- Summers, D. M., Johnson, R. J., Hudson, A., Collett, D., Watson, C. J., Bradley, J. A. Effect of donor age and cold storage time on outcome in recipients of kidneys donated after circulatory death in the UK: a cohort study. Lancet. 381 (9868), 727-734 (2013).
- Wadei, H. M., Heckman, M. G., et al. Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation. Transplantation. 96 (3), 274-281 (2013).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J. S., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. B. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., Favreau, F., Chatauret, N., Thuillier, R., Maiga, S., Hauet, T. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Gallinat, A., Paul, A., et al. Role of oxygenation in hypothermic machine perfusion of kidneys from heart beating donors. Transplantation. 94 (8), 809-813 (2012).
- Thuillier, R., Allain, G., et al. Benefits of active oxygenation during hypothermic machine perfusion of kidneys in a preclinical model of deceased after cardiac death donors. J Surg Res. 184 (2), 1174-1181 (2013).
- Hosgood, S. A., Barlow, A. D., Yates, P. J., Snoeijs, M. G. J., van Heurn, E. L. W., Nicholson, M. L. A pilot study assessing the feasibility of a short period of normothermic preservation in an experimental model of non heart beating donor kidneys. J Surg Res. 171 (1), 283-290 (2011).
- Delpech, P. O., Thuillier, R., et al. Effects of warm ischaemia combined with cold preservation on the hypoxia-inducible factor 1α pathway in an experimental renal autotransplantation model. Br J Surg. 101 (13), 1739-1750 (2014).
- Kirk, A. D. Crossing the bridge: large animal models in translational transplantation research. Immunol Rev. 196, 176-196 (2003).
- Golriz, M., Hafezi, M., et al. Do we need animal hands-on courses for transplantation surgery. Clin Transplant. 27, 6-15 (2013).
- He, B., Musk, G. C., Mou, L., Waneck, G. L., Delriviere, L. Laparoscopic surgery for kidney orthotopic transplant in the pig model. JSLS. 17 (1), 126-131 (2013).
- Faure, A., Maurin, C., et al. An experimental porcine model of heterotopic renal autotransplantation. Transplant Proc. 45 (2), 672-676 (2013).
- Hosgood, S. A., Yates, P. J., Nicholson, M. L. 1400W reduces ischemia reperfusion injury in an ex-vivo porcine model of the donation after circulatory death kidney donor. World J Transplant. 4 (4), 299-305 (2014).
- Ghanekar, A., Mendicino, M., et al. Endothelial induction of fgl2 contributes to thrombosis during acute vascular xenograft rejection. J Immunol. 172 (9), 5693-5701 (2004).
- Ghanekar, A., Lajoie, G., et al. Improvement in rejection of human decay accelerating factor transgenic pig-to-primate renal xenografts with administration of rabbit antithymocyte serum. Transplantation. 74 (1), 28-35 (2002).
- Cowan, P. J., Cooper, D. K. C., d'Apice, A. J. F. Kidney xenotransplantation. Kidney Int. 85 (2), 265-275 (2014).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography; a new technique. Acta radiol. 39 (5), 368-376 (1953).
- Hanto, D. W., Maki, T., et al. Intraoperative administration of inhaled carbon monoxide reduces delayed graft function in kidney allografts in Swine. Am J Transplant. 10 (11), 2421-2430 (2010).
- Maathuis, M. -. H. J., Manekeller, S., et al. Improved kidney graft function after preservation using a novel hypothermic machine perfusion device. Ann Surg. 246 (6), 982-991 (2007).
- Gallinat, A., Paul, A., et al. Hypothermic reconditioning of porcine kidney grafts by short-term preimplantation machine perfusion. Transplantation. 93 (8), 787-793 (2012).
- Snoeijs, M. G., Matthijsen, R. A., et al. Autologous transplantation of ischemically injured kidneys in pigs. J Surg Res. 171 (2), 844-850 (2011).
- Golriz, M., Fonouni, H., Nickkholgh, A., Hafezi, M., Garoussi, C., Mehrabi, A. Pig kidney transplantation: an up-to-date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
- Hosgood, S. A., Bagul, A., Yang, B., Nicholson, M. L. The relative effects of warm and cold ischemic injury in an experimental model of nonheartbeating donor kidneys. Transplantation. 85 (1), 88-92 (2008).
- Hoyer, D. P., Gallinat, A., et al. Influence of oxygen concentration during hypothermic machine perfusion on porcine kidneys from donation after circulatory death. Transplantation. 98 (9), 944-950 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon