Method Article
El uso de una batería de químicos y ecotoxicológicos Métodos para la Evaluación de la eficacia de procesos de tratamiento de aguas residuales para quitar potencia estrogénica
En este artículo
Resumen
Los compuestos alteradores endocrinos (EDC) representan un riesgo considerable para el medio ambiente acuático. plantas de tratamiento de aguas residuales municipales son los principales contribuyentes a la potencia estrogénica de las aguas superficiales. La metodología proporcionada en este documento permite una evaluación de la eficacia e idoneidad de los procesos de tratamiento de aguas residuales con respecto a la eliminación de la EDC.
Resumen
Endocrine Disrupting Compounds pose a substantial risk to the aquatic environment. Ethinylestradiol (EE2) and estrone (E1) have recently been included in a watch list of environmental pollutants under the European Water Framework Directive. Municipal wastewater treatment plants are major contributors to the estrogenic potency of surface waters. Much of the estrogenic potency of wastewater treatment plant (WWTP) effluents can be attributed to the discharge of steroid estrogens including estradiol (E2), EE2 and E1 due to incomplete removal of these substances at the treatment plant. An evaluation of the efficacy of wastewater treatment processes requires the quantitative determination of individual substances most often undertaken using chemical analysis methods. Most frequently used methods include Gas Chromatography-Mass Spectrometry (GCMS/MS) or Liquid Chromatography-Mass Spectrometry (LCMS/MS) using multiple reaction monitoring (MRM). Although very useful for regulatory purposes, targeted chemical analysis can only provide data on the compounds (and specific metabolites) monitored. Ecotoxicology methods additionally ensure that any by-products produced or unknown estrogenic compounds present are also assessed via measurement of their biological activity. A number of in vitro bioassays including the Yeast Estrogen Screen (YES) are available to measure the estrogenic activity of wastewater samples. Chemical analysis in conjunction with in vivo and in vitro bioassays provides a useful toolbox for assessment of the efficacy and suitability of wastewater treatment processes with respect to estrogenic endocrine disrupting compounds. This paper utilizes a battery of chemical and ecotoxicology tests to assess conventional, advanced and emerging wastewater treatment processes in laboratory and field studies.
Introducción
Las preocupaciones sobre los efectos adversos de los compuestos disruptores endocrinos sobre la vida silvestre de la salud reproductiva ha llevado a la Unión Europea para colocar dos sustancias estrogénicas (estradiol y etinilestradiol) en una "lista de vigilancia" en virtud de la Directiva Marco del Agua (DMA). EDC abarca una variedad de clases químicas, incluyendo los estrógenos naturales y sintéticos esteroides, medicamentos, pesticidas y productos químicos industriales y componentes de productos de consumo con efectos adversos conocidos sobre la vida silvestre. Algunos de estos compuestos pueden tener un impacto en la salud humana 1.
La investigación ha demostrado que los efluentes de las PTAR son estrogénica a pescar 2 y como consecuencia muchas aguas receptoras también son estrogénica a 3 de los pescados. Esto fue demostrado por primera vez a través de encuestas nacionales en el Reino Unido, que mostró un aumento de las concentraciones de vitelogenina (un precursor de la proteína específica yema femenina 4) en la sangre del pez macho salvaje y un alto prevalencia de intersexuales (desarrollo de huevos y / o conductos reproductores femeninos en los testículos de los machos) en especies de peces normalmente gonochoristic 5,6.
tratamiento de aguas residuales convencional es típicamente un proceso de tres etapas que consiste en una selección preliminar seguido de tratamiento primario y secundario que elimina tanto la materia orgánica disuelta y suspendida. La eficacia de eliminación de individuo EDC es dependiente de las propiedades fisicoquímicas de las sustancias y de la eficacia del proceso de tratamiento aplicado. Para muchos de eliminación EDC por adsorción y degradación biológica puede ser significativa pero incompleta. El tratamiento terciario, tales como la filtración de arena, puede ser eficaz en el aumento de eliminación EDC 7 mientras que el tratamiento avanzado utilizando oxidación avanzada (por ejemplo ozono) o carbón activado pueden ser efectivos para lograr la eliminación completa cerca de 7.
La evaluación de cualquier nueva tecnología para el tratamiento de aguas residuales needs para determinar la eficacia del proceso propuesto en la eliminación de la EDC. Una batería de pruebas, incluyendo análisis químico dirigido junto con las pruebas de la ecotoxicología, utilizando in vivo e in vitro en bioensayos, proporciona datos completos para este fin. Aunque es muy útil para fines de regulación, el análisis químico dirigido sólo puede proporcionar datos sobre los compuestos (y los metabolitos específicos) supervisados. Los bioensayos permiten, además, la "detección" de los efectos adversos de los metabolitos y transformación de las aguas residuales generadas tratamiento subproductos que de otro modo se detectaría 8,9. Este artículo describe el uso de una batería de ensayos de laboratorio ecotoxicidad químicos y para evaluar la eficacia de una serie de procesos de tratamiento de aguas residuales avanzadas y emergentes en la eliminación de la potencia estrogénica del crudo y de las aguas residuales tratadas y las aguas receptoras.
Protocolo
Declaración de Ética: Los protocolos para la evaluación de la actividad endocrina de los productos químicos / mezclas en los peces interrumpir han sido aprobados por el Bienestar Animal de la Universidad de Brunel de Londres y del cuerpo de Revisión Ética (AWERB) y el Ministerio del Interior del Reino Unido en virtud de los Animales (Procedimientos Científicos) Act 1986.
Recogida de muestras 1. Agua, Conservación y Extracción
- La recogida de muestras y conservación
- Antes de su uso, limpiar las botellas con un agente limpiador tensioactivo adecuado. Después de limpiar, enjuagar las botellas con agua, desagüe y seco.
- Recoger muestras en botellas de vidrio de capacidad de 2-L que contiene un conservante que consiste en 0,5 g de cobre (II) nitrato y 6 ml de 3,6 M solución de ácido clorhídrico. Almacenar las muestras por debajo de 10 ° C. Extraer y analizar tan pronto como sea posible después de la recogida y preservación.
- Extracción de la muestra y la limpieza (para el análisis de estrógeno esteroide) 10
- Extracción en fase sólida (SPE)
- Antes de la extracción, para reducir los sólidos en suspensión, las muestras de agua de filtro utilizando un papel de filtro de tamaño de poro de 1 m.
- Una vez filtrado, muestras de Spike con el estándar interno mediante la adición de 100 l de clavar solución madre de patrón interno deuterado que contiene 2,4,16,16-d 4 -estrone: 2,4,16,16-d 4 -17β-estradiol (E2) : 2,4,16,16 y d-4 -17α-etinilestradiol (EE2) (todos a 40 mg / l en metanol) a 1.000 ml de efluente (o 100 ml influente) que resulta en aumento interna de 2 ng / l para las aguas residuales muestras de los efluentes, y 20 ng / L para las muestras del influente de aguas residuales.
- Coloque bolsas desechables de válvulas, cartuchos SPE estireno, divinilbenceno y embalses de cartucho al aparato de SPE. Conectar la bomba de vacío para probar el equipo está sellado adecuadamente.
- Pipeta de 5 ml de acetato de etilo en cada depósito, para acondicionar los cartuchos. Conectar la bomba de vacío (por debajo de 10 inHg para permitir un caudal de menos de 10 ml por minuto)y tire a través del líquido. No deje que los cartuchos SPE se sequen. Repita el proceso con 5 ml de metanol seguido de 5 ml de agua.
- Rellenar cada depósito del cartucho con agua y conectar tubos de PTFE de 1/8 "entre los depósitos de cartucho y botellas de muestra de vidrio. Conectar el vacío a una velocidad de flujo de menos de 10 ml por minuto y permitir que la muestra pase a través del cartucho. vaciar el frasco de residuos, según sea necesario.
- Seque los cartuchos SPE en vacío (o mediante el uso de aire o nitrógeno) hasta que el contenido del cartucho cambiar de color (por ejemplo, de color marrón oscuro a marrón claro).
- Poner 10 ml frascos limpios de recogida de vidrio secos en estante y el lugar en el interior del colector de extracción. Compruebe que cada revestimiento está por encima de un vial. Pipeta de 8 ml de diclorometano en cada depósito de muestras, interruptor de la bomba de vacío (velocidad de flujo de menos de 10 ml por minuto) y tire el líquido a través en los viales de colección.
- Eliminar viales de 10 ml desde el colector de SPEy el uso de un concentrador para reducir el volumen a 1 ml. Transferir cada muestra en un vial automuestreador y concentrar aún más a 100 l utilizando nitrógeno purga el equipo.
- Antes de la extracción, para reducir los sólidos en suspensión, las muestras de agua de filtro utilizando un papel de filtro de tamaño de poro de 1 m.
- Cromatografía de exclusión molecular (GPC) de limpieza
- Inyectar 95 l de extracto de la muestra se eluyó en el HPLC equipado GPC usando las condiciones descritas en la Tabla 1. Se concentra la GPC extracto hasta 200 l usando un concentrador y nitrógeno purga aparato y luego hacer hasta 2,0 ml con hexano.
- SPE limpieza
- Coloque bolsas desechables de válvulas, cartuchos aminopropilo, y depósitos de cartuchos al colector de SPE. Poner 10 ml frascos limpios de recogida de vidrio secos en estante y el lugar en el interior del colector de extracción. Pipeta 2 ml de hexano en cada depósito, para acondicionar los cartuchos. Deje que el líquido pase a través de los cartuchos.
- Pipetear el extracto de muestra GPC en el depósito y de nuevo permitir que el líquidopasar a través del cartucho. Recoger el eluido de la muestra en el vial y eliminar desde el colector. No se deshaga de eluato.
- Ponga un nuevo vial de 10 ml limpio y seco en la colección de cremallera y colocar dentro del colector de extracción. Para lavar el cartucho, añadir 2 ml de acetato de etilo en hexano (30% v / v) al depósito y tire del líquido a través del cartucho. Repetir con otros 2 ml de acetato de etilo en hexano, descartando todos los lavados.
- Coloque el vial de 10 ml colección original (paso 1.2.3.2) de nuevo en el estante en el interior del colector de extracción. Pipeta 2 ml de acetato de etilo en acetona (50% v / v) en el depósito, conectar la bomba de vacío (por debajo del 2 inHg para permitir un caudal de menos de 2 ml por minuto) y tire el líquido a través en el vial . Repetir el proceso con otros 2 ml de acetato de etilo.
- Retirar el vial de muestra y el uso de un concentrador para reducir el volumen a 1 ml de extracto. Transferir la muestra en un vial de vidrio pequeño y usar nitrógeno purga equipo, para evaporar tque el extracto hasta sequedad incipiente.
- Añadir 100 ml de metanol y mezclar bien. Transferir el extracto a un muestreador automático vial (con 0,3 ml de inserción) y la tapa del frasco. Analizar las muestras usando LCMS / MS (véase la sección 2).
- Extracción en fase sólida (SPE)
| Columna: | gel PL, 50 A, 300 x 7,5 mm, 5 micras |
| Columna de seguridad: | PL gel, 50 x 7,5 mm, 5 micras |
| Fase móvil: | diclorometano |
| Tasa de flujo: | 1 ml por min |
| Temperatura de la columna: | 25 ° C |
| Detector UV: | 210 nm |
| Volumen de inyección: | 95 l |
| Modo de inyección: | Estarard |
| Dibuje velocidad: | 500 ml por min |
| Expulsar velocidad: | 500 ml por min |
| Posición Draw: | 3 mm |
| Fracción recogida: | 3 ml fracción (7-10 min) en viales de 10 ml |
Tabla 1. Las condiciones y parámetros para la cromatografía de exclusión molecular (GPC) limpieza de muestras de aguas residuales extraídos. Tabla detalles de la columna de GPC, fase móvil, la temperatura, el volumen de inyección, y la longitud de onda del detector.
- extracción de la muestra (para evaluación de la levadura de estrógeno)
- muestras de filtro como se detallan en el apartado 1.2.1.1. Coloque bolsas desechables de válvulas, cartuchos SPE C18, y los depósitos de cartucho al aparato de SPE. Interruptor de la bomba de vacío para probar el equipo está sellado adecuadamente.
- Pipeta de 5 ml de metanol en cada depósito, para acondicionar el C18 cartuchos. Activar el vacío (a aproximadamente 5 inHg para permitir un flujo de aproximadamente 5 ml por minuto) y dejar correr el líquido a través, haciendo una pausa durante 1 min a medio camino. No deje que los cartuchos se secan. Repita el proceso, ya sea con calidad HPLC o agua doblemente destilada (ddH2O). Una vez más no funcionar en seco.
- Extraer muestras de agua como se describe en el apartado 1.2.1.4. Continuar el vacío durante al menos 30 minutos para secar completamente los cartuchos.
- Colocar los viales limpios de recogida de 10 ml seco en un bastidor en el colector de extracción. Compruebe que cada revestimiento está por encima de un vial. Añadir 5 ml de metanol a cada depósito. A su vez en el vacío (caudal máximo de 5 ml / min) y permitir que el líquido pase a través del cartucho en el vial, haciendo una pausa durante 2 minutos a la mitad.
- Antes del análisis utilizando la pantalla SÍ, reducir el extracto hasta sequedad incipiente usando nitrógeno y reconstituir con 500-1.000 l de etanol. Sellar las tapas de los frascos de la muestra para evitar la evaporación y mantener a 4 ° C (en contra explosionesrefrigerador).
2. Análisis Químico El uso de LCMS / MS
- Optimizar las condiciones de funcionamiento del sistema de LCMS / MS utilizando las instrucciones del fabricante.
- Analizar las soluciones de calibración estándar, los extractos de la muestra, muestras de control en blanco y analítico de la calidad (AQC) usando la cromatografía de líquidos y condiciones de espectrometría de masas, y controlar las transiciones de iones como se detalla en la Tabla 2. Determinar la concentración de estrógenos esteroides en el extracto de la muestra usando interna 10 estándares.
| CLEM | |||||
| Cromatografía líquida | |||||
| Columna: | C18 (2), 150 x 4,6 mm, 5 micras. | ||||
| Volumen de inyección: | 20 l | ||||
| Fluir: | 0,5 ml por minuto. | ||||
| METROfase óvil: | Un disolvente: agua que contiene 0,1% de amoníaco. | ||||
| Disolvente B: acetonitrilo. | |||||
| programa de gradiente: | |||||
| Tiempo (min) | 0 | 10 | 18 | 24 | 28 |
| A: relación de disolvente B | 90:10:00 | 50:50:00 | 0.479167 | 0.479167 | 90:10:00 |
| Espectrometría de masas | |||||
| Fuente: | Electronebulización (ion negativo) | ||||
| Gas y fuente: | CUR: 20 psi, GS1: 70 psi, GS2: 30 psi | ||||
| TEM: 600 ° C, gas CAD 5 y IonSpray tensión -900 | |||||
| transiciones MRM: | |||||
| E1: | 269/145 y 269/143 | ||||
| E2: | 271/145 y 271/143 | ||||
| EE2: | 295/145 y 295/143 | ||||
| E1-D4: | 273/147 | ||||
| E2-D4: | 275/147 | ||||
| EE2-D4: | 299/145 | ||||
Tabla 2. Detalles de los parámetros y condiciones del análisis de LCMS / MS de los estrógenos esteroides en extractos de aguas residuales. Tabla da el volumen de inyección de muestra y el caudal, las condiciones de fase móvil unand gradiente.
3. Uso de actividad estrogénica in vitro evaluación de la levadura de estrógeno (SI) Ensayo 8
- Preparar y almacenar componentes mínimos medianas y medianas según la Tabla 3 (a) a (g).
| (a) medio mínimo (pH 7,1): |
| Preparar un 2 Fe (SO 4) 3 solución mediante la adición de 40 mg de Fe 2 (SO 4) 3 a 50 ml de agua doblemente destilada (ddH2O) |
| Añadir 1 l de ddH2O a un vaso de precipitados de vidrio de 2 L |
| Añadir los siguientes componentes al vaso de precipitados: |
| 13,61 g de KH 2 PO 4 |
| 1,98 g de (NH4) 2 SO4 |
| 4,2 g de KOH |
| 0,2 g MgSO 4 |
| 1 ml de la 2 Fe (SO 4) 3 solución |
| 50 mg L-leucina |
| 50 mg L-histidina |
| 50 mg de adenina |
| 20 mg L-arginina-HCl |
| 20 mg L-metionina |
| 30 mg L-tirosina |
| 30 mg L-isoleucina |
| 30 mg L-lisina-HCl |
| 25 mg L-fenilalanina |
| 100 mg de ácido L-glutámico |
| 150 mg L-valina |
| 375 mg L-serina |
| Poner el vaso de precipitados sobre un agitador climatizada con una pulga magnética y se agita hasta que se disuelve todo |
| Comprobar que el pH es de 7.1 y ajustar si es necesario |
| Usando una jeringa estéril de 50 ml dispensar alícuotas de 45 ml en frascos de vidrio con tapa de rosca de metal superiores |
| Esterilizar el medio mínimo a 121 ° C durante 10 min en un autoclave |
| Almacenar a temperatura ambiente |
| (b) D - (+) - glucosa: |
| Preparar una solución de 20% w / v en ddH 2 O |
| Dispensar alícuotas de 20 ml a viales de vidrio con tapa de rosca de metal superiores |
| Esterilizar la solución de glucosa a 121 ° C durante 10 min en un autoclave |
| Almacenar a temperatura ambiente |
| (c) ácido L-aspártico: |
| Hacer una solución madre de 4 mg / ml en ddH2O |
| Dispensar alícuotas de 20 ml a viales de vidrio con tapa de rosca de metal superiores |
| Esterilizar la solución ácido L-aspártico en 121 ° C durante 10 min en un autoclave |
| Almacenar a temperatura ambiente |
| (d) La vitamina Solución: |
| Preparar una solución de biotina mediante la adición de 2 mg de biotina a 100 ml de ddH 2 O |
| Pesar 8 mg de tiamina, piridoxina 8 mg, 8 mg de ácido pantoténico, 40 mg de inositol. Añadir todos los componentes secos y 20 ml de la solución de biotina a 180 ml de ddH2O |
| Hacer alícuotas de 10 ml estériles mediante la filtración a través de un tamaño de poro de filtro desechable 0,2-m en botellas de vidrio estériles, en una cabina de flujo de aire laminar |
| Almacenar a 4 ° C |
| (e) L-Treonina: |
| Preparar 100 ml de 24 mg / ml de L-treonina en ddH2O |
| Dispensar alícuotas de 10 ml a viales de vidrio con tapa de rosca de metal superiores |
| Esterilizar la solución de L-treonina en 121 ° C durante 10 min en un autoclave |
| Almacenar a temperatura ambiente |
| (f) de cobre (II) Sulfato: |
| Preparar 25 ml de una (II) de solución de sulfato de cobre 20 mM en ddH 2 O |
| Hacer alícuotas de 5 ml estériles por filtración a través de un filtro de tamaño de poro 0,2-m en botellas de vidrio estériles, en una cabina de flujo laminar |
| Almacenar a temperatura ambiente |
| (g) rojo de clorofenol-β-D-galactopiranósido (CPRG): |
| Preparar 25 ml de una solución de 10 mg / ml de CPRG en ddH 2 O |
| Hacer alícuotas de 5 ml estériles por filtración a través de un filtro de tamaño de poro 0,2-m en botellas de vidrio estériles, en una cabina de flujo laminar |
| Almacenar a 4 ° C |
Tabla ensayo Screen estrógeno 3. Levadura; preparación y almacenamiento de los componentes mínimos medianas y medianas.
- Preparación y Storage de cultivo de levadura concentrada 10x
- El día 1, preparar el medio de crecimiento (como se detalla en el punto 3.4.1) y se vierte en un matraz cónico estéril. Añadir 125 l de 10x concentrado a partir de levadura vial criogénico almacenado a -20 ° C. Incubar los medios inoculados a 28 ° C durante aproximadamente 24 h en un agitador orbital.
- En el día 2, hacer dos botellas de medio de crecimiento (~ 50 ml) y se vierte en matraces cónicos estériles separadas. Añadir 1 ml de 24-hr levaduras cultivadas en cada frasco de medio de crecimiento. Incubar los medios inoculados a 28 ° C durante aproximadamente 24 h en un agitador orbital.
- En el día 3, se vierte cada cultivo de 24 horas en un tubo de centrífuga de 50 ml estéril. Centrifugar los tubos de 50 ml a 4 ° C durante 10 minutos a 2000 x g. Verter el sobrenadante y volver a suspender cada sedimento en 5 ml de medio mínimo con 15% de glicerol. Hacer alícuotas de 0,5 ml del cultivo de levadura concentrado 10x en crioviales estériles y tienda de 1,2 ml a -20 ° C durante un máximo de 4 meses.
- AEELas acciones químicas de racionamiento y almacenamiento de las curvas de calibración para
- Enjuague toda la cristalería y espátulas dos veces con etanol absoluto y dejar secar antes de su uso para eliminar cualquier resto de contaminantes.
- Pesar E2 directamente en un vial de vidrio en un armario de pesaje de polvo y ajustar la concentración en volumen en etanol absoluto. Diluir a una concentración de 2x10 -7 M (54,48 g / L). Junta de la tapa y se almacena a 4 ° C (en un refrigerador libre de chispas).
- ensayo productor
- En el día 0, preparar un medio de crecimiento. Para la botella de 45 ml de medio mínimo añadir 5 ml de solución de glucosa, solución de ácido L-aspártico 1,25 ml, 0,5 ml de solución de vitaminas, 0,4 ml de solución de L-treonina, y solución de sulfato de cobre 125 l (II). Verter medio de cultivo en un matraz cónico estéril.
- Añadir 125 l de caldo concentrado 10x (descongelado de almacenamiento -20 ° C) al matraz e incubar el medio inoculado a 28 ° C durante aproximadamente 24 horas en un agitador orbital.
- El día 1, etiquetar un 96 pocillos 'placa de dilución' estéril y realizar diluciones seriadas (100 volúmenes l en etanol) de E2 curva estándar y química (s) prueba / extracto de efluentes (s) (por ejemplo, EE2).
- Etiqueta pocillos 96 'placa de ensayo (s)' estéril ópticamente microtitulación de fondo plano. En cada placa incluir espacios en blanco (más / menos disolvente) y una curva estándar E2, además de filas de producto químico (s) de prueba / extracto (s) del efluente.
- Pipeta de 10 l de cada concentración (E2, químicas o extracto) en el pocillo correspondiente de la placa de ensayo. Pipeta de 10 l de etanol en cada pozo 'blanco de disolvente' de la placa de ensayo. Deja placa de ensayo con la tapa de evaporar a sequedad.
- Hacer una botella de medio de crecimiento (~ 50 ml) y añadir 0,5 ml de solución de rojo de clorofenol-β-D-galactopiranósido (CPRG) por botella. Determinar la densidad de células de levadura en el cultivo de 24 hr mediante la medición de la turbidez del cultivo a 620 nm en un lector de placas. Inocular el de unamedio ssay con 4x10 células de levadura 7 del cultivo de 24 horas.
- Verter medio de ensayo se inocularon en una cubeta estéril. Usando una pipeta multicanal añadir 200 l de medio de ensayo inoculado a cada pocillo de la placa de ensayo de 96 pocillos.
- Ponga la tapa en la placa de ensayo de 96 pocillos y sellar los bordes con cinta adhesiva. Agitar la placa (s) de ensayo vigorosamente durante 2 min en un agitador de placas de titulación y se incuba a 32 ° C en un armario de calefacción con ventilación natural.
- El día 2, agitar la placa (s) de ensayo vigorosamente en un agitador de placas de titulación durante 2 min. Regreso a 32 ° C incubadora.
- En el día 4, agitar la placa (s) de ensayo vigorosamente durante 2 minutos en un agitador de placas de titulación. Deja la placa (s) en reposo durante aproximadamente 1 hr luego leer la placa (s) de ensayo a una absorbancia de 540 nm (absorbancia óptima para CPRG ~ 575 nm) y 620 nm (para la turbidez) utilizando un lector de placas. Deja placa (s) a temperatura ambiente y leer más tarde si es necesario.
- En el día 0, preparar un medio de crecimiento. Para la botella de 45 ml de medio mínimo añadir 5 ml de solución de glucosa, solución de ácido L-aspártico 1,25 ml, 0,5 ml de solución de vitaminas, 0,4 ml de solución de L-treonina, y solución de sulfato de cobre 125 l (II). Verter medio de cultivo en un matraz cónico estéril.
- cálculos de actividad estrogénica
- lecturas correctas de ensayo para turbidez usando la siguiente ecuación: corregido = valor de la muestra o estándar (E2) de la absorbancia a 540 nm - [muestra o estándar de absorbancia (E2) a 620 nm - absorbancia en blanco a 620 nm]. Parcela E2 curva estándar con espacios apropiados (para comprobar la contaminación) 8.
- Utilice la muestra corregida (extracto o química) para calcular los equivalentes de estradiol ''. Utilice los valores de la curva estándar E2 trazados y ecuación de regresión (3 parámetros o polinomio lineal en función de ajuste) para interpolar la muestra / extraer valores de absorbancia a valores equivalentes E2. Uso factor de concentración (es decir, agua extraída y el volumen de etanol, el extracto se resuspendió en) para calcular la actividad estrogénica en la muestra pre-extraído.
4. Evaluación Basada en el Laboratorio de actividad estrogénica in vivo Utilizando Vitellogenin inducción en Male Fathead peces pequeños
- Utilice Pimephales masculinos (PimephalesPimephales)> 4 meses de edad, que exhiben características sexuales secundarias (es decir, el desarrollo de tubérculos nupciales y un fatpad dorsal) indicativo de la determinación sexual masculina.
- Para prevenir la actividad de desove, los machos maduros separada tres semanas (± 3 días) antes de la iniciación de la prueba. Configurar al menos dos acuarios de vidrio de 45 L con una carga máxima de 3 g / l. Para garantizar un número suficiente de peces sanos para la prueba, utilice un mínimo de 100 hombres.
- Mantener a los peces macho en condiciones ambientales idénticas, como se experimentó en la prueba (es decir, la temperatura del agua de 25 ± 1 ° C y de 16: 8 h luz: oscuridad fotoperíodo). Mantener el caudal de agua de dilución para cada tanque para asegurar un tiempo de reemplazo 95% de al menos cada 6 a 8 horas, es decir, 330 ml / min para un tanque de 45 l.
- aparatos de ensayo y diseño experimental
- Utilizar tanques de cristal grandes para acomodar una carga de hasta 3 g de pescado por litro de water. Por 8 machos adultos (nominalmente 4,5 g cada una), use un tanque de 10-20 L.
- Utilizar dos recipientes en paralelo para cada tratamiento y proteger a cada tanque de cualquier alteración visual innecesarias (es decir, utilizar pantallas de tarjetas laminadas entre los tanques). Identificar cada tanque con un número de estudio, una concentración de exposición y un número de identificación del buque.
- Para los estudios de efluentes de aguas residuales
- A la llegada, traslado inmediato de los efluentes en un tanque de almacenamiento a 10 ± 1 ° C. Iniciar la dosificación de efluentes dentro de dos horas de la recepción de los efluentes.
- Alimentar el efluente, a través de la bomba peristáltica, desde el tanque de almacenamiento de C 10 ° a un recipiente de aclimatación. Calentar el efluente en el recipiente de aclimatación a 18 ± 2 ° C. Bombear el efluente caliente del recipiente de aclimatación a los recipientes de mezcla / de dosificación y luego a los acuarios de ensayo (que contiene el pescado). Calentar los acuarios a una temperatura de 25 ± 1 ° C.
- Para los estudios de dosificación de productos químicos
- Pesar sustancias químicas de prueba en un armario con un peso de polvo. Preparar acciones químicas concentradas en ddH 2 O preferiblemente sin el uso de disolventes.
Nota: Si se requieren disolventes para solubilizar los compuestos de ensayo, utilizar controles de disolvente, además del control de agua de dilución. - alimentación por gravedad o bomba de agua de dilución a partir de un depósito de compensación de temperatura controlada a través del dispositivo (s) de control de flujo de dosificación / recipiente de mezcla. Bomba concentró química de la (s) usando un sistema de bombeo peristáltico a la dosificación / recipientes de mezcla. Controlar la velocidad de la bomba (de química de valores) y el caudal de agua (agua de dilución) para conseguir la concentración de exposición deseado.
Nota: Use un tubo de silicona para alimentar química del agua / prueba para cada recipiente de ensayo de la dosificación / recipiente de mezcla. Utilice una velocidad de flujo que es suficiente para proporcionar un reemplazo recipiente de 75% en al menos 24 horas, es decir, 20 ml / min para un tanque de 20 l. Mantener la velocidad de flujo a ± 10% del valor nominal especificado.
- Pesar sustancias químicas de prueba en un armario con un peso de polvo. Preparar acciones químicas concentradas en ddH 2 O preferiblemente sin el uso de disolventes.
- Mantener la exposición de temperatura del agua del tanque a 25 ± 1 ° C, el oxígeno disuelto por encima del 70% del valor de saturación del aire (5.8 mg L -1 a 25 ° C) y ± 0,5 unidades de pH (a partir de pH entre 6,5 y 8,5) a lo largo del estudio. Establecer las condiciones de iluminación al fotoperíodo de 16 h de luz: 8 h de oscuridad, con períodos de transición / oscuridad del amanecer de 20 min.
- Alimentar a los peces dos veces al día con el recién descongelado artemia adulta congelada (Artemia) a 2,5 (± 0,1) g por depósito de cada juego. También alimentar a los peces una vez al día con una cantidad pequeña (dos pizca dedo) de un alimento para peces en escamas tropical. Deja un mínimo de 3 horas entre cada toma.
- Mantenga un registro diario de alimentación para controlar la respuesta de alimentación / comportamiento (bueno, regular o mala, en comparación con los controles). Sifón de los tanques al menos dos veces por semana (preferiblemente todos los días) para eliminar cualquier alimento no consumido y heces. Limpiar los lados y el fondo de los recipientes de ensayo al menos una vez por semana.
- Tomar la muestra de agua semanals de cada tanque para confirmar la actividad estrogénica (a través de la pantalla de levadura) y la composición química (a través de la química analítica). Ver secciones 1-3 para los detalles de muestreo de agua, extracción y análisis.
Nota: Para cada experimento, utilizar el control de la dilución en agua (control negativo), control positivo (E2 o EE2), además de al menos tres diluciones de efluente (100, 50 y 25%) o sustancia de ensayo para monitorizar la respuesta de la dosis. Si se prueban nuevas tecnologías, el uso de compuesto / efluente con o sin tratamiento (por ejemplo, EE2 sin tratamiento, con EE2 TAML / peróxido de hidrógeno (H 2 O 2) tratamiento de 12; Figura 1).
- Utilizar tanques de cristal grandes para acomodar una carga de hasta 3 g de pescado por litro de water. Por 8 machos adultos (nominalmente 4,5 g cada una), use un tanque de 10-20 L.
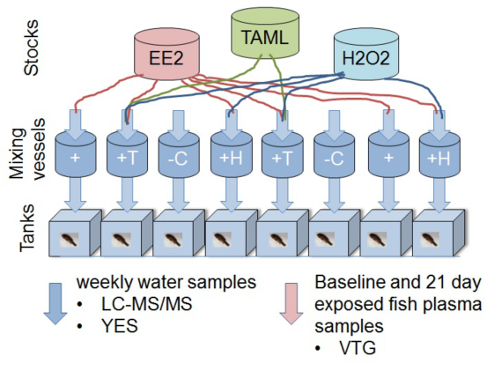
Figura 1. Esquema que representa el diseño experimental de un bioensayo in vivo Piscardo vitelogenina para determinar la eliminación de la ecotoxicidad de 17α-etinilestradiol mediante el tratamiento del agua TAML / peróxido. La experimental configurar consta de ocho acuarios de vidrio 11 l cada uno alimentado con flujo continuo de agua. soluciones químicas de valores individuales y agua (filtrada sin cloro) se entregan a las cámaras de mezcla. Las concentraciones nominales (sin reacción) en los recipientes de mezcla están a 2 ng / L EE2, 80 nM TAML y 0,16 mg / LH 2 O 2. Soluciones de productos químicos Stock (EE2, H 2 O 2 y TAML) se preparan y se dosifican por separado para que las reacciones comienzan en los recipientes de mezcla. Fish (8 Pimephales macho por tanque) están expuestos a la mezcla (s) después de un tiempo de contacto de reacción de aproximadamente 45 minutos. Las muestras de agua se han tomado de los tanques de exposición semanal. Las muestras de plasma se toman de Pimephales para medir la vitelogenina biomarcador estrogénica (VTG) de un grupo de referencia, en el inicio del estudio, y todos los demás peces después de 21 días de exposición. Los tratamientos específicos son: '-C'; control negativo (agua de dilución única), '+'; control positivo de EE2,'H +'; EE2 además de H 2 O 2, '+ T'; EE2 además de H 2 O 2 más TAML. Esta cifra ha sido modificado de Mills et al. 2015 12. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Procedimiento de prueba
- período de aclimatación
- Medir el peso húmedo (g) de cada pez macho sexualmente maduros, y asignar al azar a cada tanque (8 hombres por tanque).
- Mantener a los peces sin asignar del mismo lote y mantenerlas en las mismas condiciones de ensayo. Utilizar estos peces para sustituir alguna de las personas que muestran signos de daño físico o la falta de condiciones durante el período de aclimatación de 7 días. Asegurar al final del periodo de aclimatación de cada tanque de tratamiento tiene 8 machos que han completamente aclimatados a las condiciones de prueba.
- Tomar muestras de plasma "línea base" de un niño de 8 machos adicionales de la misma batch de pez macho. Siga el método de muestreo de sangre en la sección 4.4 y el método de análisis de vitelogenina (VTG) en 4.5.
- Después del período de aclimatación, entregar las existencias de dosificación de efluentes o químicos para los tanques de exposición durante 21 días como se describe en 4.2.2 ó 4.2.3. mortalidad monitor, el comportamiento y la apariencia física de los peces en cada tanque se replican diariamente antes de la primera alimentación del día. Grabar cualquier comportamiento anormal o incidentes.
Nota: Asegúrese de condiciones ambientales y de las tasas de alimentación a mantener la salud de los peces (secciones 4.2.4 y 4.2.5).
- período de aclimatación
- El muestreo pescado después de período de exposición de 21 días
- 12 horas antes de la toma de muestras, deja de comer a los peces.
- Marcar tubos de microcentrífuga para la recogida de muestras de sangre, se suman ~ 5 l de aprotinina (un inhibidor de la proteasa) y los colocan en hielo.
- Hacer una solución de 500 mg / L de MS222 (anestésico) mediante la disolución de 500 mg de MS222 por 1 L de agua de-clorado (aclimatados previamentea 25 ± 1 ° C). Neutralizar la MS222 a pH 7,4 ± 0,4 utilizando NaOH 1 M.
- Mover cada pez del tanque en el MS222 tamponada. Mantener en la solución hasta el cese de todo movimiento opérculo (típicamente 5 ± 1 min).
- Medir y registrar la longitud tenedor (mm) bajo la anestesia terminal. Utilizar un bisturí desechable para amputar la cola, y el uso de un tubo de hematocrito heparinizada para recoger la sangre de la arteria caudal (Figura 2). dispensar con cuidado la sangre en el tubo de microcentrífuga de pre-marcado y mantener en hielo.
- Matar a los peces inmediatamente después de la extracción de sangre. Confirmar la muerte por el cese permanente de la circulación y / o la destrucción del cerebro. Medir y registrar el peso total de peces (más cercana a 0,01 g), y la disección de tejidos según se requiera.
- Centrifugar la sangre (7000 xg durante 5 min a 4 ° C) dentro de 2 horas de la recogida. Transferir el sobrenadante de plasma con una pipeta en la nueva bañera de microcentrífuga de 0,4 ml etiquetadoES y almacenar en hielo. Congelar los tubos que contienen el plasma en hielo seco a los 30 minutos de centrifugación y se almacena a -80 ° C antes del análisis de las concentraciones plasmáticas VTG.

Figura 2. Las fotos que muestran pez pequeño macho de cabeza gorda (Pimephales promelas), recogida de plasma y la ubicación de los testículos. Al final de la exposición de 21 días todos los peces deben ser eliminados para recoger muestras de sangre. Una vez bajo esta longitud terminal de anestesia peces (longitud tenedor, mm) se debe medir, rápidamente seguido por la recogida de sangre de la arteria caudal Photo-A:. Roja línea de puntos indica la ubicación de la amputación de la cola (un bisturí desechable debe utilizarse para amputar la cola ). Foto-B muestra un tubo de hematocrito heparinizada utilizado para recoger la sangre. Cada producto debería ser sacrificado inmediatamente después de su muestra de sangre se ha tomado, en este caso, toda la cabezaha sido separada del cuerpo (Foto-C). Una vez que el pescado se ha matado a la cavidad del cuerpo se puede abrir para revelar los órganos internos. Foto-C muestra la localización de los testículos (gónadas) en relación con la vejiga natatoria (SB) de los peces ciprínidos, por ejemplo, el piscardo, gobio, la carpa, etc. Por favor haga clic aquí para ver una versión más grande de esta figura.
- Medir las concentraciones plasmáticas VTG con un kit homóloga VTG ligado a enzimas (ELISA) diseñado específicamente para Pimephales.
- Preparar estándares y tampones VTG como se describe en el protocolo del fabricante. Diluir la muestra de plasma 1:50, 1: 5000, y 1: 500 000 y el ensayo en duplicado para obtener lecturas dentro del rango de la curva estándar VTG según las instrucciones del fabricante. Siga las instrucciones del fabricante para calcular las concentraciones de vitelogenina.
5. Las evaluaciones de campo de avanzada / Novel Tratamiento de Aguas Residuales de tecnologías para mitigar actividad estrogénica in vivo Utilizando Vitellogenin e Intersex inducción en Roach (Rutilus rutilus)
- Captura de cucarachas salvajes que viven aguas abajo de emisarios depuradora de aguas residuales
Nota: El uso de cucarachas (Rutilus rutilus) u otras especies abundantes de agua dulce o salobre peces, que son gonocórico y se sabe que son sensibles a las alteraciones endocrinas estrogénica.- La captura de peces mediante pesca eléctrica, redes, trampas o otros métodos de pesca reconocidos en función de la situación 13. El transporte de los peces en tanques aireados volver al laboratorio para el muestreo.
- Preparar tubos de microcentrífuga como se detalla en 4.4.2. Prepárese tamponada MS222 como se describe en 4.4.3. Anestesiar a los peces como se detalla en 4.4.4.
- Medir la longitud del pez y el peso bajo anestesia terminal.
- Recoger la sangre de la arteria caudal utilizando dispojeringa heparinizada sable. Matar a cada pez inmediatamente después de la recogida de muestras de sangre. dispensar cuidado la sangre en tubos de microcentrífuga de pre-etiquetados y mantener en hielo. Preparar el plasma como se describe en el paso 4.4.7 y medir VTG por ELISA (4.5).
- El uso de pinzas eliminan 2-3 escamas de pescado en todas las capturas y colocan en pequeños sobres etiquetados individualmente. Guarde los sobres a temperatura ambiente en un lugar seco para la determinación de edad más avanzada pescado y análisis de crecimiento.
- cavidad del cuerpo abierto con un bisturí para revelar los órganos internos. Sacar la tripa para revelar la vejiga natatoria con una gónada se encuentra en ambos lados (Figura 2). Retirar con cuidado las gónadas emparejados con unas pinzas de nariz fina y el lugar en un vial de vidrio. Cubrir las gónadas con fijador de Bouin en una proporción de 1:10 tejido: fijador.
- Deje el tejido en Bouin de por 6-24 hr, dependiendo del tamaño del tejido (fijador penetra en 1 mm por hora). Una vez fijado, verter un líquido fijador de Bouin lad Cuelgue con un 70% de alcoholes metilados industriales (IMS). Almacenar el tejido fijado a temperatura ambiente hasta que se procesen los tejidos para histopatología (sección 5.3).
- El campo de la evaluación basada en la actividad estrogénica in vivo usando vitelogenina e intersexuales en la inducción de cucarachas
- Diseño experimental y configurar
Nota: Configurar los tanques y planta piloto con suficiente antelación a la puesta en marcha el trabajo en vivo. Iniciar los tanques que fluyen 3-4 semanas antes de cualquier adición de pescado para el sistema. Monitorear las tasas de flujo de agua, la calidad y las condiciones (pH, temperatura, oxígeno disuelto, etc.) regularmente para asegurarse de parámetros del agua se puede mantener.- La construcción de grandes tanques de agua del grifo (por ejemplo, 300-1.000 L) en el sitio en la planta piloto, que puede recibir el "control" de-clorada, efluente tratado norma (s) y avanzado de efluentes (s) tratados en paralelo. Coloque la bomba de aire / aireadores a los tanques. caudales de agua establecida para conseguir al menos 6 tanque de vintercambios olumen por día.
Nota: Asegúrese de que los tanques están bien aisladas y se encuentran sombreados para evitar fluctuaciones excesivas de temperatura diarias. Tanques de diseño para permitir la observación de los peces, por alteraciones del comportamiento (falta de alimentación, etc.), signos de la enfermedad y la mortalidad.
- La construcción de grandes tanques de agua del grifo (por ejemplo, 300-1.000 L) en el sitio en la planta piloto, que puede recibir el "control" de-clorada, efluente tratado norma (s) y avanzado de efluentes (s) tratados en paralelo. Coloque la bomba de aire / aireadores a los tanques. caudales de agua establecida para conseguir al menos 6 tanque de vintercambios olumen por día.
- Iniciar la exposición al flotar las bolsas de cucaracha (de la piscifactoría) en los tanques respectivos durante 1 hora. Añadir agua del tanque a las bolsas gradualmente hasta que la temperatura del agua y las condiciones del ambiente. Liberar el pescado en sus tanques.
- Alimentar cucaracha adulta diaria de alimento para peces en pellets (tamaño 0,5-0,8). Alimentar cucaracha juvenil diariamente en pequeños gránulos (teniendo tamaños de gránulos 100-300) no estrogénico 14 de alimentación ad libitum, ajustado sobre la base de los alimentos no consumidos. Mantenga un registro de alimentación respuesta de alimentación documentación / comportamiento diario (bueno, regular o mala, en comparación con los controles).
- Tomar muestras de agua semanales de cada tanque para confirmar la actividad estrogénica y composición química. Sesecciones e 1-3 para los detalles de los métodos de muestreo y análisis del agua.
- Diseño experimental y configurar
- La histopatología de los peces gónadas 15
- Retirar con cuidado las gónadas disecados y fijados (que se describen en los pasos 5.1.6 y 5.1.7) desde el contenedor con unas pinzas y colocar en una tabla de cortar.
- Utilice una hoja de micrótomo para cortar cada gónada en 3 partes (anterior, medio y posterior) y desde cada parte cortó una sección transversal de espesor de 3-5 mm. Con cuidado, coloque los seis pedazos en un casete de biopsia de plástico etiquetada, y ponerlo en un procesador de tejidos utilizando los tiempos listados en la Tabla 4.
- tejidos incrustar cera y la sección de micrótomo rotatorio (3-5 micras). secciones de transferencia a portaobjetos de vidrio recubierto bio-adhesivo de la etiqueta y colocar los portaobjetos en una placa calentada (fijado en 45 ° C) se sequen durante 24 horas.
- Tinción de las diapositivas, ya sea manualmente o usando una tinción automatizado, usando los intervalos detallados en la Tabla 5. Coloque una gota de agente de montaje sobre el tejido manchado, y lay un vidrio cubreobjetos sobre el agente de montaje para proteger el tejido.
- En primer lugar, examinar cada diapositiva a bajo aumento (20X, es decir, con objetivo 2X, con líneas 10X del ojo de aumento) para determinar el sexo y el número de puntos de anexos a la cavidad del cuerpo 15. Tenga en cuenta cualquier anormalidad para cada pez.
- En un mayor aumento (100X o 400X), examinar el tejido para evaluar etapas gametogénesis, anormalidades y la presencia de ovocitos en el tejido testicular. Registrar la gravedad de la intersexualidad utilizando el siguiente sistema de calificación que va de 0 (el tejido normal de sexo masculino) a (tejido ovárico 100%) 7 6 (véase la Tabla 6).
| Número paso | Tratamiento | Propósito | Tiempo (h) |
| 1 | 70% IMS | Deshidración | 3 |
| 2 | 90% IMS | Deshidración | 2.5 |
| 3 | 95% IMS | Deshidración | 1.5 |
| 4 | 100% IMS | Deshidración | 1.5 |
| 5 | 100% IMS | Deshidración | 1.5 |
| 6 | 100% IMS | Deshidración | 1.5 |
| 7 | 100% IMS | Deshidración | 1.5 |
| 8 | cámara de compensación Histología | Claro | 1.5 |
| 9 | cámara de compensación Histología | Claro | 1.5 |
| 10 | cámara de compensación Histología | Claro | 1.5 |
| 11 | CERA | la infiltración de cera | 1.25 |
| 12 | CERA | la infiltración de cera | 1.25 |
| Total 20 hr |
Tabla 4. Régimen de procesamiento para la cera de impregnación de los tejidos para histopatología. Los tejidos deben ser procesadas en un procesador automático de tejidos. Los tejidos deben ser sumergidas en las soluciones detalladas para el período de tiempo especificado.
| Manchar no. | Manchar | Propósito | Tiempo (min) |
| 1 | agente de Histología de Compensación | Se disuelve la cera | 15 |
| 2 | 100% IMS | Hidratación | 2 |
| 3 | 90% IMS | Hidratación | 2 |
| 4 | 70% IMS | Hidratación | 2 |
| 5 | Agua del grifo (en ejecución) | Enjuague | 2 |
| 6 | hematoxilina | núcleos de las células manchas azules | 10 |
| 7 | Agua del grifo (en ejecución) | eliminar el exceso de | 10 |
| 8 | acidificada IMS | decloración | 20 sec |
| 9 | Agua del grifo (en ejecución) | Enjuague | 20 sec |
| 10 | Lico 3 | sal | 20 sec |
| 11 | Agua del grifo (en ejecución) | Enjuague | 20 sec |
| 12 | 1% eosina (acuoso) | Las manchas de color rosa citoplasma | 20 sec |
| 13 | Agua del grifo (en ejecución) | eliminar el exceso de | 5 |
| 14 | 70% IMS | Deshidración | 2 |
| 15 | 90% IMS | Deshidración | 2 |
| dieciséis | 100% IMS | Deshidración | 5 |
| 17 | agente de Histología de Compensación | Eliminar IMS, el agente de unión | 5 |
Tabla 5. Soluciones y tiempos de inmersión para la tinción HE, de los tejidos gonadales pescado (H & E). Los portaobjetos se debe colocar en cada baño para el allocated vez en secuencia. Se requiere H & E tinción de los tejidos para determinar los impactos del desarrollo o de la organización de efluentes de aguas residuales estrogénicos sobre las gónadas de peces.
| Puntuación | sección Descripción |
| 0 | testículos masculinos normales |
| 1 | Multifocal ovotestis con 1-5 ovocitos (por lo general por separado) dispersos en el tejido testicular |
| 2 | ovotestis multifocal, 6-20 ovocitos menudo en pequeños grupos dispersos entre el tejido testicular |
| 3 | ovotestis multifocal, 21-50 ovocitos en racimos |
| 4 | > 50 y <100 ovocitos. Sección suele ser multifocal y tiene el aspecto de un mosaico de pruebatejido icular y de ovario. |
| 5 | > 100 ovocitos, por lo general multifocal pero también podría ser focal con zonas claramente identificables de tejido ovárico y testicular separado del tejido testicular. |
| 6 | > 50 por ciento del tejido gonadal en la sección es de ovario y está claramente separada del tejido testicular de células epiteliales y tejidos fagocíticas. |
| 7 | 100 por ciento de tejido gonadal en la sección es de ovario. |
Tabla 6. El sistema de puntuación para evaluar la gravedad de la afección intersexual en la cucaracha. Histológicamente muestras preparadas de tejido gonadal deben ser examinados bajo microscopio de luz, a 20X, 100X y 400X de ampliación, para evaluar cualquier anomalía y la presencia de ovocitos en el tejido testicular. Esta tabla se modificó a partir de Jobling et al. 2006 6.
Resultados
Los intentos de comprender el impacto de las mejoras a los procesos de tratamiento de aguas residuales o para determinar la tecnología más adecuada para equipar a los equipos como tratamiento terciario de la EDAR existente con respecto a la eficacia de la eliminación de los perturbadores endocrinos de los efluentes vertidos, requiere no sólo la medición del químico clave componentes que entran en las obras, sino que requiere el análisis de los productos de degradación que pueden tener también actividad como perturbadores endocrinos. En los efluentes de aguas residuales domésticas, las sustancias más estrogénicas presentes son las hormonas esteroides, estrona (E1), 17β-estradiol (E2) y 17α-etinilestradiol (EE2) 5,8. Estrógenos esteroides se excretan principalmente del cuerpo como una mezcla de conjugados inactivos 16,17. Estos estrógenos conjugados se deconjugated sustancialmente en el sistema de alcantarillado por la actividad bacteriana y una mayor degradación se produce en la EDAR. Los esteroides deconjugated are retirado de la corriente de aguas residuales por adsorción al lodo o biodegrada durante el tratamiento secundario que resulta en la formación, en primer lugar de los subproductos de transformación y en última instancia la mineralización completa puede ocurrir del componente activo inicial. El análisis químico de todos los compuestos individuales en la corriente de efluente sería difícil, lento y costoso y no cubriría componentes activos desconocidos presentes en una muestra. Además, una suma de la contribución de cada componente estrogénico sólo proporcionará una indicación de la potencia estrogénica acumulativo de una muestra de los compuestos analizados. Este es un riesgo en los procesos de transformación generan sustancias estrogénicas desconocidas o las que el afluente es de origen industrial. La combinación de análisis químico con in vivo y en bioensayos in vitro ecotoxicología proporciona una solución a la presencia de componentes estrogénicos desconocidos en mezclas tales como las aguas residuales tratadas. Ensayos in vitro tales como la levadura de estrógeno Screen (SI) se han utilizado ampliamente para determinar la actividad estrogénica de los efluentes de aguas residuales y para ayudar a identificar los componentes activos en las muestras tratadas 8,18,19. Sin embargo, las comparaciones entre in vivo e in vitro, las pruebas pueden ser significativos 11 y una evaluación exhaustiva de nuevos procesos con respecto al tratamiento de las enfermedades endocrinas potencia interrumpir requiere una batería de pruebas químicas y ecotoxicología.
Una determinación de si las plantas o los procesos de tratamiento individuales eliminar los compuestos activos de la corriente de aguas residuales se puede lograr utilizando el análisis químico que sigue extracción de la muestra, la concentración y la limpieza del extracto antes del análisis, lo más a menudo llevado a cabo usando LCMS (/ MS) o GCMS (/ MS) métodos. Los datos obtenidos de los análisis químicos se pueden utilizar para determinar el cumplimiento de individuo concentraciones previstas sin efecto (PNEC) 20 o norma de calidad medioambientals (NCA) de 21 compuestos individuales específicos y por lo tanto tales métodos son vitales para los datos de cumplimiento normativo. Además, dirigidos o métodos que no son objeto de análisis químicos permiten la identificación y cuantificación de compuestos o isómeros individuales en comparación con los métodos biológicos, que proporcionan una respuesta total. Por lo tanto, los métodos de análisis químicos permiten que se hizo la evaluación de compuestos discretos para cumplir y hacer frente a estos retos tratamiento de aguas residuales en una base de plantas de tratamiento individual. Los estudios han demostrado que el tratamiento convencional de aguas residuales (por ejemplo, plantas de lodo activado) puede ser muy eficaz en la eliminación de las hormonas esteroides naturales aunque la eliminación de la hormona sintética EE2 tiende a ser menos eficaz. Los estudios de campo utilizando técnicas de tratamiento avanzado como el ozono utilizando, carbono activado granulado (GAC) y las membranas han demostrado, aunque a un alto costo, que se pueden utilizar como una solución de fin de tubería para eliminar EE2 por debajo de predigido niveles de efecto y por debajo de los límites de detección. La Figura 3 muestra la eliminación de EE2 utilizando GAC en una planta de tratamiento de aguas residuales a escala piloto. Según estudios realizados a escala piloto en las plantas de tratamiento de aguas residuales municipales utilizando el extremo del tubo de tratamiento GAC también muestran la reducción de la potencia estrogénica siguiente GAC midió utilizando la evaluación de la levadura de estrógeno (SI) como se ve en la figura 4.
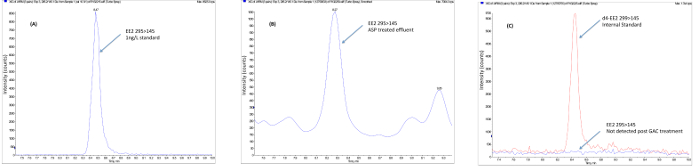
Figura 3. Ejemplo de datos de campo que muestran la eliminación de etinilestradiol después del tratamiento terciario avanzado. Las muestras (A) se recogen de la EDAR tras el tratamiento convencional (Planta de lodos activados) siguiendo los procedimientos descritos para la conservación de la muestra. (B) Las muestras se extrajeron mediante extracción en fase sólida, limpiada para eliminar las sustancias que interfieren usando SPE fase normal ycromatografía de exclusión molecular. (C) El extracto concentrado limpio se concentra a un volumen bajo y se analizó usando electropulverización de iones negativo LCMS / MS en el modo MRM. Los resultados se calculan usando la estandarización interna utilizando estándares internos marcados con isótopos. En el ejemplo mostrado, EE2 está presente en el efluente final ASP en una concentración superior al pronosticado nivel sin efecto (PNEC) de 0,1 ng / L y se elimina mediante tratamiento con CAG y el ozono (O 3) a una concentración ambientalmente seguro. Por favor, haga clic aquí para ver una versión más grande de esta figura.
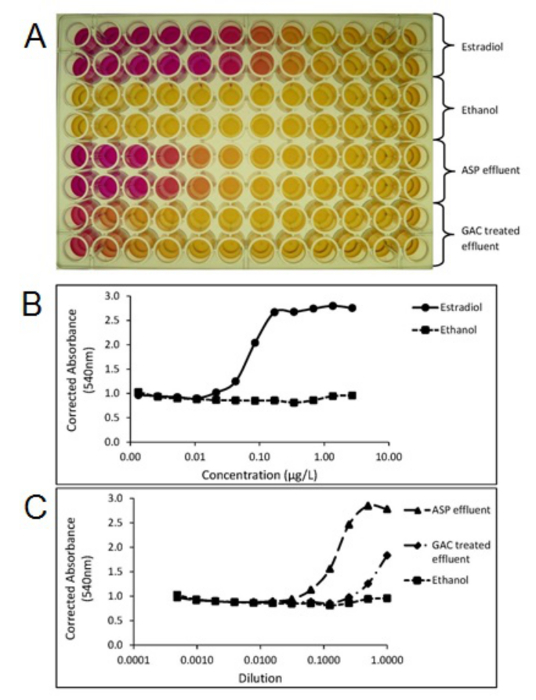
Figura 4. Foto de una placa de ensayo de evaluación de la levadura de estrógeno (SI) (A) que muestra el cambio de color de amarillo a rojo, relativa a la actividad estrogénica de las muestras. Parcelas creadas a partir de la proyección placa de ensayo SI corregidos absorbancia (540nm) de la norma estradiol (B), que se activa efluente de proceso de lodos (ASP) y carbón activado granular (GAC) tratados muestras de los efluentes de aguas residuales (C). Cada muestra fue analizada por duplicado. ASP y GAC efluentes se extrajeron y se concentraron usando los métodos descritos en la sección SPE 1. Haga clic aquí para ver una versión más grande de esta figura.
La ozonización también es eficaz en la eliminación de estrógenos esteroides y la actividad estrogénica de plantas de tratamiento de aguas residuales tratadas convencionalmente. El ozono es capaz de oxidar una amplia gama de contaminantes orgánicos y la materia orgánica disuelta en muestras de agua residual y proporciona propiedades de desinfección. La eficacia de ozonización depende de las características del agua tales como el pH, la cantidad de materia orgánica y la dosis aplicada de la capa de ozono. Los estrógenos que están mal eliminan mediante el tratamiento convencional pueden serretirado de las aguas residuales con dosis entre 0,8 y 2 mg O 3 / mg de COD. El ozono es un agente oxidante selectivo, que reacciona con los sitios ricos en electrones (enlaces insaturados carbono-carbono, compuestos aromáticos que incluyen alcoholes aromáticos), lo que hace de ozono aplicable para la descomposición de un número de EDC. Sin embargo, la eliminación de los compuestos individuales no conduce necesariamente a la mineralización completa del compuesto inicial. Las sustancias orgánicas siguiente ozonización se puede transformar intermedios de generación o la oxidación de transformación de subproductos que incluyen un número de peso molecular bajo, clases polares de compuestos tales como aldehídos, cetonas, ácidos carboxílicos, ceto ácidos, y los compuestos bromados. Los ejemplos incluyen, bromato, formaldehído, acetaldehído y ácidos carboxílicos. Uso in vivo y en bioensayos in vitro se ha demostrado que, aunque el ozono oxida sólo parcialmente algunas sustancias químicas, los principales productos de transformación resultantes tienen un estrog inferiorpotencia enic y por lo tanto la aplicación de ozono en una dosis resultados apropiados, en una alta eliminación de la actividad estrogénica.
Uno de los principales beneficios de un tratamiento adicional de las aguas residuales es la reducción de la feminización de peces machos en las aguas receptoras; un efecto adverso que puede conducir a la reducción de la fertilidad 3. Los estudios in vivo utilizando pescado (por ejemplo, cucarachas o piscardo) expuestos a las células germinales femeninas u ovocitos demostración de aguas residuales en los testículos de los machos (por ejemplo, como se ve en la Figura 5). Intersexuales o masculina VTG está ausente o reducida significativamente en los peces después de un tratamiento avanzado, como GAC 7 u ozono 22. Estos estudios muestran que los productos de transformación producidos durante la ozonización no son estrogénicos, sin embargo esto no se refiere a la toxicidad del efluente producido. Este problema se ha abordado en otros estudios, por ejemplo, un estudio realizado por Magdeburg et al. 23, que muestra que la oxidación de ozono subproductos son tóxicos para la trucha arco iris, pero esta toxicidad puede ser eliminado por filtración de arena aguas abajo siguiente ozonización.
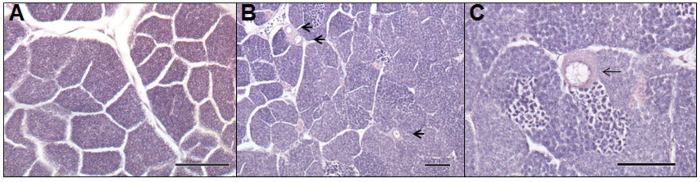
Figura 5. Las fotomicrografías de un macho normal (A) y intersexuales (B, C) gónadas de adulto Roach (Rutilus rutilus) expuestos a las aguas residuales en un campo basado evaluación. Microfotografía-A, representa una sección histológica de testículo normal de sexo masculino. Microfotografía-B y -C, representa secciones histológicas de un pez macho intersexuales, después de haber sido expuestos a efluentes de aguas residuales proceso de lodos activados durante seis meses. Las flechas indican los ovocitos presentes en el tejido testicular. La barra de escala representa 100 micras en cada una microfotografía. Por favor, haga clic aquí para ver una versión más grande de esta figura.
El alto costo de la finalización del tratamiento tubería usando ozono, GAC o la tecnología de membrana hace necesario el desarrollo de alternativas de menor costo, métodos sostenibles para la alteración del sistema endocrino eliminación química (EDC). Además, los métodos de adsorción y separación simplemente separan EDC de una fase a otra en lugar de la eliminación de ellos a través de la degradación. Activadores TAML se han desarrollado para catalizar la oxidación de hidrógeno peróxido de microcontaminantes orgánicos en las aguas residuales 12,24 - 26. TAML activadores con H 2 O 2 se degrada efectivamente EE2 y otros estrógenos esteroides en agua pura de laboratorio, así como en los efluentes de las plantas de tratamiento de aguas residuales municipales y en muestras de orina de púas 12. Los estudios de laboratorio, muestra TAML / H 2 O 2 de tratamiento proporciona una alta eliminación de estrógenos esteroides incluyendo la eliminación EE2 y reduce sustancialmente la actividad estrogénica medido in vitro utilizando el bioensayo SI y sustanciaLLY disminuye feminización peces in vivo se mide utilizando el bioensayo VTG (Figura 1 y la Figura 6).
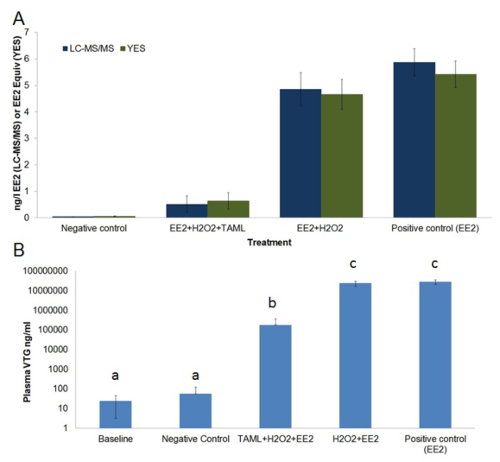
Figura 6. concentración EE2 media y la actividad estrogénica en tratados y sin tratar aguas de depósito (A) y la vitelogenina plasma en la línea de base y los peces expuestos macho (B). A) concentración EE2 (ng / L, barras de color azul oscuro) se midió por LCMS / MS , se midió la actividad estrogénica (EE2 equivalente ng / L, barras de color verde oscuro) a través vitro evaluación de la levadura estrógeno en (SI). B) vitelogenina plasma (ng / ml, barras de color azul claro) concentración en Pimephales masculinos se midieron a través de una enzima cuantitativa = Conectado ensayo inmunoenzimático (ELISA). EE2 resultados de análisis químicos indican como <0,03 ng / L EE2 (es decir, menor que el límite de detección (LOD)) se trataron como tener un medio LOD (es decir, 0.015 ng / L EE2) para su uso en los cálculos de promedios, error estándar y el análisis estadístico. EE2 y la actividad estrogénica son concentraciones promedio medido de la muestra sobre la exposición de 21 días. Plasma VTG se midió antes de la exposición (línea de base) y después de 21 días de exposición. El régimen de tratamiento consistió; control negativo (agua de dilución única), EE2 + H 2 O 2 + TAML, EE2 + H 2 O 2, y EE2-solamente. Las barras de error en el gráfico-A representan el error estándar de la media, las barras de error en el gráfico-B representan la desviación estándar. Cartas sobre las barras en el gráfico-B representan similitud estadística. Esta cifra ha sido modificado de Mills et al. 12 Haga clic aquí para ver una versión más grande de esta figura.
Discusión
plantas de tratamiento de aguas residuales son la principal vía de contaminación de aguas superficiales con EDC. Una evaluación de la eficacia de la eliminación de la actividad endocrina de los procesos de tratamiento convencionales, avanzados o emergentes requiere el uso de una variedad de ensayos químicos y biológicos. El análisis químico usando análisis no específica y selectiva proporciona datos cualitativos o cuantitativos sobre la eficacia de la eliminación de los componentes individuales y por lo tanto permite una evaluación para hacerse con los estándares de calidad ambiental o concentraciones previstas sin efecto de los compuestos o mezclas de compuestos analizados.
La generación de productos de transformación resultantes de mineralización incompleta de sustancias después del tratamiento y la presencia de componentes biológicamente activos desconocidos en las aguas residuales limita la utilidad de la prueba química solo. Una combinación de in vivo y en bioensayos in vitro en combinación con químico analíticodetección ry proporciona una caja de herramientas útiles para determinar la eficacia de la eliminación de la EDC por los países emergentes procesos de tratamiento de aguas residuales. Estas pruebas, cuando se llevó a cabo junto con los parámetros tradicionales de calidad del agua y otros puntos finales toxicológicos y microbiológicos permiten una evaluación crítica de las tecnologías de tratamiento de aguas residuales actuales y emergentes.
Es importante tener en cuenta que las pantallas de estrógeno basados en levaduras (por ejemplo, YES) no son la única en ensayos in vitro para determinar la potencia estrogénica de productos químicos y aguas residuales. Un número de ensayos basados en células de mamífero transfectadas de forma estable se han desarrollado también, por ejemplo, el ER-CALUX 27 y hERα-HeLa-9903 28 con células de cáncer de mama humano o células tumorales cervicales, respectivamente. El SI ha sido comparado con los ensayos basados en células de mamíferos similares y se ha encontrado que tienen un alto nivel comparable de reproducibilidad, las verdaderas tasas de identificación estrogénicos positivos y verdaderos negativos 29, Althouf se considera a veces ser un poco menos sensible 27. Uno de los beneficios de los ensayos de reportero con base de levadura es que en los laboratorios sin experiencia significativa con el cultivo de células de mamífero, la SI puede ser más fácilmente adoptada, ya que requiere menos estrictas medidas de control biológico y técnicas estériles (SÍ se puede realizar en una mesa de laboratorio si es necesario) . Los ensayos basados en células humanas también requieren incubadoras de CO 2 y Luminómetros en comparación con los lectores de la incubadora y la microplaca estándar que se utilizan en el SI. Reportero ensayos estrógenos basada Dos de levadura (SÍ, Saccharomyces cerevisiae y A-SI, adeninivorans Arxula) están actualmente bajo proceso de senderos entre laboratorios para la validación de la norma ISO 19040 "Calidad del agua - Determinación del potencial estrogénico del agua y las aguas residuales", destacando las industrias interés en estas técnicas.
Hay una serie de limitaciones de los métodos descritos, que incluyen la posible contaminaciónde las muestras durante el muestreo, el almacenamiento de muestras y análisis con sustancias estrogénicas originarios desde el entorno de campo o de laboratorio o por la contaminación humana (por ejemplo, plastificantes, tensioactivos, productos de cuidado personal). Este tipo de contaminación en el ensayo Sí (u otros ensayos basados en células reportero) elevará el fondo y el impacto de la utilización del ensayo. Las muestras de agua o disolventes almacenados en botellas de plástico pueden causar fácilmente los falsos positivos. Los falsos negativos son también motivo de preocupación ya que tanto LCMS / MS y el ensayo SÍ requieren SPE para concentrar los estrógenos a niveles detectables. La matriz, la elección de SPE sorbente y disolvente de elución puede afectar a la eficacia de la extracción y los tipos de compuestos eluidos. El uso de cartuchos C18 SPE para la extracción usando las condiciones descritas en este protocolo puede generar un sesgo negativo, como compuestos altamente polares y básicos serían mal el sorbente retiene. Además, este protocolo tiene que ser reconstituido del eluyente SÍ eluida de methanol a etanol a través de la evaporación a sequedad de nitrógeno donante que resulta en la pérdida de compuestos volátiles. Como resultado, el protocolo podría proporcionar subestimado actividad estrogénica de las muestras analizadas. Estas limitaciones son especialmente importantes cuando se considera el ensayo SI como compuestos desconocidos o inesperados podrían perderse, porque no han sido extraídos o se pierde debido a la evaporación. Por otra parte, la técnica de LCMS / MS hace uso de patrones internos marcados para corregir para la recuperación; este enfoque no se puede utilizar con el ensayo SÍ.
Importantes limitaciones de las pruebas in vivo de los efluentes incluyen alto coste y el tiempo necesarios para la evaluación en comparación con los métodos in vitro. Actualmente, el uso de pruebas de embrión de pez para detectar la actividad estrogénica es limitado. Sin embargo, ha habido cierto éxito con la producción de estrógenos transgénica sensible resplandeciente 30 embriones de peces, lo que podría tener aplicaciones futuras. Pimephales (utilizados en este protocol) son una especie de laboratorio comunes y la inducción VTG en los machos es un bio-marcador bien documentada de la exposición estrogénica y una medida cuantificable de estrogenicidad efluentes de aguas residuales 22 u otros compuestos estrogénicos o mezclas 31. Directrices de la OCDE para los disruptores endocrinos han sido validados utilizando adulto piscardo, medaka japoneses y pez cebra 32,33, con VTG ser un biomarcador sensible de la exposición a los estrógenos en las tres especies. Sin embargo, la inducción VTG no se correlaciona directamente con alteración de la reproducción y, por tanto, las consecuencias ecológicas de la exposición de las aguas residuales, como se ve en graves cucaracha intersexuales 3. Por otro lado, las cucarachas no son un clásico "especie de laboratorio para la Investigación de la ecotoxicología, debido a su gran tamaño, tiempo de generación largo (2-3 años para alcanzar la madurez sexual), el estilo reproductiva; desove grupo (reproducción) se lleva a cabo una vez al año, y la dificultad para identificar los machos de las hembras (excepto durantela temporada de desove). Sin embargo, esta especie normalmente gonochoristic ha sido muy bien estudiado en el Reino Unido, debido al descubrimiento de que aguas abajo de efluentes de aguas residuales estrogénicos, pez macho exhibe perturbaciones a su endocrinología (por ejemplo, presencia de vitelogenina específicos de la mujer en la sangre) y la histopatología (ovotestis - el desarrollo de los huevos en el testículo y / o conductos reproductores femeninos) 5,6. Por lo tanto, como una futura aplicación de estos protocolos, gobio (o especies similares) podrían ser una especie centinela silvestres útiles para mostrar si las mejoras reales en la calidad de las aguas residuales (y la reducción de la estrogenicidad) se ven en los ríos que reciben efluentes tratados avanzados. También se pueden emplear en final de sistemas de tuberías para controlar tecnológicamente mejorados efluentes de plantas a escala piloto 7. Al considerar qué especies a utilizar en las evaluaciones de aguas residuales in vivo hay un equilibrio entre el uso de pruebas de laboratorio de especies relativamente rápidos y controlados en comparación con elYa campo basado, pero más relevante para el medio ambiente, poniendo a prueba el uso de especies nativas. Sin embargo, tales estudios in vivo son de alto costo y sólo debe considerarse como el conjunto final de las pruebas siguientes evaluaciones utilizando análisis químicos y ensayos in vitro.
Los pasos críticos dentro de los protocolos descritos incluyen la preparación y manipulación de muestras y material de vidrio (es decir, botellas y equipo de muestreo deben ser tratados previamente con superficie adecuada de limpieza activo) para evitar la contaminación de las muestras de los contaminantes ambientales, entre ellos limitar el contacto de las muestras con plásticos y otros materiales que pueden producir falsos positivos. Esto es igualmente importante en el diseño y la construcción de sistemas de exposición de acuarios y peces. Lo ideal sería que los acuarios (los parques de vivienda y durante las exposiciones) debe ser construido a partir de materiales con baja adsorción 32 con un riesgo mínimo de contaminación. El acero inoxidable puede ser utilizado para tanques de almacenamiento de efluentes o de agua.Mientras que se prefieren los tanques de una construcción de vidrio para tanques de peces (ya que esto también proporciona una fácil observación de los peces). El uso de tubos de plástico de bajo grado o tubo debe ser evitado 32, 34 PVC y ABS se puede utilizar si 'adecuadamente sazonados', es decir, de izquierda a lixiviar cualquier contaminante en el funcionamiento de la dilución con agua durante al menos 12 horas antes de su uso. tubo de silicona de grado médico ha sido empleado con éxito en nuestras instalaciones de suministro de la bomba peristáltica de productos químicos y aguas residuales / dilución para los tanques. Además de considerar la contaminación estrogénica en la construcción y funcionamiento del sistema de deportes acuáticos, también es importante pensar en la dieta de los peces; muchos alimentos de peces propiedad se han encontrado para ser estrogénico para los peces. Por lo tanto, es importante probar cualquier alimento para la actividad (por ejemplo, en la pantalla de estrógeno levadura, Ver Beresford et al. 14) antes de su uso en este tipo de estudios.
Solución de problemasde los protocolos de ensayo de análisis químico o sí descritos se simplifica si las muestras de control de calidad que incluye los viajes múltiples, laboratorio y espacios en blanco de disolvente se analizó junto con los controles positivos y las muestras reales para eliminar resultados positivos falsos y negativos falsos. Positiva (por ejemplo, EE2) y negativo control (dilución en agua solamente) también debería siempre ser utilizado en los ensayos in vivo para confirmar la sensibilidad de biomarcador biológica esperada o punto final (es decir, VTG o histopatología), y permitir que cualquier contaminación inesperada para ser detectado ( por ejemplo, del dispositivo experimental, la dieta o las aguas de dilución). Cualquier modificación en el protocolo deben ser validados antes de realizar cualquier estudio.
Con una regulación más estricta de los compuestos estrogénicos que entran en el medio ambiente a través de los efluentes de las PTAR es contemplan que tendrán que ser desarrollado tecnologías de tratamiento de aguas residuales más eficaces. La batería de pruebas que se describen en este manuscrito complementar lapruebas de evaluación ecotoxicológicos y químicas aplican normalmente a las descargas de aguas residuales de plantas de tratamiento de efluentes. Por lo tanto, la aplicación futura de este tipo de batería integral de prueba debe permitir a los desarrolladores de tecnología de aguas residuales, y operadores de planta, para poner en práctica los diseños ecológicamente más segura teniendo en cuenta los mejores métodos para eliminar tanto los productos químicos estrogénicos específicos regulados y la actividad biológica en general.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Projects presented in this paper were funded by Severn Trent Water and Brunel University London. The authors would like to thank Alan Henshaw and John Churchley for providing field and laboratory assistance. T.J.C. thanks the Heinz Endowments for support. M.R.M. thanks the Steinbrenner Institute for a Steinbrenner Doctoral Fellowship and Carnegie Mellon University for a Presidential Fellowship.
Materiales
| Name | Company | Catalog Number | Comments |
| Wellwash Versa plate washer | Thermo Scientific | 5165010 | |
| Plate reader | Molecular Devices | SpectraMax 340PC | |
| Incubator | Memmert | INB 400 | 37 °C incubation required for carp assay |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Icemaker | Scotsman | AF80 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| ELISA kits | Biosense Laboratories | V01018401-096 (Fathead minnow) V01003402-096 (Carp) | |
| Microfuge tubes, 0.5 ml | Alpha labs | LW2372 | |
| Microfuge tubes, 1.5 ml | Alpha labs | LW2375 | |
| Sulphuric acid, 95-98% | Sigma-Aldrich | 258105 | |
| Histology | |||
| Tissue processor | Leica Biosystems | TP1020 | |
| Wax dispenser | Thermo Scientific Raymond Lamb | E66HC | |
| Metal embedding mold | Leica Biosystems | Various | |
| Hot plate | Thermo Scientific Shandon | 3120063 | |
| Cold plate (EG1150 C) | Leica Biosystems | 14038838037 | |
| Heated forceps (EG F) | Leica Biosystems | 14038835824 | |
| Microtome | Leica Biosystems | RM2235 | |
| Paraffin section floatation bath | Electrothermal | MH8517 | |
| Slide drying bench | Electrothermal | MH6616 | |
| Stainmate automated stainer | Thermo Scientific Shandon | E103/S10L | |
| Cassettes, Histosette II, biopsy | Simport | M493 | |
| Paraffin wax | Thermo Scientific Raymond Lamb | W1 | |
| Histo-Clear II | National Diagnostics | HS-202 | |
| IMS (ethanol mix), IDA99 | Tennants | ID440 | |
| Polysine adhesion slides | Thermo Scientific Gerhard Menzel | J2800AMNZ | |
| Cover slips, 22x50 mm | VWR | 631-0137 | |
| Histomount | National Diagnostics | HS-103 | |
| Haematoxylin Harris GURR | VWR | 351945S | |
| Eosin, 1%, aqueous | Pyramid Inovation | S20007-E | |
| Fisherbrand slide boxes | Fisher Scientific | 11701486 | |
| Microtome blades, MB35 | Thermo Scientific Shandon | 3050835 | |
| Bouin’s solution | Sigma Aldrich | HT10132-1L | |
| Yeast screen | |||
| Flow cabinet | Labcaire Systems Ltd | SC12R | |
| Cooled incubator | LMS Cooled Incubator | 303 | |
| Incubator | Memmert | INB 400 | |
| Shaker | Grant | PSU-10i | |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Plate shaker | Heidolph Titramax 100 | 544-11200-00 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| 12-channel pipette, electronic | Sartorius | 735441 | |
| 96-well flat-bottom microplates | MP Biomedicals Thermo Scientific Nunc Sarstedt | 76-232-05 260860 82.1581.001 | We have found that these multiwell plates all produce low backgrounds |
| HPLC grade water | Rathburn | RH1020 | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| Potassium phosphate monobasic anhydrous | Sigma-Aldrich | P-5655 | |
| Ammonium sulphate | Sigma-Aldrich | A-2939 | |
| Potassium hydroxide, pellets | Sigma-Aldrich | P-1767 | |
| Magnesium sulfate, anhydrous | Sigma-Aldrich | M-2643 | |
| Iron(III) sulfate | Sigma-Aldrich | 307718 | |
| L-Leucine | Sigma-Aldrich | L-8912 | |
| L-Histidine | Sigma-Aldrich | H-6034 | |
| Adenine | Sigma-Aldrich | A-2786 | |
| L-Argenine, hydrochloride | Sigma-Aldrich | A-6969 | |
| L-Methionine | Sigma-Aldrich | M-5308 | |
| L-Tyrosine | Sigma-Aldrich | T-8566 | |
| L-Isoleucine | Sigma-Aldrich | I-7403 | |
| L-Lysine, hydrochloride | Sigma-Aldrich | L-8662 | |
| L-Phenylalanine | Sigma-Aldrich | P-5482 | |
| L-Glutamic acid | Sigma-Aldrich | G-8415 | |
| L-Valine | Sigma-Aldrich | V-0513 | |
| L-Serine | Sigma-Aldrich | S-4311 | |
| Thiamine, hydrochloride | Sigma-Aldrich | T-1270 | |
| Pyridoxine | Sigma-Aldrich | P-5669 | |
| D-Pantothenic acid, hemicalcium salt | Sigma-Aldrich | P-5155 | |
| Inositol | Sigma-Aldrich | I-5125 | |
| D-Biotin | Sigma-Aldrich | B-4639 | |
| D-(+)-Glucose anhydrous; mixed anomers | Sigma-Aldrich | G-7021 | |
| L-Aspartic acid | Sigma-Aldrich | A-4534 | |
| L-Threonine | Sigma-Aldrich | T-8441 | |
| Copper(II) sulfate, anhydrous | Sigma-Aldrich | C-1297 | |
| Chlorophenolred-β-D galactopyranoside (CPRG) | Sigma-Aldrich | 10884308001 | |
| Glycerol | Sigma-Aldrich | G-2025 | |
| 17 β-Estradiol | Sigma-Aldrich | E-8875 | |
| Steroids | |||
| Acetone | Rathburn | ||
| Acetonitrile | Rathburn | ||
| Ammonia solution | Rathburn | ||
| Ethylacetate | Rathburn | ||
| Copper(II) nitrate | Sigma-Aldrich | ||
| Acetone | Rathburn | ||
| Dichloromethane | Rathburn | ||
| 2,4,16,16-d4-17β-estradiol | CDN Isotopes | ||
| 2,4,16,16-d4-estrone | CDN Isotopes | ||
| 2,4,16,16-d4-17α-ethynyl oestradiol | CDN Isotopes | ||
| 17β-estradiol | Sigma-Aldrich | ||
| Estrone | Sigma-Aldrich | ||
| 17α-ethynyl oestradiol | Sigma-Aldrich | ||
| Hexane | Rathburn | ||
| Hydrochloric acid | Sigma-Aldrich | ||
| Methanol | Sigma-Aldrich | ||
| Sodium hydrogen carbonate | Sigma-Aldrich | ||
| Sodium hydroxide | Sigma-Aldrich | ||
| Styrene divinyl benzene cartridge (Isolute ENV+) solid phase extraction cartridge (200 mg/6 ml) | Biotage | ||
| Isolute aminopropyl solid phase extraction cartridge (500 mg/6 ml) | Biotage | ||
| Fish study | |||
| orange-white silicon manifold tubing 0.63 bore pk 6 | Watson Marlow | 982.0063.000 | |
| straight connectors for 0.5/0.8 bore pk 20 | Watson Marlow | 999.2008.000 | |
| pumsil silicon tubing 0.8 bore 15 m | Watson Marlow | 913.A008.016 | |
| 200 series multi-channel persitaltic pump | Watson Marlow | 205CA | |
| Silicone tubing x 15 m (dosing tanks) | VWR | SFM1-3250 | |
| silicone tubing x 15 m (large for inflow/outflow) | VWR | SFM1-5450 | |
| 2.5 L glass winchester pk 4 | Fisher Scienctific | BTF-505-050B | |
| magnetic stir bar 51 x 8 mm pk 10 | Fisher Scienctific | FB55595 | |
| Ethyl 3-aminobenzoate methanesulfonate (MS222) | Sigma Aldrich | E10521-10G | |
| 17α-Ethynylestradiol | Sigma Aldrich | E4876-100MG | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| SPE | |||
| 1/8 inch PTFE tubes 'straws' colour coded pk 4 | Sigma Aldrich | 57276 | |
| disposable liners for manifold | Sigma Aldrich | 57059 | |
| filtration tubes without frits 6 ml pk 30 | Sigma Aldrich | 57242 | |
| reservior adaptors pk 12 | Sigma Aldrich | 57020-U | |
| stainless steel weight for manifold pk 4 | Sigma Aldrich | 57278 | |
| male Luer plug for manifold pk 12 | Sigma Aldrich | 504351 | |
| SPE Vacuum Manifold | Sigma Aldrich | 57265 | |
| stop cocks for extraction mainfold (supelco) pk 12 | Waters | WAT054806 | |
| Sep-Pak Plus C18 cartridge box 50 | Waters | WAT020515 | |
| Methanol HPLC grade 2.5 L | Fisher Scientific | M/4056/17 | |
| 7 ml glass vials with lids (58 x 17 mm) pk 399 | Fisher Scientific | TUL-520-031K | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| vacuum pump, e.g., VP Series Vacuum Pump | Camlab | 1136915 |
Referencias
- Bergman, &. #. 1. 9. 7. ;., Heindel, J., Jobling, S., Kidd, K., Zoeller, R. T. State-of-the-science of endocrine disrupting chemicals. Toxicol. Lett. 211, (2012).
- Rodgers-Gray, T. P., et al. Exposure of juvenile roach (Rutilus rutilus) to treated sewage effluent induces dose-dependent and persistent disruption in gonadal duct development. Environ. Sci. Technol. 35 (3), 462-470 (2001).
- Jobling, S., et al. Altered sexual maturation and gamete production in wild roach (Rutilus rutilus) living in rivers that receive treated sewage effluents. Biol. reprod. 66 (2), 272-281 (2002).
- Tyler, C. R., Der Eerden, B. V. a. n., Jobling, S., Panter, G., Sumpter, J. P. Measurement of vitellogenin, a biomarker for exposure to oestrogenic chemicals, in a wide variety of cyprinid fish. J. Comp. Physiol. B, Biochem. Syst. Environ. Physiol. 166 (7), 418-426 (1996).
- Jobling, S., Nolan, M., Tyler, C. R., Brighty, G., Sumpter, J. P. Widespread sexual disruption in wild fish. Environ. Sci. Technol. 32 (17), 2498-2506 (1998).
- Jobling, S., et al. Predicted exposures to steroid estrogens in U.K. rivers correlate with widespread sexual disruption in wild fish populations. Environ. Health Perspect. 114, 32-39 (2006).
- Baynes, A., et al. Additional treatment of wastewater reduces endocrine disruption in wild fish - a comparative study of tertiary and advanced treatments. Environ. Sci. Technol. 46 (10), 5565-5573 (2012).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environ. Toxicol. Chem. 15 (3), 241-248 (1996).
- Grover, D. P., Balaam, J., Pacitto, S., Readman, J. W., White, S., Zhou, J. L. Endocrine disrupting activities in sewage effluent and river water determined by chemical analysis and in vitro assay in the context of granular activated carbon upgrade. Chemosphere. 84 (10), 1512-1520 (2011).
- . . The determination of steroid oestrogens in waters using chromatography and mass spectrometry (2008) Methods for the Examination of Waters and Associated Materials. (2008), (2008).
- Van den Belt, K., Berckmans, P., Vangenechten, C., Verheyen, R., Witters, H. Comparative study on the in vitro/in vivo estrogenic potencies of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and nonylphenol. Aquat. toxicol. 66 (2), 183-195 (2004).
- Mills, M. R., et al. Removal of ecotoxicity of 17α-ethinylestradiol using TAML/peroxide water treatment. Sci. Rep. 5, 10511 (2015).
- . . EN 14962:2006 Water quality - Guidance on the scope and selection of fish sampling methods. , (2006).
- Beresford, N., Brian, J. V., Runnalls, T. J., Sumpter, J. P., Jobling, S. Estrogenic activity of tropical fish food can alter baseline vitellogenin concentrations in male fathead minnow (Pimephales promelas). Environ. Toxicol. Chem. 30 (5), 1139-1145 (2011).
- Nolan, M., Jobling, S., Brighty, G., Sumpter, J. P., Tyler, C. R. A histological description of intersexuality in the roach. J. Fish Biol. 58 (1), 160-176 (2001).
- Dascenzo, G., et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities. Sci. Total Environ. 302 (1-3), 199-209 (2003).
- Gomes, R. L., Birkett, J. W., Scrimshaw, M. D., Lester, J. N. Simultaneous determination of natural and synthetic steroid estrogens and their conjugates in aqueous matrices by liquid chromatography/mass spectrometry. Int. J. Environ. Anal. Chem. 85 (1), 1-14 (2005).
- Metcalfe, C. D., et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes). Environ. Toxicol. Chem. 20 (2), 297-308 (2001).
- Stalter, D., Magdeburg, A., Wagner, M., Oehlmann, J. Ozonation and activated carbon treatment of sewage effluents: Removal of endocrine activity and cytotoxicity. Water Res. 45 (3), 1015-1024 (2011).
- Caldwell, D. J., Mastrocco, F., Anderson, P. D., Länge, R., Sumpter, J. P. Predicted-no-effect concentrations for the steroid estrogens estrone, 17β-estradiol, estriol, and 17α-ethinylestradiol. Environ. Toxicol. Chem. 31 (6), 1396-1406 (2012).
- Gardner, M., Comber, S., Scrimshaw, M. D., Cartmell, E., Lester, J., Ellor, B. The significance of hazardous chemicals in wastewater treatment works effluents. Sci. Total Environ. 437, 363-372 (2012).
- Filby, A. L., Shears, J. A., Drage, B. E., Churchley, J. H., Tyler, C. R. Effects of advanced treatments of wastewater effluents on estrogenic and reproductive health impacts in fish. Environ. Sci. Technol. 44 (11), 4348-4354 (2010).
- Magdeburg, A., Stalter, D., Oehlmann, J. Whole effluent toxicity assessment at a wastewater treatment plant upgraded with a full-scale post-ozonation using aquatic key species. Chemosphere. 88 (8), 1008-1014 (2012).
- Collins, T. J. TAML oxidant activators: a new approach to the activation of hydrogen peroxide for environmentally significant problems. Acc. Chem. Res. 35 (9), 782-790 (2002).
- Collins, T. J. Designing Ligands for Oxidizing Complexes. Acc. Chem. Res. 27 (9), 279-285 (1994).
- Truong, L., Denardo, M. A., Kundu, S., Collins, T. J., Tanguay, R. L. Zebrafish Assays as Developmental Toxicity Indicators in The Design of TAML Oxidation Catalysts. Green Chem. 15 (9), 2339-2343 (2013).
- Murk, A. J., et al. Detection of estrogenic potency in wastewater and surface water with three in vitro bioassays. Environ. Toxicol. Chem. 21 (1), 16-23 (2002).
- . Test No 455: The Stably Transfected Human Estrogen Receptor-alpha Transcriptional Activation Assay for Detection of Estrogenic Agonist-Activity of Chemicals. OECD Guidelines for the Testing of Chemicals, Section 4. , (2009).
- Kolle, S. N., et al. In house validation of recombinant yeast estrogen and androgen receptor agonist and antagonist screening assays. Toxicol in Vitro. 24 (7), 2030-2040 (2010).
- Lee, O., Tyler, C. R., Kudoh, T. Development of a transient expression assay for detecting environmental oestrogens in zebrafish and medaka embryos. BMC Biotechnology. 12, 32 (2012).
- Brian, J. V., et al. Accurate prediction of the response of freshwater fish to a mixture of estrogenic chemicals. Environ Health Perspect. 113 (6), 721-728 (2005).
- . Test No 229: Fish Short Term Reproduction Assay. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
- . Test No 230: 21-day Fish Assay: A Short-Term Screening for Oestrogenic and Androgenic Activity and Aromatase Inhibition. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados