Method Article
Utilizzo di una batteria di chimici ed ecotossicologici metodi per la valutazione dell'efficacia dei processi di trattamento delle acque reflue per rimuovere estrogenica Potenza
In questo articolo
Riepilogo
Perturbano il sistema endocrino composti (EDC) pongono un rischio sostanziale per l'ambiente acquatico. impianti di trattamento delle acque reflue urbane sono tra i principali la potenza estrogenica delle acque di superficie. La metodologia fornita in questo articolo consente di valutare l'efficacia e l'adeguatezza dei processi di trattamento delle acque reflue rispetto alla rimozione EDC.
Abstract
Endocrine Disrupting Compounds pose a substantial risk to the aquatic environment. Ethinylestradiol (EE2) and estrone (E1) have recently been included in a watch list of environmental pollutants under the European Water Framework Directive. Municipal wastewater treatment plants are major contributors to the estrogenic potency of surface waters. Much of the estrogenic potency of wastewater treatment plant (WWTP) effluents can be attributed to the discharge of steroid estrogens including estradiol (E2), EE2 and E1 due to incomplete removal of these substances at the treatment plant. An evaluation of the efficacy of wastewater treatment processes requires the quantitative determination of individual substances most often undertaken using chemical analysis methods. Most frequently used methods include Gas Chromatography-Mass Spectrometry (GCMS/MS) or Liquid Chromatography-Mass Spectrometry (LCMS/MS) using multiple reaction monitoring (MRM). Although very useful for regulatory purposes, targeted chemical analysis can only provide data on the compounds (and specific metabolites) monitored. Ecotoxicology methods additionally ensure that any by-products produced or unknown estrogenic compounds present are also assessed via measurement of their biological activity. A number of in vitro bioassays including the Yeast Estrogen Screen (YES) are available to measure the estrogenic activity of wastewater samples. Chemical analysis in conjunction with in vivo and in vitro bioassays provides a useful toolbox for assessment of the efficacy and suitability of wastewater treatment processes with respect to estrogenic endocrine disrupting compounds. This paper utilizes a battery of chemical and ecotoxicology tests to assess conventional, advanced and emerging wastewater treatment processes in laboratory and field studies.
Introduzione
Preoccupazioni per quanto riguarda gli effetti negativi dei composti alterano il sistema endocrino sulla fauna selvatica salute riproduttiva ha portato l'Unione europea a mettere due sostanze estrogeniche (estradiolo e di etinilestradiolo) su una "watch list" ai sensi della direttiva quadro sulle acque (WFD). EDC comprendono una varietà di classi chimiche, tra cui gli estrogeni naturali e sintetici steroidi, farmaci, pesticidi e prodotti chimici industriali e componenti di prodotti di consumo con effetti negativi noti sulla fauna selvatica. Alcuni di questi composti possono potenzialmente avere un impatto sulla salute umana 1.
La ricerca ha dimostrato che gli effluenti da impianti di depurazione sono estrogenica a pescare 2 e di conseguenza molte acque che ricevono sono anche estrogenica per i pesci 3. Questo è stato dimostrato attraverso indagini nazionali del Regno Unito che ha mostrato un aumento delle concentrazioni di vitellogenina (una femmina specifica proteina tuorlo precursore 4) nel sangue di pesce maschio selvatico e un alto prevalenza di intersessualità (sviluppo di uova e / o condotti riproduttivi femminili nel testicolo di pesci di sesso maschile) nelle specie ittiche normalmente gonochoristic 5,6.
depurazione convenzionale è tipicamente un processo in tre fasi che consiste di uno screening preliminare seguita da trattamento primario e secondario che rimuove sia sciolto e sospese materia organica. L'efficacia di rimozione dell EDC dipende dalle proprietà fisico-chimiche delle sostanze e l'efficacia del processo di trattamento applicato. Per molti la rimozione EDC tramite adsorbimento e degradazione biologica può essere significativo, ma incompleta. Trattamento terziario, come la filtrazione a sabbia, può essere efficace ad aumentare la rimozione EDC 7 mentre il trattamento avanzato tramite ossidazione avanzata (ad esempio l'ozono) o il carbone attivo può essere efficace nel raggiungere quasi completa rimozione 7.
La valutazione di ogni nuova tecnologia per il trattamento delle acque reflue needs per determinare l'efficacia del processo proposto nella rimozione EDC. Una batteria di test, tra cui analisi chimiche mirate al fianco di test ecotossicologia, utilizzando in vivo e in vitro saggi biologici, fornisce dati completi per questo scopo. Anche se molto utile a fini normativi, analisi chimica mirata può fornire solo dati sui composti (e metaboliti specifici) monitorati. Test biologici permettono inoltre il "rilevamento" degli effetti avversi dei metaboliti e il trattamento delle acque reflue generate trasformazione di sottoprodotti che altrimenti sarebbero individuare, 8,9. Questo documento descrive l'uso di una batteria di test chimici e di laboratorio ecotossicità per valutare l'efficacia di un certo numero di processi di depurazione avanzati ed emergenti nel rimuovere la potenza estrogenica di greggio e liquami trattati e acque recipienti.
Protocollo
dichiarazione etica: Protocolli per valutare l'attività di distruttori endocrini delle sostanze chimiche / miscele nei pesci sono stati approvati dal benessere degli animali di Brunel University di Londra e etico Review Body (AWERB) e dal Regno Unito Home Office sotto gli animali (Procedure Scientifiche) Act 1986.
1. Acqua Campione raccolta, conservazione ed estrazione
- la raccolta e la conservazione del campione
- Prima dell'uso, pulire le bottiglie con un detergente tensioattivo adatto. Dopo la pulizia, sciacquare le bottiglie con acqua, scarico e asciutto.
- Raccogliere campioni in bottiglie di vetro di capacità 2-L contenente conservante costituito da 0,5 g di rame (II) e nitrato di 6 ml di soluzione di acido cloridrico 3,6 M. Conservare i campioni inferiori a 10 ° C. Estrarre e analizzare il più presto possibile dopo la raccolta e la conservazione.
- Estrazione del campione e clean-up (per l'analisi estrogeni steroidi) 10
- Estrazione in fase solida (SPE)
- Prima di estrazione, per ridurre solidi sospesi, campioni di acqua filtro utilizzando carta da filtro dimensione dei pori 1 micron.
- Una volta filtrato, campioni picco con standard interno con l'aggiunta di 100 ml di chiodare deuterato soluzione madre standard interna contenente 2,4,16,16-D 4 -estrone: 2,4,16,16-D 4 -17β-estradiolo (E2) : e 2,4,16,16-d 4 -17α-etinilestradiolo (EE2) (tutti a 40 mg / L in metanolo) a 1.000 ml di effluente (o 100 ml influente) con conseguente picco interna di 2 ng / L per acque di scarico campioni di effluenti, e 20 ng / L per i campioni influenti delle acque reflue.
- Fissare le fodere monouso valvole, cartucce SPE stirene divinilbenzene, e serbatoi cartuccia all'apparato SPE. Inserire la pompa del vuoto per testare l'apparecchiatura è adeguatamente sigillato.
- Pipettare 5 ml di acetato di etile in ciascun serbatoio, per il condizionamento delle cartucce. Accendere la pompa del vuoto (al di sotto di 10 inHg per consentire una portata inferiore a 10 ml al minuto)e tirare attraverso il liquido. Non lasciate che le cartucce SPE seccano. Ripetere con 5 ml di metanolo seguiti da 5 ml di acqua.
- Riempire ogni serbatoio della cartuccia con acqua e collegare tubi PTFE 1/8 "tra i bacini cartuccia e bottiglie di campionamento di vetro. Accendere il vuoto con una portata inferiore a 10 ml al minuto e consentire l'intero campione di passare attraverso la cartuccia. svuotare il pallone rifiuti, se necessario.
- Asciugare accuratamente le cartucce SPE sotto vuoto (o utilizzando aria o azoto) fino a quando il contenuto delle cartucce cambiare colore (ad esempio, dal marrone scuro al marrone chiaro).
- Mettere puliti a secco 10 ml fiale di vetro di raccolta in rack e posto all'interno del collettore di estrazione. Controllare che ogni nave è al di sopra di un flaconcino. Pipettare 8 ml di diclorometano in ciascun serbatoio campione, accendere la pompa del vuoto (portata inferiore a 10 ml al minuto) e tirare il liquido attraverso nelle fiale di raccolta.
- Rimuovere 10 ml fiale dal collettore SPEe utilizzare un concentratore di ridurre il volume di 1 ml. Trasferire ciascun campione nella fiala di auto-campionatore e l'ulteriore concentrarsi per 100 ml utilizzando blow down attrezzature di azoto.
- Prima di estrazione, per ridurre solidi sospesi, campioni di acqua filtro utilizzando carta da filtro dimensione dei pori 1 micron.
- Permeazione di gel cromatografia (GPC) clean-up
- Iniettare 95 ml di estratto del campione eluito in HPLC equipaggiato GPC utilizzando le condizioni descritte nella tabella 1. Concentrato GPC estrarre fino a 200 microlitri utilizzando un concentratore e azoto soffiano verso il basso apparato e poi fare fino a 2,0 ml con esano.
- SPE clean-up
- Fissare le fodere monouso valvole, cartucce amminopropil, e serbatoi cartuccia al collettore SPE. Mettere puliti a secco 10 ml fiale di vetro di raccolta in rack e posto all'interno del collettore di estrazione. Pipettare 2 ml di esano in ciascun serbatoio, per il condizionamento delle cartucce. Lasciare il liquido di passare attraverso le cartucce.
- Pipettare il campione estratto GPC nel serbatoio e ancora consentire al liquido dipassare attraverso la cartuccia. Raccogliere l'eluato campione nella fiala e rimuovere dal collettore. Non gettare eluato.
- Mettere una nuova secca flaconcino da 10 ml di raccolta pulita in rack e posizionare all'interno del collettore di estrazione. Per lavare la cartuccia, aggiungere 2 ml di acetato di etile in esano (30% v / v) al serbatoio e tirare il liquido attraverso la cartuccia. Ripetere con altri 2 ml di acetato di etile in esano, scartando tutti lavaggi.
- Posizionare i 10 ml di raccolta flacone originale (passo 1.2.3.2) indietro nel cremagliera all'interno del collettore di estrazione. Pipettare 2 ml di etile acetato in acetone (50% v / v) nel serbatoio, accendere la pompa del vuoto (al di sotto di 2 inHg per consentire una portata inferiore a 2 ml al minuto) e tirare il liquido attraverso nel flaconcino . Ripetere il processo con altri 2 ml di etile acetato.
- Rimuovere la fiala campione e utilizzare un concentratore per ridurre il volume estratto per 1 ml. Trasferire il campione in una fiala di vetro minore e utilizzando azoto spurgo attrezzature, evaporare tha estratto a secchezza incipiente.
- Aggiungere 100 ml di metanolo e mescolare bene. Trasferire l'estratto ad un autocampionatore flaconcino (0,3 ml inserto) e tappare la fiala. Analizzare i campioni utilizzando LCMS / MS (vedere la sezione 2).
- Estrazione in fase solida (SPE)
| Colonna: | PL gel, 50 A, 300 x 7,5 mm, 5 micron |
| Guardia Colonna: | PL gel, 50 x 7,5 mm, 5 micron |
| Fase mobile: | diclorometano |
| Portata: | 1 ml per minuto |
| Temperatura della colonna: | 25 ° C |
| Rivelatore UV: | 210 nm |
| Volume di iniezione: | 95 ml |
| Modalità di iniezione: | stare in piediARD |
| Draw Velocità: | 500 ml al minuto |
| Espulsione Velocità: | 500 ml al minuto |
| Posizione Draw: | 3 mm |
| Frazione raccolte: | 3 ml frazione (7 - 10 min) in 10 ml flaconcini |
Tabella 1. Condizioni e parametri per la permeazione di gel cromatografia (GPC) clean-up di campioni di acque reflue estratti. Tabella dei dettagli della colonna GPC, fase mobile, la temperatura, il volume di iniezione, e rilevatore di lunghezza d'onda.
- Estrazione del campione (per lo schermo di lievito estrogeni)
- Filtrare i campioni come indicato nella sezione 1.2.1.1. Fissare le fodere monouso valvole, cartucce C18 SPE, e serbatoi cartuccia all'apparato SPE. Accendere la pompa a vuoto per testare l'apparecchiatura è adeguatamente sigillato.
- Pipettare 5 ml di metanolo in ciascun serbatoio, per condizionare la C18 cartucce. Attivare vuoto (a circa 5 inHg per consentire un flusso di circa 5 ml al minuto) e far funzionare il liquido attraverso, facendo una pausa per 1 min a metà. Non lasciate che le cartucce di funzionare a secco. Ripetere sia con grado HPLC o acqua bidistillata (DDH 2 O). Anche in questo caso non funzionare a secco.
- Estrarre campioni di acqua come descritto nella sezione 1.2.1.4. Continuare il vuoto per almeno 30 minuti per asciugare le cartucce.
- Luogo asciutto e pulito fiale di raccolta 10 ml in un rack nel collettore di aspirazione. Controllare che ogni nave è al di sopra di un flaconcino. Aggiungere 5 ml di metanolo per ciascun serbatoio. Accendere il vuoto (flusso massimo di 5 ml / min) e permettere al liquido di passare attraverso la cartuccia nel flaconcino, fermandosi per 2 min a metà.
- Prima di analisi utilizzando la schermata YES, ridurre l'estratto a secchezza incipiente con azoto e ricostituire con 500-1000 ml di etanolo. Sigillare i coperchi di fiale campione per evitare l'evaporazione e conservare a 4 ° C (in un free-scintillafrigo).
2. Analisi chimica utilizzando LCMS / MS
- Ottimizzare le condizioni di funzionamento del sistema LCMS / MS utilizzando le istruzioni del produttore.
- Analizzare soluzioni standard di taratura, gli estratti dei campioni, campioni di controllo in bianco e analitica della qualità (AQC) utilizzando la cromatografia liquida e le condizioni di spettrometria di massa, e monitorare le transizioni di ioni come indicato nella tabella 2. Determinare la concentrazione di estrogeni steroidi nell'estratto del campione utilizzando interna norme 10.
| LCMS | |||||
| Cromatografia liquida | |||||
| Colonna: | C18 (2), 150 x 4.6 mm 5 micron. | ||||
| Volume di iniezione: | 20 microlitri | ||||
| Flusso: | 0,5 ml al minuto. | ||||
| MFase Obile: | Solvente A: acqua contenente 0,1% di ammoniaca. | ||||
| Solvente B: acetonitrile. | |||||
| programma di Gradiente: | |||||
| Tempo (min) | 0 | 10 | 18 | 24 | 28 |
| A: B rapporto di solvente | 90:10:00 | 50:50:00 | 0.479167 | 0.479167 | 90:10:00 |
| Spettrometria di massa | |||||
| Fonte: | Elettrospray (ioni negativi) | ||||
| Gas e la fonte: | CUR: 20 psi, GS1: 70 psi, GS2: 30 psi | ||||
| TEM: 600 ° C, gas CAD 5 e IonSpray tensione -900 | |||||
| transizioni MRM: | |||||
| E1: | 269/145 e 269/143 | ||||
| E2: | 271/145 e 271/143 | ||||
| EE2: | 295/145 e 295/143 | ||||
| E1-D4: | 273/147 | ||||
| E2-D4: | 275/147 | ||||
| EE2-D4: | 299/145 | ||||
Tabella 2. Dettagli parametri e le condizioni per l'analisi LCMS / MS di estrogeni steroidi in estratti delle acque reflue. Tabella dona volume di iniezione del campione e la portata, le condizioni di fase mobile AND gradiente.
3. estrogenica Attività Usando in vitro schermo lievito estrogeni (SI) Assay 8
- Preparare e memorizzare i componenti medie e medio minimo come da Tabella 3 (a) a (g).
| (a) terreno minimo (pH 7.1): |
| Preparare una Fe 2 (SO 4) 3 soluzione aggiungendo 40 mg di Fe 2 (SO 4) 3 a 50 ml di acqua bidistillata (DDH 2 O) |
| Aggiungere 1 L DDH 2 O per un bicchiere di vetro 2 L |
| Aggiungere i seguenti componenti al bicchiere: |
| 13.61 g KH 2 PO 4 |
| 1.98 g (NH 4) 2 SO 4 |
| 4,2 g KOH |
| 0,2 g MgSO 4 |
| 1 ml di Fe 2 (SO 4) 3 soluzione |
| 50 mg L-leucina |
| 50 mg di L-istidina |
| 50 mg adenina |
| 20 mg di L-arginina-HCl |
| 20 mg di L-metionina |
| 30 mg L-tirosina |
| 30 mg di L-isoleucina |
| 30 mg di L-lisina-HCl |
| 25 mg di L-fenilalanina |
| acid 100 mg L-glutammico |
| 150 mg di L-valina |
| 375 mg di L-serina |
| Mettere il bicchiere sul agitatore riscaldata con una pulce magnetica e mescolare fino a quando tutto è sciolto |
| Verificare che il pH è 7.1 e regolare, se necessario, |
| Utilizzando un 50 ml siringa sterile erogare 45 ml aliquote in bottiglie di vetro con vite di metallo top coperchi |
| Sterilizzare il terreno minimo a 121 ° C per 10 minuti in autoclave |
| Conservare a temperatura ambiente |
| (b) D - (+) - Glucosio: |
| Preparare un 20% w / v in DDH 2 O |
| Dispensare 20 ml aliquote a fiale di vetro con coperchi a vite in metallo top |
| Sterilizzare la soluzione di glucosio a 121 ° C per 10 minuti in autoclave |
| Conservare a temperatura ambiente |
| (c) L-aspartico Acido: |
| Ottenere una soluzione stock di 4 mg / ml in DDH 2 O |
| Dispensare 20 ml aliquote a fiale di vetro con coperchi a vite in metallo top |
| Sterilizzare la soluzione L-aspartico a 121 ° C per 10 minuti in autoclave |
| Conservare a temperatura ambiente |
| (d) Vitamina Soluzione: |
| Preparare una soluzione di biotina aggiungendo 2 mg di biotina a 100 ml di DDH 2 O |
| Pesare 8 mg di tiamina, 8 mg di piridossina, 8 mg di acido pantotenico, inositolo 40 mg. Aggiungere tutti i componenti secchi e 20 ml della soluzione di biotina a 180 ml DDH 2 O |
| Rendere 10 ml aliquote sterili filtrando attraverso un 0,2 micron dimensione dei pori del filtro monouso in bottiglie di vetro sterili, in una cappa a flusso laminare |
| Conservare a 4 ° C |
| (e) L-Treonina: |
| Preparare 100 ml di 24 mg / ml di L-treonina in DDH 2 O |
| Dispensare 10 ml aliquote a fiale di vetro con coperchi a vite in metallo top |
| Sterilizzare la soluzione L-treonina a 121 ° C per 10 minuti in autoclave |
| Conservare a temperatura ambiente |
| (f), rame (II) Solfato: |
| Preparare 25 ml di (II) solfato soluzione 20 mM di rame in DDH 2 O |
| Effettuare 5 ml aliquote sterili filtrando attraverso un 0,2 micron filtro dimensione dei pori in bottiglie di vetro sterili, in una cappa a flusso laminare |
| Conservare a temperatura ambiente |
| (g) di rosso di clorofenolo-β-D-galactopyranoside (CPRG): |
| Preparare 25 ml di una soluzione 10 mg / ml di CPRG in DDH 2 O |
| Effettuare 5 ml aliquote sterili filtrando attraverso un 0,2 micron filtro dimensione dei pori in bottiglie di vetro sterili, in una cappa a flusso laminare |
| Conservare a 4 ° C |
Tabella 3. Lievito dosaggio di estrogeni schermo; preparazione e conservazione dei minimi componenti medie e medio.
- Preparazione e storage di 10x coltura di lievito concentrato
- Il giorno 1, preparazione terreno di crescita (come dettagliato nella 3.4.1) e versare in una beuta sterile. Aggiungere 125 ml di 10x lievito concentrato dalla fiala criogenico conservati a -20 ° C. Incubare i media inoculato a 28 ° C per circa 24 ore su un agitatore orbitale.
- Il giorno 2, fare due bottiglie di mezzo di crescita (~ 50 ml) e versare in beute sterili separati. Aggiungere 1 ml di 24 ore di lievito coltivato in ogni bottiglia di terreni di crescita. Incubare i media inoculato a 28 ° C per circa 24 ore su un agitatore orbitale.
- Il giorno 3, versare ogni cultura di 24 ore in una provetta sterile da centrifuga da 50 ml. Centrifugare le provette da 50 ml a 4 ° C per 10 min a 2000 x g. Eliminare il sopranatante e risospendere ogni pellet in 5 ml di terreno minimo con il 15% glicerolo. Fare 0,5 ml aliquote della coltura di lievito concentrato 10x in 1,2 ml cryovials sterile e conservare a -20 ° C per un massimo di 4 mesi.
- Preparazione e di stoccaggio delle scorte chimici per curve standard
- Risciacquati e spatole due volte con etanolo assoluto e lasciare asciugare prima dell'uso per rimuovere eventuali tracce di contaminanti.
- Pesare E2 direttamente in una fiala di vetro in un armadio di pesatura polveri e regolare la concentrazione in volume in etanolo assoluto. Diluire a una concentrazione di 2x10 -7 M (54.48 mg / L). Guarnizione del coperchio e conservare a 4 ° C (in un frigorifero senza scintille).
- produttore Assay
- Il giorno 0, preparare il terreno di coltura. Per il flacone 45 ml di terreno minimo aggiungere 5 ml di soluzione di glucosio, soluzione di 1,25 ml di acido L-aspartico, 0,5 ml di soluzione di vitamina, 0,4 ml di soluzione di L-treonina, e 125 microlitri di rame (II) solfato soluzione. Versare mezzo di crescita in una beuta sterile.
- Aggiungere 125 ml di 10x magazzino concentrato (scongelato dallo stoccaggio -20 ° C) al pallone e incubare i media inoculate a 28 ° C per circa 24 ore su un agitatore orbitale.
- Il giorno 1, etichettare un 96 pozzetti 'piastra di diluizione' sterile e fare diluizioni seriali (100 volumi microlitri di etanolo) di E2 curva standard e test chimico (s) / estratto di effluente (s) (ad esempio, EE2).
- Etichetta sterile da 96 pozzetti otticamente piatta 'piastra di dosaggio (s)' fondo microtitolazione. Su ogni piastra di comprendere spazi (più / meno solvente) e una curva standard E2, oltre alle righe di sostanza chimica (s) / estratto di effluente (s).
- Pipettare 10 ml di ciascuna concentrazione (E2, chimici o estratto) nella ben appropriata della piastra saggio. Pipettare 10 ml di etanolo in ogni pozzetto 'solvente in bianco' della piastra saggio. Lascia piatto saggio con il coperchio per far evaporare a secchezza.
- Effettuare una bottiglia di mezzo di crescita (~ 50 ml) e aggiungere red-β-D-galattopiranoside soluzione 0,5 ml di clorofenolo (CPRG) per bottiglia. Determinare la densità delle cellule di lievito nella coltura di 24 ore misurando la torbidità della coltura a 620 nm in un lettore di piastre. Inoculare il unmedia ssay con 4x10 cellule di lievito 7 dalla cultura 24 ore.
- Versare terreno di coltura inoculato in un trogolo sterile. Usando una pipetta multicanale aggiungere 200 ml di terreno di coltura inoculato in ciascun pozzetto della piastra a 96 pozzetti test.
- Mettere il coperchio sulla piastra di dosaggio 96 e sigillare i bordi con nastro adesivo. Agitare la piastra di dosaggio (s) vigorosamente per 2 minuti su un agitatore titolo e incubare a 32 ° C in un armadio riscaldante ventilazione naturale.
- Il giorno 2, agitare la piastra test (s) con forza su un agitatore titolo per 2 minuti. Ritorno a 32 ° C incubatore.
- Il giorno 4, agitare la piastra test (s) energicamente per 2 minuti su un agitatore titolo. Lasciare la piastra (s) riposare per circa 1 ora quindi leggere la piastra di test (s) in assorbanza a 540 nm (assorbanza ottimale per CPRG ~ 575 nm) e 620 nm (per torbidità) utilizzando un lettore di piastre. Dare piastra (s) a temperatura ambiente e leggere in seguito, se necessario.
- Il giorno 0, preparare il terreno di coltura. Per il flacone 45 ml di terreno minimo aggiungere 5 ml di soluzione di glucosio, soluzione di 1,25 ml di acido L-aspartico, 0,5 ml di soluzione di vitamina, 0,4 ml di soluzione di L-treonina, e 125 microlitri di rame (II) solfato soluzione. Versare mezzo di crescita in una beuta sterile.
- calcoli attività estrogenica
- letture corrette analisi per torbidità utilizzando la seguente equazione: corretto value = campione o standard (E2) assorbanza a 540 nm - [campione o standard assorbanza (E2) a 620 nm - assorbanza del bianco a 620 nm]. Trama E2 curva standard con spazi adeguati (per verificare la presenza di contaminazione) 8.
- Utilizzare l'esempio corretto (estratto o chimica) per calcolare 'equivalenti Estradiolo. Utilizzare i valori tracciati E2 curva standard e equazione di regressione (3-parametro polinomiale o lineare a seconda della forma) per interpolare il campione / estrarre i valori di assorbanza a valori equivalenti E2. Uso fattore di concentrazione (cioè, acqua estratta e il volume di etanolo dell'estratto viene risospeso in) per calcolare attività estrogenica del campione pre-estratto.
4. Valutazione Laboratorio Based di estrogenica attività Utilizzando In Vivo vitellogenina induzione a Malè Fathead Minnows
- Utilizzare pesciolini Fathead maschi (Pimephalespromelas)> 4 mesi di età, che mostrano caratteri sessuali secondari (ad esempio, lo sviluppo di tubercoli nuziali e un fatpad dorsale) indicativo della determinazione sessuale maschile.
- Per evitare che l'attività di deposizione delle uova, separato matura Maschi tre settimane (± 3 giorni) prima dell'inizio del test. Impostare almeno due acquari di vetro 45 L con un carico massimo di 3 g / L. Per garantire un numero sufficiente di pesci sani per la prova, usare un minimo di 100 maschi.
- Mantenere il pesce maschio in identiche condizioni ambientali, come sarà sperimentato nel test (cioè, la temperatura dell'acqua di 25 ± 1 ° C e 16: luce 8 ore: fotoperiodo scuro). Mantenere la portata dell'acqua di diluizione per ogni serbatoio per assicurare un tempo di sostituzione 95% di almeno ogni 6 a 8 ore, cioè 330 ml / min per un serbatoio 45 L.
- Apparecchiatura di prova e disegno sperimentale
- Utilizzare contenitori in vetro di grandi dimensioni per ospitare un carico di fino a 3 g di pesce per litro di watER. Per 8 maschi adulti (nominalmente 4,5 g ciascuno), utilizzare un serbatoio di 10-20 L.
- Utilizzare due serbatoi di repliche per ogni trattamento e lo scudo ciascun serbatoio da eventuali disturbi visivi superflui (ad esempio, utilizzare schermi carta plastificata tra i serbatoi). Identificare ogni serbatoio con un numero di studio, una concentrazione di esposizione e di un numero di identificazione della nave.
- Per gli studi di acque di scarico degli effluenti
- Al suo arrivo, trasferire immediatamente effluente in un serbatoio di stoccaggio a 10 ± 1 ° C. Inizia dosaggio effluenti entro due ore dal ricevimento del refluo.
- Feed dell'effluente, tramite pompa peristaltica, dal serbatoio di accumulo C 10 ° ad una nave acclimatazione. Scaldare l'effluente nel recipiente di acclimatazione di 18 ± 2 ° C. Pompa l'effluente riscaldato dal recipiente acclimatazione alle dosaggio / vasi di miscelazione e quindi alla acquari prova (che detiene il pesce). Riscaldare acquari ad una temperatura di 25 ± 1 ° C.
- Per gli studi di dosaggio chimico
- Pesare le sostanze chimiche di prova in un armadio di polvere di pesatura. Preparare le scorte chimiche concentrate in DDH 2 O preferibilmente senza l'uso di solventi.
Nota: Se i solventi sono necessarie per solubilizzare composti in esame, utilizzare controlli con solvente in aggiunta al controllo dell'acqua di diluizione. - A gravità o acqua di diluizione pompa da un serbatoio a temperatura controllata con dispositivo di controllo del flusso (s) di dosaggio / recipiente di miscelazione. Pompa concentrato chimico stock (s) utilizzando un sistema di pompaggio peristaltico al dosaggio / vasi di miscelazione. Controllare la velocità della pompa (disponibile chimica) e portata d'acqua (acqua di diluizione) per raggiungere la concentrazione di esposizione desiderato.
Nota: utilizzare tubo in silicone per alimentare acqua / test chimico per ciascun recipiente di prova dal dosaggio / recipiente di miscelazione. Utilizzare una portata che è sufficiente a fornire un sostituto recipiente 75% in almeno 24 ore, cioè 20 ml / min per un serbatoio 20 L. Mantenere la portata al ± 10% del valore nominale specificato.
- Pesare le sostanze chimiche di prova in un armadio di polvere di pesatura. Preparare le scorte chimiche concentrate in DDH 2 O preferibilmente senza l'uso di solventi.
- Mantenere la temperatura esposizione all'acqua del serbatoio a 25 ± 1 ° C, ossigeno disciolto superiore al 70% del valore di saturazione dell'aria (5.8 mg L -1 a 25 ° C) e ± 0,5 unità di pH (a partire pH tra 6,5 e 8,5) in tutto lo studio. Impostare le condizioni di luce al fotoperiodo di luce 16 ore: 8 ore scuro, con periodi di transizione / crepuscolo all'alba di 20 min.
- Nutrire il pesce due volte al giorno con appena scongelati adulto congelato artemia (Artemia) a 2,5 (± 0,1) g per serbatoio per caduta. alimentare Anche il pesce una volta al giorno con una piccola quantità (due antischiacciamento) di un cibo per pesci fiocco tropicale. Lasciare un minimo di 3 ore tra ogni avanzamento.
- Mantenere un record alimentazione quotidiana per monitorare la risposta alimentazione / comportamento (buono, moderata o scarsa, rispetto ai controlli). Sifone i carri armati, almeno due volte a settimana (preferibilmente ogni giorno) per rimuovere qualsiasi cibo e le feci non consumati. Pulire i lati e il fondo dei recipienti almeno una volta alla settimana.
- Prendere campione d'acqua settimanales da ogni cisterna per confermare attività estrogenica (via schermo lievito) e la composizione chimica (via chimica analitica). Vedere le sezioni 1-3 per i dettagli di campionamento delle acque, l'estrazione e l'analisi.
Nota: Per ogni esperimento, utilizzare il controllo di diluizione dell'acqua (controllo negativo), controllo positivo (E2 o EE2) più almeno tre diluizioni di effluenti (100, 50 e 25%) o test chimico per monitorare la risposta dose. Se nuove tecnologie sono testati, utilizzare compound / effluente con o senza trattamento (ad esempio, EE2 senza trattamento, EE2 con perossido TAML / idrogeno (H 2 O 2) trattamento 12; Figura 1).
- Utilizzare contenitori in vetro di grandi dimensioni per ospitare un carico di fino a 3 g di pesce per litro di watER. Per 8 maschi adulti (nominalmente 4,5 g ciascuno), utilizzare un serbatoio di 10-20 L.
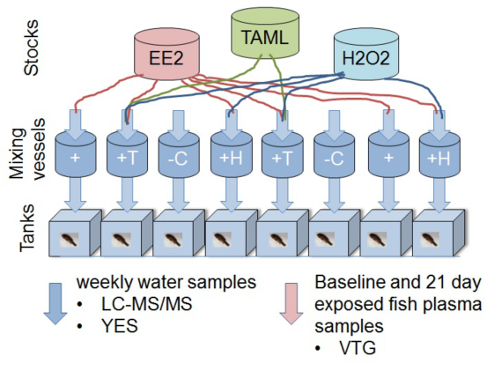
Figura 1. Schema che rappresenta disegno sperimentale di un in vivo vairone a testa grossa vitellogenin saggio biologico per determinare la rimozione di ecotossicità di 17α-etinilestradiolo con TAML trattamento delle acque / perossido. Il experimental impostare consiste di otto acquari vetro 11 L ciascuno alimentato con un flusso continuo di acqua. Soluzioni chimiche Stock individuali e acqua (filtrata de-clorurati) vengono consegnati alle camere di miscelazione. Le concentrazioni nominali (senza reazione) nei vasi di miscelazione sono 2 ng / L EE2, 80 Nm TAML e 0,16 mg / LH 2 O 2. Le soluzioni chimiche Stock (EE2, H 2 O 2 e TAML) sono preparati e dosati separatamente in modo che le reazioni iniziano nei vasi di miscelazione. Pesce (8 pesciolini fathead maschi per serbatoio) sono esposti alla miscela (s) dopo un tempo di contatto di reazione di circa 45 minuti. I campioni di acqua sono presi dai serbatoi di esposizione settimanale. I campioni di plasma sono presi da pesciolini fathead per misurare la vitellogenina biomarker estrogenica (VTG) da un gruppo basale, all'inizio dello studio, e tutti gli altri pesci dopo 21 giorni di esposizione. I trattamenti specifici sono: '-C'; controllo negativo (acqua di diluizione solo), '+'; controllo positivo di EE2,'+ H'; EE2 più H 2 O 2, '+ T'; EE2 più H 2 O 2 più TAML. Questa cifra è stata modificata da Mills et al. 2015 12. Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Procedura di prova
- periodo di acclimatazione
- Misurare peso umido (g) di ogni pesce maschi sessualmente maturi, e allocare in modo casuale per ogni serbatoio (8 maschi per ogni serbatoio).
- Mantenere i pesci non allocato dallo stesso lotto e mantenerli nelle stesse condizioni di prova. Utilizzare questi pesci per sostituire tutti gli individui che mostrano segni di danni fisici o di una mancanza di condizioni durante il periodo di acclimatazione di 7 giorni. Assicurare alla fine del periodo di acclimatazione ciascun serbatoio di trattamento ha 8 maschi che sono pienamente acclimatati alle condizioni di prova.
- Prendere campioni di plasma 'di base' da ulteriori 8 maschi dalla stessa batch di pesci di sesso maschile. Seguire il metodo di campionamento del sangue nella sezione 4.4 e il metodo vitellogenina (VTG) analisi 4.5.
- Dopo il periodo di acclimatazione, consegnare scorte di dosaggio degli effluenti chimici o ai serbatoi di esposizione per 21 giorni, come descritto al punto 4.2.2 o 4.2.3. mortalità Monitor, comportamento e l'aspetto fisico del pesce in ogni replicano serbatoio giornaliero prima della prima alimentazione del giorno. Registra qualsiasi comportamento anomalo o di incidenti.
Nota: Assicurare le condizioni ambientali e di tassi di alimentazione mantenere la salute dei pesci (punti 4.2.4 e 4.2.5).
- periodo di acclimatazione
- Il campionamento di pesce dopo periodo di esposizione di 21 giorni
- 12 ore prima del campionamento, smettere di alimentare i pesci.
- tubi micro-centrifuga Label per la raccolta di campioni di sangue, aggiungono ~ 5 ml di Aprotinin (un inibitore della proteasi) e disporli sul ghiaccio.
- Fare una soluzione di 500 mg / L di MS222 (anestetico) sciogliendo 500 mg di MS222 per 1 L di acqua de-clorurati (in precedenza acclimatatia 25 ± 1 ° C). Neutralizzare il MS222 a pH 7,4 ± 0,4 con 1 M NaOH.
- Spostare ogni pesce dal serbatoio nel MS222 tamponata. Conservare nella soluzione fino alla cessazione di ogni movimento opercolo (tipicamente 5 ± 1 min).
- Misurare e registrare la lunghezza delle forche (mm) sotto l'anestetico terminale. Utilizzare un bisturi monouso amputare la coda, e utilizzare un tubo hemocrit eparinizzata per raccogliere il sangue dall'arteria caudale (Figura 2). erogare con cautela il sangue nella provetta pre-etichettati e tenere in ghiaccio.
- Uccidere il pesce subito dopo aver disegnato il sangue. Conferma morte per cessazione permanente della circolazione e / o la distruzione del cervello. Misurare e registrare il peso del pesce totale (al più vicino 0,01 g), e sezionare i tessuti come richiesto.
- Centrifugare il sangue (7000 xg per 5 minuti a 4 ° C) in 2 ore di collezione. Trasferire il surnatante del plasma con una pipetta in nuova etichetta 0,4 ml microcentrifuga vascaES e memorizzare sul ghiaccio. Bloccare le provette contenenti plasma in ghiaccio secco in 30 min di centrifugazione e conservare a -80 ° C prima dell'analisi delle concentrazioni plasmatiche VTG.

Figura 2. Foto che ritraggono maschio pesciolino Fathead (promelas), raccolta del plasma e la posizione dei testicoli. Al termine dell'esposizione di 21 giorni tutti i pesci devono essere uccisi per raccogliere campioni di sangue. Una volta sotto questo terminale lunghezza pesce anestetico (lunghezza della forcella, mm) devono essere misurati, seguito rapidamente da prelievo di sangue dall'arteria caudale Photo-A:. Linea rossa tratteggiata indica la posizione per la coda amputazione (un bisturi monouso dovrebbe essere usato amputare la coda ). Photo-B mostra un tubo hemocrit eparinizzata utilizzato per raccogliere il sangue. Ogni pesce dovrebbe quindi essere ucciso immediatamente dopo il campione di sangue è stato preso, in questo caso l'intera testaè stato reciso dal corpo (Photo-C). Una volta che il pesce è stato ucciso cavità del corpo può essere aperto per rivelare gli organi interni. Photo-C mostra la posizione del testicolo (gonadi) in relazione alla vescica natatoria (SB) nei pesci ciprinidi, ad esempio, vairone a testa grossa, lasche, carpe, ecc Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Misurare le concentrazioni plasmatiche VTG con un kit di omologa VTG enzyme-linked immunosorbent assay (ELISA) progettato specificamente per pesciolini fathead.
- Preparare gli standard e buffer VTG come indicato nel protocollo del produttore. Diluire campione di plasma 1:50, 1: 5.000 e 1: 500.000 e li dosaggio in duplicato per ottenere letture all'interno della gamma curva standard VTG secondo le istruzioni del produttore. Seguire le linee guida del produttore per calcolare le concentrazioni di vitellogenina.
5. valutazioni sul campo di Avanzato / Novel trattamento delle acque reflue tecnologie per mitigare estrogenica Attività Utilizzando In Vivo vitellogenina e intersessuali induzione a Roach (Rutilus rutilus)
- Cattura di scarafaggio selvatici che vivono a valle di scarichi trattamento delle acque reflue
Nota: utilizzare lasca (Rutilus rutilus) o altre specie abbondante acqua dolce o salmastra di pesce, che sono gonochoristic e conosciuto per essere sensibili alle alterazioni del sistema endocrino estrogenica.- La cattura di pesci utilizzando elettropesca, netting, intrappolando o altri metodi di pesca riconosciuti a seconda della situazione 13. Trasporto del pesce in vasche aerate torna al laboratorio per il campionamento.
- Preparare microprovette come descritto nella 4.4.2. Preparare tamponata MS222 come descritto in 4.4.3. Anestetizzare il pesce come descritto nella 4.4.4.
- Misurare la lunghezza del pesce e il peso sotto anestesia terminale.
- Prelevare il sangue dal caudale dell'arteria utilizzando disposable siringa eparina. Uccidi ogni pesce immediatamente dopo la raccolta campione di sangue. erogare con attenzione il sangue in provette da microcentrifuga pre-etichettati e tenere in ghiaccio. Preparare il plasma come descritto al punto 4.4.7 e misurare VTG mediante test ELISA (4.5).
- Utilizzando pinze rimuovere 2-3 scaglie di pesce da ogni pesce e porre in etichettate singolarmente buste di carta di piccole dimensioni. buste Conservare a temperatura ambiente in condizioni di asciutto per la determinazione dell'età pesce più tardi e l'analisi della crescita.
- cavità aperta corpo con un bisturi per rivelare gli organi interni. Estrarre l'intestino per rivelare la vescica natatoria con un gonadi posta a cavallo (Figura 2). Rimuovere con attenzione le gonadi in coppia con pinza sottile naso e posto in un flaconcino di vetro. Coprire le gonadi con fissativo di Bouin con un rapporto di 1:10 del tessuto: fissativo.
- Lasciare il tessuto in Bouin per 6-24 ore a seconda delle dimensioni del tessuto (fissativo penetra a 1 mm per ora). Una volta fissato, versare fuori fissativo una del BouinD Sostituire con il 70% alcool denaturato industriale (IMS). Conservare il tessuto fissato a temperatura ambiente fino tessuti sono trattati per istopatologia (paragrafo 5.3).
- La valutazione Campo base di attività estrogenica utilizzare in vivo vitellogenin e intersessuali induzione Roach
- Disegno sperimentale e impostare
Nota: Impostare i carri armati e impianto pilota con largo anticipo del vivo lavoro partenza. Avviare i serbatoi scorre 3-4 settimane prima di qualsiasi aggiunta di pesci al sistema. Monitorare portate d'acqua, la qualità e le condizioni (pH, temperatura, ossigeno disciolto, ecc) regolarmente per assicurarsi che i parametri di acqua può essere mantenuta.- Costruire grandi serbatoi acqua di rubinetto (ad esempio, 300-1,000 L) in loco presso l'impianto pilota, che può ricevere 'controllo' de-clorurati, standard di acque trattate (s) e Advanced effluente trattato (s) in parallelo. Fissare la pompa di aria / aeratori ai serbatoi. Set portate d'acqua per raggiungere almeno 6 serbatoio vscambi OLUME al giorno.
Nota: Assicurarsi che i serbatoi sono ben isolati e ombreggiate per evitare eccessive fluttuazioni termiche giornaliere. Serbatoi progettazione per consentire l'osservazione del pesce, per alterazioni comportamentali (mancanza di alimentazione, ecc), segni di malattia e mortalità.
- Costruire grandi serbatoi acqua di rubinetto (ad esempio, 300-1,000 L) in loco presso l'impianto pilota, che può ricevere 'controllo' de-clorurati, standard di acque trattate (s) e Advanced effluente trattato (s) in parallelo. Fissare la pompa di aria / aeratori ai serbatoi. Set portate d'acqua per raggiungere almeno 6 serbatoio vscambi OLUME al giorno.
- Inizia l'esposizione di galleggiamento i sacchi di Roach (dalla fattoria pesce) nei rispettivi serbatoi per 1 ora. Aggiungere acqua serbatoio per le borse gradualmente fino a temperatura dell'acqua e le condizioni sono ambiente. Rilasciare il pesce in loro carri armati.
- Alimentare scarafaggio adulto ogni giorno sul cibo per pesci pellettato (formato 0,5-0,8). Alimentare scarafaggio giovanile quotidianamente sul piccolo pellet (pellet dimensioni 100-300) non-estrogenici di alimentazione 14 ad libitum, rettificato sulla base di mangimi non consumati. Tenere un registro giornaliero di alimentazione risposta alimentazione documentazione / comportamento (buono, moderata o scarsa, rispetto ai controlli).
- Prendere campioni di acqua settimanali da ogni cisterna per confermare attività estrogenica e la composizione chimica. See sezioni di 1-3 per i dettagli di metodi di campionamento e di analisi dell'acqua.
- Disegno sperimentale e impostare
- L'esame istopatologico di pesce gonadi 15
- Rimuovere con attenzione le gonadi sezionati e fissi (descritte nei passi 5.1.6 e 5.1.7) dal contenitore con pinzette e posto su un tagliere.
- Utilizzare una lama microtomo per tagliare ogni gonade in 3 parti (anteriore, media e posteriore) e da ogni parte tagliato una sezione trasversale spessore di 3-5 mm. Posizionare con cura tutti e sei i pezzi in una cassetta di plastica biopsia etichettato, e posto in tessuto processore utilizzando i tempi indicati nella tabella 4.
- Cera tessuti incorporare e sezione sul microtomo rotativo (3-5 micron). sezioni Trasferire vetrini rivestito etichettati bio-adesivo e posto diapositive su un piatto riscaldato (impostato a 45 ° C) per asciugare per 24 ore.
- Stain le diapositive, manualmente o tramite un coloratore automatico, utilizzando i tempi descritti in Tabella 5. Mettere una goccia di mezzo di montaggio sul tessuto macchiato, elay un vetro coprioggetto sopra il mezzo di montaggio per proteggere i tessuti.
- In primo luogo, esaminare ogni diapositiva a basso ingrandimento (20X, cioè oggettiva 2X, con linee 10X dell'occhio di ingrandimento) per determinare il sesso e il numero di punti di allegati alla cavità del corpo 15. Prendere nota di eventuali anomalie per ogni pesce.
- Ad un maggiore ingrandimento (100X o 400X), esaminare il tessuto per valutare le fasi gametogenesi, anomalie e la presenza di ovociti in tessuto testicolare. Registrare la gravità della intersessualità utilizzando il seguente sistema di classificazione da 0 (tessuto maschio normale) a (tessuto ovarico 100%) 7 6 (vedi Tabella 6).
| numero di passo | Trattamento | Scopo | Tempo (h) |
| 1 | 70% IMS | Disidratazione | 3 |
| 2 | 90% IMS | Disidratazione | 2.5 |
| 3 | 95% IMS | Disidratazione | 1.5 |
| 4 | 100% IMS | Disidratazione | 1.5 |
| 5 | 100% IMS | Disidratazione | 1.5 |
| 6 | 100% IMS | Disidratazione | 1.5 |
| 7 | 100% IMS | Disidratazione | 1.5 |
| 8 | agente di compensazione Istologia | radura | 1.5 |
| 9 | agente di compensazione Istologia | radura | 1.5 |
| 10 | agente di compensazione Istologia | radura | 1.5 |
| 11 | CERA | Cera infiltrazione | 1.25 |
| 12 | CERA | Cera infiltrazione | 1.25 |
| 20 hr TOTALE |
Tabella 4. regime di perfezionamento per la cera impregnazione tessuti per istopatologia. I tessuti devono essere trattati in un processatore automatico. I tessuti devono essere immersi nelle soluzioni dettagliate per il periodo di tempo specificato.
| Stain no. | Macchia | Scopo | Tempo (min) |
| 1 | agente di Istologia Clearing | Si scioglie la cera | 15 |
| 2 | 100% IMS | Idratazione | 2 |
| 3 | 90% IMS | Idratazione | 2 |
| 4 | 70% IMS | Idratazione | 2 |
| 5 | ACQUA RUBINETTO (in esecuzione) | Sciacquare | 2 |
| 6 | HAEMOTOXYLIN | nuclei delle cellule macchie blu | 10 |
| 7 | ACQUA RUBINETTO (in esecuzione) | rimuovere l'eccesso | 10 |
| 8 | acidificato IMS | declorazione | 20 sec |
| 9 | ACQUA RUBINETTO (in esecuzione) | Sciacquare | 20 sec |
| 10 | Lico 3 | sale | 20 sec |
| 11 | ACQUA RUBINETTO (in esecuzione) | Sciacquare | 20 sec |
| 12 | 1% EOSINA (acquosa) | Macchie di colore rosa citoplasma | 20 sec |
| 13 | ACQUA RUBINETTO (in esecuzione) | rimuovere l'eccesso | 5 |
| 14 | 70% IMS | Disidratazione | 2 |
| 15 | 90% IMS | Disidratazione | 2 |
| 16 | 100% IMS | Disidratazione | 5 |
| 17 | agente di Istologia Clearing | Rimuovere IMS, legante | 5 |
Tabella 5. Soluzioni e tempi di immersione per Ematossilina e eosina (H & E) colorazione dei tessuti gonadici pesce. I vetrini deve essere collocato in ogni bagno per la allocated volta in sequenza. H & E colorazione dei tessuti è necessaria per determinare l'impatto di sviluppo o organizzative di effluenti di acque reflue estrogenici sulle gonadi di pesce.
| Punto | Sezione Descrizione |
| 0 | Normale testicoli maschili |
| 1 | Multifocale ovotestis con 1-5 ovociti (di solito singolarmente) sparsi tra il tessuto testicolare |
| 2 | ovotestis multifocale, 6-20 ovociti spesso in piccoli gruppi sparsi tra il tessuto testicolare |
| 3 | ovotestis multifocale, 21-50 ovociti in cluster |
| 4 | > 50 e <100 ovociti. Sezione è solitamente multifocale ed ha l'aspetto di un mosaico di provatessuto icular e ovarico. |
| 5 | > 100 ovociti, di solito multifocale ma potrebbe anche essere focale con zone chiaramente identificabili di tessuto ovarico e testicolare separata dal tessuto testicolare. |
| 6 | > 50 per cento del tessuto gonadico sulla sezione è ovarico ed è chiaramente separata dal tessuto testicolare da parte delle cellule epiteliali e tessuti fagociti. |
| 7 | 100 per cento del tessuto gonadico sulla sezione è ovarico. |
Tabella 6. sistema di punteggio per valutare la gravità della condizione di intersessualità in scarafaggio. Istologicamente vetrini preparati di tessuto gonadico devono essere esaminati al microscopio ottico, a 20X, 100X e 400X ingrandimento, per valutare eventuali anomalie e la presenza di ovociti in tessuto testicolare. Questa tabella viene modificata da Jobling et al. 2006 6.
Risultati
I tentativi di comprendere l'impatto dei miglioramenti ai processi di trattamento delle acque reflue o per determinare la tecnologia più appropriata per adeguare le attrezzature come trattamento terziario in impianti di depurazione esistenti per quanto riguarda l'efficacia della rimozione di attività perturbatrice a livello endocrino di scarichi idrici, richiede non solo la misura della sostanza chimica chiave componenti che entrano le opere ma richiede l'analisi dei prodotti di degradazione che possono anche avere attività endocrina perturbatrice. In acque di scarico domestiche, le sostanze più estrogeniche presenti sono gli ormoni steroidei, estrone (E1), 17β-estradiolo (E2) e 17α-etinilestradiolo (EE2) 5,8. Estrogeni steroidi sono escreti principalmente dal corpo come una miscela di coniugati inattivi 16,17. Questi estrogeni coniugati sono sostanzialmente deconjugated nel sistema fognario per l'attività batterica e l'ulteriore degradazione avviene nel trattamento delle acque reflue. Gli steroidi deconjugated are rimosso dal flusso delle acque reflue per assorbimento fanghi o biodegradata durante il trattamento secondario causando la formazione, in primo luogo di sottoprodotti di trasformazione e, infine completa mineralizzazione può verificarsi del componente attivo iniziale. L'analisi chimica di tutti i singoli composti nella corrente effluente sarebbe difficile, lungo e costoso e non coprirebbe componenti attivi sconosciuti presenti in un campione. Inoltre, una somma del contributo estrogenica di ciascun componente fornirà soltanto un'indicazione della potenza estrogenica cumulativo di un campione dei composti analizzati. Questo è un rischio in cui i processi di trasformazione generano sostanze estrogeniche sconosciute o dove l'influente è di origine industriale. Combinando analisi chimica con in vivo e in vitro biosaggi ecotossicologici fornisce una soluzione per la presenza di componenti estrogenici sconosciuti in miscele quali acque reflue trattate. In vitro come il lievito Estrogen Screen (SI) sono stati ampiamente utilizzati per determinare l'attività estrogenica di acque di scarico e per aiutare a identificare i componenti attivi nei campioni trattati 8,18,19. Tuttavia, il confronto tra in vivo e in vitro possono essere significativi 11 e una valutazione globale di nuovi processi per quanto riguarda il trattamento di interferente endocrino potenza richiede una batteria di test chimici ed ecotossicologia.
Per stabilire se i singoli impianti o processi di trattamento rimuovere i composti attivi dal flusso di acque reflue può essere ottenuta utilizzando l'analisi chimica, che segue l'estrazione del campione, la concentrazione e la pulizia dell'estratto prima dell'analisi, il più delle volte effettuata utilizzando LCMS (/ MS) o GCMS (/ MS) metodi. I dati ottenuti dalle analisi chimiche possono essere utilizzati per determinare la conformità con i singoli concentrazioni prevedibili senza effetti (PNEC) 20 o standard di qualità ambientales (SQA) 21 dei singoli composti specifico e quindi tali metodi sono di vitale importanza per i dati di conformità alle normative. Inoltre, mirati o metodi non-targeting analisi chimica permettono l'identificazione e la quantificazione di composti o isomeri individuali rispetto ai metodi biologici, che forniscono una risposta totale. metodi di analisi chimica consentono pertanto la valutazione di composti discreti per essere fatto per incontrare e per affrontare queste sfide trattamento delle acque reflue su base impianto di trattamento individuale. Studi hanno dimostrato che il trattamento delle acque reflue convenzionale (ad esempio, impianti a fanghi attivi) può essere altamente efficace nella rimozione di ormoni steroidei naturali sebbene rimozione del ormone sintetico EE2 tende ad essere meno efficace. Studi sul campo utilizzando trattamenti che utilizza tecniche come l'ozono, carbone granulato attivato (GAC) e membrane hanno dimostrato, anche se ad alto costo, che possono essere usati come soluzione end-of-pipe per rimuovere EE2 al di sotto preditti livelli di effetto e al di sotto dei limiti di rilevabilità. La figura 3 mostra la rimozione di EE2 utilizzando GAC in un impianto di trattamento delle acque reflue comunali scala pilota. Gli studi intrapresi su scala pilota negli impianti di trattamento delle acque reflue municipali utilizzando estremità del tubo trattamento GAC mostrano anche la riduzione della potenza estrogenica seguente GAC misurata utilizzando la schermata di lievito estrogeni (SI) come si vede in figura 4.
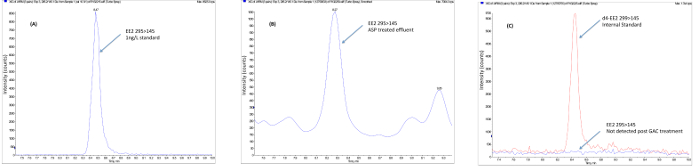
Figura 3. dati di campo Esempio che mostra la rimozione di etinilestradiolo in seguito al trattamento terziario avanzato. (A) I campioni sono raccolti presso l'impianto di trattamento seguente (impianto a fanghi attivi) trattamento convenzionale seguendo le procedure descritte per la conservazione del campione. (B) I campioni vengono estratti mediante estrazione in fase solida, ripulito per rimuovere sostanze che interferiscono con il normale SPE fase epermeazione di gel cromatografia. (C) L'estratto concentrato pulito è concentrata ad un volume basso e analizzato utilizzando negativo ioni elettrospray LCMS / MS in modalità MRM. I risultati sono calcolati utilizzando la standardizzazione interno utilizzando standard interni marcati con isotopi. Nell'esempio illustrato, EE2 è presente nell'effluente finale ASP ad una concentrazione superiore al prevista senza effetto (PNEC) di 0,1 ng / L e viene rimosso utilizzando GAC e ozono (O 3) ad una concentrazione di materiali. Fare click qui per visualizzare una versione più grande di questa figura.
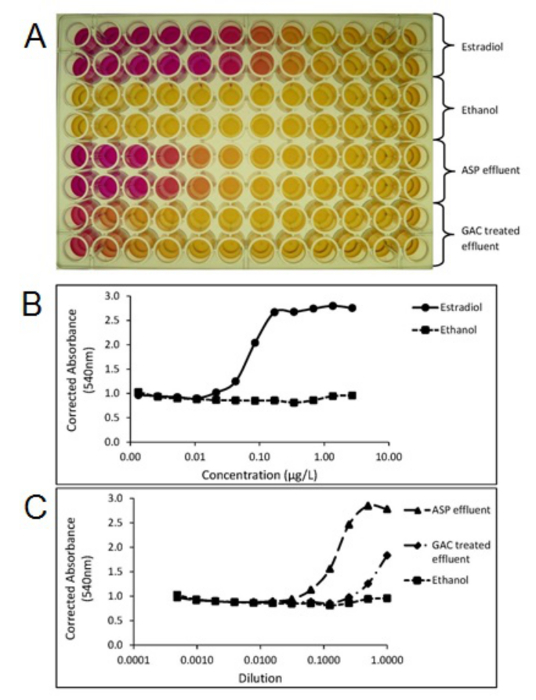
Figura 4. Foto di una piastra di test Yeast Estrogen schermo (SI) (A) mostrando cambiamento di colore dal giallo al rosso, relativa ad attività estrogenica dei campioni. Trame create dalla proiezione piastra di test SI corretti assorbanza (540nm) dello standard estradiolo (B), attivato processo a fanghi effluenti (ASP) e Carbone attivo granulare (GAC) trattati campioni di acque di scarico degli effluenti (C). Ogni campione è stato testato in duplicato. Effluenti ASP e GAC sono stati estratti e concentrati utilizzando i metodi SPE di cui al punto 1. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Ozonizzazione è anche efficace nella rimozione di estrogeni steroidei e attività estrogenica da impianti di trattamento delle acque reflue trattate in modo convenzionale. L'ozono è in grado di ossidare una vasta gamma di contaminanti organici e sostanze organiche disciolte in campioni di acque reflue e fornisce proprietà di disinfezione. L'efficacia di ozonizzazione dipende dalle caratteristiche dell'acqua quali pH, quantità di materia organica e la dose applicata di ozono. Estrogeni che sono mal rimossi dal trattamento convenzionale può essererimossi dalle acque di scarico con dosi comprese tra 0,8 e 2 mg O 3 / mg DOC. L'ozono è un agente ossidante selettiva, che reagisce con i siti di elettroni ricchi (legami insaturi carbonio-carbonio, composti aromatici, inclusi alcoli aromatici), che rende l'ozono applicabile per la ripartizione di un numero di EDC. Tuttavia, l'eliminazione di singoli composti non comporta necessariamente la mineralizzazione completa del composto originale. Le sostanze organiche seguente ozonizzazione può essere trasformata intermedi generatrici o trasformazione ossidazione sottoprodotti che includono un numero di basso peso molecolare, classi di composti polari quali aldeidi, chetoni, acidi carbossilici, acidi cheto, e composti bromurati. Esempi includono, bromato, formaldeide, acetaldeide e acidi carbossilici. Uso in vivo e in vitro biosaggi è stato dimostrato che, sebbene l'ozono ossida solo parzialmente alcune sostanze chimiche, i risultanti principali metaboliti hanno una minore estrogENIC potenza e quindi l'applicazione di ozono a un appropriato della dose risulta in una elevata rimozione di attività estrogenica.
Uno dei principali vantaggi di ulteriore trattamento di reflui è la riduzione della femminilizzazione dei pesci maschi a ricevere acque; un effetto negativo che può portare ad una riduzione della fertilità 3. Studi in vivo a base di pesce (per esempio, scarafaggio o vairone a testa grossa) esposti a cellule o ovociti femminili germinali delle acque reflue spettacolo nel testicolo di pesci di sesso maschile (ad esempio, come si vede in figura 5). Intersessualità o maschio VTG è assente o significativamente ridotta nei pesci in seguito al trattamento avanzato come GAC 7 o ozono 22. Questi studi mostrano che prodotti di trasformazione ottenuti durante ozonizzazione non sono estrogenici, tuttavia questo non affronta la tossicità dell'effluente prodotta. Questo problema è stato risolto in altri studi, ad esempio, uno studio condotto da Magdeburgo et al. 23 che dimostra che l'ossidazione dell'ozono sottoprodotti sono tossici per trota arcobaleno ma questa tossicità può essere rimosso mediante filtrazione sabbia valle dopo ozonizzazione.
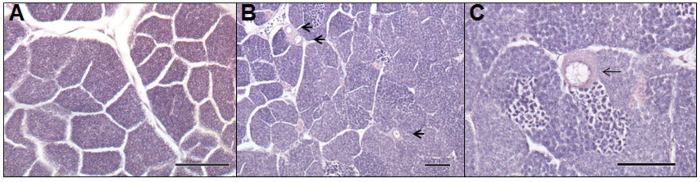
Figura 5. microfotografie di un maschio normale (A) e intersessuali (B, C) gonadi da adulto lasca (Rutilus rutilus) esposti ad acque reflue in un campo base di valutazione. Photomicrograph-A, raffigura una sezione istologica di normale testicoli maschili. Photomicrograph-B e -C, raffigura sezioni istologiche di un pesce maschio intersessuale, essendo stati esposti al processo a fanghi attivi delle acque di scarico degli effluenti per sei mesi. Le frecce indicano ovociti presenti nel tessuto testicolare. Barra della scala rappresenta 100 micron di ogni microfotografia. Clicca qui per vedere una versione più grande di questa figura.
Il costo elevato della fine del trattamento tubo con l'ozono, GAC o tecnologia a membrana richiede lo sviluppo di alternative a basso costo, metodi sostenibili per la perturbazione del sistema endocrino chimica (EDC) rimozione. Inoltre, adsorbimento e separazione metodi semplicemente separano EDC da una fase all'altra anziché eliminare tramite degradazione. Attivatori TAML sono stati sviluppati per catalizzare l'ossidazione di idrogeno perossido di microinquinanti organici nelle acque reflue 12,24 - 26. TAML attivatori con H 2 O 2 in modo efficace degradano EE2 e altri estrogeni steroidei in acqua pura di laboratorio così come negli effluenti provenienti da impianti di trattamento delle acque reflue municipali e nei campioni di urina a spillo 12. Gli studi di laboratorio, mostra TAML / H 2 O 2 trattamento fornisce alta rimozione estrogeni steroidi tra cui la rimozione EE2 e riduce sostanzialmente attività estrogenica misurata in vitro utilizzando il saggio biologico YES e substantially diminuisce femminilizzazione dei pesci in vivo misurata usando il saggio biologico VTG (Figura 1 e Figura 6).
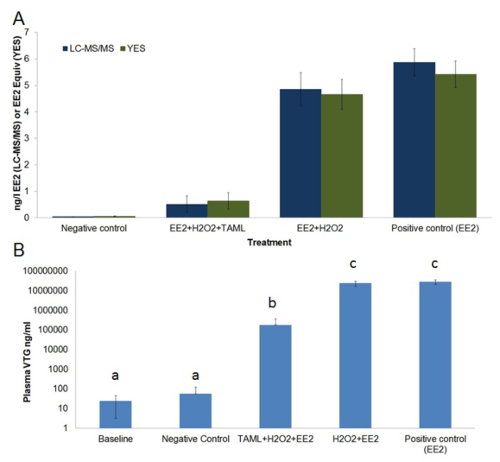
Figura 6. la concentrazione media EE2 e attività estrogenica in trattati e acque non trattate serbatoio (A) e vitellogenin plasma basale e pesci esposti maschio (B). A) la concentrazione EE2 (ng / L, barre blu scuro) è stata misurata da LCMS / MS , attività estrogenica (EE2 equivalente ng / L, barre di colore verde scuro) è stata misurata mediante in vitro schermo lievito estrogeni (sI). B) vitellogenin plasma (ng / ml, bar azzurre) la concentrazione di pesciolini fathead maschi sono stati misurati tramite un enzima quantitativa linked immunosorbent assay (ELISA). EE2 risultati delle analisi chimico indicati come <0,03 ng / L EE2 (cioè, inferiore a limite di rilevazione (LOD)) sono stati trattati come aventi la metà LOD (vale a dire, 0.015 ng / L EE2) per l'utilizzo nei calcoli delle medie, errore standard e l'analisi statistica. EE2 e attività estrogenica sono concentrazioni medie misurate campionati sopra l'esposizione di 21 giorni. Plasma VTG è stata misurata prima dell'esposizione (baseline) e dopo l'esposizione 21 giorni. Il regime di trattamento consisteva; controllo negativo (acqua di diluizione solo), EE2 + H 2 O 2 + TAML, EE2 + H 2 O 2, e EE2-only. Le barre di errore in grafico-A rappresentano l'errore standard della media, barre di errore in grafico-B rappresentano la deviazione standard. Le lettere di cui sopra bar grafico-B rappresentano somiglianza statistica. Questa cifra è stata modificata da Mills et al. 12 Cliccate qui per vedere una versione più grande di questa figura.
Discussione
impianti di depurazione sono la principale via di contaminazione delle acque di superficie con EDC. Una valutazione dell'efficacia di rimozione di attività endocrina di processi di trattamento convenzionali, avanzata o emergenti richiede l'uso di una varietà di saggi chimici e biologici. L'analisi chimica utilizzando l'analisi non mirati e mirata fornisce dati qualitativi o quantitativi sull'efficacia della rimozione dei singoli componenti e permette quindi una valutazione da effettuare sulla base degli standard di qualità ambientale o concentrazioni prevedibili senza effetti per i composti o miscele di composti analizzati.
La generazione di prodotti di trasformazione derivanti dalla mineralizzazione incompleta di sostanze dopo il trattamento e la presenza di componenti biologicamente attivi sconosciuti nelle acque reflue limita l'utilità del solo test chimici. Una combinazione di in vivo e in vitro biosaggi in combinazione con chimico analiticolo screening ry fornisce una serie di strumenti utili per determinare l'efficacia di rimozione EDC emergendo processi di trattamento delle acque reflue. Questi test, se condotta a fianco di tradizionali parametri di qualità dell'acqua e di altri end-point tossicologici e microbiologici consentono una valutazione critica delle tecnologie di trattamento delle acque reflue attuali ed emergenti.
E 'importante notare che gli schermi di estrogeni a base di lievito (ad esempio, SI) non sono l'unico in vitro per determinare la potenza estrogenica di prodotti chimici e reflui. Sono stati sviluppati un certo numero di stabilmente trasfettate test basati cellule di mammiferi anche, per esempio, l'ER-CALUX 27 e hERα-HeLa-9903 28 con cellule di cancro al seno umano o cellule tumorali cervicali rispettivamente. Il SI è stato paragonato a saggi cellulari a base di mammiferi simili ed è stato trovato per avere un elevato livello comparabile di riproducibilità, veri tassi positivi e veri negativi estrogenici di identificazione 29, starebbeugh a volte è considerato un po 'meno sensibili 27. Un vantaggio di saggi reporter di lievito base è che in laboratori senza esperienza significativa con colture cellulari di mammifero YES può essere facilmente adottata, in quanto richiede misure di controllo biologico meno rigorosi e tecniche sterili (SI può essere eseguita sul banco se necessario) . I saggi a base di cellule umane richiedono anche di CO 2 incubatori e luminometri rispetto ai lettori di incubazione e micropiastre standard utilizzati nella SI. Saggi di estrogeni a base giornalista Due lievito (sì, Saccharomyces cerevisiae e A-SI, Arxula adeninivorans) stanno attualmente intraprendendo percorsi inter-laboratorio per la validazione di ISO 19040 "Qualità dell'acqua - Determinazione del potenziale estrogenico delle acque e delle acque reflue" evidenziando le industrie interesse per queste tecniche.
Ci sono un certo numero di limitazioni dei metodi descritti che include la potenziale contaminazionedei campioni durante il campionamento, conservazione dei campioni e l'analisi con sostanze estrogeniche provenienti dall'ambiente campo o laboratorio o da contaminazione umana (per esempio, plastificanti, tensioattivi, prodotti per la cura personale). Questo tipo di contaminazione nel saggio SI (o altri saggi reporter di base cellulari) elevare lo sfondo e l'impatto utilizzo del test. I campioni di acqua o solventi conservati in bottiglie di plastica può facilmente causare falsi positivi. I falsi negativi sono anche di preoccupazione sia come LCMS / MS e il test YES richiedono SPE concentrarsi estrogeni a livelli rilevabili. La matrice, la scelta di SPE sorbente e eluizione solvente può influenzare l'efficienza di estrazione ei tipi di composti eluiti. Utilizzando cartucce C18 SPE per l'estrazione utilizzando le condizioni descritte in questo protocollo può generare un bias negativo, come composti altamente polari e di base sarebbero stati mal conservati dal assorbente. Inoltre, questo protocollo richiede ricostituzione dell'eluente SÌ eluiti dal metanoolo di etanolo per evaporazione a secchezza azoto funder conseguente perdita di composti volatili. Di conseguenza, il protocollo potrebbe fornire sottovalutato attività estrogenica di campioni esaminati. Queste limitazioni sono particolarmente importante se si considera il test YES come composti sconosciuti o inattesi potrebbe essere perso, perché non sono stati estratti o sono persi a causa di evaporazione. Inoltre, la tecnica LCMS / MS si avvale di standard interni marcati per correggere per il recupero; questo approccio non può essere usato con il test YES.
Limitazioni significative di test in vivo di effluenti includono elevati costi e il tempo necessario per la valutazione rispetto ai metodi in vitro. Attualmente l'uso di test embrionali pesce per rilevare attività estrogenica è limitata. Tuttavia, vi è stato un certo successo con la produzione di estrogeni transgenico sensibile incandescente embrioni di pesce 30, che potrebbero avere future applicazioni. pesciolini Fathead (utilizzati in questo ProtoColo) sono una specie di laboratorio comuni e VTG induzione in pesci di sesso maschile è un bio-marcatore ben documentata di esposizione estrogenica e una misura quantificabile di acque di scarico dell'effluente estrogenicità 22 o altri composti estrogenici o miscele 31. Linee direttrici OCSE per interferenti endocrini sono stati convalidati usando adulti vairone a testa grossa, Medaka giapponesi e zebrafish 32,33, con VTG essere un biomarker sensibile di esposizione agli estrogeni in tutte e tre le specie. Tuttavia, VTG induzione non direttamente correlata alla compromissione riproduttiva e quindi le conseguenze ecologiche di esposizione delle acque reflue, come si vede in scarafaggio gravemente intersessuati 3. D'altra parte, scarafaggio non sono una «specie di laboratorio" classici per la ricerca ecotossicologia a causa delle loro grandi dimensioni, molto tempo generazione (2-3 anni per raggiungere la maturità sessuale), stile riproduttivo; gruppo di deposizione delle uova (di allevamento) si svolge una volta l'anno, e la difficoltà di individuare i maschi dalle femmine (diversi durantela stagione riproduttiva). Tuttavia, questa specie normalmente gonochoristic è stato molto ben studiato nel Regno Unito, a causa della scoperta che a valle di effluenti di acque reflue estrogenici, pesci di sesso maschile esposto perturbazioni alla loro endocrinologia (ad esempio, presenza di vitellogenin femminile-specifica nel sangue) e istopatologia (ovotestis - sviluppare le uova nel testicolo e / o condotti riproduttivi femminili) 5,6. Pertanto, come una futura applicazione di questi protocolli, scarafaggio (o specie simili) potrebbe essere una specie sentinella selvatiche utile per mostrare se reali miglioramento della qualità delle acque di scarico (e ridotta) estrogenicità sono visti nei fiumi che ricevono effluenti trattati avanzato. Possono anche essere impiegati in fine tubazioni per monitorare effluenti tecnologicamente migliorati da piante scala pilota 7. Quando si considera che le specie da utilizzare nelle valutazioni delle acque reflue in vivo vi è un compromesso tra le specie di laboratorio di test utilizzando relativamente rapido e controllati rispetto alpiù campo base, ma più rispettosa dell'ambiente rilevanti, test utilizzando specie autoctone. Tuttavia, tali valutazioni in vivo sono costi elevati e dovrebbe essere considerata solo come la serie finale di test seguenti valutazioni utilizzando l'analisi chimica e test in vitro.
Passaggi critici all'interno dei protocolli descritti comprendono la preparazione e la manipolazione dei campioni e oggetti di vetro (ad esempio, bottiglie e apparecchiature di campionamento devono essere pre-trattati con superficie detergente idoneo attiva) per evitare la contaminazione dei campioni da contaminanti ambientali, tra cui limitare il contatto dei campioni con la plastica e altri materiali che possono produrre falsi positivi. Questo è altrettanto importante durante la progettazione e la costruzione di sistemi di esposizione acquari e pesci. Idealmente acquari (scorte abitative e durante le esposizioni) dovrebbe essere costruito con materiali a basso assorbimento 32 con il minimo rischio di contaminazione. L'acciaio inossidabile può essere utilizzato per serbatoi acque nere effluenti o sull'acqua.Mentre i serbatoi di una costruzione di vetro sono preferiti per acquari (come questo offre anche un facile osservazione del pesce). L'impiego di tubi in plastica a basso grado o tubo deve essere evitata 32, 34 e PVC ABS può essere utilizzato se 'correttamente esperto', cioè, a sinistra per filtrare eventuali contaminanti in acqua corrente di diluizione per almeno 12 ore prima dell'uso. tubo in silicone di grado medico è stato impiegato con successo nella nostra struttura per la consegna pompa peristaltica di prodotti chimici e di acqua delle acque reflue / diluizione ai serbatoi. Oltre a considerare la contaminazione estrogenica nella costruzione e la gestione del sistema di Aquatics, è anche importante per pensare la dieta del pesce; molti alimenti di pesce proprietà sono stati trovati per essere estrogenica per i pesci. Pertanto, è importante per testare tutti gli alimenti per l'attività (per esempio, nella schermata di estrogeni lievito, vedere Beresford et al. 14) prima di utilizzarli in questi tipi di studi.
Risoluzione dei problemidei protocolli di analisi di analisi chimica o sì descritti è semplificata se i campioni di garanzia della qualità compresi i viaggi multipli, di laboratorio e gli spazi di solventi vengono analizzati insieme a controlli positivi e campioni reali per eliminare i falsi risultati positivi e falsi negativi. Positivo (ad esempio, EE2) e negativo (solo acqua di diluizione) il controllo dovrebbe sempre essere utilizzato nei test in vivo per confermare la sensibilità del biomarcatore biologico previsto o endpoint (cioè, VTG o istopatologia), e consentire a qualsiasi contaminazione inaspettata da rilevare ( ad esempio, dal set sperimentale up, dieta, o acque di diluizione). Tutte le modifiche nel protocollo devono essere convalidati prima di effettuare qualsiasi studio.
Con una regolamentazione più severa di composti estrogenici che entra nell'ambiente tramite effluenti WWTP è prevedere che più efficaci tecnologie di trattamento delle acque di scarico dovranno essere sviluppati. La batteria di test descritti in questo manoscritto complimentare laecotossicologiche e chimiche test di valutazione normalmente applicati al trattamento delle acque reflue degli scarichi dell'impianto effluenti. Pertanto, futura applicazione di questo tipo di batteria olistica della prova dovrebbe consentire agli sviluppatori di tecnologia delle acque reflue, e gestori di impianti, di attuare i disegni più ecologicamente sicuro in considerazione i migliori metodi per rimuovere entrambe le sostanze chimiche estrogeniche regolamentati specifici e attività biologica complessiva.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Projects presented in this paper were funded by Severn Trent Water and Brunel University London. The authors would like to thank Alan Henshaw and John Churchley for providing field and laboratory assistance. T.J.C. thanks the Heinz Endowments for support. M.R.M. thanks the Steinbrenner Institute for a Steinbrenner Doctoral Fellowship and Carnegie Mellon University for a Presidential Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Wellwash Versa plate washer | Thermo Scientific | 5165010 | |
| Plate reader | Molecular Devices | SpectraMax 340PC | |
| Incubator | Memmert | INB 400 | 37 °C incubation required for carp assay |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Icemaker | Scotsman | AF80 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| ELISA kits | Biosense Laboratories | V01018401-096 (Fathead minnow) V01003402-096 (Carp) | |
| Microfuge tubes, 0.5 ml | Alpha labs | LW2372 | |
| Microfuge tubes, 1.5 ml | Alpha labs | LW2375 | |
| Sulphuric acid, 95-98% | Sigma-Aldrich | 258105 | |
| Histology | |||
| Tissue processor | Leica Biosystems | TP1020 | |
| Wax dispenser | Thermo Scientific Raymond Lamb | E66HC | |
| Metal embedding mold | Leica Biosystems | Various | |
| Hot plate | Thermo Scientific Shandon | 3120063 | |
| Cold plate (EG1150 C) | Leica Biosystems | 14038838037 | |
| Heated forceps (EG F) | Leica Biosystems | 14038835824 | |
| Microtome | Leica Biosystems | RM2235 | |
| Paraffin section floatation bath | Electrothermal | MH8517 | |
| Slide drying bench | Electrothermal | MH6616 | |
| Stainmate automated stainer | Thermo Scientific Shandon | E103/S10L | |
| Cassettes, Histosette II, biopsy | Simport | M493 | |
| Paraffin wax | Thermo Scientific Raymond Lamb | W1 | |
| Histo-Clear II | National Diagnostics | HS-202 | |
| IMS (ethanol mix), IDA99 | Tennants | ID440 | |
| Polysine adhesion slides | Thermo Scientific Gerhard Menzel | J2800AMNZ | |
| Cover slips, 22x50 mm | VWR | 631-0137 | |
| Histomount | National Diagnostics | HS-103 | |
| Haematoxylin Harris GURR | VWR | 351945S | |
| Eosin, 1%, aqueous | Pyramid Inovation | S20007-E | |
| Fisherbrand slide boxes | Fisher Scientific | 11701486 | |
| Microtome blades, MB35 | Thermo Scientific Shandon | 3050835 | |
| Bouin’s solution | Sigma Aldrich | HT10132-1L | |
| Yeast screen | |||
| Flow cabinet | Labcaire Systems Ltd | SC12R | |
| Cooled incubator | LMS Cooled Incubator | 303 | |
| Incubator | Memmert | INB 400 | |
| Shaker | Grant | PSU-10i | |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Plate shaker | Heidolph Titramax 100 | 544-11200-00 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| 12-channel pipette, electronic | Sartorius | 735441 | |
| 96-well flat-bottom microplates | MP Biomedicals Thermo Scientific Nunc Sarstedt | 76-232-05 260860 82.1581.001 | We have found that these multiwell plates all produce low backgrounds |
| HPLC grade water | Rathburn | RH1020 | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| Potassium phosphate monobasic anhydrous | Sigma-Aldrich | P-5655 | |
| Ammonium sulphate | Sigma-Aldrich | A-2939 | |
| Potassium hydroxide, pellets | Sigma-Aldrich | P-1767 | |
| Magnesium sulfate, anhydrous | Sigma-Aldrich | M-2643 | |
| Iron(III) sulfate | Sigma-Aldrich | 307718 | |
| L-Leucine | Sigma-Aldrich | L-8912 | |
| L-Histidine | Sigma-Aldrich | H-6034 | |
| Adenine | Sigma-Aldrich | A-2786 | |
| L-Argenine, hydrochloride | Sigma-Aldrich | A-6969 | |
| L-Methionine | Sigma-Aldrich | M-5308 | |
| L-Tyrosine | Sigma-Aldrich | T-8566 | |
| L-Isoleucine | Sigma-Aldrich | I-7403 | |
| L-Lysine, hydrochloride | Sigma-Aldrich | L-8662 | |
| L-Phenylalanine | Sigma-Aldrich | P-5482 | |
| L-Glutamic acid | Sigma-Aldrich | G-8415 | |
| L-Valine | Sigma-Aldrich | V-0513 | |
| L-Serine | Sigma-Aldrich | S-4311 | |
| Thiamine, hydrochloride | Sigma-Aldrich | T-1270 | |
| Pyridoxine | Sigma-Aldrich | P-5669 | |
| D-Pantothenic acid, hemicalcium salt | Sigma-Aldrich | P-5155 | |
| Inositol | Sigma-Aldrich | I-5125 | |
| D-Biotin | Sigma-Aldrich | B-4639 | |
| D-(+)-Glucose anhydrous; mixed anomers | Sigma-Aldrich | G-7021 | |
| L-Aspartic acid | Sigma-Aldrich | A-4534 | |
| L-Threonine | Sigma-Aldrich | T-8441 | |
| Copper(II) sulfate, anhydrous | Sigma-Aldrich | C-1297 | |
| Chlorophenolred-β-D galactopyranoside (CPRG) | Sigma-Aldrich | 10884308001 | |
| Glycerol | Sigma-Aldrich | G-2025 | |
| 17 β-Estradiol | Sigma-Aldrich | E-8875 | |
| Steroids | |||
| Acetone | Rathburn | ||
| Acetonitrile | Rathburn | ||
| Ammonia solution | Rathburn | ||
| Ethylacetate | Rathburn | ||
| Copper(II) nitrate | Sigma-Aldrich | ||
| Acetone | Rathburn | ||
| Dichloromethane | Rathburn | ||
| 2,4,16,16-d4-17β-estradiol | CDN Isotopes | ||
| 2,4,16,16-d4-estrone | CDN Isotopes | ||
| 2,4,16,16-d4-17α-ethynyl oestradiol | CDN Isotopes | ||
| 17β-estradiol | Sigma-Aldrich | ||
| Estrone | Sigma-Aldrich | ||
| 17α-ethynyl oestradiol | Sigma-Aldrich | ||
| Hexane | Rathburn | ||
| Hydrochloric acid | Sigma-Aldrich | ||
| Methanol | Sigma-Aldrich | ||
| Sodium hydrogen carbonate | Sigma-Aldrich | ||
| Sodium hydroxide | Sigma-Aldrich | ||
| Styrene divinyl benzene cartridge (Isolute ENV+) solid phase extraction cartridge (200 mg/6 ml) | Biotage | ||
| Isolute aminopropyl solid phase extraction cartridge (500 mg/6 ml) | Biotage | ||
| Fish study | |||
| orange-white silicon manifold tubing 0.63 bore pk 6 | Watson Marlow | 982.0063.000 | |
| straight connectors for 0.5/0.8 bore pk 20 | Watson Marlow | 999.2008.000 | |
| pumsil silicon tubing 0.8 bore 15 m | Watson Marlow | 913.A008.016 | |
| 200 series multi-channel persitaltic pump | Watson Marlow | 205CA | |
| Silicone tubing x 15 m (dosing tanks) | VWR | SFM1-3250 | |
| silicone tubing x 15 m (large for inflow/outflow) | VWR | SFM1-5450 | |
| 2.5 L glass winchester pk 4 | Fisher Scienctific | BTF-505-050B | |
| magnetic stir bar 51 x 8 mm pk 10 | Fisher Scienctific | FB55595 | |
| Ethyl 3-aminobenzoate methanesulfonate (MS222) | Sigma Aldrich | E10521-10G | |
| 17α-Ethynylestradiol | Sigma Aldrich | E4876-100MG | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| SPE | |||
| 1/8 inch PTFE tubes 'straws' colour coded pk 4 | Sigma Aldrich | 57276 | |
| disposable liners for manifold | Sigma Aldrich | 57059 | |
| filtration tubes without frits 6 ml pk 30 | Sigma Aldrich | 57242 | |
| reservior adaptors pk 12 | Sigma Aldrich | 57020-U | |
| stainless steel weight for manifold pk 4 | Sigma Aldrich | 57278 | |
| male Luer plug for manifold pk 12 | Sigma Aldrich | 504351 | |
| SPE Vacuum Manifold | Sigma Aldrich | 57265 | |
| stop cocks for extraction mainfold (supelco) pk 12 | Waters | WAT054806 | |
| Sep-Pak Plus C18 cartridge box 50 | Waters | WAT020515 | |
| Methanol HPLC grade 2.5 L | Fisher Scientific | M/4056/17 | |
| 7 ml glass vials with lids (58 x 17 mm) pk 399 | Fisher Scientific | TUL-520-031K | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| vacuum pump, e.g., VP Series Vacuum Pump | Camlab | 1136915 |
Riferimenti
- Bergman, &. #. 1. 9. 7. ;., Heindel, J., Jobling, S., Kidd, K., Zoeller, R. T. State-of-the-science of endocrine disrupting chemicals. Toxicol. Lett. 211, (2012).
- Rodgers-Gray, T. P., et al. Exposure of juvenile roach (Rutilus rutilus) to treated sewage effluent induces dose-dependent and persistent disruption in gonadal duct development. Environ. Sci. Technol. 35 (3), 462-470 (2001).
- Jobling, S., et al. Altered sexual maturation and gamete production in wild roach (Rutilus rutilus) living in rivers that receive treated sewage effluents. Biol. reprod. 66 (2), 272-281 (2002).
- Tyler, C. R., Der Eerden, B. V. a. n., Jobling, S., Panter, G., Sumpter, J. P. Measurement of vitellogenin, a biomarker for exposure to oestrogenic chemicals, in a wide variety of cyprinid fish. J. Comp. Physiol. B, Biochem. Syst. Environ. Physiol. 166 (7), 418-426 (1996).
- Jobling, S., Nolan, M., Tyler, C. R., Brighty, G., Sumpter, J. P. Widespread sexual disruption in wild fish. Environ. Sci. Technol. 32 (17), 2498-2506 (1998).
- Jobling, S., et al. Predicted exposures to steroid estrogens in U.K. rivers correlate with widespread sexual disruption in wild fish populations. Environ. Health Perspect. 114, 32-39 (2006).
- Baynes, A., et al. Additional treatment of wastewater reduces endocrine disruption in wild fish - a comparative study of tertiary and advanced treatments. Environ. Sci. Technol. 46 (10), 5565-5573 (2012).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environ. Toxicol. Chem. 15 (3), 241-248 (1996).
- Grover, D. P., Balaam, J., Pacitto, S., Readman, J. W., White, S., Zhou, J. L. Endocrine disrupting activities in sewage effluent and river water determined by chemical analysis and in vitro assay in the context of granular activated carbon upgrade. Chemosphere. 84 (10), 1512-1520 (2011).
- . . The determination of steroid oestrogens in waters using chromatography and mass spectrometry (2008) Methods for the Examination of Waters and Associated Materials. (2008), (2008).
- Van den Belt, K., Berckmans, P., Vangenechten, C., Verheyen, R., Witters, H. Comparative study on the in vitro/in vivo estrogenic potencies of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and nonylphenol. Aquat. toxicol. 66 (2), 183-195 (2004).
- Mills, M. R., et al. Removal of ecotoxicity of 17α-ethinylestradiol using TAML/peroxide water treatment. Sci. Rep. 5, 10511 (2015).
- . . EN 14962:2006 Water quality - Guidance on the scope and selection of fish sampling methods. , (2006).
- Beresford, N., Brian, J. V., Runnalls, T. J., Sumpter, J. P., Jobling, S. Estrogenic activity of tropical fish food can alter baseline vitellogenin concentrations in male fathead minnow (Pimephales promelas). Environ. Toxicol. Chem. 30 (5), 1139-1145 (2011).
- Nolan, M., Jobling, S., Brighty, G., Sumpter, J. P., Tyler, C. R. A histological description of intersexuality in the roach. J. Fish Biol. 58 (1), 160-176 (2001).
- Dascenzo, G., et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities. Sci. Total Environ. 302 (1-3), 199-209 (2003).
- Gomes, R. L., Birkett, J. W., Scrimshaw, M. D., Lester, J. N. Simultaneous determination of natural and synthetic steroid estrogens and their conjugates in aqueous matrices by liquid chromatography/mass spectrometry. Int. J. Environ. Anal. Chem. 85 (1), 1-14 (2005).
- Metcalfe, C. D., et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes). Environ. Toxicol. Chem. 20 (2), 297-308 (2001).
- Stalter, D., Magdeburg, A., Wagner, M., Oehlmann, J. Ozonation and activated carbon treatment of sewage effluents: Removal of endocrine activity and cytotoxicity. Water Res. 45 (3), 1015-1024 (2011).
- Caldwell, D. J., Mastrocco, F., Anderson, P. D., Länge, R., Sumpter, J. P. Predicted-no-effect concentrations for the steroid estrogens estrone, 17β-estradiol, estriol, and 17α-ethinylestradiol. Environ. Toxicol. Chem. 31 (6), 1396-1406 (2012).
- Gardner, M., Comber, S., Scrimshaw, M. D., Cartmell, E., Lester, J., Ellor, B. The significance of hazardous chemicals in wastewater treatment works effluents. Sci. Total Environ. 437, 363-372 (2012).
- Filby, A. L., Shears, J. A., Drage, B. E., Churchley, J. H., Tyler, C. R. Effects of advanced treatments of wastewater effluents on estrogenic and reproductive health impacts in fish. Environ. Sci. Technol. 44 (11), 4348-4354 (2010).
- Magdeburg, A., Stalter, D., Oehlmann, J. Whole effluent toxicity assessment at a wastewater treatment plant upgraded with a full-scale post-ozonation using aquatic key species. Chemosphere. 88 (8), 1008-1014 (2012).
- Collins, T. J. TAML oxidant activators: a new approach to the activation of hydrogen peroxide for environmentally significant problems. Acc. Chem. Res. 35 (9), 782-790 (2002).
- Collins, T. J. Designing Ligands for Oxidizing Complexes. Acc. Chem. Res. 27 (9), 279-285 (1994).
- Truong, L., Denardo, M. A., Kundu, S., Collins, T. J., Tanguay, R. L. Zebrafish Assays as Developmental Toxicity Indicators in The Design of TAML Oxidation Catalysts. Green Chem. 15 (9), 2339-2343 (2013).
- Murk, A. J., et al. Detection of estrogenic potency in wastewater and surface water with three in vitro bioassays. Environ. Toxicol. Chem. 21 (1), 16-23 (2002).
- . Test No 455: The Stably Transfected Human Estrogen Receptor-alpha Transcriptional Activation Assay for Detection of Estrogenic Agonist-Activity of Chemicals. OECD Guidelines for the Testing of Chemicals, Section 4. , (2009).
- Kolle, S. N., et al. In house validation of recombinant yeast estrogen and androgen receptor agonist and antagonist screening assays. Toxicol in Vitro. 24 (7), 2030-2040 (2010).
- Lee, O., Tyler, C. R., Kudoh, T. Development of a transient expression assay for detecting environmental oestrogens in zebrafish and medaka embryos. BMC Biotechnology. 12, 32 (2012).
- Brian, J. V., et al. Accurate prediction of the response of freshwater fish to a mixture of estrogenic chemicals. Environ Health Perspect. 113 (6), 721-728 (2005).
- . Test No 229: Fish Short Term Reproduction Assay. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
- . Test No 230: 21-day Fish Assay: A Short-Term Screening for Oestrogenic and Androgenic Activity and Aromatase Inhibition. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon