Method Article
Utilisation d'une batterie de produits chimiques et écotoxicologiques Méthodes pour l'évaluation de l'efficacité des processus de traitement des eaux usées pour supprimer œstrogénique Potency
Dans cet article
Résumé
Perturbateurs endocriniens (EDC) posent un risque important pour l'environnement aquatique. Les usines municipales de traitement des eaux usées sont les principaux contributeurs à la puissance œstrogénique des eaux de surface. La méthodologie fournie dans le présent document permet une évaluation de l'efficacité et de la pertinence des processus de traitement des eaux usées par rapport à l'élimination EDC.
Résumé
Endocrine Disrupting Compounds pose a substantial risk to the aquatic environment. Ethinylestradiol (EE2) and estrone (E1) have recently been included in a watch list of environmental pollutants under the European Water Framework Directive. Municipal wastewater treatment plants are major contributors to the estrogenic potency of surface waters. Much of the estrogenic potency of wastewater treatment plant (WWTP) effluents can be attributed to the discharge of steroid estrogens including estradiol (E2), EE2 and E1 due to incomplete removal of these substances at the treatment plant. An evaluation of the efficacy of wastewater treatment processes requires the quantitative determination of individual substances most often undertaken using chemical analysis methods. Most frequently used methods include Gas Chromatography-Mass Spectrometry (GCMS/MS) or Liquid Chromatography-Mass Spectrometry (LCMS/MS) using multiple reaction monitoring (MRM). Although very useful for regulatory purposes, targeted chemical analysis can only provide data on the compounds (and specific metabolites) monitored. Ecotoxicology methods additionally ensure that any by-products produced or unknown estrogenic compounds present are also assessed via measurement of their biological activity. A number of in vitro bioassays including the Yeast Estrogen Screen (YES) are available to measure the estrogenic activity of wastewater samples. Chemical analysis in conjunction with in vivo and in vitro bioassays provides a useful toolbox for assessment of the efficacy and suitability of wastewater treatment processes with respect to estrogenic endocrine disrupting compounds. This paper utilizes a battery of chemical and ecotoxicology tests to assess conventional, advanced and emerging wastewater treatment processes in laboratory and field studies.
Introduction
Les préoccupations concernant les effets néfastes des composés endocriniens perturbateurs sur la faune de santé génésique a conduit l'Union européenne à placer deux substances oestrogéniques (estradiol et éthinylestradiol) sur une «liste de surveillance» en vertu de la directive cadre sur l'eau (DCE). EDC englobent une variété de classes chimiques, y compris les œstrogènes naturels et synthétiques de stéroïdes, les médicaments, les pesticides et les produits chimiques industriels et composants de produits de consommation avec des effets indésirables connus sur la faune. Certains de ces composés peuvent avoir un impact potentiellement la santé humaine 1.
La recherche a montré que les effluents de la station d' épuration sont oestrogénique à pêcher 2 et comme conséquence de nombreuses eaux réceptrices sont également oestrogénique pour les poissons 3. Cela a été démontré d' abord par des enquêtes nationales au Royaume-Uni qui a montré une augmentation des concentrations de vitellogénine (une femelle spécifique de la protéine précurseur jaune 4) dans le sang des poissons mâles sauvages et une haute prévalence de intersexe (développement des œufs et / ou des conduits reproducteurs féminins dans les testicules des poissons mâles) chez les espèces de poissons normalement gonochorique 5,6.
le traitement classique des eaux usées est généralement un processus en trois étapes consistant en un examen préalable suivi d'un traitement primaire et secondaire qui supprime à la fois dissous et mis en suspension la matière organique. L'efficacité de l'élimination de l'individu EDC dépend des propriétés physico-chimiques des substances et sur l'efficacité du processus de traitement appliquée. Pour beaucoup élimination EDC par adsorption et la dégradation biologique peut être importante mais incomplète. Le traitement tertiaire, comme la filtration sur sable, peut être efficace pour augmenter le retrait EDC 7 alors que le traitement avancé utilisant l' oxydation avancée (par exemple l' ozone) ou du charbon actif peuvent être efficaces pour atteindre près de l' élimination complète 7.
L'évaluation de toute nouvelle technologie pour le traitement des eaux usées needs pour déterminer l'efficacité du processus proposé dans l'enlèvement d'EDC. Une batterie de tests, y compris l' analyse chimique ciblée aux côtés de tests d'écotoxicologie, en utilisant in vivo et essais biologiques in vitro, fournit des données détaillées à cet effet. Bien que très utile à des fins réglementaires, l'analyse chimique ciblée ne peut fournir des données sur les composés (et métabolites spécifiques) surveillés. Bioassays permettent en outre la «détection» des effets indésirables des métabolites et la transformation des eaux usées de traitement généré par les sous-produits qui seraient autrement pas détectés 8,9. Cet article décrit l'utilisation d'une batterie de tests de laboratoire d'écotoxicité chimiques et d'évaluer l'efficacité d'un certain nombre de procédés de traitement des eaux usées avancées et émergentes pour éliminer la puissance œstrogénique du brut et les eaux usées traitées et les eaux réceptrices.
Protocole
déclaration éthique: Protocoles d'évaluation perturbateurs endocriniens activité de produits chimiques / mélanges dans les poissons ont été approuvés par la protection des animaux de Brunel University de Londres et du corps éthique critique (AWERB) et par le Home Office du Royaume-Uni sous les Animaux (Scientific Procedures) Act 1986.
Prélèvement des échantillons 1. L'eau, la préservation et Extraction
- collecte et préservation échantillon
- Avant utilisation, nettoyer les bouteilles avec une surface appropriée agent de nettoyage actif. Après le nettoyage, rincer les bouteilles avec de l'eau, les égoutter et sécher.
- Prélever des échantillons dans des flacons en verre d'une capacité de 2 litres contenant un conservateur constitué de 0,5 g de cuivre (II), le nitrate et 6 ml d'une solution 3,6 M d'acide chlorhydrique. Conserver les échantillons en dessous de 10 ° C. Extraire et analyser le plus tôt possible la collecte et la conservation suivante.
- Extraction de l' échantillon et de nettoyage (pour l' analyse de l' oestrogène stéroïde) 10
- Extraction en phase solide (SPE)
- Avant extraction, afin de réduire les matières en suspension, des échantillons d'eau de filtre à l'aide de 1 um papier pores de filtre de taille.
- Une fois filtrée, des échantillons de pointes avec étalon interne en ajoutant 100 pi de dopage solution étalon interne deutéré mère contenant 2,4,16,16-d 4 -estrone: 2,4,16,16-d 4 -17β-estradiol (E2) et 2,4,16,16-d4 -17α-éthinylestradiol (EE2) (tous à 40 g / L dans du methanol) à 1000 ml d' effluent (ou 100 ml affluente) conduisant à pic interne de 2 ng / l pour les eaux usées les échantillons d'effluents, et 20 ng / L pour les échantillons de boues d'influent.
- Fixer sacs jetables de soupapes, des cartouches de SPE styrène divinyl benzène et les réservoirs de la cartouche dans l'appareil de SPE. Mettre la pompe à vide pour tester l'équipement est convenablement scellé.
- Introduire à la pipette 5 ml d'acétate d'éthyle dans chaque réservoir, pour le conditionnement des cartouches. Mettre en marche la pompe à vide (au-dessous de 10 poHg pour permettre à un débit inférieur à 10 ml par minute)et tirez à travers le liquide. Ne laissez pas les cartouches de SPE dessèchent. Répéter l'opération avec 5 ml de méthanol suivi par 5 ml d'eau.
- Recharger chaque réservoir de la cartouche avec de l'eau et raccorder 1/8 "tubes PTFE entre les réservoirs de la cartouche et les flacons d'échantillons en verre. Mettre le vide à une vitesse inférieure à 10 ml par minute de débit et permettre à l'ensemble de l'échantillon de passer à travers la cartouche. Videz le flacon de déchets si nécessaire.
- Sécher soigneusement les cartouches SPE sous vide (ou en utilisant de l' air ou de l' azote) jusqu'à ce que le contenu de la cartouche changer de couleur (par exemple, du brun foncé au brun clair).
- Mettre 10 ml des flacons de collecte de verre sèches et propres dans le rack et place à l'intérieur du collecteur d'extraction. Vérifiez que chaque chemise est au-dessus d'un flacon. Pipette 8 ml de dichlorométhane dans chaque réservoir d'échantillon, interrupteur sur la pompe à vide (taux inférieur à 10 ml par minute) et tirer le liquide à travers dans les flacons de collecte.
- Retirer flacons de 10 ml à partir du collecteur SPEet utiliser un concentrateur pour réduire le volume à 1 ml. Transférer chaque échantillon dans l'auto-échantillonneur flacon et se concentrer davantage à 100 pi avec de l'azote chablis équipement.
- Avant extraction, afin de réduire les matières en suspension, des échantillons d'eau de filtre à l'aide de 1 um papier pores de filtre de taille.
- Chromatographie sur gel perméable (GPC) nettoyage
- Injecter 95 ul de l'extrait d'échantillon élué dans le HPLC équipé GPC en utilisant les conditions décrites dans le tableau 1. Concentré GPC extrait jusqu'à 200 ul en utilisant un concentrateur et d' azote soufflent vers le bas appareil et ensuite faire jusqu'à 2,0 ml avec de l' hexane.
- SPE nettoyage
- Fixer sacs jetables de soupapes, cartouches aminopropyle, et les réservoirs de la cartouche au collecteur SPE. Mettre 10 ml des flacons de collecte de verre sèches et propres dans le rack et place à l'intérieur du collecteur d'extraction. Pipette 2 ml d'hexane dans chaque réservoir, pour conditionner les cartouches. Permettre au liquide de passer à travers les cartouches.
- Pipeter l'extrait d'échantillon dans le réservoir de CPG et encore permettre au liquide depasser à travers la cartouche. Recueillir l'échantillon éluat dans le flacon et retirer du collecteur. Ne pas jeter éluat.
- Mettre un nouveau flacon sec 10 ml de collection propre dans rack et placer à l'intérieur du collecteur d'extraction. Laver la cartouche, ajouter 2 ml d'acétate d'éthyle dans de l'hexane (30% v / v) dans le réservoir et extraire le liquide à travers la cartouche. Répéter l'opération avec encore 2 ml d'acétate d'éthyle dans de l'hexane, en éliminant tous les lavages.
- Placer le 10 ml collection flacon d'origine (étape 1.2.3.2) retour dans le rack à l'intérieur du collecteur d'extraction. Introduire à la pipette 2 ml d'acétate d'éthyle dans de l'acétone (50% v / v) dans le réservoir, mettre la pompe à vide (au-dessous de 2 poHg pour permettre à un taux inférieur à 2 ml par minute) et tirer le liquide à travers dans la fiole . Répétez le processus avec un autre 2 ml d'acétate d'éthyle.
- Retirer le flacon d'échantillon et en utilisant un concentrateur pour réduire le volume d'extrait d'1 ml. Transférer l'échantillon dans un flacon de verre plus petit et utiliser de l'azote chablis équipement, pour évaporer til extrait à siccité naissante.
- Ajouter 100 ul de méthanol et bien mélanger. Transférer l'extrait à un échantillonneur automatique flacon (avec 0,3 ml insert) et boucher le flacon. Analyser les échantillons en utilisant LCMS / MS (voir la section 2).
- Extraction en phase solide (SPE)
| Colonne: | PL gel, 50 A, 300 x 7,5 mm, 5 um |
| Garde Colonne: | gel PL, 50 x 7,5 mm, 5 um |
| Phase mobile: | dichlorométhane |
| Débit: | 1 ml par minute |
| Température de la colonne: | 25 ° C, |
| Détecteur UV: | 210 nm |
| Volume d'injection: | 95 pi |
| Mode d'injection: | Supporterard |
| Dessinez vitesse: | 500 ml par min |
| Ejecter vitesse: | 500 ml par min |
| Position Draw: | 3 mm, |
| La fraction recueillie: | 3 ml de la fraction (7-10 min) dans des flacons de 10 ml |
Tableau 1. Conditions et paramètres de chromatographie sur gel perméable (GPC) nettoyage des échantillons d'eaux usées extraites. Tableau de détails colonne GPC, phase mobile, la température, le volume d'injection, et le détecteur de longueur d' onde.
- extraction de l'échantillon (pour écran Yeast Estrogen)
- Filtrer les échantillons que détaillés dans la section 1.2.1.1. Attacher sacs jetables, des cartouches de valve SPE C18 et les réservoirs de la cartouche dans l'appareil de SPE. Mettre la pompe à vide pour tester l'équipement est convenablement scellé.
- Pipette 5 ml de méthanol dans chaque réservoir, pour conditionner le C18 cartouches. Allumez le vide (à environ 5 inHg pour permettre un débit d'environ 5 ml par minute) et laisser le liquide à travers, faisant une pause pendant 1 min à mi-chemin à travers. Ne laissez pas les cartouches sont à sec. Répéter les opérations avec soit de qualité HPLC ou de l' eau distillée deux fois (ddH 2 O). Encore une fois ne fonctionne pas à sec.
- Extraire des échantillons d'eau, comme décrit dans la section 1.2.1.4. Poursuivre le vide pendant au moins 30 minutes pour sécher les cartouches.
- Placer les flacons de collecte de 10 ml propre et sec dans un rack dans le collecteur d'extraction. Vérifiez que chaque chemise est au-dessus d'un flacon. Ajouter 5 ml de methanol à chaque réservoir. Allumez le vide (débit maximal de 5 ml / min) et laisser passer le liquide à travers la cartouche dans le flacon, une pause pendant 2 min à mi-chemin à travers.
- Avant l'analyse en utilisant l'écran OUI, réduire l'extrait à siccité naissante en utilisant l'azote et reconstituer avec 500-1000 ul d'éthanol. Sceller les couvercles des flacons d'échantillons pour éviter l'évaporation et de garder à 4 ° C (dans un sans étincellesfrigo).
2. Analyse chimique utilisant LCMS / MS
- Optimiser les conditions de fonctionnement du système LCMS / MS en utilisant les instructions du fabricant.
- Analyser les solutions d'étalonnage standard, les extraits d'échantillons, le contrôle vierge et qualité analytique (AQC) échantillons en utilisant la chromatographie en phase liquide et les conditions de spectrométrie de masse, et de surveiller les transitions d'ions comme indiqué dans le tableau 2. Déterminer la concentration d'oestrogènes stéroïdes dans l'extrait d'échantillon à l' aide interne 10 normes.
| LCMS | |||||
| chromatographie liquide | |||||
| Colonne: | C18 (2), 150 x 4,6 mm, 5 um. | ||||
| Volume d'injection: | 20 ul | ||||
| Écoulement: | 0,5 ml par minute. | ||||
| Mla phase obile: | Solvant A: eau contenant 0,1% d'ammoniaque. | ||||
| Solvant B: acétonitrile. | |||||
| programme Gradient: | |||||
| Temps (min) | 0 | dix | 18 | 24 | 28 |
| A: B taux de solvant | 90:10:00 | 50:50:00 | 0.479167 | 0.479167 | 90:10:00 |
| Spectrométrie de masse | |||||
| La source: | Electrospray (ion négatif) | ||||
| Gaz et source: | CUR: 20 psi, GS1: 70 psi, GS2: 30 psi | ||||
| TEM: 600 ° C, CAD gaz 5 et Ionspray tension -900 | |||||
| transitions MRM: | |||||
| E1: | 269/145 et 269/143 | ||||
| E2: | 271/145 et 271/143 | ||||
| EE2: | 295/145 et 295/143 | ||||
| E1-D4: | 273/147 | ||||
| E2-D4: | 275/147 | ||||
| EE2-D4: | 299/145 | ||||
Tableau 2. Détails paramètres et conditions pour l' analyse des oestrogènes stéroïdes dans des extraits d'eaux usées LCMS / MS. Le tableau donne le volume d'injection échantillon et le débit, les conditions de la phase mobile and gradient.
3. Activité œstrogénique Utilisation in vitro écran Yeast Estrogen (YES) Assay 8
- Préparer et stocker un minimum de moyennes et moyennes des composants selon le tableau 3 (a) à (g).
| (a) Medium Minimal (pH 7,1): |
| Préparer un alliage Fe 2 (SO 4) 3 par addition d'une solution de 40 mg de Fe 2 (SO 4) 3 à 50 ml d'eau bidistillée (ddH 2 O) |
| Ajouter 1 L ddH 2 O à un 2 L bêcher en verre |
| Ajouter les composants suivants dans le bêcher: |
| 13,61 g KH 2 PO 4 |
| 1,98 g (NH 4) 2 SO 4 |
| 4,2 g de KOH |
| 0,2 g MgSO4 |
| 1 ml de Fe 2 (SO 4) 3 solution |
| 50 mg de L-leucine |
| 50 mg de L-histidine |
| 50 adénine mg |
| 20 mg de L-arginine-HCl |
| 20 mg de L-méthionine |
| 30 mg de L-tyrosine |
| 30 mg de L-isoleucine |
| 30 mg de L-lysine-HCl |
| 25 mg de L-phénylalanine |
| l'acide 100 mg L-glutamique |
| 150 mg de L-valine |
| 375 mg de L-sérine |
| Placer le bécher sur un agitateur chauffé avec une puce magnétique et remuer jusqu'à ce qu'il soit tout dissous |
| Vérifier que le pH est de 7,1 et d'ajuster si nécessaire |
| En utilisant une seringue stérile de 50 ml distribuer 45 ml aliquotes dans des bouteilles en verre avec couvercles à vis métallique |
| Stériliser le milieu minimal à 121 ° C pendant 10 min dans un autoclave |
| Ranger à température ambiante |
| (b) D - (+) - Glucose: |
| Préparer une solution à 20% p / v dans ddH 2 O |
| Distribuer 20 ml aliquotes dans des flacons de verre avec couvercles à vis métallique |
| Stériliser la solution de glucose à 121 ° C pendant 10 min dans un autoclave |
| Ranger à température ambiante |
| (c) Acide L-aspartique: |
| Faire une solution mère de 4 mg / ml dans ddH 2 O |
| Distribuer 20 ml aliquotes dans des flacons de verre avec couvercles à vis métallique |
| Stériliser la solution acide L-aspartique à 121 ° C pendant 10 min dans un autoclave |
| Ranger à température ambiante |
| (d) Solution de vitamine: |
| Préparer une solution de biotine par addition de 2 mg de biotine à 100 ml d'ddH 2 O |
| Peser 8 mg de thiamine, 8 mg de pyridoxine, l'acide pantothénique 8 mg, 40 mg d'inositol. Ajouter tous les composants secs et 20 ml de solution de biotine à 180 ml ddH 2 O |
| Faire aliquotes de 10 ml stérile par filtration à travers un 0,2 um de taille de pores filtre jetable dans des flacons en verre stériles dans une hotte à flux laminaire d'air |
| Conserver à 4 ° C |
| (e) L-Thréonine: |
| Préparer 100 ml de 24 mg / ml de L-thréonine dans ddH 2 O |
| Distribuer 10 ml aliquotes dans des flacons de verre avec couvercles à vis métallique |
| Stériliser la solution de L-thréonine à 121 ° C pendant 10 min dans un autoclave |
| Ranger à température ambiante |
| (f), cuivre (II) Sulfate: |
| Préparer 25 ml d'une 20 mM de cuivre (II) dans une solution de sulfate ddH 2 O |
| Faire aliquotes de 5 ml stérile par filtration à travers un filtre de 0,2 um de taille de pore dans des flacons stériles en verre, dans une enceinte à flux laminaire |
| Ranger à température ambiante |
| (g) le rouge de chlorophénol-β-D-galactopyranoside (CPRG): |
| Préparer 25 ml d'une solution à 10 mg / ml de CPRG dans ddH 2 O |
| Faire aliquotes de 5 ml stérile par filtration à travers un filtre de 0,2 um de taille de pore dans des flacons stériles en verre, dans une enceinte à flux laminaire |
| Conserver à 4 ° C |
Tableau test de l' écran Estrogen 3. Yeast; préparation et le stockage des minimales moyennes et moyennes composants.
- Préparation et storage de 10x culture de levure concentrée
- Le jour 1, préparer le milieu de croissance (comme détaillé dans 3.4.1) et verser dans un flacon conique stérile. Ajouter 125 pi de 10x levure concentrée du flacon cryogénique stocké à -20 ° C. Incuber les milieux inoculés à 28 ° C pendant environ 24 heures sur un agitateur orbital.
- Le jour 2, faire deux bouteilles de milieu de croissance (~ 50 ml) et verser dans des flacons coniques stériles séparés. Ajouter 1 ml de 24 heures de culture de levure dans chaque flacon de milieu de croissance. Incuber les milieux inoculés à 28 ° C pendant environ 24 heures sur un agitateur orbital.
- Au jour 3, verser chaque culture de 24 heures dans un tube de centrifugeuse de 50 ml stérile. Centrifuger les tubes de 50 ml à 4 ° C pendant 10 min à 2000 x g. Verser le surnageant et remettre en suspension chaque culot dans 5 ml de milieu minimal avec 15% de glycérol. Faire aliquotes de 0,5 ml de la culture de levure concentrée 10x dans 1,2 ml cryotubes stériles et conserver à -20 ° C pour une durée maximale de 4 mois.
- Preparation et de stockage des stocks de produits chimiques pour les courbes standards
- Rincer la verrerie et les spatules deux fois avec de l'éthanol absolu et laisser sécher avant de l'utiliser pour éliminer toute trace de contaminants.
- Peser E2 directement dans un flacon en verre dans une enceinte de pesage de poudre et d'ajuster la concentration en volume dans l'éthanol absolu. Diluer à une concentration de 2x10 -7 M (54,48 mg / L). couvercle de Seal et conserver à 4 ° C (dans un réfrigérateur sans étincelles).
- producteur Assay
- Au jour 0, préparer un milieu de croissance. À la bouteille de milieu minimal de 45 ml, ajouter 5 ml de solution de glucose, une solution d'acide L-aspartique 1,25 ml, 0,5 ml de solution de vitamines, 0,4 ml de solution de L-thréonine, et 125 ul de cuivre (II), une solution de sulfate. Verser le milieu de croissance dans une fiole conique stérile.
- Ajouter 125 pi de 10x mère concentrée (décongelé de -20 ° C stockage) dans le flacon et incuber les milieux inoculés à 28 ° C pendant environ 24 heures sur un agitateur orbital.
- Le jour 1, étiqueter un 96 puits «plaque de dilution» stérile et faire des dilutions en série (100 volumes ul dans de l' éthanol) de E2 courbe standard et chimique (s) de test / extrait de l' effluent (s) (par exemple, EE2).
- Étiquette stérile de 96 puits à fond plat optiquement 'plaque (s) d'essai »de microtitrage. Sur chaque plaque comprennent des blancs (plus / moins de solvant) et une courbe standard E2, en plus des lignes de produits chimiques (s) de test / extrait (s) de l'effluent.
- Introduire à la pipette 10 ul de chaque concentration (E2, chimique ou extrait) dans le puits approprié de la plaque d'essai. Pipette 10 pi d'éthanol dans chaque «solvant blanc» et de la plaque d'essai. Laisser la plaque test avec le couvercle pour évaporer à sec.
- Faire une bouteille de milieu de croissance (~ 50 ml) et ajouter du rouge-β-D-galactopyranoside (GPRC) solution par bouteille de 0,5 ml de chlorophénol. Déterminer la densité des cellules de levure dans la culture de 24 heures en mesurant la turbidité de la culture à 620 nm dans un lecteur de plaque. Inoculer l'unmoyen éssayé avec 4x10 cellules de levure 7 de la culture de 24 h.
- Verser milieu d'essai inoculé dans une cuve stérile. En utilisant une pipette à canaux multiples ajouter 200 ul de milieu de test inoculé à chaque puits de la plaque de dosage à 96 puits.
- Mettez le couvercle sur la plaque d'essai de 96 puits et sceller les bords avec du ruban adhésif. Agiter la plaque (s) d'essai vigoureusement pendant 2 min sur un agitateur de plaque de titration et incuber à 32 ° C dans une étuve à ventilation naturelle.
- Le jour 2, agiter la plaque (s) d'essai vigoureusement sur un agitateur de plaque de titration pendant 2 min. Retour à 32 ° C incubateur.
- Le jour 4, agiter la plaque (s) d'essai vigoureusement pendant 2 min sur un agitateur de plaque de titrage. Laissez la plaque (s) au repos pendant environ 1 heure puis de lire la plaque (s) d'essai à une absorbance de 540 nm (absorbance optimale pour CPRG ~ 575 nm) et 620 nm (pour la turbidité) en utilisant un lecteur de plaque. Laissez plaque (s) à la température ambiante et de lire plus tard si nécessaire.
- Au jour 0, préparer un milieu de croissance. À la bouteille de milieu minimal de 45 ml, ajouter 5 ml de solution de glucose, une solution d'acide L-aspartique 1,25 ml, 0,5 ml de solution de vitamines, 0,4 ml de solution de L-thréonine, et 125 ul de cuivre (II), une solution de sulfate. Verser le milieu de croissance dans une fiole conique stérile.
- activité oestrogénique calculs
- lectures correctes d'essai pour la turbidité à l'aide de l'équation suivante: Correction value = échantillon ou standard (E2) absorbance à 540 nm - [échantillon ou (E2) absorbance standard à 620 nm - absorbance du blanc à 620 nm]. Plot E2 courbe standard avec des espaces appropriés (pour vérifier la contamination) 8.
- Utilisez l'échantillon corrigé (extrait ou chimique) pour calculer «équivalents estradiol». Utilisez les E2 valeurs de courbe standard tracée et l'équation de régression (3-paramètre polynôme ou linéaire en fonction de l'ajustement) pour interpoler l'échantillon / extraire des valeurs d'absorbance à des valeurs équivalentes E2. Utilisez le facteur de concentration ( à savoir, l' eau extraite et le volume d'éthanol , l'extrait est remis en suspension dans) pour calculer l' activité oestrogénique dans l' échantillon pré-extrait.
4. Laboratoire d' évaluation basée sur des activité œstrogène Utilisation In Vivo Vitellogenin Induction in Male Fathead ménés
- Utilisez vairons mâles (Pimephalespromelas)> 4 mois, qui présentent des caractéristiques sexuelles secondaires ( par exemple, le développement de perliformes et fatpad dorsale) indiquant la détermination sexuelle masculine.
- Pour empêcher l'activité de frai, mature séparée mâles trois semaines (± 3 jours) avant le début de l'essai. Mettre en place au moins deux 45 L aquariums en verre avec une charge maximale de 3 g / L. Pour assurer un nombre suffisant de poissons en bonne santé pour le test, utiliser un minimum de 100 hommes.
- Gardez le poisson mâle dans des conditions environnementales identiques seront expérimentés dans le test (ie, température de l' eau de 25 ± 1 ° C et 16: la lumière de 8 heures: photopériode foncé). Maintenir le débit d'eau de dilution dans chaque réservoir pour assurer un temps de remplacement de 95% d'au moins tous les 6 à 8 heures, soit 330 ml / min pour un réservoir de 45 L.
- Appareil d'essai et la conception expérimentale
- Utiliser de grands réservoirs de verre pour accueillir une charge allant jusqu'à 3 g de poisson par litre de water. Pour 8 mâles adultes (nominalement 4,5 g chacun), utiliser un réservoir de 10-20 L.
- Utilisez deux réservoirs répétés pour chaque traitement et protéger chaque réservoir de toutes les perturbations visuelles inutiles (c. -à- utiliser des écrans de cartes laminées entre les réservoirs). Identifier chaque réservoir avec un certain nombre d'études, une concentration d'exposition et un numéro d'identification du navire.
- Pour les études effluents d'eaux usées
- À l'arrivée, transférer immédiatement l'effluent dans un réservoir de stockage à 10 ± 1 ° C. Commencer le dosage des effluents à l'intérieur de deux h de réception de l'effluent.
- Nourrissez l'effluent, par l'intermédiaire d'une pompe péristaltique, à partir du réservoir de stockage C 10 ° à un navire d'acclimatation. Chauffer l'effluent dans la cuve d'acclimatation à 18 ± 2 ° C. Pomper l'effluent chauffé de la cuve d'acclimatation aux récipients de mélange / dosage, puis à l'aquariums d'essai (qui contient le poisson). Chauffer les aquariums à une température de 25 ± 1 ° C.
- Pour les études de dosage chimiques
- Peser les produits chimiques d'essai dans une enceinte de pesage de poudre. Préparer des stocks de produits chimiques concentrés dans ddH 2 O de préférence , sans l'utilisation de solvants.
Remarque: Si des solvants sont nécessaires pour solubiliser les composés d'essai, l'utilisation des contrôles de solvant, en plus du contrôle de l'eau de dilution. - alimentation par gravité ou de l'eau de dilution de la pompe à partir d'une température contrôlée tête réservoir via un dispositif (s) de contrôle de débit de dosage / cuve de mélange. Pompe concentrée stock (s) chimique en utilisant un système de pompage péristaltique pour le dosage / mélange des navires. Contrôler le débit de la pompe (de stock chimique) et le débit d'eau (eau de dilution) pour obtenir la concentration d'exposition souhaitée.
Remarque: Utilisez un tube de silicone pour nourrir chimique de l'eau / de test pour chaque récipient d'essai à partir du dosage / cuve de mélange. Utiliser un débit qui est suffisant pour fournir un remplacement de la cuve à 75% dans au moins 24 heures, soit 20 ml / min pour un réservoir de 20 litres. Maintenir le débit à ± 10% de la valeur nominale spécifiée.
- Peser les produits chimiques d'essai dans une enceinte de pesage de poudre. Préparer des stocks de produits chimiques concentrés dans ddH 2 O de préférence , sans l'utilisation de solvants.
- Maintenir l' exposition à la température de l' eau du réservoir à 25 ± 1 ° C, l' oxygène dissous au dessus de 70% de la valeur de saturation d'air (5,8 mg L -1 à 25 ° C) et à ± 0,5 unité de pH (pH de départ compris entre 6,5 et 8,5) tout au long de l' étude. Définir les conditions d'éclairage à la photopériode de lumière 16 h: 8 h sombre, avec des périodes de transition / crépuscule à l'aube de 20 min.
- Nourrir les poissons deux fois par jour avec fraîchement décongelé adultes congelées crevettes de saumure (Artemia) à 2,5 (± 0,1) g par réservoir par alimentation. Aussi nourrir les poissons une fois par jour avec une petite quantité (deux de pincement des doigts) d'un aliment tropical de poissons en flocons. Laisser un minimum de 3 heures entre chaque repas.
- Gardez une trace de l'alimentation quotidienne pour surveiller la réponse d'alimentation / comportement (bon, modéré ou faible, par rapport aux témoins). Siphonner les réservoirs au moins deux fois par semaine (de préférence tous les jours) pour enlever toute la nourriture et les fèces uneaten. Nettoyer les côtés et le fond des récipients d'essai au moins une fois par semaine.
- Prendre un échantillon d'eau hebdomadaires de chaque citerne pour confirmer l'activité œstrogénique (via l'écran de levure) et de la composition chimique (via la chimie analytique). Voir les sections 1-3 pour les détails de l'échantillonnage de l'eau, l'extraction et l'analyse.
Remarque: Pour chaque expérience, utilisez le contrôle de dilution de l'eau (contrôle négatif), le contrôle positif (E2 ou EE2) plus au moins trois dilutions d'effluents (100, 50 et 25%) ou chimique de test pour surveiller la réponse de dose. Si de nouvelles technologies sont testées, utilisez composé / effluent avec ou sans traitement (par exemple, EE2 sans traitement, EE2 avec TAML / peroxyde d'hydrogène (H 2 O 2) traitement 12; Figure 1).
- Utiliser de grands réservoirs de verre pour accueillir une charge allant jusqu'à 3 g de poisson par litre de water. Pour 8 mâles adultes (nominalement 4,5 g chacun), utiliser un réservoir de 10-20 L.
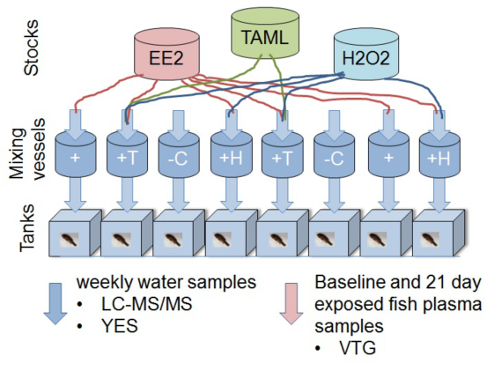
Figure 1. Schéma représentant la conception expérimentale d'un essai biologique in vivo Vairon à grosse tête vitellogénine pour déterminer le retrait de l' écotoxicité de 17α-éthinylestradiol utilisant TAML / traitement de l' eau de peroxyde. L'experimental mis en place se compose de huit 11 L verre chaque aquarium nourris avec un flux continu d'eau. solutions chimiques d'actions individuelles et de l'eau (filtrée de-chloré) sont livrés aux chambres de mélange. Des concentrations nominales (sans réaction) dans les récipients de mélange sont de 2 ng / L EE2, 80 nM TAML et 0,16 pg / LH 2 O 2. Solutions chimiques d'achat d'actions (EE2, H 2 O 2 et TAML) sont préparés et dosés séparément afin que les réactions commencent dans les récipients de mélange. Poisson (8 vairons mâles par réservoir) sont exposés au mélange (s) après un temps d'environ 45 minutes de contact de réaction. Des échantillons d'eau sont prélevés dans les réservoirs d'exposition hebdomadaire. Les échantillons de plasma sont prélevés vairons pour mesurer la vitellogénine biomarqueur oestrogénique (VTG) à partir d'un groupe de référence, au début de l'étude, et tous les autres poissons après 21 jours d'exposition. Les traitements spécifiques sont les suivants: 'C'; contrôle négatif (eau de dilution uniquement), '+'; contrôle positif de EE2,'+ H'; EE2 plus H 2 O 2 '+ T'; EE2 plus H 2 O 2 plus TAML. Ce chiffre a été modifié depuis Mills et al. 2015 12. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Procédure de test
- période d'acclimatation
- Mesurer le poids humide (g) de chaque poisson mâle sexuellement mature, et allouer au hasard pour chaque réservoir (8 mâles par réservoir).
- Gardez le poisson non alloué du même lot et de les maintenir dans les mêmes conditions de test. Utilisez ces poissons pour remplacer les personnes qui présentent des signes de dommages physiques ou un manque de condition pendant la période d'acclimatation de 7 jours. S'assurer à la fin de la période d'acclimatation de chaque réservoir de traitement a 8 hommes qui ont pleinement acclimatés aux conditions d'essai.
- Prenez des échantillons de plasma "de base" de un 8 hommes supplémentaires de la même batch des poissons mâles. Suivez la méthode de prélèvement de sang dans la section 4.4 et la méthode Vitellogenin (VTG) d'analyse en 4.5.
- Après la période d'acclimatation, de livrer les stocks de dosage des effluents chimiques ou aux réservoirs d'exposition pendant 21 jours comme décrit au point 4.2.2 ou 4.2.3. mortalité Monitor, le comportement et l'apparence physique des poissons dans chaque répliquent réservoir quotidiennement avant la première alimentation de la journée. Notez tout comportement anormal ou incidents.
Remarque: Veiller à des conditions environnementales et les taux d'alimentation maintiennent la santé des poissons (sections 4.2.4 et 4.2.5).
- période d'acclimatation
- Poisson d'échantillonnage après la période d'exposition de 21 jours
- 12 h avant le prélèvement, arrêter l'alimentation des poissons.
- tubes micro-centrifugeuse étiquette pour la collecte des échantillons de sang, ajouter ~ 5 pi d'aprotinine (un inhibiteur de la protéase) et placez-les sur la glace.
- Faire une solution de 500 mg / L de MS222 (anesthésique) par dissolution de 500 mg de MS222 par 1 L d'eau de-chloré (anciennement acclimatésà 25 ± 1 ° C). Neutraliser le MS222 à pH 7,4 ± 0,4 en utilisant 1 M NaOH.
- Déplacer chaque poisson du réservoir dans le MS222 tamponnée. Gardez à la solution jusqu'à ce que la cessation de tout mouvement opercule (typiquement 5 ± 1 min).
- Mesurer et enregistrer la longueur de la fourche (mm) sous l'anesthésique terminal. Utiliser un scalpel jetable pour amputer la queue, et d' utiliser un tube hématocrite hépariné pour recueillir le sang de l'artère caudale (Figure 2). passer soigneusement le sang dans le tube à centrifuger pré-étiquetés et garder sur la glace.
- Tuer le poisson immédiatement après avoir dessiné le sang. Confirmer la mort par arrêt définitif de la circulation et / ou la destruction du cerveau. Mesurer et noter le poids total du poisson (le plus proche de 0,01 g), et de disséquer les tissus selon les besoins.
- Centrifuger le sang (7000 xg pendant 5 min à 4 ° C) dans les 2 heures de la collecte. Transférer le surnageant de plasma à l'aide d'une pipette dans un nouveau marqué 0,4 ml microcentrifugeuse baignoirees et de stocker sur la glace. Congeler les tubes contenant du plasma sur glace sèche dans les 30 minutes de centrifugation et conserver à -80 ° C avant l'analyse des concentrations plasmatiques de VTG.

Figure 2. Photos représentant vairon mâle fathead (Pimephales promelas), la collecte et l' emplacement du testis plasma. A la fin de l'exposition de 21 jours tous les poissons devraient être tués pour prélever des échantillons de sang. Une fois sous cette longueur terminale anesthésique de poisson (longueur à la fourche, mm) doit être mesuré, rapidement suivie par la collecte de sang de l'artère caudale Photo-A:. Ligne pointillée rouge indique l' emplacement de la queue amputation (un scalpel jetable doit être utilisé pour amputer la queue ). photo-B montre un tube hématocrite hépariné utilisé pour recueillir le sang. Chaque poisson doit ensuite être tué immédiatement après son échantillon de sang a été prise, dans ce cas, toute la têtea été séparée du corps (Photo-C). Une fois que le poisson a été tué la cavité du corps peut être ouvert pour révéler les organes internes. Photo-C montre l'emplacement du testicule (gonades) par rapport à la vessie natatoire (SB) dans les poissons cyprinidés, par exemple, Vairon à grosse tête, le gardon, la carpe, etc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Mesurer les concentrations plasmatiques de VTG avec une enzyme-linked immunosorbent assay (ELISA) kit VTG homologue conçu spécifiquement pour les vairons.
- Préparer des normes et des tampons VTG tel que décrit dans le protocole du fabricant. Diluer plasma échantillon 1:50, 1: 5000 et 1: 500.000 et doser les en double exemplaire pour obtenir des lectures dans la plage de courbe standard VTG selon les instructions du fabricant. Suivez les directives du fabricant pour calculer les concentrations de vitellogénine.
5. Les évaluations sur le terrain de Advanced / Novel Wastewater Treatment Technologies pour atténuer l' activité œstrogène Utilisation de In Vivo Vitellogenin et intersexe Induction dans Roach (Rutilus rutilus)
- Capture of wild gardon vivant en aval des exutoires Wastewater Treatment Plant
Remarque: Utilisez le gardon (Rutilus rutilus) ou d' autres espèces d'eau douce en abondance ou de poissons saumâtres, qui sont gonochorique et connu pour être sensible à la perturbation endocrinienne oestrogénique.- Attrapez des poissons en utilisant électropêche, des filets, le piégeage ou d' autres méthodes de pêche reconnues selon la situation 13. Transporter le poisson dans les réservoirs aérés retour au laboratoire pour l'échantillonnage.
- Préparer des tubes de microcentrifugation comme indiqué dans 4.4.2. Préparer tamponnée MS222 comme décrit dans 4.4.3. Anesthetize poissons comme détaillé dans 4.4.4.
- Mesurer la longueur du poisson et le poids sous anesthésie terminal.
- Prélever le sang de la caudale artère en utilisant disposeringue héparinée zibeline. Tuez chaque poisson immédiatement après le prélèvement d'échantillons de sang. passer soigneusement le sang dans des tubes à centrifuger pré-étiquetés et garder sur la glace. Préparer le plasma comme décrit dans l'étape 4.4.7 et mesurer VTG par ELISA (4,5).
- En utilisant des pinces enlever les écailles de poisson 2-3 de chaque poisson et placez dans de petites enveloppes de papier marqués individuellement. Stockez les enveloppes à la température ambiante dans des conditions sèches pour les poissons plus tard détermination de l'âge et de l'analyse de la croissance.
- cavité corporelle ouverte avec un scalpel pour faire apparaître les organes internes. Sortez l'intestin pour révéler la vessie natatoire avec un gonades situé de chaque côté (Figure 2). Retirez délicatement les gonades appariés avec une pince à bec fin et lieu dans un flacon en verre. Couvrir les gonades avec le fixateur de Bouin à un rapport de 1:10 tissu: fixatif.
- Laissez le tissu dans Bouin pour 6-24 heures en fonction de la taille du tissu (fixateur pénètre à 1 mm par heure). Une fois fixé, verser fixateur de l'un BouinD remplacer par 70% de l'alcool dénaturé (IMS). Stocker le tissu fixé à la température ambiante jusqu'à ce que les tissus sont traités pour l'histopathologie (section 5.3).
- Champ évaluation fondée de l' activité oestrogénique in vivo en utilisant vitellogénine et intersexuées induction dans le gardon
- Design expérimental et mis en place
Remarque: Mettre en place les réservoirs et usine pilote bien avant le travail vivo départ dans. Démarrez les réservoirs qui coule 3-4 semaines avant tout ajout de poissons au système. Surveiller les débits d'eau, la qualité et les conditions (pH, température, oxygène dissous, etc.) régulièrement pour vous assurer des paramètres de l' eau peut être maintenue.- Construire de grands réservoirs d' eau du robinet (par exemple, 300-1000 L) sur le site de l'usine pilote, qui peut recevoir le «contrôle» de-chloré, effluent traité standard (s) et avancé des effluents (s) traité en parallèle. Fixer la pompe à air / aérateurs dans les réservoirs. Définir des débits d'eau pour atteindre au moins 6 réservoir véchanges olume par jour.
Remarque: Assurez-vous que les réservoirs sont bien isolés et ombragés pour éviter des fluctuations excessives de température quotidiennes. Les réservoirs de conception pour permettre une observation du poisson, des altérations du comportement (en absence d'alimentation, etc.), des signes de maladie et de mortalité.
- Construire de grands réservoirs d' eau du robinet (par exemple, 300-1000 L) sur le site de l'usine pilote, qui peut recevoir le «contrôle» de-chloré, effluent traité standard (s) et avancé des effluents (s) traité en parallèle. Fixer la pompe à air / aérateurs dans les réservoirs. Définir des débits d'eau pour atteindre au moins 6 réservoir véchanges olume par jour.
- Démarrez l'exposition en faisant flotter les sacs de roach (de la ferme de poissons) dans les réservoirs respectifs pendant 1 h. Ajouter de l'eau du réservoir pour les sacs progressivement jusqu'à ce que la température de l'eau et les conditions sont ambiante. Relâchez le poisson dans leurs réservoirs.
- Nourrissez roach adulte par jour sur la nourriture des poissons granulés (taille 0,5-0,8). Nourrissez roach juvénile quotidienne sur les petits granulés (tailles de granulés 100-300) non-oestrogénique alimentation 14 ad libitum, ajusté sur la base d'aliments non consommés. Tenir un registre d'alimentation réponse documentant d'alimentation / comportement quotidien (bonne, moyenne ou mauvaise, par rapport aux témoins).
- Prélever des échantillons d'eau hebdomadaires de chaque citerne pour confirmer l'activité oestrogénique et la composition chimique. Sesections e 1-3 pour les détails des méthodes d'échantillonnage et d'analyse de l'eau.
- Design expérimental et mis en place
- Histopathologie des poissons gonades 15
- Retirez délicatement les gonades disséquées et fixes (décrites dans les étapes 5.1.6 et 5.1.7) du récipient avec des pinces et les placer sur une planche à découper.
- Utilisez une lame microtome pour couper chaque gonades en 3 parties (antérieure, moyenne et postérieure) et à partir de chaque partie coupé une section transversale d'épaisseur de 3-5 mm. Placez soigneusement les six morceaux dans une cassette de biopsie plastique étiqueté, et la placer dans le processeur de tissus en utilisant les timings énumérés dans le tableau 4.
- Wax tissus et section sur microtome rotatif (3-5 pm) incorporer. sections de transfert aux étiquetés lames de verre enduit bio-adhésif et placer les lames sur une plaque chauffée (fixée à 45 ° C) à sécher pendant 24 heures.
- Colorer les lames, soit manuellement , soit à l' aide d' une coloration automatisée, en utilisant les horaires détaillés dans le tableau 5. Déposer une goutte d'agent de fixation sur le tissu teinté, et lay un verre Coverslip sur l'agent de montage pour protéger le tissu.
- Tout d' abord, examiner chaque lame à faible grossissement (20X, ie objectif 2X, avec des lignes 10X oculaires grossissement) pour déterminer le sexe et le nombre de points de pièces jointes à la cavité du corps 15. Notez toutes les anomalies pour chaque poisson.
- A un plus fort grossissement (100X ou 400X), examiner les tissus pour évaluer les stades de la gamétogenèse, des anomalies et la présence d'ovocytes dans le tissu testiculaire. Notez la gravité de l' intersexualité avec le système suivant de notation allant de 0 (tissu mâle normal) à 7 (100% tissu ovarien) 6 (voir le tableau 6).
| Numéro de l' étape | Traitement | Objectif | Temps (h) |
| 1 | 70% IMS | déshydration | 3 |
| 2 | 90% IMS | déshydration | 2.5 |
| 3 | 95% IMS | déshydration | 1.5 |
| 4 | 100% IMS | déshydration | 1.5 |
| 5 | 100% IMS | déshydration | 1.5 |
| 6 | 100% IMS | déshydration | 1.5 |
| 7 | 100% IMS | déshydration | 1.5 |
| 8 | Histologie agent de compensation | Clairière | 1.5 |
| 9 | Histologie agent de compensation | Clairière | 1.5 |
| dix | Histologie agent de compensation | Clairière | 1.5 |
| 11 | LA CIRE | Wax infiltration | 1.25 |
| 12 | LA CIRE | Wax infiltration | 1.25 |
| 20 h TOTAL |
Tableau 4. régime de traitement pour la cire d' imprégnation des tissus pour l' histopathologie. Les tissus doivent être traités dans un processeur automatique de tissu. Les tissus doivent être immergés dans les solutions détaillées pour la période de temps spécifiée.
| Colorer pas. | Tache | Objectif | Temps (min) |
| 1 | Agent histologie Compensateur | Dissout la cire | 15 |
| 2 | 100% IMS | hydration | 2 |
| 3 | 90% IMS | hydration | 2 |
| 4 | 70% IMS | hydration | 2 |
| 5 | EAU DU ROBINET (RUNNING) | Rincer | 2 |
| 6 | hématoxyline | noyaux cellulaires Taches bleu | dix |
| 7 | EAU DU ROBINET (RUNNING) | Enlever l'excès | dix |
| 8 | acidifiés IMS | déchloration | 20 sec |
| 9 | EAU DU ROBINET (RUNNING) | Rincer | 20 sec |
| dix | LiCO 3 | Sel | 20 sec |
| 11 | EAU DU ROBINET (RUNNING) | Rincer | 20 sec |
| 12 | 1% EOSIN (AQUEUSE) | Taches roses cytoplasme | 20 sec |
| 13 | EAU DU ROBINET (RUNNING) | Enlever l'excès | 5 |
| 14 | 70% IMS | déshydration | 2 |
| 15 | 90% IMS | déshydration | 2 |
| 16 | 100% IMS | déshydration | 5 |
| 17 | Agent histologie Compensateur | Retirer IMS, agent de liaison | 5 |
Tableau 5. Solutions et temps d'immersion pour hématoxyline et de l' éosine (H & E) coloration des tissus du poisson gonadiques. Les lames doivent être placés dans chaque bain pour le allocATED temps en séquence. H & E coloration des tissus est nécessaire pour déterminer les impacts du développement ou de l'organisation des effluents d'eaux usées oestrogéniques sur les gonades poissons.
| But | Section description |
| 0 | testis mâle normal |
| 1 | Multifocale ovotestis avec 1-5 ovocytes (habituellement individuellement) dispersés dans le tissu testiculaire |
| 2 | ovotestis multifocale, 6-20 oocytes souvent en petites grappes dispersées entre le tissu testiculaire |
| 3 | ovotestis multifocale, 21-50 oocytes en grappes |
| 4 | > 50 et <100 ovocytes. Section est habituellement multifocale et a l'apparence d'une mosaïque de teststissus iculier et de l'ovaire. |
| 5 | > 100 ovocytes, habituellement multifocale mais pourrait aussi être focale avec des zones clairement identifiables de tissu ovarien et testiculaire séparé du tissu testiculaire. |
| 6 | > 50 pour cent du tissu gonadique sur la section est de l'ovaire et est clairement séparé du tissu testiculaire par les cellules épithéliales et les tissus phagocytaires. |
| 7 | 100 pour cent des tissus gonadiques sur la section de l'ovaire. |
Tableau 6. Système de notation pour évaluer la gravité de l' état de l' intersexualité dans le gardon. Histologiquement lames préparées de tissu gonadique devraient être examinées au microscope optique, à 20X, 100X et 400X, pour évaluer d' éventuelles anomalies et la présence d'ovocytes dans le tissu testiculaire. Ce tableau est modifié à partir Jobling et al. 2006 6.
Résultats
Les tentatives visant à comprendre l'impact des améliorations aux procédés de traitement des eaux usées ou de déterminer la technologie la plus appropriée pour moderniser l'équipement comme traitement tertiaire au WWTP existant par rapport à l'efficacité de l'élimination de l'activité perturbant le système endocrinien des effluents déchargés, exige non seulement la mesure du produit chimique clé composants qui entrent dans les œuvres, mais nécessite l'analyse des produits de dégradation qui peuvent aussi avoir une activité perturbant le système endocrinien. Dans les effluents d'eaux usées domestiques, les substances les plus œstrogéniques sont les hormones stéroïdiennes, l' estrone (E1), 17β-oestradiol (E2) et 17α-éthinylestradiol (EE2) 5,8. Les oestrogènes stéroïdiens sont principalement éliminés du corps sous forme de mélange de conjugués inactifs 16,17. Ces œstrogènes conjugués sont sensiblement déconjugués dans le système d'évacuation des eaux usées par l'activité bactérienne et une nouvelle dégradation se produit dans la station d'épuration. Les stéroïdes déconjugués are retiré du courant d'eaux résiduaires par adsorption sur de la boue ou biodégrader au cours du traitement secondaire conduisant à la formation, d'une part de sous-produits de transformation et, finalement, la minéralisation complète peut se produire du composant actif initial. L'analyse chimique de tous les composés individuels dans le courant d'effluent serait difficile, longue et coûteuse et ne couvre pas les composants actifs inconnus présents dans un échantillon. De plus, une somme de la contribution de chaque composant oestrogénique ne fournira une indication de l'activité oestrogénique cumulative d'un échantillon des composés analysés. Ceci est un risque où les processus de transformation génèrent des substances oestrogéniques inconnus ou lorsque l'affluent est d'origine industrielle. La combinaison de l' analyse chimique avec in vivo et dans des essais biologiques in vitro écotoxicologiques apporte une solution à la présence de composants œstrogéniques inconnus dans des mélanges tels que les eaux usées traitées. Les essais in vitro tels que la levure Estrogen Screen (YES) ont été largement utilisées pour déterminer l'activité oestrogénique des effluents d'eaux usées et pour aider à identifier les composants actifs dans les échantillons traités 8,18,19. Cependant, les comparaisons entre in vivo et in vitro tests peuvent être significatifs 11 et une évaluation complète des nouveaux processus en matière de traitement du système endocrinien activité perturbant nécessite une batterie de tests chimiques et écotoxicologiques.
Pour déterminer si les usines de traitement individuels ou processus supprimer des composés actifs dans le flux des eaux usées peut être réalisé en utilisant une analyse chimique qui suit l'extraction de l'échantillon, la concentration et le nettoyage de l'extrait avant l'analyse, le plus souvent effectué à l'aide LCMS (/ MS) ou SMGC (/ SM). Les données obtenues à partir de l' analyse chimique peuvent être utilisés pour déterminer la conformité individuelle prédit concentrations sans effet (PNEC) 20 ou standards de qualité de l' environnements (NQE) 21 de composés individuels spécifiques et par conséquent , ces méthodes sont essentielles pour les données de conformité réglementaire. En outre, ciblées ou par des méthodes d'analyse chimique non ciblés permettent l'identification et la quantification de composés individuels ou d'isomères par rapport aux procédés biologiques, qui donnent une réponse totale. Les méthodes d'analyse chimique permettent donc l'évaluation des composés discrets à faire se rencontrer et de faire face à ces problèmes de traitement des eaux usées sur une base de l'usine de traitement individuel. Des études ont montré que le traitement des eaux usées classique (par exemple, les installations à boues activées) peut être très efficace dans l'élimination des hormones stéroïdes naturelles , bien que la suppression de l'hormone synthétique EE2 a tendance à être moins efficaces. Des études de terrain à l'aide de traitement avancé utilisant des techniques telles que l'ozone, le carbone granulé activé (GAC) et les membranes ont démontré, mais à un coût élevé, qu'ils peuvent être utilisés comme une solution de bout-de-pipe pour enlever EE2 au-dessous de predigés niveaux d'effet et au - dessous des limites de détection. La figure 3 montre le retrait de EE2 utilisant GAC à une usine de traitement des eaux usées municipales à l'échelle pilote. Des études menées à l' échelle pilote dans les usines de traitement des eaux usées municipales à l' aide de l' extrémité du tuyau de traitement GAC montrent également la réduction de la puissance estrogénique suivante GAC mesurée à l' aide de l'écran Yeast Estrogen (YES) comme on le voit sur la figure 4.
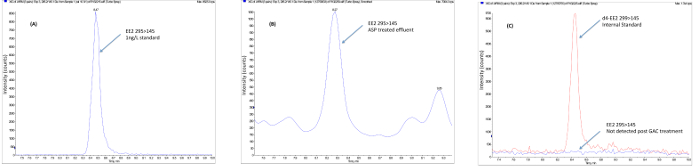
Figure 3. Données sur le terrain Exemple montrant l'enlèvement d'éthinylestradiol suivant un traitement tertiaire avancé. (A) Les échantillons sont recueillis à partir de la station d' épuration suivante (usine de boues activées) traitement conventionnel suivant les procédures décrites pour la conservation de l' échantillon. (B) Les échantillons sont extraits en utilisant l' extraction en phase solide, nettoyé à éliminer les substances interférant au moyen de SPE en phase normale etchromatographie par perméation de gel. (C) L'extrait concentré pur est concentrée à un faible volume et analysé à l' aide électropulvérisation à ions négatifs LCMS / MS en mode MRM. Les résultats sont calculés en utilisant la normalisation interne à l'aide des standards internes marqués par des isotopes. Dans l'exemple illustré, EE2 est présent dans l'effluent final ASP à une concentration supérieure à la dose sans effet (PNEC) de 0,1 ng / L et est éliminé en utilisant GAC et de l' ozone (O 3) à une concentration sécuritaire pour l' environnement. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
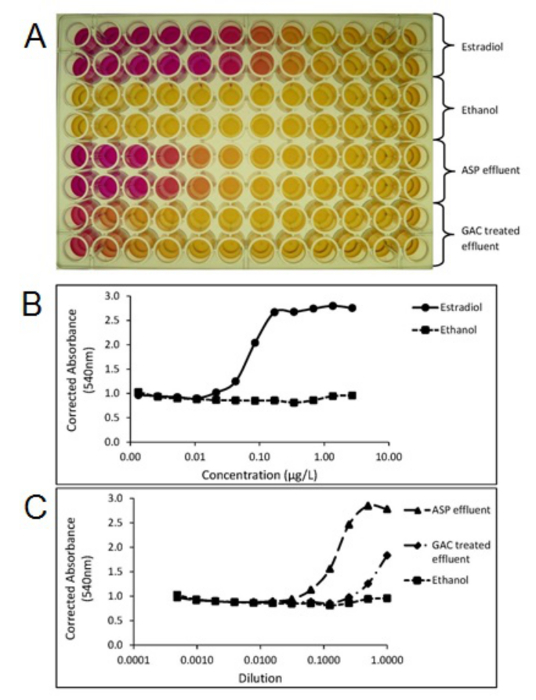
Figure 4. Photo d'un écran Yeast Estrogen (YES) plaque d'essai (A) montrant le changement de couleur du jaune au rouge, relatif à l' activité oestrogénique des échantillons. Parcelles créés à partir de la plaque d'essai YES démontrant corrigées absorbance (540nm) de la norme estradiol (B), procédé par boues activées des effluents (ASP) et charbon actif en grains (CAG) traités échantillons effluents d'eaux usées (C). Chaque échantillon a été testé en double. ASP et GAC effluents ont été extraites et concentrées en utilisant les méthodes de SPE décrites dans la section 1. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
L'ozonation est également efficace pour éliminer les oestrogènes stéroïdes et de l'activité oestrogénique de traités de façon conventionnelle les usines de traitement des eaux usées. L'ozone est capable d'oxyder une large gamme de contaminants organiques et des matières organiques dissoutes dans les échantillons d'eaux usées et fournit des propriétés de désinfection. L'efficacité de l'ozonation dépend des caractéristiques de l'eau tels que le pH, la quantité de matière organique et la dose appliquée de l'ozone. Les estrogènes qui sont mal éliminés par un traitement conventionnel peut êtreenlevés des eaux usées avec des doses comprises entre 0,8 et 2 mg O 3 / mg COD. L'ozone est un agent oxydant sélectif, qui réagit avec les sites d'électrons riches (les liaisons insaturées carbone-carbone, des composés aromatiques, y compris les alcools aromatiques), ce qui rend l'ozone applicable pour la répartition d'un certain nombre d'EDC. Toutefois, l'élimination des composés individuels ne conduit pas nécessairement à la minéralisation complète du composé d'origine. l'ozonation des substances organiques suivantes peuvent être transformés intermédiaires de génération ou d'une oxydation de transformation des sous-produits qui comprennent un certain nombre de bas poids moléculaire, des classes de composés polaires tels que des aldéhydes, des cétones, des acides carboxyliques, des céto-acides et les composés bromés. Des exemples comprennent le bromate, le formaldéhyde, l'acétaldéhyde et des acides carboxyliques. L' utilisation in vivo et in vitro dans des essais biologiques , il a été démontré que , bien que l' ozone oxyde partiellement certaines substances chimiques, les principaux produits de transformation résultants ont une faible estrogenic puissance et donc l'application de l'ozone à un résultat approprié de la dose dans un retrait élevé d'activité oestrogénique.
L'un des principaux avantages d'un traitement supplémentaire des eaux usées est la réduction de la féminisation des poissons mâles dans les eaux réceptrices; un effet négatif qui peut entraîner une diminution de la fertilité 3. Dans des études in vivo à l' aide de poissons (par exemple, le gardon ou Vairon à grosse tête) exposés à des eaux usées montrent des cellules germinales femelles ou des ovocytes dans les testicules des poissons mâles (par exemple, comme on le voit sur la figure 5). Intersexes ou mâle VTG est absent ou réduit de manière significative dans les poissons suite à un traitement avancé tel que GAC 7 ou ozone 22. Ces études montrent que les produits de transformation produites au cours de l'ozonation ne sont pas oestrogénique, mais cela ne répond pas à la toxicité de l'effluent produit. Cette question a été abordée dans d' autres études, par exemple une étude de Magdeburg et al. 23 qui montre que l' oxydation de l' ozone sous-produits sont toxiques pour la truite arc , mais cette toxicité peut être éliminé par filtration sur sable aval suivant ozonation.
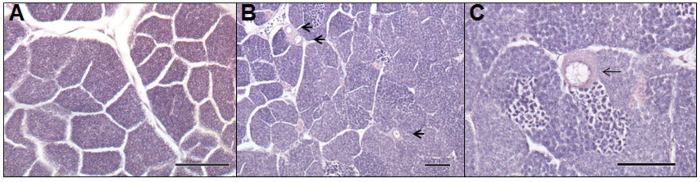
Figure 5. photomicrographies d'un mâle normal (A) et intersexuées (B, C) gonades de roach adulte (Rutilus rutilus) exposées à des eaux usées dans un champ évaluation fondée. Photomicrographie-A, représente une coupe histologique de testis mâle normal. Photomicrographie-B et C, dépeint des coupes histologiques d'un poisson mâle intersexe, ayant été exposés à procédé par boues activées effluents d'eaux usées pendant six mois. Les flèches indiquent les ovocytes présents dans le tissu testiculaire. La barre d'échelle représente 100 um dans chaque microphotographie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Le coût élevé de la fin du traitement de la conduite en utilisant l'ozone, le GAC ou la technologie membranaire nécessite le développement d'un faible coût de remplacement, des méthodes durables pour perturbateurs endocriniens chimiques (EDC) l'enlèvement. En outre, les méthodes d'adsorption et de séparation simplement séparent EDC d'une phase à l'autre plutôt que de les éliminer par la dégradation. Activateurs TAML ont été développés pour catalyser l' hydrogène oxydation par le peroxyde de micropolluants organiques dans les eaux usées 12,24 - 26. TAML activateurs avec H 2 O 2 dégrade efficacement EE2 et d' autres oestrogènes stéroïdes dans l' eau de laboratoire pure ainsi que dans les effluents des usines municipales de traitement des eaux usées et dans des échantillons d'urine enrichis 12. Des études en laboratoire, montre TAML / H 2 O 2 traitement permet l' élimination de l' oestrogène stéroïde élevé , y compris le retrait EE2 et réduit sensiblement l' activité oestrogénique mesurée in vitro en utilisant le bioessai OUI et substantially diminue poissons féminisation in vivo mesurée en utilisant le bioessai VTG (Figure 1 et Figure 6).
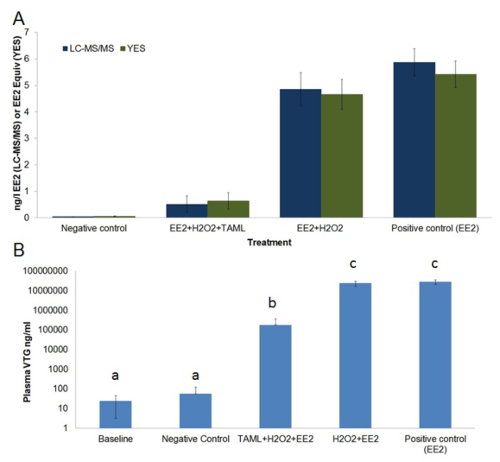
Figure 6. concentration de EE2 moyenne et l' activité oestrogénique dans les eaux traitées et non traitées du réservoir (A) et vitellogénine du plasma dans la ligne de base et les poissons exposés mâle (B). A) de concentration de EE2 (ng / L, barres bleu foncé) a été mesurée par LCMS / MS , l' activité oestrogénique (EE2 ng / équivalent L, barres vert foncé) a été mesurée via vitro écran dans Yeast Estrogen (YES). B) vitellogénine plasmatique (ng / ml, bars bleu clair) concentration en vairons mâles ont été mesurés par une enzyme quantitative liés en immunosorbent assay (ELISA). EE2 résultats des analyses chimiques déclarées comme <0,03 ng / L de EE2 (ie, inférieure à la limite de détection (LOD)) ont été considérés comme ayant la moitié LOD (ie, 0,015 ng / L EE2) pour une utilisation dans le calcul des moyennes, erreur standard et l'analyse statistique. EE2 et l'activité oestrogénique sont des concentrations moyennes mesurées échantillonnées au cours de l'exposition de 21 jours. VTG plasma a été mesurée avant l'exposition (de base) et après l'exposition de 21 jours. Le régime de traitement a consisté; contrôle négatif (eau de dilution uniquement), EE2 + H 2 O 2 + TAML, EE2 + H 2 O 2, et EE2 seule. Les barres d'erreur dans le graphique-A représentent l'erreur standard de la moyenne, les barres d'erreur dans le graphique-B représentent l'écart type. Lettres au-dessus des barres dans le graphique-B représentent la similarité statistique. Ce chiffre a été modifié depuis Mills et al. 12 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
les usines de traitement des eaux usées sont la principale voie de contamination des eaux de surface avec EDC. Une évaluation de l'efficacité de l'élimination de l'activité du système endocrinien des procédés de traitement classiques, avancée ou émergents nécessite l'utilisation d'une variété de dosages chimiques et biologiques. L'analyse chimique en utilisant une analyse non ciblée et ciblée fournit des données qualitatives ou quantitatives sur l'efficacité de l'élimination des composants individuels et permet donc une évaluation à faire par rapport aux normes de qualité de l'environnement ou les concentrations prédites sans effet pour les composés ou mélanges de composés analysés.
La génération des produits de transformation résultant de la minéralisation incomplète des matières après le traitement et la présence de composants biologiquement actifs inconnus dans les eaux usées limite l'utilité des tests chimiques seuls. Une combinaison in vivo et in vitro dans des essais biologiques en combinaison avec chimistedépistage ry fournit une boîte à outils utile pour déterminer l'efficacité de l'élimination EDC par des procédés de traitement des eaux usées émergents. Ces tests, lorsqu'elles sont conduites aux côtés de paramètres de qualité de l'eau traditionnels et d'autres points finaux toxicologiques et microbiologiques permettent une évaluation critique des technologies de traitement des eaux usées actuelles et émergentes.
Il est important de noter que les écrans à base de levure d'œstrogènes (par exemple, YES) ne sont pas le seul essais in vitro pour déterminer la puissance œstrogénique des produits chimiques et des eaux usées. Un certain nombre d'essais à base de cellules de mammifère transfectées de manière stable ont été développés aussi, par exemple, l'ER-CALUX 27 et hERa-HeLa-9903 28 avec des cellules de cancer du sein humain ou des cellules tumorales du col , respectivement. Le OUI a été comparé à des tests similaires à base de cellules de mammifères et a été trouvé pour avoir un niveau élevé comparable de reproductibilité, les taux réels oestrogéniques positifs et négatifs vrais identification 29, although il est parfois considéré comme un peu moins sensibles 27. Un des avantages de levure à base des dosages de rapporteur est que dans les laboratoires sans expérience significative avec la culture de cellules de mammifères OUI peut être plus facilement adoptée, car elle nécessite des mesures de bio-contrôle moins strictes et des techniques stériles (OUI peut être effectuée sur la paillasse si nécessaire) . Les tests basés sur les cellules humaines ont également besoin de CO 2 incubateurs et luminomètres par rapport aux lecteurs de l' incubateur et de microplaques standards utilisés dans le OUI. Deux levures tests oestrogène à base de rapporteurs (OUI, Saccharomyces cerevisiae et, adeninivorans Arxula-OUI A) sont actuellement en cours sentiers inter-laboratoires pour la validation de la norme ISO 19040 "Qualité de l' eau - Détermination du potentiel oestrogénique de l' eau et des eaux usées" mettant en évidence les industries l'intérêt pour ces techniques.
Il existe un certain nombre de limitations des procédés décrits, qui comprennent la contamination potentielledes échantillons au cours de l' échantillonnage, le stockage d'échantillons et l' analyse des substances oestrogéniques provenant de l'environnement sur le terrain ou en laboratoire ou par contamination humaine (par exemple, des plastifiants, des tensioactifs, des produits de soins personnels). Ce type de contamination dans le test YES (ou d'autres dosages de rapporteur à base de cellules) va élever le fond et l'impact de l'utilisation du dosage. Des échantillons d'eau ou de solvants stockés dans des bouteilles en plastique peuvent facilement provoquer des faux positifs. Les faux négatifs sont également préoccupants à la fois comme LCMS / MS et le test YES nécessitent SPE se concentrer oestrogènes à des niveaux détectables. La matrice, le choix du sorbant et SPE solvant d'élution peut affecter l'efficacité de l'extraction et les types de composés élués. L'utilisation de cartouches C18 SPE pour l'extraction en utilisant les conditions décrites dans le présent protocole peut générer un biais négatif, comme des composés hautement polaires et basiques seraient mal conservés par le sorbant. En outre, ce protocole doit être reconstitué de l'éluant OUI élue de methanol à l'éthanol par évaporation à sec source de financement de l'azote résultant dans la perte de composés volatils. En conséquence, le protocole pourrait apporter une sous-estimé l'activité œstrogénique des échantillons testés. Ces limitations sont particulièrement importantes lorsque l'on considère l'essai YES comme composés inconnus ou inattendus pourrait manquer, parce qu'il n'a pas été extraits ou ils sont perdus à cause de l'évaporation. En outre, la technique LCMS / MS utilise des normes internes marquées pour corriger pour la récupération; cette approche ne peut pas être utilisé avec le dosage OUI.
Limitations significatives des tests in vivo des effluents comprennent le coût et le temps nécessaires à l' évaluation élevée par rapport aux méthodes in vitro. Actuellement, l'utilisation de tests d'embryons de poissons pour détecter l'activité oestrogénique est limitée. Cependant, il y a eu un certain succès avec la production d' œstrogènes transgéniques sensibles rougeoyante embryons de poisson 30, ce qui pourrait avoir des applications futures. vairons Fathead (utilisés dans ce protocol) est une espèce de laboratoire communes et VTG induction chez les poissons mâles est un bio-marqueur bien documenté d'exposition oestrogénique et une mesure quantifiable des effluents d' eaux usées strogénicité 22 ou d' autres composés oestrogéniques ou des mélanges 31. Les lignes directrices de test OCDE pour les perturbateurs endocriniens ont été validés à l' aide des adultes Vairon à grosse tête, medaka japonais et zebrafish 32,33, avec VTG étant un biomarqueur sensible de l' exposition aux œstrogènes chez les trois espèces. Cependant, VTG induction ne correspond pas directement à altération de la reproduction et donc les conséquences écologiques de l' exposition des eaux usées, comme on le voit dans sévèrement roach intersexe 3. D'autre part, le gardon ne sont pas une «espèce de laboratoire" classiques pour la recherche sur l'écotoxicologie en raison de leur grande taille, longue durée de génération (2-3 ans pour atteindre la maturité sexuelle), le style de la reproduction; groupe frai (reproduction) a lieu une fois par an, et la difficulté d'identifier les mâles des femelles (autres que pendantla saison de ponte). Cependant, cette espèce normalement gonochorique a été très bien étudié au Royaume - Uni, en raison de la découverte que , en aval des effluents d'eaux usées oestrogéniques, les poissons mâles exposées perturbations à leur endocrinologie (par exemple, la présence de la vitellogénine femelle spécifique dans le sang) et l' histopathologie (ovotestis - le développement des œufs dans les testicules et / ou conduits reproducteurs féminins) 5,6. Par conséquent, comme une application future de ces protocoles, le gardon (ou espèces similaires) pourraient être une espèce sentinelle sauvages utiles pour montrer si réelles améliorations à la qualité des eaux usées (et strogénicité réduite) sont observés dans les rivières qui reçoivent des effluents traités avancés. Ils peuvent également être utilisés en fin de systèmes de tuyaux pour surveiller l' amélioration technologique des effluents provenant des installations à l'échelle pilote 7. Lorsque l'on considère que les espèces à utiliser dans des évaluations des eaux usées in vivo il existe un compromis entre les espèces de laboratoire d'essai en utilisant relativement rapides et contrôlés par rapport à laplus le terrain sur la base, mais plus pertinent pour l'environnement, les tests utilisant des espèces indigènes. Cependant, comme des évaluations in vivo sont un coût élevé et ne devrait être considérée comme la dernière série de tests suivants évaluations en utilisant l' analyse chimique et dans des essais in vitro.
Les étapes critiques dans les protocoles décrits comprennent la préparation et la manipulation des échantillons et de la verrerie (c. -à- bouteilles et l' équipement d'échantillonnage doivent être pré-traités avec la surface de l' agent de nettoyage actif approprié) afin d' éviter la contamination des échantillons de contaminants de l' environnement , y compris en limitant le contact des échantillons avec des matières plastiques et d'autres matériaux qui peuvent produire des résultats faussement positifs. Ceci est tout aussi important lors de la conception et la construction de systèmes d'exposition aquariums et de poissons. Idéalement aquariums (stocks de logements et pendant les expositions) devrait être construit à partir de matériaux à faible adsorption 32 avec le risque de contamination minimale. L'acier inoxydable peut être utilisé pour des réservoirs de rétention d'effluents ou de l'eau.Considérant que les réservoirs d'une construction de verre sont préférés pour les réservoirs de poissons (car cela fournit également une observation facile du poisson). L'utilisation de tuyaux ou des tubes en plastique de qualité faible doit être évité 32, PVC 34 et ABS peut être utilisé si «bien assaisonné», à savoir, de gauche à lessiver les contaminants dans l' eau de dilution courante pendant au moins 12 heures avant l'utilisation. tube de silicium de qualité médicale a été employée avec succès dans notre usine pour la livraison de la pompe péristaltique de produits chimiques et de l'eau des eaux usées / de dilution aux réservoirs. Aussi bien que compte tenu de la contamination oestrogénique dans la construction et le fonctionnement du système aquatique, il est également important de penser à l'alimentation des poissons; de nombreux aliments de poissons de propriété ont été trouvés pour être oestrogénique pour les poissons. Par conséquent , il est important de tester tous les aliments pour l' activité (par exemple, dans l'écran de Estrogen de levure, Voir Beresford et al. 14) avant de les utiliser dans ces types d'études.
Dépannagedes protocoles d'essai d'analyse chimique ou OUI décrits est simplifiée si les échantillons d'assurance de la qualité, y compris Voyage multiple, laboratoire et ébauches de solvants sont analysés à côté des contrôles positifs et des échantillons réels pour éliminer les faux résultats positifs et faux négatifs. Positive (par exemple, EE2) et négatif (dilution de l' eau seulement) le contrôle doit aussi toujours être utilisé dans les essais in vivo pour confirmer la sensibilité des biomarqueurs ou le terminal (ie, VTG ou histopathologie) biologique prévu, et permettre à toute contamination inattendue à détecter ( par exemple de dispositif expérimental up, régime alimentaire, ou dans les eaux de dilution). Toute modification dans le protocole doivent être validés avant d'effectuer toute étude.
Avec une réglementation plus stricte des composés oestrogéniques pénètrent dans l'environnement par les effluents des SEEU il est envisage que les technologies plus efficaces de traitement des eaux usées devront être mis au point. La batterie de tests décrits dans ce manuscrit félicite leLes tests d'évaluation écotoxicologiques et chimiques normalement appliquées au traitement des eaux usées rejets d'effluents de l'usine. Par conséquent, l'application future de ce type de batterie holistique de l'essai devrait permettre aux développeurs de technologie des eaux usées, et les exploitants de centrales, de mettre en œuvre les conceptions les plus écologiquement sûr compte tenu des meilleures méthodes pour éliminer les produits chimiques oestrogéniques réglementés spécifiques et l'activité biologique globale.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Projects presented in this paper were funded by Severn Trent Water and Brunel University London. The authors would like to thank Alan Henshaw and John Churchley for providing field and laboratory assistance. T.J.C. thanks the Heinz Endowments for support. M.R.M. thanks the Steinbrenner Institute for a Steinbrenner Doctoral Fellowship and Carnegie Mellon University for a Presidential Fellowship.
matériels
| Name | Company | Catalog Number | Comments |
| Wellwash Versa plate washer | Thermo Scientific | 5165010 | |
| Plate reader | Molecular Devices | SpectraMax 340PC | |
| Incubator | Memmert | INB 400 | 37 °C incubation required for carp assay |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Icemaker | Scotsman | AF80 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| ELISA kits | Biosense Laboratories | V01018401-096 (Fathead minnow) V01003402-096 (Carp) | |
| Microfuge tubes, 0.5 ml | Alpha labs | LW2372 | |
| Microfuge tubes, 1.5 ml | Alpha labs | LW2375 | |
| Sulphuric acid, 95-98% | Sigma-Aldrich | 258105 | |
| Histology | |||
| Tissue processor | Leica Biosystems | TP1020 | |
| Wax dispenser | Thermo Scientific Raymond Lamb | E66HC | |
| Metal embedding mold | Leica Biosystems | Various | |
| Hot plate | Thermo Scientific Shandon | 3120063 | |
| Cold plate (EG1150 C) | Leica Biosystems | 14038838037 | |
| Heated forceps (EG F) | Leica Biosystems | 14038835824 | |
| Microtome | Leica Biosystems | RM2235 | |
| Paraffin section floatation bath | Electrothermal | MH8517 | |
| Slide drying bench | Electrothermal | MH6616 | |
| Stainmate automated stainer | Thermo Scientific Shandon | E103/S10L | |
| Cassettes, Histosette II, biopsy | Simport | M493 | |
| Paraffin wax | Thermo Scientific Raymond Lamb | W1 | |
| Histo-Clear II | National Diagnostics | HS-202 | |
| IMS (ethanol mix), IDA99 | Tennants | ID440 | |
| Polysine adhesion slides | Thermo Scientific Gerhard Menzel | J2800AMNZ | |
| Cover slips, 22x50 mm | VWR | 631-0137 | |
| Histomount | National Diagnostics | HS-103 | |
| Haematoxylin Harris GURR | VWR | 351945S | |
| Eosin, 1%, aqueous | Pyramid Inovation | S20007-E | |
| Fisherbrand slide boxes | Fisher Scientific | 11701486 | |
| Microtome blades, MB35 | Thermo Scientific Shandon | 3050835 | |
| Bouin’s solution | Sigma Aldrich | HT10132-1L | |
| Yeast screen | |||
| Flow cabinet | Labcaire Systems Ltd | SC12R | |
| Cooled incubator | LMS Cooled Incubator | 303 | |
| Incubator | Memmert | INB 400 | |
| Shaker | Grant | PSU-10i | |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Plate shaker | Heidolph Titramax 100 | 544-11200-00 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| 12-channel pipette, electronic | Sartorius | 735441 | |
| 96-well flat-bottom microplates | MP Biomedicals Thermo Scientific Nunc Sarstedt | 76-232-05 260860 82.1581.001 | We have found that these multiwell plates all produce low backgrounds |
| HPLC grade water | Rathburn | RH1020 | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| Potassium phosphate monobasic anhydrous | Sigma-Aldrich | P-5655 | |
| Ammonium sulphate | Sigma-Aldrich | A-2939 | |
| Potassium hydroxide, pellets | Sigma-Aldrich | P-1767 | |
| Magnesium sulfate, anhydrous | Sigma-Aldrich | M-2643 | |
| Iron(III) sulfate | Sigma-Aldrich | 307718 | |
| L-Leucine | Sigma-Aldrich | L-8912 | |
| L-Histidine | Sigma-Aldrich | H-6034 | |
| Adenine | Sigma-Aldrich | A-2786 | |
| L-Argenine, hydrochloride | Sigma-Aldrich | A-6969 | |
| L-Methionine | Sigma-Aldrich | M-5308 | |
| L-Tyrosine | Sigma-Aldrich | T-8566 | |
| L-Isoleucine | Sigma-Aldrich | I-7403 | |
| L-Lysine, hydrochloride | Sigma-Aldrich | L-8662 | |
| L-Phenylalanine | Sigma-Aldrich | P-5482 | |
| L-Glutamic acid | Sigma-Aldrich | G-8415 | |
| L-Valine | Sigma-Aldrich | V-0513 | |
| L-Serine | Sigma-Aldrich | S-4311 | |
| Thiamine, hydrochloride | Sigma-Aldrich | T-1270 | |
| Pyridoxine | Sigma-Aldrich | P-5669 | |
| D-Pantothenic acid, hemicalcium salt | Sigma-Aldrich | P-5155 | |
| Inositol | Sigma-Aldrich | I-5125 | |
| D-Biotin | Sigma-Aldrich | B-4639 | |
| D-(+)-Glucose anhydrous; mixed anomers | Sigma-Aldrich | G-7021 | |
| L-Aspartic acid | Sigma-Aldrich | A-4534 | |
| L-Threonine | Sigma-Aldrich | T-8441 | |
| Copper(II) sulfate, anhydrous | Sigma-Aldrich | C-1297 | |
| Chlorophenolred-β-D galactopyranoside (CPRG) | Sigma-Aldrich | 10884308001 | |
| Glycerol | Sigma-Aldrich | G-2025 | |
| 17 β-Estradiol | Sigma-Aldrich | E-8875 | |
| Steroids | |||
| Acetone | Rathburn | ||
| Acetonitrile | Rathburn | ||
| Ammonia solution | Rathburn | ||
| Ethylacetate | Rathburn | ||
| Copper(II) nitrate | Sigma-Aldrich | ||
| Acetone | Rathburn | ||
| Dichloromethane | Rathburn | ||
| 2,4,16,16-d4-17β-estradiol | CDN Isotopes | ||
| 2,4,16,16-d4-estrone | CDN Isotopes | ||
| 2,4,16,16-d4-17α-ethynyl oestradiol | CDN Isotopes | ||
| 17β-estradiol | Sigma-Aldrich | ||
| Estrone | Sigma-Aldrich | ||
| 17α-ethynyl oestradiol | Sigma-Aldrich | ||
| Hexane | Rathburn | ||
| Hydrochloric acid | Sigma-Aldrich | ||
| Methanol | Sigma-Aldrich | ||
| Sodium hydrogen carbonate | Sigma-Aldrich | ||
| Sodium hydroxide | Sigma-Aldrich | ||
| Styrene divinyl benzene cartridge (Isolute ENV+) solid phase extraction cartridge (200 mg/6 ml) | Biotage | ||
| Isolute aminopropyl solid phase extraction cartridge (500 mg/6 ml) | Biotage | ||
| Fish study | |||
| orange-white silicon manifold tubing 0.63 bore pk 6 | Watson Marlow | 982.0063.000 | |
| straight connectors for 0.5/0.8 bore pk 20 | Watson Marlow | 999.2008.000 | |
| pumsil silicon tubing 0.8 bore 15 m | Watson Marlow | 913.A008.016 | |
| 200 series multi-channel persitaltic pump | Watson Marlow | 205CA | |
| Silicone tubing x 15 m (dosing tanks) | VWR | SFM1-3250 | |
| silicone tubing x 15 m (large for inflow/outflow) | VWR | SFM1-5450 | |
| 2.5 L glass winchester pk 4 | Fisher Scienctific | BTF-505-050B | |
| magnetic stir bar 51 x 8 mm pk 10 | Fisher Scienctific | FB55595 | |
| Ethyl 3-aminobenzoate methanesulfonate (MS222) | Sigma Aldrich | E10521-10G | |
| 17α-Ethynylestradiol | Sigma Aldrich | E4876-100MG | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| SPE | |||
| 1/8 inch PTFE tubes 'straws' colour coded pk 4 | Sigma Aldrich | 57276 | |
| disposable liners for manifold | Sigma Aldrich | 57059 | |
| filtration tubes without frits 6 ml pk 30 | Sigma Aldrich | 57242 | |
| reservior adaptors pk 12 | Sigma Aldrich | 57020-U | |
| stainless steel weight for manifold pk 4 | Sigma Aldrich | 57278 | |
| male Luer plug for manifold pk 12 | Sigma Aldrich | 504351 | |
| SPE Vacuum Manifold | Sigma Aldrich | 57265 | |
| stop cocks for extraction mainfold (supelco) pk 12 | Waters | WAT054806 | |
| Sep-Pak Plus C18 cartridge box 50 | Waters | WAT020515 | |
| Methanol HPLC grade 2.5 L | Fisher Scientific | M/4056/17 | |
| 7 ml glass vials with lids (58 x 17 mm) pk 399 | Fisher Scientific | TUL-520-031K | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| vacuum pump, e.g., VP Series Vacuum Pump | Camlab | 1136915 |
Références
- Bergman, &. #. 1. 9. 7. ;., Heindel, J., Jobling, S., Kidd, K., Zoeller, R. T. State-of-the-science of endocrine disrupting chemicals. Toxicol. Lett. 211, (2012).
- Rodgers-Gray, T. P., et al. Exposure of juvenile roach (Rutilus rutilus) to treated sewage effluent induces dose-dependent and persistent disruption in gonadal duct development. Environ. Sci. Technol. 35 (3), 462-470 (2001).
- Jobling, S., et al. Altered sexual maturation and gamete production in wild roach (Rutilus rutilus) living in rivers that receive treated sewage effluents. Biol. reprod. 66 (2), 272-281 (2002).
- Tyler, C. R., Der Eerden, B. V. a. n., Jobling, S., Panter, G., Sumpter, J. P. Measurement of vitellogenin, a biomarker for exposure to oestrogenic chemicals, in a wide variety of cyprinid fish. J. Comp. Physiol. B, Biochem. Syst. Environ. Physiol. 166 (7), 418-426 (1996).
- Jobling, S., Nolan, M., Tyler, C. R., Brighty, G., Sumpter, J. P. Widespread sexual disruption in wild fish. Environ. Sci. Technol. 32 (17), 2498-2506 (1998).
- Jobling, S., et al. Predicted exposures to steroid estrogens in U.K. rivers correlate with widespread sexual disruption in wild fish populations. Environ. Health Perspect. 114, 32-39 (2006).
- Baynes, A., et al. Additional treatment of wastewater reduces endocrine disruption in wild fish - a comparative study of tertiary and advanced treatments. Environ. Sci. Technol. 46 (10), 5565-5573 (2012).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environ. Toxicol. Chem. 15 (3), 241-248 (1996).
- Grover, D. P., Balaam, J., Pacitto, S., Readman, J. W., White, S., Zhou, J. L. Endocrine disrupting activities in sewage effluent and river water determined by chemical analysis and in vitro assay in the context of granular activated carbon upgrade. Chemosphere. 84 (10), 1512-1520 (2011).
- . . The determination of steroid oestrogens in waters using chromatography and mass spectrometry (2008) Methods for the Examination of Waters and Associated Materials. (2008), (2008).
- Van den Belt, K., Berckmans, P., Vangenechten, C., Verheyen, R., Witters, H. Comparative study on the in vitro/in vivo estrogenic potencies of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and nonylphenol. Aquat. toxicol. 66 (2), 183-195 (2004).
- Mills, M. R., et al. Removal of ecotoxicity of 17α-ethinylestradiol using TAML/peroxide water treatment. Sci. Rep. 5, 10511 (2015).
- . . EN 14962:2006 Water quality - Guidance on the scope and selection of fish sampling methods. , (2006).
- Beresford, N., Brian, J. V., Runnalls, T. J., Sumpter, J. P., Jobling, S. Estrogenic activity of tropical fish food can alter baseline vitellogenin concentrations in male fathead minnow (Pimephales promelas). Environ. Toxicol. Chem. 30 (5), 1139-1145 (2011).
- Nolan, M., Jobling, S., Brighty, G., Sumpter, J. P., Tyler, C. R. A histological description of intersexuality in the roach. J. Fish Biol. 58 (1), 160-176 (2001).
- Dascenzo, G., et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities. Sci. Total Environ. 302 (1-3), 199-209 (2003).
- Gomes, R. L., Birkett, J. W., Scrimshaw, M. D., Lester, J. N. Simultaneous determination of natural and synthetic steroid estrogens and their conjugates in aqueous matrices by liquid chromatography/mass spectrometry. Int. J. Environ. Anal. Chem. 85 (1), 1-14 (2005).
- Metcalfe, C. D., et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes). Environ. Toxicol. Chem. 20 (2), 297-308 (2001).
- Stalter, D., Magdeburg, A., Wagner, M., Oehlmann, J. Ozonation and activated carbon treatment of sewage effluents: Removal of endocrine activity and cytotoxicity. Water Res. 45 (3), 1015-1024 (2011).
- Caldwell, D. J., Mastrocco, F., Anderson, P. D., Länge, R., Sumpter, J. P. Predicted-no-effect concentrations for the steroid estrogens estrone, 17β-estradiol, estriol, and 17α-ethinylestradiol. Environ. Toxicol. Chem. 31 (6), 1396-1406 (2012).
- Gardner, M., Comber, S., Scrimshaw, M. D., Cartmell, E., Lester, J., Ellor, B. The significance of hazardous chemicals in wastewater treatment works effluents. Sci. Total Environ. 437, 363-372 (2012).
- Filby, A. L., Shears, J. A., Drage, B. E., Churchley, J. H., Tyler, C. R. Effects of advanced treatments of wastewater effluents on estrogenic and reproductive health impacts in fish. Environ. Sci. Technol. 44 (11), 4348-4354 (2010).
- Magdeburg, A., Stalter, D., Oehlmann, J. Whole effluent toxicity assessment at a wastewater treatment plant upgraded with a full-scale post-ozonation using aquatic key species. Chemosphere. 88 (8), 1008-1014 (2012).
- Collins, T. J. TAML oxidant activators: a new approach to the activation of hydrogen peroxide for environmentally significant problems. Acc. Chem. Res. 35 (9), 782-790 (2002).
- Collins, T. J. Designing Ligands for Oxidizing Complexes. Acc. Chem. Res. 27 (9), 279-285 (1994).
- Truong, L., Denardo, M. A., Kundu, S., Collins, T. J., Tanguay, R. L. Zebrafish Assays as Developmental Toxicity Indicators in The Design of TAML Oxidation Catalysts. Green Chem. 15 (9), 2339-2343 (2013).
- Murk, A. J., et al. Detection of estrogenic potency in wastewater and surface water with three in vitro bioassays. Environ. Toxicol. Chem. 21 (1), 16-23 (2002).
- . Test No 455: The Stably Transfected Human Estrogen Receptor-alpha Transcriptional Activation Assay for Detection of Estrogenic Agonist-Activity of Chemicals. OECD Guidelines for the Testing of Chemicals, Section 4. , (2009).
- Kolle, S. N., et al. In house validation of recombinant yeast estrogen and androgen receptor agonist and antagonist screening assays. Toxicol in Vitro. 24 (7), 2030-2040 (2010).
- Lee, O., Tyler, C. R., Kudoh, T. Development of a transient expression assay for detecting environmental oestrogens in zebrafish and medaka embryos. BMC Biotechnology. 12, 32 (2012).
- Brian, J. V., et al. Accurate prediction of the response of freshwater fish to a mixture of estrogenic chemicals. Environ Health Perspect. 113 (6), 721-728 (2005).
- . Test No 229: Fish Short Term Reproduction Assay. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
- . Test No 230: 21-day Fish Assay: A Short-Term Screening for Oestrogenic and Androgenic Activity and Aromatase Inhibition. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon