Method Article
O uso de uma bateria de métodos químicos e ecotoxicológicos para a avaliação da eficácia dos Processos de Tratamento de Águas Residuais remover estrogénica Potência
Neste Artigo
Resumo
Desreguladores endócrinos (EDC) representam um risco significativo para o ambiente aquático. plantas municipais de tratamento de esgoto são grandes contribuintes para a potência estrogênica das águas superficiais. A metodologia prevista neste artigo permite uma avaliação da eficácia e adequação dos processos de tratamento de águas residuais em relação à remoção de EDC.
Resumo
Endocrine Disrupting Compounds pose a substantial risk to the aquatic environment. Ethinylestradiol (EE2) and estrone (E1) have recently been included in a watch list of environmental pollutants under the European Water Framework Directive. Municipal wastewater treatment plants are major contributors to the estrogenic potency of surface waters. Much of the estrogenic potency of wastewater treatment plant (WWTP) effluents can be attributed to the discharge of steroid estrogens including estradiol (E2), EE2 and E1 due to incomplete removal of these substances at the treatment plant. An evaluation of the efficacy of wastewater treatment processes requires the quantitative determination of individual substances most often undertaken using chemical analysis methods. Most frequently used methods include Gas Chromatography-Mass Spectrometry (GCMS/MS) or Liquid Chromatography-Mass Spectrometry (LCMS/MS) using multiple reaction monitoring (MRM). Although very useful for regulatory purposes, targeted chemical analysis can only provide data on the compounds (and specific metabolites) monitored. Ecotoxicology methods additionally ensure that any by-products produced or unknown estrogenic compounds present are also assessed via measurement of their biological activity. A number of in vitro bioassays including the Yeast Estrogen Screen (YES) are available to measure the estrogenic activity of wastewater samples. Chemical analysis in conjunction with in vivo and in vitro bioassays provides a useful toolbox for assessment of the efficacy and suitability of wastewater treatment processes with respect to estrogenic endocrine disrupting compounds. This paper utilizes a battery of chemical and ecotoxicology tests to assess conventional, advanced and emerging wastewater treatment processes in laboratory and field studies.
Introdução
Preocupações sobre os efeitos adversos de compostos de desregulação endócrina sobre a vida selvagem da saúde reprodutiva, levou a União Europeia a colocar duas substâncias estrogênicas (estradiol e etinilestradiol) em uma "lista de observação" no âmbito da Directiva-Quadro da Água (DQA). EDC abrangem uma variedade de classes químicas, incluindo estrogénios naturais e sintéticos de esteróides, medicamentos, pesticidas e produtos químicos industriais e componentes de produtos de consumo, com efeitos nocivos conhecidos sobre a vida selvagem. Alguns destes compostos podem ter impacto sobre a saúde humana 1.
A pesquisa mostrou que os efluentes da ETAR são estrogênica a pescar 2 e, como consequência muitas águas receptoras são também estrogênica para os peixes 3. Isto foi demonstrado pela primeira vez através de inquéritos nacionais no Reino Unido, que mostrou aumento das concentrações de vitelogenina (um precursor específica do sexo feminino proteína gema 4) no sangue dos peixes machos selvagens e um alto prevalência de intersex (desenvolvimento de ovos e / ou condutas sexuais no testículo de peixes machos) em espécies de peixes normalmente gonochoristic 5,6.
tratamento de águas residuais convencional é tipicamente um processo de três fases que consiste de um rastreio preliminar, seguido por tratamento primário e secundário que remove ambos dissolvidos e suspensos matéria orgânica. A eficácia da remoção de EDC indivíduo é dependente das propriedades físico-químicas das substâncias e sobre a eficácia do processo de tratamento aplicado. Para muitos remoção EDC via adsorção e degradação biológica pode ser significativo, mas incompleta. O tratamento terciário, tais como filtração de areia, pode ser eficaz no aumento da remoção de EDC 7 enquanto que o tratamento avançado utilizando oxidação avançada (por exemplo ozono) ou carvão activado podem ser eficazes em conseguir a remoção completa próximo de 7.
A avaliação de qualquer nova tecnologia para nee tratamento de águas residuaisDS para determinar a eficácia do processo proposto na remoção de EDC. Uma bateria de testes, incluindo a análise química direcionada ao lado de testes ecotoxicologia, usando in vivo e in bioensaios in vitro, fornece dados completos para esta finalidade. Embora muito útil para fins de regulamentação, análise química alvo só pode fornecer dados sobre os compostos (e metabolitos específicos) monitorados. Bioensaios, adicionalmente, permitir que a "detecção" de efeitos adversos de metabolitos e transformação de águas residuais gerados pelo tratamento de subprodutos que poderiam ser detectada 8,9. Este documento descreve a utilização de uma bateria de ensaios laboratoriais químicos e ecotoxicidade para avaliar a eficácia de um número de processos de tratamento de águas residuais avançados e emergentes na remoção da potência estrogénica de esgoto em bruto e tratado e águas receptoras.
Protocolo
declaração de ética: Protocolos para avaliar a desregulação do sistema endócrino atividade de substâncias / misturas em peixes foram aprovados pelo Bem-Estar Animal da Universidade de Brunel e Ética Corpo Review (AWERB) e pela UK Home Office sob os Animais (Scientific Procedures) Act de 1986.
1. Água Coleta de Amostras, Preservação e Extração
- coleta de amostras e preservação
- Antes da utilização, limpar os frascos com um agente de limpeza tensio-activo adequado. Após a limpeza, lavar as garrafas com água, escorrer e secar.
- Recolha de amostras em frascos de vidro de capacidade de 2 L contendo um conservante consistindo em 0,5 g de cobre (II), nitrato e 6 ml de 3,6 M solução de ácido clorídrico. Armazene as amostras abaixo de 10 ° C. Extrair e analisar o mais rapidamente possível a recolha e preservação seguinte.
- Extração e clean-up (para análise de estrogénio esteróide) 10
- Solid Phase Extraction (SPE)
- Antes de extração, para reduzir os sólidos em suspensão, amostras de água do filtro, utilizando 1 um papel poros do filtro tamanho.
- Depois filtrou-se amostras de pico com padrão interno por adição de 100 ul de solução spiking padrão interno deuterado estoque contendo 2,4,16,16-d 4 -estrone: 2,4,16,16-d 4 -17β-estradiol (E2) : e 2,4,16,16-d 4 -17α-etinilestradiol (EE2) (todos a 40 ng / L, em metanol) a 1000 ml de efluente (ou 100 ml de efluente), resultando em aumento interno de 2 ng / L para o esgoto amostras de efluentes, e 20 ng / L para amostras de esgoto afluente.
- Anexar forros descartáveis válvulas, cartuchos SPE estireno divinil benzeno e reservatórios de cartucho para o aparelho de SPE. Ligar a bomba de vácuo para testar o equipamento está adequadamente vedado.
- Pipeta de 5 ml de acetato de etilo em cada reservatório, para condicionar os cartuchos. Ligar a bomba de vácuo (abaixo de 10 inHg para permitir uma taxa de fluxo inferior a 10 ml por minuto)e puxe através do líquido. Não deixe os cartuchos de SPE secar. Repita processo com 5 ml de metanol seguidos por 5 ml de água.
- Ateste cada reservatório do cartucho com água e ligar 1/8 "tubos de PTFE entre os reservatórios de cartucho de vidro e frascos de amostras. Ligue o vácuo, a uma taxa de fluxo inferior a 10 ml por minuto e permitir que toda a amostra a passar através do cartucho. esvazie o frasco de resíduos, se necessário.
- Seque bem os cartuchos SPE sob vácuo (ou usando ar ou azoto) até que o conteúdo do cartucho de mudar de cor (por exemplo, do marrom escuro ao castanho claro).
- Coloque frascos de 10 ml para recolha de vidro limpas e secas em rack e no interior do colector de extração. Verifique se cada forro é acima de um frasco. Pipeta 8 ml de diclorometano em cada reservatório de amostra, ligar a bomba de vácuo (taxa de fluxo inferior a 10 ml por minuto) e puxar o líquido através para dentro de frascos de recolha.
- Remova frascos de 10 ml do colector SPEe utilizar um concentrador para reduzir o volume de 1 ml. Transfira cada amostra em frasco de auto-amostrador e mais concentrar para 100 ul usando nitrogênio derrubar equipamento.
- Antes de extração, para reduzir os sólidos em suspensão, amostras de água do filtro, utilizando 1 um papel poros do filtro tamanho.
- Gel cromatografia de permeação (GPC) clean-up
- Injecte 95 ul do extracto de amostra eluída no HPLC equipado GPC usando as condições descritas na Tabela 1. Concentra-se o extracto até à GPC 200 mL utilizando um concentrador de azoto e soprar para baixo aparelhos e completa-se até 2,0 ml com hexano.
- SPE clean-up
- Anexar forros descartáveis válvulas, cartuchos de aminopropilo e reservatórios de cartucho para o colector de SPE. Coloque frascos de 10 ml para recolha de vidro limpas e secas em rack e no interior do colector de extração. Pipetar 2 ml de hexano em cada reservatório, para condicionar os cartuchos. Permitir que o líquido passe através dos cartuchos.
- Pipetar o extracto da amostra a GPC para o reservatório e, novamente, para permitir que o líquidopassar através do cartucho. Recolher o fluido de amostra no frasco e retire do colector. Não descarte eluato.
- Coloque um novo frasco de 10 ml coleta seca limpa em rack e colocar dentro de colector de extração. Para lavar o cartucho, adicionar 2 ml de acetato de etilo em hexano (30% v / v) para o reservatório e puxar o líquido através do cartucho. Repetir com mais 2 ml de acetato de etilo em hexano, descartando-se todas as lavagens.
- Coloque o original 10 frasco ml coleção (passo 1.2.3.2) de volta na prateleira dentro do colector de extração. Pipetar 2 ml de acetato de etilo em acetona (50% v / v) para dentro do reservatório, ligar a bomba de vácuo (abaixo de 2 inHg para permitir um débito de menos do que 2 ml por minuto) e puxar o líquido através de dentro do frasco . Repetir o processo com mais 2 ml de acetato de etilo.
- Retirar o frasco de amostras e utilizar um concentrador para reduzir o volume de extracto para 1 ml. Transferir a amostra para um frasco de vidro menor e usar azoto soprar para baixo equipamento, para evaporar tele extrair à secura incipiente.
- Adicionar 100 ul de metanol e misturar bem. Transfira o extrato com um auto-amostrador frasco (com 0,3 ml de inserção) e tampa do frasco. Analisar as amostras usando LCMS / MS (ver secção 2).
- Solid Phase Extraction (SPE)
| Coluna: | gel de PL, 50 A, 300 x 7,5 mm, 5? M |
| Coluna Guard: | gel de PL, 50 x 7,5 mm, 5? M |
| Na fase móvel: | diclorometano |
| Quociente de vazão: | 1 ml por minuto |
| Temperatura da coluna: | 25 ° C |
| Detector de UV: | 210 nm |
| Volume de injecção: | 95 ul |
| Modo de injeção: | Ficar de péard |
| Desenhe velocidade: | 500 ml por minuto |
| Ejectar velocidade: | 500 ml por minuto |
| Posição Draw: | 3 milímetros |
| Fracção recolhida: | 3 ml da fracção (7 - 10 min) em 10 ml de frascos |
Tabela 1. Condições e parâmetros para Gel cromatografia de permeação (GPC) clean-up de amostras de águas residuais extraídos. Detalhes da tabela coluna GPC, fase móvel, temperatura, volume de injeção, eo comprimento de onda do detector.
- extração da amostra (para tela Yeast estrogênio)
- amostras de filtro, conforme detalhado no ponto 1.2.1.1. Anexar forros descartáveis válvulas, cartuchos C18 SPE e reservatórios de cartucho para o aparelho de SPE. Ligar a bomba de vácuo para testar o equipamento está adequadamente vedado.
- Pipetar 5 ml de metanol em cada reservatório, para condicionar o C18 cartuchos. Ligue vácuo (a cerca de 5 inHg para permitir um fluxo de cerca de 5 ml por minuto) e deixar a corrida líquido através, parando por 1 min meio do caminho. Não deixe os cartuchos de correr seca. Repita o processo com qualquer grau HPLC ou água bidestilada (ddH2O). Mais uma vez não secam.
- Extrair amostras de água como descrito na seção 1.2.1.4. Continuar a vácuo durante pelo menos 30 min para secar completamente os cartuchos.
- Coloque os frascos de coleta de 10 ml limpas e secas em um rack no colector de extração. Verifique se cada forro é acima de um frasco. Adicionar 5 ml de metanol para cada reservatório. Ligue o vácuo (fluxo máximo de 5 ml / min) e permitir que o líquido passe através do cartucho para o frasco, detendo-se durante 2 min a meio.
- Antes da análise usando a tela de SIM, reduzir o extracto à secura incipiente usando nitrogênio e reconstituir com 500-1.000 etanol ul. Selar as tampas dos frascos de amostra para evitar a evaporação e manter a 4 ° C (em um free-faíscageladeira).
2. Análise química usando LCMS / MS
- Optimizar as condições de funcionamento do sistema LCMS / MS utilizando as instruções do fabricante.
- Analisar soluções de calibração padrão, os extractos da amostra, em branco e analítico de controle de qualidade amostras (AQC), utilizando a cromatografia líquida e condições de espectrometria de massa, e monitorar as transições de íon como detalhado na Tabela 2. Determinar a concentração de estrogênios esteróides no extracto de amostra usando interna normas 10.
| LCMS | |||||
| Cromatografia líquida | |||||
| Coluna: | C18 (2), 150 x 4,6 mm, 5 um. | ||||
| Volume de injecção: | 20 ul | ||||
| Fluxo: | 0,5 ml por minuto. | ||||
| Mfase óvel: | Solvente A: água contendo 0,1% de amoníaco. | ||||
| Solvente B: acetonitrilo. | |||||
| Programa de gradiente: | |||||
| Tempo (min) | 0 | 10 | 18 | 24 | 28 |
| Na relação A: solvente B | 90:10:00 | 50:50:00 | 0.479167 | 0.479167 | 90:10:00 |
| Espectrometria de massa | |||||
| Fonte: | Electrospray (iões negativos) | ||||
| Gás e fonte: | CUR: 20 psi, GS1: 70 psi, GS2: 30 psi | ||||
| TEM: 600 ° C, gás CAD 5 e IonSpray tensão -900 | |||||
| transições de MRM: | |||||
| E1: | 269/145 e 269/143 | ||||
| E2: | 271/145 e 271/143 | ||||
| EE2: | 295/145 e 295/143 | ||||
| E1-D4: | 273/147 | ||||
| E2-D4: | 275/147 | ||||
| EE2-D4: | 299/145 | ||||
Tabela 2. Detalhes parâmetros e condições para a análise LCMS / MS de estrogênios esteróides em extratos de águas residuais. Tabela dá volume injeção da amostra e taxa de fluxo, as condições de fase móvel Agradiente nd.
3. estrogénica Atividade Usando In Vitro Tela Yeast estrogênio (YES) Ensaio 8
- Preparar e armazenar o mínimo de componentes de média e média de acordo com a Tabela 3 (a) a (g).
| (a) meio mínimo (pH 7,1): |
| Prepara-se uma Fe 2 (SO 4) 3 pela adição de solução de 40 mg de Fe 2 (SO 4) 3 a 50 ml de água bidestilada (ddH2O) |
| Adicionar 1 L ddH2O para um copo de vidro de 2 L |
| Adicionar os seguintes componentes para a proveta: |
| 13,61 g KH 2 PO 4 |
| 1,98 g de (NH 4) 2 SO 4 |
| 4,2 g de KOH |
| 0,2 g de MgSO4 |
| 1 ml de Fe 2 (SO 4) 3 solução |
| 50 mg de L-leucina |
| 50 mg de L-histidina |
| 50 mg de adenina |
| 20 mg de L-arginina-HCl |
| 20 mg de L-metionina |
| 30 mg de L-tirosina |
| 30 mg de L-isoleucina |
| 30 mg de L-lisina-HCl |
| 25 mg de L-fenilalanina |
| 100 mg de ácido L-glutâmico |
| 150 mg de L-valina |
| 375 mg de L-serina |
| Coloque o copo no agitador aquecida com uma pulga magnética e mexa até que tudo é dissolvido |
| Verifique se o pH é 7,1 e ajustar, se necessário |
| Usando um 50 ml seringa estéril dispensar 45 ml alíquotas em frascos de vidro com tampas superior parafuso de metal |
| Esteriliza-se o meio mínimo a 121 ° C durante 10 minutos numa autoclave |
| Armazenar em temperatura ambiente |
| (b) D - (+) - Glucose: |
| Prepara-se uma solução de 20% w / v em ddH2O |
| Dispensar 20 ml alíquotas para frascos de vidro com tampas superior parafuso de metal |
| Esterilizar a solução de glucose a 121 ° C durante 10 minutos numa autoclave |
| Armazenar em temperatura ambiente |
| (c) Ácido L-Aspártico: |
| Produzir uma solução stock de 4 mg / ml em ddH2O |
| Dispensar 20 ml alíquotas para frascos de vidro com tampas superior parafuso de metal |
| Esterilizar a solução de L-ácido aspártico a 121 ° C durante 10 minutos numa autoclave |
| Armazenar em temperatura ambiente |
| (d) Solução de vitamina: |
| Prepara-se uma solução de biotina por adição de 2 mg de biotina a 100 mL de ddH2O |
| Pesar 8 mg de tiamina, piridoxina 8 mg, 8 mg de ácido pantotênico, 40 mg inositol. Adicionar todos os componentes secos e 20 ml de solução de biotina a 180 ml de ddH2O |
| Adicione 10 ml alíquotas estéreis por filtração através de um filtro descartável de tamanho de poro de 0,2 | iM em frascos de vidro estéreis, numa câmara de fluxo laminar de ar |
| Armazenar a 4 ° C |
| (e) L-Treonina: |
| Preparação de 100 ml de 24 mg / ml de L-treonina em ddH2O |
| Dispensar 10 ml alíquotas para frascos de vidro com tampas superior parafuso de metal |
| Esterilizar a solução de L-treonina a 121 ° C durante 10 minutos numa autoclave |
| Armazenar em temperatura ambiente |
| (f) de cobre (II) Sulfato: |
| Preparar 25 ml de uma solução 20 mM de cobre (II) Sulfato em ddH2O |
| Faça alíquotas de 5 ml esterilizadas por filtração através de um filtro de tamanho de poro de 0,2 | iM em frascos de vidro estéreis, numa câmara de fluxo laminar |
| Armazenar em temperatura ambiente |
| (g) vermelho de clorofenol-β-D-galactopiranósido (CPRG): |
| Preparar 25 ml de uma solução a 10 mg / ml de CPRG em ddH2O |
| Faça alíquotas de 5 ml esterilizadas por filtração através de um filtro de tamanho de poro de 0,2 | iM em frascos de vidro estéreis, numa câmara de fluxo laminar |
| Armazenar a 4 ° C |
Tabela ensaio Tela estrogênio 3. levedura; preparação e armazenamento dos mínimos componentes de média e média.
- Preparação e storage de 10x cultura de levedura concentrado
- No dia 1, preparar o meio de crescimento (tal como descrito no ponto 3.4.1) e despeje em um frasco cónico estéril. Adicionar 125 ul de 10x concentrado a partir de levedura frasco criogénico armazenado a -20 ° C. Incubar o meio inoculado a 28 ° C durante cerca de 24 horas num agitador orbital.
- No dia 2, fazer duas garrafas de meio de crescimento (~ 50 ml) e despeje em frascos cónicos estéreis separadas. Adicionar 1 ml de 24-hr de levedura cultivadas em cada frasco de meio de crescimento. Incubar o meio inoculado a 28 ° C durante cerca de 24 horas num agitador orbital.
- No dia 3, verter cada cultura de 24 h para um tubo de centrífuga de 50 mL estéril. Centrifugar os tubos de 50 ml a 4 ° C durante 10 min a 2000 x g. Decantar o sobrenadante, e re-suspender cada sedimento em 5 ml de meio mínimo com 15% de glicerol. Faça alíquotas de 0,5 ml da cultura de levedura concentrado 10x em criotubos e armazenar estéreis de 1,2 ml a -20 ° C durante um máximo de 4 meses.
- Prepastocks químicos ração e armazenamento de curvas padrão para
- Lavar todos os vidros e espátulas duas vezes com etanol absoluto e deixar secar antes de usar para remover qualquer vestígio de contaminantes.
- Pesar E2 directamente num frasco de vidro numa câmara de pesagem pó e ajuste a concentração em volume em etanol absoluto. Dilui-se a uma concentração de 2x10 -7 M (54,48 g / L). tampa de vedação e armazenar a 4 ° C (no frigorífico livre de faísca).
- produtor ensaio
- No dia 0, preparar o meio de crescimento. Para a garrafa de 45 ml de meio mínimo de 5 ml da solução de glicose, 1,25 ml de solução de ácido L-aspártico, 0,5 ml de solução de vitaminas, 0,4 ml de solução de L-treonina, e uma solução de sulfato de cobre 125 ul (II). Pour meio de crescimento num balão cónico estéril.
- Adicionar 125 ul de estoque de 10x concentrado (descongelada do armazenamento a -20 ° C) ao balão e incubar o meio inoculado a 28 ° C durante cerca de 24 horas num agitador orbital.
- No dia 1, um rótulo de 96 cavidades 'placa de diluição "estéril e fazer diluições em série (100 ul volume em etanol) de E2 curva padrão e químico (s) de teste / extracto de efluente (s) (por exemplo, EE2).
- Etiqueta estéreis de 96 poços 'placa de ensaio (s)' opticamente fundo plano microtitulação. Em cada placa incluir espaços em branco (mais / menos) de solventes e uma curva padrão de E2, além de linhas de produto químico (s) de teste / extracto (s) de efluente.
- Pipetar 10 ul de cada concentração de (E2, químicos ou extracto) para o poço apropriado da placa de ensaio. Pipetar 10 ul de etanol em cada poço 'solvente em branco "da placa de ensaio. Deixar placa de ensaio com a tampa para evaporar à secura.
- Adicione um frasco de meio de crescimento (~ 50 ml) e adiciona-β vermelho-D-galactopiranósido 0,5 ml de solução de clorofenol (CPRG) por frasco. Determinar a densidade de células de levedura em cultura a 24 horas pela medição da turbidez da cultura a 620 nm num leitor de placas. Inocular o ummédio ssay com 4x10 células de levedura 7 a partir da cultura de 24 horas.
- Pour meio de ensaio inoculado em uma calha estéril. Usando uma pipeta de multi-canal adicionar 200 uL de meio de ensaio inoculado para cada poço da placa de 96 poços de ensaio.
- Coloque a tampa sobre a placa de ensaio de 96 poços e selar as extremidades com fita. Agitar a placa (s) de ensaio vigorosamente durante 2 min num agitador de placas de titulação e incubar a 32 ° C numa câmara de aquecimento naturalmente ventilado.
- No dia 2, agitar a placa (s) de ensaio vigorosamente num agitador de placa de titulação durante 2 min. Voltar para 32 ° C incubadora.
- No dia 4, agitar a placa (s) de ensaio vigorosamente durante 2 min num agitador de placas de titulação. Deixar a placa (s) em repouso durante cerca de 1 h, em seguida, ler a placa (s) de ensaio a uma absorvância de 540 nm (absorção óptima para CPRG ~ 575 nm) e 620 nm (para a turbidez) utilizando um leitor de placas. Deixar placa (s) à temperatura ambiente e lido mais tarde, se necessário.
- No dia 0, preparar o meio de crescimento. Para a garrafa de 45 ml de meio mínimo de 5 ml da solução de glicose, 1,25 ml de solução de ácido L-aspártico, 0,5 ml de solução de vitaminas, 0,4 ml de solução de L-treonina, e uma solução de sulfato de cobre 125 ul (II). Pour meio de crescimento num balão cónico estéril.
- cálculos atividade estrogênica
- leituras correctas de ensaio para a turvação, utilizando a equação seguinte: Valor corrigido = amostra ou padrão (E2) de absorvância a 540 nm - [absorvância padrão (E2) ou amostra a 620 nm - em branco absorvância a 620 nm]. Lote E2 curva padrão com espaços em branco apropriados (para verificar se há contaminação) 8.
- Utilizar o exemplo corrigido (extrato ou químico) para calcular 'equivalentes' Estradiol. Use as E2 valores curva padrão plotados e equação de regressão (3 parâmetros polinomial ou linear, dependendo fit) para interpolar a amostra / extrair os valores de absorção para valores equivalentes E2. Uso factor de concentração (isto é, água e extraiu-se o volume de etanol ao extracto é re-suspenso em) para calcular a actividade estrogénica na amostra pré-extraída.
4. Avaliação Based Laboratório de estrogênico Atividade Usando In Vivo VITELOGENINA Indução em Male Fathead Minnows
- Use peixinhos fathead do sexo masculino (PimephalesPimephales)> 4 meses de idade, que exibem características sexuais secundárias (isto é, o desenvolvimento de tubérculos nuptial e um fatpad dorsal) indicativo de determinação sexual masculina.
- Para evitar que a atividade de desova, separada madura machos três semanas (± 3 dias) antes do início do teste. Configure pelo menos dois 45 L aquários de vidro com uma carga máxima de 3 g / L. Para assegurar um número suficiente de peixe saudável para o teste, utilizar um mínimo de 100 machos.
- Manter o peixe macho sob condições ambientais idênticas como será experimentada no teste (ou seja, a temperatura da água de 25 ± 1 ° C e 16: 8 hr de luz: escuro fotoperíodo). Manter a taxa de fluxo da água de diluição para cada tanque de garantir um tempo de substituição de 95% de, pelo menos, a cada 6 a 8 horas, ou seja, 330 ml / min para um tanque de 45 litros.
- equipamento de ensaio e delineamento experimental
- Use tanques de vidro grandes para acomodar uma carga de até 3 g de peixe por litro de water. Para 8 machos adultos (nominalmente 4,5 g cada), use um tanque de 10-20 L.
- Use dois tanques repetidos para cada tratamento e proteger cada tanque de quaisquer distúrbios visuais desnecessários (isto é, usar telas cartão laminado entre os tanques). Identificar cada tanque com um número de estudo, uma concentração de exposição e um número de identificação da embarcação.
- Para os estudos de efluentes de águas residuais
- Na chegada, imediatamente transferir efluente para um tanque de armazenamento a 10 ± 1 ° C. Iniciar a dosagem efluente dentro de duas horas após a recepção do efluente.
- Alimentação do efluente, através de uma bomba peristáltica, a partir do tanque de armazenamento de 10 ° C para um recipiente de aclimatação. Aquecer o efluente no recipiente de aclimatação a 18 ± 2 ° C. Bombear o efluente aquecido a partir do recipiente para a dosagem de aclimatação / recipientes de mistura e, em seguida, para o teste de aquários (que contém o peixe). Aquecer os aquários a uma temperatura de 25 ± 1 ° C.
- Para os estudos de dosagem química
- Pesar produtos químicos de teste em um gabinete de pó de pesagem. Prepare existências químicas concentradas em ddH2O de preferência sem a utilização de solventes.
Nota: Se solventes são necessários para solubilizar os compostos de teste, utilizar controlos do solvente, além da água de diluição de controlo. - alimentação por gravidade ou água de diluição da bomba de um tanque de cabeçalho de temperatura controlada via dispositivo (s) de controle de fluxo para dosagem / vaso de mistura. Bomba de concentrado da (s) químico utilizando um sistema de bombagem peristáltica para o doseamento / recipientes de mistura. Controlar a taxa de bomba (de química estoque) e taxa de fluxo de água (água de diluição) para atingir a concentração de exposição desejado.
Nota: Use tubo de silicone para alimentar químico das águas / teste para cada recipiente de ensaio da dosagem / vaso de mistura. Usar um caudal que é suficiente para proporcionar uma substituição vaso de 75% em pelo menos 24 horas, isto é, 20 ml / min para um tanque de 20 litros. Manter o caudal a ± 10% do valor nominal especificado.
- Pesar produtos químicos de teste em um gabinete de pó de pesagem. Prepare existências químicas concentradas em ddH2O de preferência sem a utilização de solventes.
- Manter a temperatura da água do tanque de exposição a 25 ± 1 ° C, o oxigénio dissolvido acima de 70% do valor de saturação de ar (5,8 mg L-1 a 25 ° C) e ± 0,5 unidades de pH a partir de pH (entre 6,5 e 8,5) ao longo do estudo. Definir condições de iluminação ao fotoperíodo de luz 16 horas: 8 h escuro, com períodos de transição / crepúsculo amanhecer de 20 min.
- Alimentar os peixes duas vezes por dia com recém-descongelado adulto congelada salmoura camarão (Artemia) a 2,5 (± 0,1) g por tanque por feed. Também alimentar os peixes uma vez por dia com uma pequena quantidade (dois pitada dedo) de um alimento em flocos peixes tropicais. Deixar um mínimo de 3 horas entre cada feed.
- Mantenha um registro alimentação diária para monitorar a resposta de alimentação / comportamento (boa, moderada ou pobre, em comparação com os controles). Sifão os tanques, pelo menos, duas vezes por semana (de preferência diariamente) para remover qualquer restos de comida e fezes. Limpe os lados e fundo dos recipientes de ensaio pelo menos uma vez por semana.
- Tome amostra de água semanals de cada tanque para confirmar atividade estrogênica (via tela de levedura) e composição química (via química analítica). Consulte as secções 1-3 para detalhes de amostragem de água, extração e análise.
Nota: Para cada experiência, utilizar água de diluição de controlo (controlo negativo), controlo positivo (E2 ou EE2) e de pelo menos três diluições de efluente (100, 50 e 25%) ou produtos químicos de teste para monitorizar a resposta de dose. Se novas tecnologias são testados, utilizar composto / efluente com ou sem tratamento (por exemplo, EE2 sem tratamento, com EE2 TAML / peróxido de hidrogénio (H 2 O 2) tratamento de 12; Figura 1).
- Use tanques de vidro grandes para acomodar uma carga de até 3 g de peixe por litro de water. Para 8 machos adultos (nominalmente 4,5 g cada), use um tanque de 10-20 L.
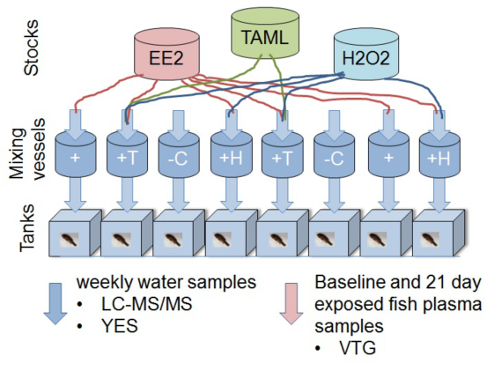
Figura 1. Diagrama representando delineamento experimental de um bioensaio in vivo vairão vitelogenina para determinar a remoção de ecotoxicidade do 17α-etinilestradiol usando TAML / tratamento de água peróxido. A experimental configurar consiste em oito 11 L aquários de vidro cada alimentados com fluxo contínuo de água. soluções de produtos químicos individuais e água (filtrada de-clorada) são entregues para as câmaras de mistura. Concentrações nominais (sem reação) nos vasos de mistura são de 2 ng / L EE2, 80 nM TAML e 0,16 g / LH 2 O 2. Soluções de Química (EE2, H 2 O 2 e TAML) são preparadas e doseadas separadamente para que as reacções de início nos vasos de mistura. Peixe (8 do sexo masculino peixinhos fathead por tanque) são expostas à mistura (s) depois de um tempo de contacto de reacção de cerca de 45 minutos. As amostras de água são retirados dos tanques de exposição semanais. As amostras de plasma são tomadas a partir peixinhos fathead para medir a vitelogenina biomarcador estrogénica (VGT) a partir de um grupo de linha de base, no início do estudo, e todos os outros peixes após 21 dias de exposição. Os tratamentos específicos são: 'C'; controle negativo (água de diluição apenas), '+'; controlo positivo de EE2,'+ H'; EE2 mais H 2 O 2, '+ T'; EE2 mais H 2 O 2, mais TAML. Este valor foi modificado a partir Mills et al. 2015 12. Por favor clique aqui para ver uma versão maior desta figura.
- Procedimento de teste
- período de aclimatação
- Medir o peso molhado (g) de cada peixes machos sexualmente maduros, e alocar aleatoriamente para cada tanque (8 machos por tanque).
- Manter os peixes não afectados do mesmo lote e mantê-las sob as mesmas condições de ensaio. Use estes peixes para substituir todos os indivíduos que apresentam sinais de danos físicos ou a falta de condições durante o período de aclimatação de 7 dias. Assegurando, ao fim do período de aclimatação de cada tanque de tratamento tem 8 machos que tenham completamente aclimatados às condições de ensaio.
- Tome amostras de plasma 'de base' de um adicional de 8 machos da mesma batch de peixes machos. Siga o método de amostragem de sangue na secção 4.4 e o método de análise vitelogenina (VTG) em 4,5.
- Após o período de aclimatação, entregar stocks de dosagem de efluentes ou químicos para os tanques de exposição durante 21 dias, conforme descrito no 4.2.2 ou 4.2.3. Monitor de mortalidade, o comportamento e a aparência física dos peixes em cada tanque de replicar diariamente antes da primeira refeição do dia. Grave qualquer comportamento ou incidentes anormais.
Nota: Certifique-se de condições ambientais e as taxas de alimentação manter a saúde dos peixes (pontos 4.2.4 e 4.2.5).
- período de aclimatação
- Amostragem de peixes após o período de exposição de 21 dias
- 12 horas antes da amostragem, parar de alimentar os peixes.
- Etiqueta tubos micro-centrífuga para a recolha de amostras de sangue, adicione ~ 5 mL de aprotinina (um inibidor de protease) e colocá-los no gelo.
- Adicione uma solução de 500 mg / L de MS222 (anestésico) por dissolução de 500 mg de MS222 por 1 L de água clorada-des (previamente aclimatadoa 25 ± 1 ° C). Neutraliza-se a MS222 para pH 7,4 ± 0,4 usando NaOH 1 M.
- Mova cada peixe do tanque para o MS222 tamponada. Mantenha na solução até à cessação de todo o movimento opérculo (tipicamente 5 ± 1 min).
- Meça e registre o comprimento do garfo (mm) sob a anestesia terminal. Usar um bisturi descartável para amputação da cauda, e usar um tubo heparinizado o hematócrito para recolher o sangue a partir da artéria caudal (Figura 2). Cuidadosamente dispensar o sangue para dentro do tubo de microcentrífuga pré-rotulados e manter em gelo.
- Matar os peixes imediatamente depois de desenhar o sangue. Confirmar morte por cessação permanente da circulação e / ou a destruição do cérebro. Meça e registre o peso do peixe total (a mais próxima de 0,01 g), e dissecar tecidos, conforme necessário.
- Centrifuga-se o sangue (7000 x g durante 5 min a 4 ° C) dentro de 2 horas de recolha. Transferir o sobrenadante de plasma com uma pipeta em um novo 0,4 ml banheira de microcentrífuga rotuladoes e armazenar no gelo. Congelar os tubos contendo plasma em gelo seco dentro de 30 min de centrifugação e armazenar a -80 ° C antes da análise das concentrações de plasma VTG.

Figura 2. Fotos que retratam peixinho masculino fathead (Pimephales promelas), coleta de plasma e localização dos testículos. No final da exposição de 21 dias todos os peixes devem ser mortos para recolher amostras de sangue. Uma vez sob este comprimento terminal de anestésico peixe (comprimento do garfo, mm) deve ser medido, rapidamente seguido por recolha de sangue da artéria caudal Photo-A:. Linha pontilhada vermelha indica o local de amputação de cauda (um bisturi descartável deve ser utilizado para amputar a cauda ). Photo-B mostra um tubo heparinizado o hematócrito usado para coletar o sangue. Cada peixe deve então ser mortos imediatamente após a sua amostra de sangue foi feita, neste caso, toda a cabeçafoi separada do corpo (Foto-C). Uma vez que o peixe foi morto na cavidade do corpo pode ser aberto para revelar os órgãos internos. Photo-C mostra a localização dos testículos (gônadas) em relação à bexiga natatória (SB) em peixes ciprinídeo, por exemplo, vairão, barata, carpa, etc. Por favor, clique aqui para ver uma versão maior desta figura.
- Medir as concentrações VTG plasma com um kit de ligado a enzima homóloga VGT ensaio imunoabsorvente (ELISA) desenhado especificamente para peixinhos fathead.
- Preparar padrões e tampões VTG como descrito no protocolo do fabricante. Dilui-se a amostra de plasma 1:50, 1: 5000 e 1: 500000 e ensaiar-los em duplicado para obter leituras dentro da gama da curva padrão VTG conforme as instruções do fabricante. Siga as orientações do fabricante para calcular as concentrações de vitelogenina.
5. avaliações de campo da Advanced / Novel Tratamento de Águas Residuais Technologies para Mitigar estrogénica Atividade Usando In Vivo vitelogenina e Intersex Indução em Roach (Rutilus Rutilus)
- Captura de Roach selvagens que vivem a jusante do emissários ETAR
Nota: Use roach (Rutilus Rutilus) ou outras espécies abundantes água doce ou salgados, que são gonochoristic e conhecido por ser sensível à desregulação endócrina estrogênica.- Captura de peixes utilizando pesca elétrica, compensação, prendendo ou outros métodos de pesca reconhecidas, dependendo da situação 13. Transportar o peixe em tanques gaseificadas volta ao laboratório para amostragem.
- Preparar tubos de microcentrífuga como detalhado em 4.4.2. Prepare tamponada MS222 como descrito em 4.4.3. Anestesiar os peixes como detalhado em 4.4.4.
- Medir o comprimento dos peixes e peso sob anestesia terminal.
- Recolha de sangue do caudal da artéria usando disposeringa heparinizada sable. Matar uns aos peixes imediatamente após a coleta de amostra de sangue. Cuidadosamente dispensar o sangue em tubos de microcentrífuga pré-rotulados e manter em gelo. Prepare de plasma tal como descrito no passo 4.4.7 e medir VGT por ELISA (4,5).
- Utilizando uma pinça remover 2-3 escamas de peixe de cada peixe e colocar em envelopes de papel pequenas marcados individualmente. envelopes Armazenar à temperatura ambiente em condições secas para determinação da idade dos peixes mais tarde e análise de crescimento.
- Abrir a cavidade do corpo com um bisturi para revelar os órgãos internos. Retire o intestino para revelar a bexiga natatória com uma gonadal localizados em cada lado (figura 2). Remova cuidadosamente as gônadas emparelhados com uma pinça de nariz fino e coloque em um frasco de vidro. Cobrir as gónadas com fixador de Bouin, na proporção de 1:10 de tecido: fixador.
- Deixar o tecido em Bouin durante 6-24 horas, dependendo do tamanho do tecido (fixador penetra a 1 mm por hora). Uma vez fixado, despeje um fixador do BouinD Substituir com 70% de álcool desnaturado industrial (IMS). Armazenar o tecido fixado à temperatura ambiente até que os tecidos são processados para histopatologia (secção 5.3).
- Campo avaliação baseada da atividade estrogênica usando indução in vivo vitelogenina e intersex na roach
- O delineamento experimental e configurar
Nota: Configure os tanques e planta piloto com bastante antecedência da in vivo o trabalho de partida. Iniciar os tanques de fluxo de 3-4 semanas antes de qualquer adição de peixe para o sistema. Monitorar as taxas de fluxo de água, qualidade e condições (pH, temperatura, oxigênio dissolvido, etc.) regularmente para se certificar parâmetros de água pode ser mantida.- Construir tanques grandes (por exemplo, 300-1,000 L) no local, a planta piloto, que pode receber "controle" de-clorada água da torneira, efluente tratado padrão (s) e avançado de efluentes (s) tratada em paralelo. Anexar bomba de ar / aeradores para os tanques. caudais de água estabelecidos para cumprir, pelo menos, 6 tanque de vtrocas OLUME por dia.
Nota: Certifique-tanques com certeza são bem isolado e protegido para evitar flutuações de temperatura diurna excessiva. Tanques de design para permitir a observação do peixe, por alterações comportamentais (falta de alimentação, etc.), sinais de doença e mortalidade.
- Construir tanques grandes (por exemplo, 300-1,000 L) no local, a planta piloto, que pode receber "controle" de-clorada água da torneira, efluente tratado padrão (s) e avançado de efluentes (s) tratada em paralelo. Anexar bomba de ar / aeradores para os tanques. caudais de água estabelecidos para cumprir, pelo menos, 6 tanque de vtrocas OLUME por dia.
- Comece a exposição flutuante os sacos de barata (a partir da fazenda de peixes) nos respectivos tanques durante 1 h. Adicione a água do tanque para os sacos gradualmente até a temperatura da água e as condições são ambiente. Solte o peixe em seus tanques.
- Alimente roach adulto diariamente em comida de peixe peletizada (tamanho 0,5-0,8). Alimente roach juvenil diariamente na pequena peletizada (tamanhos de pelotização 100-300) não estrogênica de alimentação 14 ad libitum, ajustado com base em alimentos não consumidos. Mantenha um registro de alimentação resposta de alimentação documentação / comportamento diário (bom, moderada ou pobre, em comparação com os controles).
- Recolher amostras de água semanais de cada tanque para confirmar atividade estrogênica e composição química. See seções 1-3 para detalhes de métodos de amostragem de água e análise.
- O delineamento experimental e configurar
- O exame histopatológico de peixes gônadas 15
- Remova cuidadosamente as gônadas dissecados e fixos (descritas nos passos 5.1.6 e 5.1.7) do recipiente com uma pinça e coloque sobre uma placa de corte.
- Use uma lâmina de micrótomo para cortar cada gônada em 3 partes (anterior, médio e posterior) e de cada parte cortada uma secção transversal de espessura de 3-5 mm. Cuidadosamente colocar todas as seis peças numa cassete de biópsia de plástico rotulados e colocar em processador de tecidos usando as temporizações listados na Tabela 4.
- Cera tecidos incorporar e seção sobre micrótomo rotativo (3-5 mm). secções de transferência para lâminas de vidro revestido de bio-adesivo e rotulados Colocar as lâminas em uma placa aquecida (fixada em 45 ° C) para secar durante 24 h.
- Corar as lâminas, quer manualmente ou utilizando um corante automatizado, utilizando os intervalos descritos na Tabela 5. Colocar uma gota de agente de montagem sobre o tecido manchado, e Lay uma lamela de vidro sobre o agente de montagem para proteger o tecido.
- Em primeiro lugar, examine cada slide com pequeno aumento (20X, ou seja objectiva 2X, com linhas 10X olho ampliação) para determinar o sexo eo número de pontos de anexos para a cavidade do corpo 15. Nota alguma anomalia para cada peixe.
- Numa ampliação mais elevada (100X ou 400X), examinar o tecido para avaliar as fases gametogenesis, anomalias e a presença de oócitos em tecido testicular. Grave a gravidade da hermafroditas usando o seguinte sistema de classificação que varia de 0 (tecido normal do sexo masculino) para (tecido ovariano 100%) 7 6 (ver Tabela 6).
| Número etapa | Tratamento | propósito | Tempo (h) |
| 1 | 70% de IMS | Desidratação | 3 |
| 2 | 90% de IMS | Desidratação | 2.5 |
| 3 | 95% de IMS | Desidratação | 1,5 |
| 4 | 100% IMS | Desidratação | 1,5 |
| 5 | 100% IMS | Desidratação | 1,5 |
| 6 | 100% IMS | Desidratação | 1,5 |
| 7 | 100% IMS | Desidratação | 1,5 |
| 8 | Agente de Compensação Histologia | clareira | 1,5 |
| 9 | Agente de Compensação Histologia | clareira | 1,5 |
| 10 | Agente de Compensação Histologia | clareira | 1.5 |
| 11 | CERA | infiltração de cera | 1,25 |
| 12 | CERA | infiltração de cera | 1,25 |
| Total 20 hr |
Tabela 4. regime de Processamento para a cera impregnar tecidos para exame histopatológico. Os tecidos devem ser tratados em um processador de tecido automático. Os tecidos devem ser imersos nas soluções detalhadas para o período de tempo especificado.
| Mancha não. | Mancha | propósito | Tempo (min) |
| 1 | agente de Histologia Clearing | dissolve a cera | 15 |
| 2 | 100% IMS | hidratação | 2 |
| 3 | 90% de IMS | hidratação | 2 |
| 4 | 70% de IMS | hidratação | 2 |
| 5 | ÁGUA DA TORNEIRA (em execução) | Rinse | 2 |
| 6 | HAEMOTOXYLIN | núcleos celulares manchas azuis | 10 |
| 7 | ÁGUA DA TORNEIRA (em execução) | Retire o excesso de | 10 |
| 8 | acidificada IMS | dechlorination | 20 seg |
| 9 | ÁGUA DA TORNEIRA (em execução) | Rinse | 20 seg |
| 10 | Lico 3 | sal | 20 seg |
| 11 | ÁGUA DA TORNEIRA (em execução) | Rinse | 20 seg |
| 12 | 1% Eosina (aquoso) | Manchas rosa citoplasma | 20 seg |
| 13 | ÁGUA DA TORNEIRA (em execução) | Retire o excesso de | 5 |
| 14 | 70% de IMS | Desidratação | 2 |
| 15 | 90% de IMS | Desidratação | 2 |
| 16 | 100% IMS | Desidratação | 5 |
| 17 | agente de Histologia Clearing | Remover IMS agente de ligação | 5 |
Tabela 5. Soluções e tempos de imersão para hematoxilina e eosina (H & E) coloração de tecidos gonadal dos peixes. As lâminas devem ser colocados em cada banho para a alocaçãociado vez em sequência. coloração H & E de tecidos é necessária para determinar os impactos de desenvolvimento ou organização de efluentes de águas residuais estrogênicos nas gónadas de peixe.
| Ponto | seção Descrição |
| 0 | testículo normal masculino |
| 1 | Multifocal ovotestis com 1-5 oócitos (geralmente sozinhos) espalhados entre o tecido testicular |
| 2 | ovotestis multifocal, 6-20 oócitos muitas vezes em pequenos grupos espalhados entre o tecido testicular |
| 3 | ovotestis multifocal, 21-50 oócitos em clusters |
| 4 | > 50 <100 e oócitos. Secção é geralmente multifocal e tem a aparência de um mosaico de testeicular e tecido ovariano. |
| 5 | > 100 oócitos, geralmente multifocal, mas também poderia ser focal com zonas claramente identificáveis de tecido de ovário e de testículo separada do tecido testicular. |
| 6 | > 50 por cento do tecido gonadal sobre a secção é do ovário e é claramente separada do tecido testicular por células epiteliais e tecidos fagocíticas. |
| 7 | 100 por cento de tecido gonadal sobre a secção é ovário. |
Tabela 6. Sistema de pontuação para avaliar a gravidade da condição intersexual em Roach. Histologicamente lâminas preparadas de tecido gonadal deve ser examinado sob microscópio de luz, em 20X, 100X e 400X ampliação, para avaliar qualquer anormalidade e a presença de ovócitos no tecido testicular. Esta tabela é modificada a partir Jobling et al. 2006 6.
Resultados
As tentativas de compreender o impacto de melhorias para os processos de tratamento de águas residuais ou para determinar a tecnologia mais apropriada para retrofit de equipamentos como tratamento terciário na ETAR existente em relação à eficácia da remoção da atividade perturbação do sistema endócrino dos efluentes descarregados, exige não só a medição da química chave componentes que entram as obras, mas requer a análise dos produtos de degradação, que também podem ter actividade perturbação do sistema endócrino. Nos efluentes de esgoto doméstico, as substâncias mais estrogênicos presentes são os hormônios esteróides, estrona (E1), 17β-estradiol (E2) e 17α-etinilestradiol (EE2) 5,8. Estrogénios esteróides são primariamente excretados a partir do corpo, como uma mistura de conjugados inactivos 16,17. Estes estrogênios conjugados são substancialmente desconjugado no sistema de esgotos pela atividade bacteriana e mais degradação ocorre na ETAR. Os esteróides AR desconjugadoe removidos da corrente de águas residuais por adsorção às lamas ou biodegradado durante o tratamento secundário resultando na formação, em primeiro lugar, subprodutos de transformação e, em última análise completa mineralização pode ocorrer do componente activo inicial. A análise química de todos os compostos individuais na corrente de efluente seria difícil, demorado e caro e não iria cobrir componentes activos desconhecidas presentes numa amostra. Além disso, uma soma de a contribuição de cada componente estrogénico só irá fornecer uma indicação da potência estrogénica cumulativa de uma amostra dos compostos analisados. Este é um risco no caso de processos de transformação gerar substâncias estrogênicas desconhecidos ou onde o efluente é de origem industrial. Combinando com análise química in vivo e in vitro em bioensaios Ecotoxicology fornece uma solução para a presença de componentes estrogénicos desconhecidos em misturas, tais como esgotos tratados. Em ensaios in vitro, tais como a levedura Estrogen Screen (SIM) têm sido amplamente utilizados para determinar a actividade estrogénica de efluentes de esgoto e para ajudar a identificar os componentes activos em amostras tratadas 8,18,19. No entanto, as comparações entre in vivo e em ensaios in vitro, podem ser significativos 11 e uma avaliação abrangente de novos processos no que diz respeito ao tratamento de potência de desregulação endócrina requer uma bateria de testes químicos e ecotoxicologia.
A determinação de se as plantas de tratamento individuais ou processos de remoção de compostos activos a partir do fluxo de águas residuais pode ser alcançado por meio de análise química que se segue a extracção da amostra, concentração e limpeza do extracto antes da análise, na maioria das vezes realizada utilizando LCMS (/ MS) ou GCMS (/ EM). Os dados obtidos a partir da análise química pode ser usado para determinar o cumprimento indivíduo concentrações previsivelmente sem efeitos (PNEC) 20 ou norma de qualidade ambientals (NQA) 21 de compostos individuais específicas e, por conseguinte, tais métodos são vitais para os dados de conformidade regulamentar. Além disso, métodos alvo ou não-alvo de análise química permitir a identificação e quantificação de compostos individuais ou isómeros, quando comparada com métodos biológicos, que proporcionam uma resposta total. métodos de análise química, portanto, permitir a avaliação de compostos discretos a ser feita para atender e para enfrentar esses desafios de tratamento de esgoto em regime de estação de tratamento individual. Estudos têm mostrado que o tratamento de águas residuais convencional (por exemplo, plantas de lamas activadas) pode ser altamente eficaz na remoção das hormonas esteróides naturais, embora a remoção da hormona sintética EE2 tende a ser menos eficaz. Ensaios de campo usando um tratamento avançado utilizando técnicas, tais como o ozono, o carbono activado granulado (GAC) e membranas demonstraram, embora a um custo elevado, que pode ser usado como uma solução final de ciclo para remover a EE2 abaixo predinfligido níveis de efeito e para abaixo dos limites de detecção. A Figura 3 mostra a remoção de EE2 usando GAC numa instalação de tratamento de águas residuais municipais em escala piloto. Estudos realizados em escala piloto em estações de tratamento de águas residuais municipais que utilizam extremidade do tubo tratamento GAC também mostram a redução da potência estrogénica seguinte GAC medida usando a tela de levedura estrogênio (YES), como visto na Figura 4.
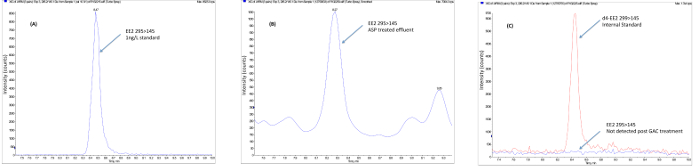
Figura 3. dados de campo Exemplo mostrando a remoção de etinilestradiol após o tratamento terciário avançado. As amostras (A) são recolhidos a partir da ETAR após o tratamento convencional (Instalação de lama activada) seguindo os procedimentos descritos para a preservação da amostra. (B) As amostras são extraídos usando extração em fase sólida, limpa-up para remover substâncias interferentes utilizando SPE a fase normal ecromatografia de permeação em gel. (C) O extracto concentrado limpo é concentrada até um volume baixo e analisados utilizando iões negativos por electropulverização LC MS / MS em modo MRM. Os resultados são calculados utilizando padronização interna utilizando padrões internos isotopicamente marcados. No exemplo mostrado, o EE2 está presente no efluente final de ASP, a uma concentração acima do previsto nenhum nível de efeito (PNEC) de 0,1 ng / L e é removido usando GAC e ozono (O3) a uma concentração segura para o ambiente. Por favor clique aqui para ver uma versão maior desta figura.
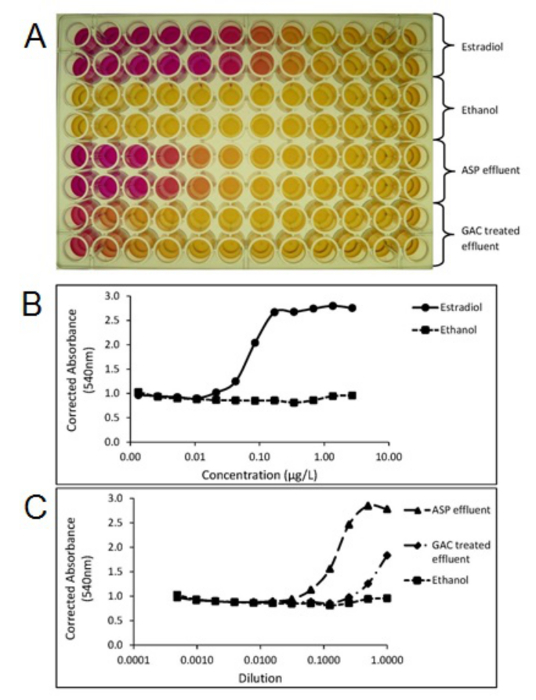
Figura 4. A foto de uma placa de ensaio de tela Levedura de estrogénio (SIM) (A), que mostra a mudança de cor de amarelo para vermelho, relativos à actividade estrogénica das amostras. Tramas criadas a partir da exibição placa de ensaio SIM corrigido absorvância (540nm) do padrão de estradiol (B), activado efluentes processo de lodo (ASP) e Carvão ativado granular (GAC) amostras de efluentes de águas residuais tratadas (C). Cada amostra foi testada em duplicado. ASP e do GAC efluentes foram extraídos e concentrou-se utilizando os métodos SPE descritos na seção 1. Por favor clique aqui para ver uma versão maior desta figura.
Ozonização também é eficiente na remoção de estrogénios esteróides e atividade estrogênica de estações de tratamento de águas residuais tratados de maneira convencional. O ozono é capaz de oxidar uma vasta gama de contaminantes orgânicos e matéria orgânica dissolvida em amostras de águas residuais e fornece propriedades de desinfecção. A eficácia de ozonização depende de características da água, tais como pH, quantidade de matéria orgânica e a dose aplicada de ozono. Os estrogénios que são mal removido por tratamento convencional pode serremovido de águas residuais com doses entre 0,8 mg e 2 O 3 / mg de COD. O ozono é um agente oxidante selectivo, o qual reage com sítios de electrões ricos (ligações insaturadas carbono-carbono, compostos aromáticos incluindo álcoois aromáticos), o que torna o ozono aplicável para a repartição de uma série de EDC. No entanto, a eliminação dos compostos individuais não conduz necessariamente a completa mineralização do composto inicial. As substâncias orgânicas na sequência de ozonização podem ser transformadas intermediários gerar ou oxidação transformação dos subprodutos que incluem um número de peso molecular baixo, as classes de compostos polares, tais como aldeídos, cetonas, ácidos carboxílicos, ácidos ceto, e compostos bromados. Exemplos incluem, bromato, formaldeído, acetaldeído e ácidos carboxílicos. Usando in vivo e in bioensaios in vitro foi demonstrado que, embora apenas parcialmente ozono oxida algumas substâncias químicas, os principais metabolitos resultantes têm uma estrog inferiorpotência ENIC e, portanto, a aplicação de ozônio em uma apropriadas da dose resulta em uma alta remoção de atividade estrogênica.
Um dos principais benefícios do tratamento adicional de efluentes é a redução na feminização dos peixes machos em águas receptoras; um efeito adverso que pode levar à redução da fertilidade 3. Estudos in vivo usando peixe (por exemplo, barata ou vairão) expostas a águas residuais mostrar células germinativas femininas ou oócitos nos testículos de peixe macho (por exemplo, como pode ser visto na Figura 5). Intersex ou VTG masculino é ausente ou significativamente reduzido em peixes após o tratamento avançado, como GAC 7 ou ozono 22. Estes estudos mostram que os produtos de transformação produzidos durante a ozonização são não estrogénico, no entanto, isto não se dirige a toxicidade do efluente produzido. Esta questão foi abordada em outros estudos, por exemplo, um estudo de Magdeburg et al. 23, que mostra que a oxidação de ozono subprodutos são tóxicos para truta arco-íris, mas esta toxicidade pode ser removido por meio de filtração de areia a jusante seguinte ozonização.
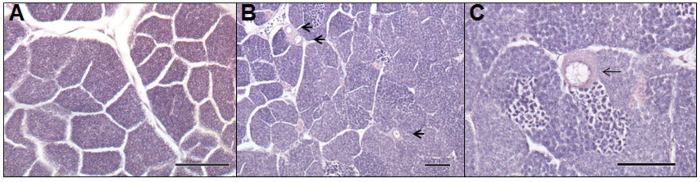
Figura 5. As fotomicrografias de um macho normal (A) e hermafroditas (B, C) gónadas de adulto da barata (Rutilo rutilus) expostas a águas residuais em um campo com base avaliação. Fotomicrografia-A, descreve uma secção histológica de testículo do sexo masculino normais. Photomicrograph-B e -C, retrata cortes histológicos de um peixe macho intersex, tendo sido expostos ao efluente de águas residuais processo de lamas activadas durante seis meses. As setas indicam os oócitos presentes no tecido testicular. Barra de escala representa 100 mm em cada fotomicrografia. Por favor clique aqui para ver uma versão maior desta figura.
O alto custo do final do tratamento tubulação usando ozônio, GAC ou tecnologia de membrana requer o desenvolvimento de baixo custo alternativa, métodos sustentáveis de desregulação endócrina remoção química (EDC). Além disso, os métodos de adsorção e separação simplesmente separar EDC de uma fase para outra, em vez de eliminá-los através de degradação. Activadores TAML têm sido desenvolvidos para catalisar a oxidação de peróxido de hidrogénio de micro-poluentes em águas residuais 12,24 - 26. TAML ativadores com H 2 O 2 efetivamente degradar EE2 e outros estrogênios esteróides em água pura de laboratório, bem como nos efluentes das estações de tratamento de águas residuais municipais e em amostras de urina perfurantes 12. Os estudos de laboratório, mostra TAML / H 2 O 2 de tratamento proporciona uma elevada remoção de estrogénio esteróide incluindo a remoção de EE2 e reduz substancialmente actividade estrogénica medida in vitro utilizando o bioensaio SIM e substantially diminui feminização peixe in vivo medida usando o bioensaio VGT (Figura 1 e Figura 6).
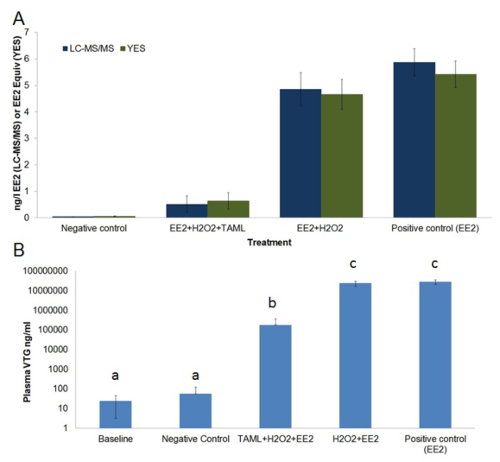
Figura 6. Concentração média EE2 actividade estrogénica e em tratados e não tratados águas de tanque (A) e vitelogenina no plasma da linha de base e peixes expostos macho (B). A) EE2 concentração (ng / L, barras azul escuro) foi medida por LCMS / MS , actividade estrogénica (EE2 equivalente ng / L, escuras barras verdes) foi medido através in vitro tela Levedura de estrogénio (SIM). B) vitelogenina Plasma (ng / ml, luz barras azuis) concentração em peixinhos fathead machos foram medidos por meio de uma enzima quantitativa -linked ensaio imunoabsorvente (ELISA). EE2 resultados da análise química indicados como <0,03 ng / L EE2 (isto é, menor do que o limite de detecção (LOD)) foram tratados como tendo metade LOD (isto é, 0,015 ng / L EE2) para uso em cálculos de médias, desvio padrão e a análise estatística. EE2 e atividade estrogênica são concentrações medidos médios da amostra sobre a exposição 21 dias. Plasma VGT foi medida antes da exposição (linha de base) e após 21 dias de exposição. O regime de tratamento consistiu em; controlo negativo (apenas água de diluição), EE2 + H 2 O 2 + TAML, EE2 + H 2 O 2, e somente EE2. As barras de erro em gráfico-A representam o erro padrão da média, as barras de erro em gráfico-B representam o desvio padrão. Letras acima bares em gráfico-B representam semelhança estatística. Este valor foi modificado a partir Mills et al. 12 Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
estações de tratamento de águas residuais são a principal via de contaminação da água de superfície com EDC. Uma avaliação da eficácia da remoção da actividade endócrina de processos convencionais de tratamento, avançados ou emergentes requer o uso de uma variedade de ensaios químicos e biológicos. A análise química por meio de análise não-alvo e orientada fornece dados qualitativos ou quantitativos sobre a eficácia da remoção de componentes individuais e, portanto, permite uma avaliação a ser feita em relação aos padrões de qualidade ambiental ou concentrações previsivelmente sem efeitos para os compostos ou misturas de compostos analisados.
A geração de produtos de transformação resultante da mineralização incompleta de substâncias após o tratamento e a presença de componentes biologicamente activos desconhecidos nas águas residuais limita a utilidade do teste de produto químico por si só. Uma combinação de in vivo e in bioensaios in vitro em combinação com o químico analíticorastreio ry proporciona uma caixa de ferramentas útil para determinar a eficácia da remoção de EDC por processos de tratamento de águas residuais emergente. Estes testes, quando realizadas juntamente com os parâmetros tradicionais de qualidade da água e outros pontos finais toxicológicos e microbiológicos permitem uma avaliação crítica de tecnologias de tratamento de águas residuais atuais e emergentes.
É importante notar que a levedura telas à base de estrogénio (por exemplo, SIM) não são os únicos ensaios in vitro para determinar a potência estrogénica de produtos químicos e águas residuais. Uma série de ensaios baseados em células de mamífero transfectadas de forma estável foram desenvolvidos também, por exemplo, o ER-CALUX 27 e hERa-HeLa-9903 28 com células humanas de cancro da mama ou células de tumor do colo do útero, respectivamente. O SIM tem sido comparado a ensaios baseados em células de mamíferos semelhantes e foi encontrado para ter um alto nível comparável de reprodutibilidade, verdadeiras taxas estrogênicos positivos e negativos verdadeira identificação 29, although às vezes é considerado ligeiramente menos sensíveis 27. Uma das vantagens de ensaios de repórter de levedura base é que em laboratórios sem experiência significativa com a cultura de células de mamífero o SIM pode ser mais facilmente adoptado, uma vez que requer medidas de controle biológicos menos rigorosas e técnicas estéreis (SIM pode ser executada no topo da bancada, se necessário) . Os ensaios baseados em células humanas também exigem incubadoras de CO 2 e luminômetros comparação com o padrão de incubadoras e de microplacas leitores utilizados no SIM. Ensaios de repórter de estrogênio com base Dois levedura (sim, Saccharomyces cerevisiae e A-SIM, adeninivorans Arxula) estão actualmente submetidos a inter-laboratoriais trilhas para a validação da ISO 19040 "Qualidade da água - Determinação do potencial estrogênico da água e das águas residuais", destacando as indústrias interesse nestas técnicas.
Há um certo número de limitações dos métodos descritos que incluem a contaminação potencialde amostras durante a amostragem, o armazenamento da amostra e análise com substâncias estrogénicas provenientes do ambiente de campo ou laboratório, ou pela contaminação humana (por exemplo, plastificantes, agentes tensioactivos, produtos para cuidados pessoais). Este tipo de contaminação no ensaio SIM (ou outros ensaios baseados em células repórter) irá elevar o fundo e impactam a utilização do ensaio. As amostras de água ou solventes armazenados em garrafas de plástico podem facilmente provocar falsos positivos. Falsos negativos são também motivo de preocupação tanto como LCMS / MS e no ensaio SIM exigem SPE para concentrar estrogênios a níveis detectáveis. A matriz, a escolha de SPE e solvente de eluição sorvente pode afectar a eficiência da extracção e os tipos de compostos eluídos. Usando cartuchos de C18 SPE para a extração usando as condições descritas neste protocolo pode gerar um viés negativo, como compostos altamente polares e básicos seria mal retida pelo adsorvente. Além disso, este protocolo exige que a reconstituição do eluente SIM eluído a partir metanol em etanol por meio de evaporação até à secura azoto financiador resultando na perda de compostos voláteis. Como resultado, o protocolo poderia fornecer subestimada actividade estrogénica de amostras testadas. Estas limitações são especialmente importantes quando se considera o ensaio SIM como compostos desconhecidos ou inesperados pode ser desperdiçada, porque eles não foram extraídos, quer sejam perdidos devido à evaporação. Além disso, a técnica LCMS / MS faz uso de padrões internos marcados para corrigir para a valorização; esta abordagem não pode ser utilizado com o ensaio SIM.
Limitações significativas de ensaios in vivo de efluentes incluem elevado custo e tempo requerido para a avaliação em comparação com métodos in vitro. Actualmente a utilização de testes de embriões de peixes para detectar a actividade estrogénica é limitada. No entanto, tem havido algum sucesso com a produção de estrogênio transgênica responde brilhando embriões de peixes 30, que poderiam ter aplicações futuras. peixinhos Fathead (usados neste PROTOCol) são uma espécie de laboratório comuns e indução VGT em peixes machos é um bio-marcador bem documentada de exposição estrogénica e uma medida quantificável dos efluentes de águas residuais estrogenicidade 22 ou outros compostos estrogénicos ou misturas 31. Orientações de ensaio da OCDE para os produtos químicos de desregulação endócrina foram validados usando adulto vairão, medaka japonês e peixe-zebra 32,33, com VTG ser um biomarcador sensível de exposição estrogênio em todas as três espécies. No entanto, a indução VTG não se correlaciona diretamente a insuficiência reprodutiva e, portanto, as consequências ecológicas da exposição de águas residuais, como visto em severamente roach intersex 3. Por outro lado, barata não são um clássico espécie de laboratório 'para a investigação ecotoxicologia devido ao seu grande tamanho, tempo de geração (2-3 anos para atingir a maturidade sexual), estilo reprodutiva; desova grupo (reprodução) ocorre uma vez por ano, e a dificuldade para identificar os machos das fêmeas (exceto durantea época de desova). No entanto, esta espécie normalmente gonochoristic foi muito bem estudadas, no Reino Unido, devido à descoberta de que a jusante de efluentes de águas residuais estrogénicos, peixes machos exibiram perturbações ao seu Endocrinology (por exemplo, a presença de vitelogenina-específica fêmea no sangue) e histopatologia (ovotestis - o desenvolvimento de ovos nos testículos e / ou condutas reprodutivos femininos) 5,6. Portanto, como uma futura aplicação desses protocolos, barata (ou espécies semelhantes) poderia ser um útil espécies sentinela selvagens para mostrar se melhorias reais para a qualidade das águas residuais (e estrogenicidade reduzida) são vistos nos rios que recebem os efluentes tratados avançados. Eles também podem ser empregadas em final de sistemas de tubagens para monitorar efluentes tecnologicamente melhorado a partir de plantas em escala piloto 7. Ao considerar quais as espécies para usar em nas avaliações de águas residuais in vivo, há uma troca entre espécies de laboratório relativamente rápidas e controladas de teste usando comparação com omais campo com base, mas ambientalmente mais relevantes, testando com espécies nativas. No entanto, tais testes in vivo são de alto custo e só deve ser considerada como o conjunto final de testes seguintes avaliações usando análise química e ensaios in vitro.
As etapas críticas dentro dos protocolos descritos incluem a preparação e manipulação de amostras e material de vidro (ou seja, garrafas e equipamento de amostragem devem ser pré-tratadas com superfície adequada agente de limpeza ativa) para evitar a contaminação das amostras de contaminantes ambientais, incluindo a limitação de contacto das amostras com plásticos e outros materiais que podem produzir falsos positivos. Isto é igualmente importante na concepção e construção de sistemas de exposição aquários e peixes. Idealmente aquários (ações da habitação e durante exposições) deve ser construído a partir de materiais com baixa adsorção 32 com risco de contaminação mínima. O aço inoxidável pode ser usado para tanques de retenção de efluentes ou água.Considerando tanques de uma construção de vidro são preferidos para tanques de peixes (pois isso também proporciona fácil observação do peixe). A utilização de tubos de plástico de grau baixo ou na tubagem deve ser evitado 32, 34 de PVC e ABS pode ser usado se 'adequadamente temperado', isto é, da esquerda para lixiviar para fora quaisquer contaminantes em água corrente de diluição, pelo menos, 12 h antes da utilização. tubo de silicone de grau médico tem sido empregada com sucesso em nossas instalações para entrega bomba peristáltica de produtos químicos e de água de águas residuais / diluição para tanques. Além de considerar a contaminação estrogênica na construção e funcionamento do sistema aquatics, também é importante pensar sobre a dieta do peixe; muitos alimentos decoro peixes foram encontrados para ser estrogénica para peixes. Por isso, é importante testar todos os alimentos para a atividade (por exemplo, na Tela de estrogênio levedura, Veja Beresford et al. 14) antes de usá-los neste tipo de estudos.
Solução de problemasdos protocolos de ensaio de análises químicas ou sim descritos é simplificado se as amostras de garantia de qualidade, incluindo viagens múltiplas, laboratório e espaços em branco de solventes são analisados juntamente com controlos positivos e amostras reais para eliminar resultados falsos positivos e falsos negativos. Positiva (por exemplo, EE2) e negativo (apenas água de diluição) de controlo deve também ser sempre utilizado nos ensaios in vivo para confirmar a sensibilidade de biomarcador biológica esperada ou ponto de extremidade (isto é, VTG ou histopatologia), e permitir que qualquer contaminação inesperado para ser detectada ( por exemplo, de arranjo experimental, dieta, ou águas de diluição). As alterações ao protocolo devem ser validados antes da realização de qualquer estudo.
Com regulação mais estrita dos compostos estrogênicos que entram no ambiente através de efluentes ETAR que se preveja que as tecnologias mais eficazes de tratamento de esgoto terá de ser desenvolvido. A bateria de testes descritos neste manuscrito cumprimentar otestes de avaliação ecotoxicológicos e químicos normalmente aplicado a tratamento de águas residuais as descargas de efluentes da planta. Portanto, a futura aplicação deste tipo de bateria holística de teste deve permitir que desenvolvedores de tecnologia de águas residuais, e operadores de plantas, para implementar os projetos ecologicamente mais segura, considerando os melhores métodos para remover os produtos químicos estrogênicos regulamentadas específicas e atividade biológica em geral.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Projects presented in this paper were funded by Severn Trent Water and Brunel University London. The authors would like to thank Alan Henshaw and John Churchley for providing field and laboratory assistance. T.J.C. thanks the Heinz Endowments for support. M.R.M. thanks the Steinbrenner Institute for a Steinbrenner Doctoral Fellowship and Carnegie Mellon University for a Presidential Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Wellwash Versa plate washer | Thermo Scientific | 5165010 | |
| Plate reader | Molecular Devices | SpectraMax 340PC | |
| Incubator | Memmert | INB 400 | 37 °C incubation required for carp assay |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Icemaker | Scotsman | AF80 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| ELISA kits | Biosense Laboratories | V01018401-096 (Fathead minnow) V01003402-096 (Carp) | |
| Microfuge tubes, 0.5 ml | Alpha labs | LW2372 | |
| Microfuge tubes, 1.5 ml | Alpha labs | LW2375 | |
| Sulphuric acid, 95-98% | Sigma-Aldrich | 258105 | |
| Histology | |||
| Tissue processor | Leica Biosystems | TP1020 | |
| Wax dispenser | Thermo Scientific Raymond Lamb | E66HC | |
| Metal embedding mold | Leica Biosystems | Various | |
| Hot plate | Thermo Scientific Shandon | 3120063 | |
| Cold plate (EG1150 C) | Leica Biosystems | 14038838037 | |
| Heated forceps (EG F) | Leica Biosystems | 14038835824 | |
| Microtome | Leica Biosystems | RM2235 | |
| Paraffin section floatation bath | Electrothermal | MH8517 | |
| Slide drying bench | Electrothermal | MH6616 | |
| Stainmate automated stainer | Thermo Scientific Shandon | E103/S10L | |
| Cassettes, Histosette II, biopsy | Simport | M493 | |
| Paraffin wax | Thermo Scientific Raymond Lamb | W1 | |
| Histo-Clear II | National Diagnostics | HS-202 | |
| IMS (ethanol mix), IDA99 | Tennants | ID440 | |
| Polysine adhesion slides | Thermo Scientific Gerhard Menzel | J2800AMNZ | |
| Cover slips, 22x50 mm | VWR | 631-0137 | |
| Histomount | National Diagnostics | HS-103 | |
| Haematoxylin Harris GURR | VWR | 351945S | |
| Eosin, 1%, aqueous | Pyramid Inovation | S20007-E | |
| Fisherbrand slide boxes | Fisher Scientific | 11701486 | |
| Microtome blades, MB35 | Thermo Scientific Shandon | 3050835 | |
| Bouin’s solution | Sigma Aldrich | HT10132-1L | |
| Yeast screen | |||
| Flow cabinet | Labcaire Systems Ltd | SC12R | |
| Cooled incubator | LMS Cooled Incubator | 303 | |
| Incubator | Memmert | INB 400 | |
| Shaker | Grant | PSU-10i | |
| Fisherbrand whirlimixer | Fisher Scientific | 13214789 | |
| Plate shaker | Heidolph Titramax 100 | 544-11200-00 | |
| 12-Channel F1 digital multichannel pipette | Thermo Scientific Finnpipette | 4661070 | |
| 12-channel pipette, electronic | Sartorius | 735441 | |
| 96-well flat-bottom microplates | MP Biomedicals Thermo Scientific Nunc Sarstedt | 76-232-05 260860 82.1581.001 | We have found that these multiwell plates all produce low backgrounds |
| HPLC grade water | Rathburn | RH1020 | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| Potassium phosphate monobasic anhydrous | Sigma-Aldrich | P-5655 | |
| Ammonium sulphate | Sigma-Aldrich | A-2939 | |
| Potassium hydroxide, pellets | Sigma-Aldrich | P-1767 | |
| Magnesium sulfate, anhydrous | Sigma-Aldrich | M-2643 | |
| Iron(III) sulfate | Sigma-Aldrich | 307718 | |
| L-Leucine | Sigma-Aldrich | L-8912 | |
| L-Histidine | Sigma-Aldrich | H-6034 | |
| Adenine | Sigma-Aldrich | A-2786 | |
| L-Argenine, hydrochloride | Sigma-Aldrich | A-6969 | |
| L-Methionine | Sigma-Aldrich | M-5308 | |
| L-Tyrosine | Sigma-Aldrich | T-8566 | |
| L-Isoleucine | Sigma-Aldrich | I-7403 | |
| L-Lysine, hydrochloride | Sigma-Aldrich | L-8662 | |
| L-Phenylalanine | Sigma-Aldrich | P-5482 | |
| L-Glutamic acid | Sigma-Aldrich | G-8415 | |
| L-Valine | Sigma-Aldrich | V-0513 | |
| L-Serine | Sigma-Aldrich | S-4311 | |
| Thiamine, hydrochloride | Sigma-Aldrich | T-1270 | |
| Pyridoxine | Sigma-Aldrich | P-5669 | |
| D-Pantothenic acid, hemicalcium salt | Sigma-Aldrich | P-5155 | |
| Inositol | Sigma-Aldrich | I-5125 | |
| D-Biotin | Sigma-Aldrich | B-4639 | |
| D-(+)-Glucose anhydrous; mixed anomers | Sigma-Aldrich | G-7021 | |
| L-Aspartic acid | Sigma-Aldrich | A-4534 | |
| L-Threonine | Sigma-Aldrich | T-8441 | |
| Copper(II) sulfate, anhydrous | Sigma-Aldrich | C-1297 | |
| Chlorophenolred-β-D galactopyranoside (CPRG) | Sigma-Aldrich | 10884308001 | |
| Glycerol | Sigma-Aldrich | G-2025 | |
| 17 β-Estradiol | Sigma-Aldrich | E-8875 | |
| Steroids | |||
| Acetone | Rathburn | ||
| Acetonitrile | Rathburn | ||
| Ammonia solution | Rathburn | ||
| Ethylacetate | Rathburn | ||
| Copper(II) nitrate | Sigma-Aldrich | ||
| Acetone | Rathburn | ||
| Dichloromethane | Rathburn | ||
| 2,4,16,16-d4-17β-estradiol | CDN Isotopes | ||
| 2,4,16,16-d4-estrone | CDN Isotopes | ||
| 2,4,16,16-d4-17α-ethynyl oestradiol | CDN Isotopes | ||
| 17β-estradiol | Sigma-Aldrich | ||
| Estrone | Sigma-Aldrich | ||
| 17α-ethynyl oestradiol | Sigma-Aldrich | ||
| Hexane | Rathburn | ||
| Hydrochloric acid | Sigma-Aldrich | ||
| Methanol | Sigma-Aldrich | ||
| Sodium hydrogen carbonate | Sigma-Aldrich | ||
| Sodium hydroxide | Sigma-Aldrich | ||
| Styrene divinyl benzene cartridge (Isolute ENV+) solid phase extraction cartridge (200 mg/6 ml) | Biotage | ||
| Isolute aminopropyl solid phase extraction cartridge (500 mg/6 ml) | Biotage | ||
| Fish study | |||
| orange-white silicon manifold tubing 0.63 bore pk 6 | Watson Marlow | 982.0063.000 | |
| straight connectors for 0.5/0.8 bore pk 20 | Watson Marlow | 999.2008.000 | |
| pumsil silicon tubing 0.8 bore 15 m | Watson Marlow | 913.A008.016 | |
| 200 series multi-channel persitaltic pump | Watson Marlow | 205CA | |
| Silicone tubing x 15 m (dosing tanks) | VWR | SFM1-3250 | |
| silicone tubing x 15 m (large for inflow/outflow) | VWR | SFM1-5450 | |
| 2.5 L glass winchester pk 4 | Fisher Scienctific | BTF-505-050B | |
| magnetic stir bar 51 x 8 mm pk 10 | Fisher Scienctific | FB55595 | |
| Ethyl 3-aminobenzoate methanesulfonate (MS222) | Sigma Aldrich | E10521-10G | |
| 17α-Ethynylestradiol | Sigma Aldrich | E4876-100MG | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| SPE | |||
| 1/8 inch PTFE tubes 'straws' colour coded pk 4 | Sigma Aldrich | 57276 | |
| disposable liners for manifold | Sigma Aldrich | 57059 | |
| filtration tubes without frits 6 ml pk 30 | Sigma Aldrich | 57242 | |
| reservior adaptors pk 12 | Sigma Aldrich | 57020-U | |
| stainless steel weight for manifold pk 4 | Sigma Aldrich | 57278 | |
| male Luer plug for manifold pk 12 | Sigma Aldrich | 504351 | |
| SPE Vacuum Manifold | Sigma Aldrich | 57265 | |
| stop cocks for extraction mainfold (supelco) pk 12 | Waters | WAT054806 | |
| Sep-Pak Plus C18 cartridge box 50 | Waters | WAT020515 | |
| Methanol HPLC grade 2.5 L | Fisher Scientific | M/4056/17 | |
| 7 ml glass vials with lids (58 x 17 mm) pk 399 | Fisher Scientific | TUL-520-031K | |
| Absolute ethanol | Hayman Kimia | F200238 | |
| vacuum pump, e.g., VP Series Vacuum Pump | Camlab | 1136915 |
Referências
- Bergman, &. #. 1. 9. 7. ;., Heindel, J., Jobling, S., Kidd, K., Zoeller, R. T. State-of-the-science of endocrine disrupting chemicals. Toxicol. Lett. 211, (2012).
- Rodgers-Gray, T. P., et al. Exposure of juvenile roach (Rutilus rutilus) to treated sewage effluent induces dose-dependent and persistent disruption in gonadal duct development. Environ. Sci. Technol. 35 (3), 462-470 (2001).
- Jobling, S., et al. Altered sexual maturation and gamete production in wild roach (Rutilus rutilus) living in rivers that receive treated sewage effluents. Biol. reprod. 66 (2), 272-281 (2002).
- Tyler, C. R., Der Eerden, B. V. a. n., Jobling, S., Panter, G., Sumpter, J. P. Measurement of vitellogenin, a biomarker for exposure to oestrogenic chemicals, in a wide variety of cyprinid fish. J. Comp. Physiol. B, Biochem. Syst. Environ. Physiol. 166 (7), 418-426 (1996).
- Jobling, S., Nolan, M., Tyler, C. R., Brighty, G., Sumpter, J. P. Widespread sexual disruption in wild fish. Environ. Sci. Technol. 32 (17), 2498-2506 (1998).
- Jobling, S., et al. Predicted exposures to steroid estrogens in U.K. rivers correlate with widespread sexual disruption in wild fish populations. Environ. Health Perspect. 114, 32-39 (2006).
- Baynes, A., et al. Additional treatment of wastewater reduces endocrine disruption in wild fish - a comparative study of tertiary and advanced treatments. Environ. Sci. Technol. 46 (10), 5565-5573 (2012).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environ. Toxicol. Chem. 15 (3), 241-248 (1996).
- Grover, D. P., Balaam, J., Pacitto, S., Readman, J. W., White, S., Zhou, J. L. Endocrine disrupting activities in sewage effluent and river water determined by chemical analysis and in vitro assay in the context of granular activated carbon upgrade. Chemosphere. 84 (10), 1512-1520 (2011).
- . . The determination of steroid oestrogens in waters using chromatography and mass spectrometry (2008) Methods for the Examination of Waters and Associated Materials. (2008), (2008).
- Van den Belt, K., Berckmans, P., Vangenechten, C., Verheyen, R., Witters, H. Comparative study on the in vitro/in vivo estrogenic potencies of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and of 17beta-estradiol, estrone, 17alpha-ethynylestradiol and nonylphenol. Aquat. toxicol. 66 (2), 183-195 (2004).
- Mills, M. R., et al. Removal of ecotoxicity of 17α-ethinylestradiol using TAML/peroxide water treatment. Sci. Rep. 5, 10511 (2015).
- . . EN 14962:2006 Water quality - Guidance on the scope and selection of fish sampling methods. , (2006).
- Beresford, N., Brian, J. V., Runnalls, T. J., Sumpter, J. P., Jobling, S. Estrogenic activity of tropical fish food can alter baseline vitellogenin concentrations in male fathead minnow (Pimephales promelas). Environ. Toxicol. Chem. 30 (5), 1139-1145 (2011).
- Nolan, M., Jobling, S., Brighty, G., Sumpter, J. P., Tyler, C. R. A histological description of intersexuality in the roach. J. Fish Biol. 58 (1), 160-176 (2001).
- Dascenzo, G., et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities. Sci. Total Environ. 302 (1-3), 199-209 (2003).
- Gomes, R. L., Birkett, J. W., Scrimshaw, M. D., Lester, J. N. Simultaneous determination of natural and synthetic steroid estrogens and their conjugates in aqueous matrices by liquid chromatography/mass spectrometry. Int. J. Environ. Anal. Chem. 85 (1), 1-14 (2005).
- Metcalfe, C. D., et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes). Environ. Toxicol. Chem. 20 (2), 297-308 (2001).
- Stalter, D., Magdeburg, A., Wagner, M., Oehlmann, J. Ozonation and activated carbon treatment of sewage effluents: Removal of endocrine activity and cytotoxicity. Water Res. 45 (3), 1015-1024 (2011).
- Caldwell, D. J., Mastrocco, F., Anderson, P. D., Länge, R., Sumpter, J. P. Predicted-no-effect concentrations for the steroid estrogens estrone, 17β-estradiol, estriol, and 17α-ethinylestradiol. Environ. Toxicol. Chem. 31 (6), 1396-1406 (2012).
- Gardner, M., Comber, S., Scrimshaw, M. D., Cartmell, E., Lester, J., Ellor, B. The significance of hazardous chemicals in wastewater treatment works effluents. Sci. Total Environ. 437, 363-372 (2012).
- Filby, A. L., Shears, J. A., Drage, B. E., Churchley, J. H., Tyler, C. R. Effects of advanced treatments of wastewater effluents on estrogenic and reproductive health impacts in fish. Environ. Sci. Technol. 44 (11), 4348-4354 (2010).
- Magdeburg, A., Stalter, D., Oehlmann, J. Whole effluent toxicity assessment at a wastewater treatment plant upgraded with a full-scale post-ozonation using aquatic key species. Chemosphere. 88 (8), 1008-1014 (2012).
- Collins, T. J. TAML oxidant activators: a new approach to the activation of hydrogen peroxide for environmentally significant problems. Acc. Chem. Res. 35 (9), 782-790 (2002).
- Collins, T. J. Designing Ligands for Oxidizing Complexes. Acc. Chem. Res. 27 (9), 279-285 (1994).
- Truong, L., Denardo, M. A., Kundu, S., Collins, T. J., Tanguay, R. L. Zebrafish Assays as Developmental Toxicity Indicators in The Design of TAML Oxidation Catalysts. Green Chem. 15 (9), 2339-2343 (2013).
- Murk, A. J., et al. Detection of estrogenic potency in wastewater and surface water with three in vitro bioassays. Environ. Toxicol. Chem. 21 (1), 16-23 (2002).
- . Test No 455: The Stably Transfected Human Estrogen Receptor-alpha Transcriptional Activation Assay for Detection of Estrogenic Agonist-Activity of Chemicals. OECD Guidelines for the Testing of Chemicals, Section 4. , (2009).
- Kolle, S. N., et al. In house validation of recombinant yeast estrogen and androgen receptor agonist and antagonist screening assays. Toxicol in Vitro. 24 (7), 2030-2040 (2010).
- Lee, O., Tyler, C. R., Kudoh, T. Development of a transient expression assay for detecting environmental oestrogens in zebrafish and medaka embryos. BMC Biotechnology. 12, 32 (2012).
- Brian, J. V., et al. Accurate prediction of the response of freshwater fish to a mixture of estrogenic chemicals. Environ Health Perspect. 113 (6), 721-728 (2005).
- . Test No 229: Fish Short Term Reproduction Assay. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
- . Test No 230: 21-day Fish Assay: A Short-Term Screening for Oestrogenic and Androgenic Activity and Aromatase Inhibition. OECD Guidelines for the Testing of Chemicals, Section 2. , (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados