Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo para el aislamiento del Círculo de Willis Ratón
En este artículo
Resumen
We describe here a reproducible protocol for isolating the mouse circle of Willis.
Resumen
El círculo arterial cerebral (circulus arterioso cerebral) o círculo de Willis (vaca) es una anastomosis circulatorio que rodea el quiasma óptico y el hipotálamo que suministra sangre al cerebro y las estructuras circundantes. Se ha implicado en varios trastornos cerebrovasculares, incluyendo angiopatía cerebral amiloide (CAA) vasculopatías -asociado, aterosclerosis intracraneal y aneurismas intracraneales. Los estudios de los mecanismos moleculares que subyacen a estas enfermedades para la identificación de nuevas dianas farmacológicas para su prevención requieren modelos animales. Algunos de estos modelos puede ser transgénico, mientras que otros implican el aislamiento del cerebro-vascular, incluyendo el método CoW.The descrito aquí es adecuado para el aislamiento de vaca en cualquier linaje de ratón y tiene un potencial considerable para el cribado (expresión de genes, la producción de proteínas, proteínas modificaciones posteriores a la traducción, análisis secretoma, etc.) los estudios sobre los grandes vasos del cerebro-ratónvasculatura. También se puede utilizar para estudios ex vivo, mediante la adaptación del sistema de baño de órganos aislados desarrollado para arterias olfativas ratón.
Introducción
El círculo arterial cerebral (circulus arterioso cerebri), también conocido como el polígono de Willis (vaca), el lazo de Willisor Willis polígono) fue descrito por primera vez por Thomas Willis en 1664. Es una anastomosis circulatorio situado alrededor del quiasma óptico y el hipotálamo que pueden ser considerado como un eje central el suministro de sangre al cerebro y las estructuras circundantes. La sangre entra en esta estructura a través de la carótida interna y las arterias vertebrales y fluye fuera del círculo a través de la mitad interior y las arterias cerebrales posteriores. Cada una de estas arterias ha ramas izquierda y derecha de cada lado del círculo. El basilar, puesto comunicación, y la comunicación de las arterias completa el círculo anterior (Figura 1 y Figura 2). El riesgo de alteración del flujo sanguíneo en cualquiera de las arterias de salida de flujo se reduce al mínimo por la fusión de sangre que entra en el círculo de la carótida y las arterias cerebrales, garantizando de este modo que la sangre suficiente se suministra a la blluvia. Esta estructura también sirve como la principal vía de flujo sanguíneo colateral en enfermedades oclusivas graves de la arteria carótida interna.
Existen varios tipos de trastornos cerebrovasculares tienen su origen en la vaca. Los más comunes son la angiopatía amiloide cerebral (CAA) -asociado vasculopatías, la aterosclerosis intracraneal y los aneurismas intracraneales. 1, 2, 3 Estos trastornos pueden conducir a la hipoperfusión debido a la vasodilatación, e intracerebral y / o hemorragias subaracnoideas en última instancia se traduce en accidentes cerebrovasculares hemorrágicos o isquémicos o , a lo sumo, un ataque isquémico transitorio. Los recientes avances en los procedimientos de diagnóstico, incluyendo neuroimagen, posiblemente combinado con la angiografía, han hecho posible diagnosticar estas enfermedades cerebrovasculares importantes clínicamente, sin la necesidad de una biopsia cerebral. Sin embargo, los tratamientos eficaces y específicos (farmacológicos o endovasculares) la actualidad se carece y por lo tanto hay una necesidad de definir nuevosdianas moleculares.
La identificación de nuevos objetivos de medicamentos para la prevención de estas enfermedades en los seres humanos requerirá modelos animales y formas de aislar el cerebro-vascular incluyendo la vaca. Estos modelos deben proporcionar evidencia de pistas y de los cambios específicos, incluyendo los cambios inflamatorios, que se producen en las paredes de los grandes vasos en modelos animales de aneurisma de la arteria intracraneal, AAC o aterosclerosis intracraneal. 4, 5, 6
Hemos establecido un método para el aislamiento CdT ratón para facilitar los estudios de inflamación de los vasos en la enfermedad de Alzheimer (AD) y enfermedades relacionadas, tales como la CAA. Este método para el aislamiento de la CoW ratón fue desarrollado para la evaluación de la expresión génica inflamatoria cerebrovascular durante la progresión de la enfermedad. Junto con la detección de la deposición de amiloide beta dentro de las paredes de las arterias y leptomeníngeo pial, este método podría hacer más fácil para disuadirmina de la posible relación entre la expresión de genes inflamatorios en la pared cerebro-vascular y acumulación de Aß-péptido. La red vascular del cerebro, incluyendo el leptomeníngeo y pial en el espacio subaracnoideo, es una extensión de las grandes arterias que forman el círculo de Willis. El método descrito aquí podría ser utilizado para aislar el CoW de cualquier linaje de ratón y podría ser utilizado para todo tipo de detección (por ejemplo, la expresión génica, la producción de proteínas y las modificaciones postraduccionales de proteínas) en los grandes vasos del ratón cerebro-vascular.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos se realizaron de conformidad con las normas de la Comunidad Europea para el cuidado y uso de animales de laboratorio, con la aprobación del comité de ética local de la experimentación con animales (Ile de France-Paris-Comité, Autorización 4270).
1. anestesia
- Infundir una dosis letal de pentobarbital (hasta 1 mg / 10 g de peso corporal) (aguja de calibre 27 y una jeringa de 1 ml) por vía intraperitoneal en ratones adultos antes de la cirugía.
La perfusión 2. Embarcación
NOTA: No hay necesidad de aplicar el ungüento veterinario para los ojos durante la perfusión del vaso. Este procedimiento es rápido (5-10 minutos) y termina en la muerte del animal. Confirmar la falta de respuesta con una pizca dedo del pie.
- Usando tijeras iris, hacer una incisión, de aproximadamente 4 cm de longitud, en la pared abdominal y el peritoneo, justo debajo de la caja torácica.
- Hacer una pequeña incisión (unos pocos milímetros de largo) en el diafragma y luego continue la incisión de la membrana a lo largo de toda la longitud de la caja torácica para exponer la cavidad pleural.
- Levantar el esternón y la abrazadera de distancia de la punta del esternón con la pinza hemostática; colocar la pinza hemostática en el cuello. Con cuidado, recortar el tejido adiposo que conecta el esternón hasta el corazón.
- Pasar la aguja de perfusión de calibre 15 a través del ventrículo izquierdo en el vértice del corazón.
- Por último, utilizar tijeras para cortar uno de los lóbulos del hígado para crear una toma de corriente.
NOTA: Una salida alternativa se puede crear mediante el uso de tijeras iris para crear una incisión en la aurícula derecha. - Perfundir el animal con 25 a 50 ml de solución salina tamponada con fosfato (PBS) con una bomba que funciona a una velocidad de 2,5 ml / min. El hígado debe Blanch como la sangre se sustituye con PBS.
- Después de aproximadamente cinco minutos, una vez que el fluido desde el hígado está completamente claro, detener la perfusión.
- Si se planea inmunotinción o tinción regular, perfundir el animal con 50 ml de paraformaldehído(PFA; 4% en PBS) durante 15 min.
NOTA: Precaución, humos PFA son tóxicos. La perfusión del animal con PFA debe llevarse a cabo en una campana de humos ventilada.
3. El aislamiento del cerebro y el Círculo de Willis
- Aislamiento del cerebro
- Retire la cabeza con un par de tijeras quirúrgicas.
- Hacer una incisión en la línea media con tijeras iris, a lo largo de la piel desde el cuello hasta la nariz.
- Se quita la piel para exponer el cráneo y eliminar los músculos y los tejidos adiposos residuales con unas tijeras iris.
- Coloque el extremo agudo de la tijera iris en el foramen magnum en un lado y deslice con cuidado a lo largo de la superficie interna del cráneo al meato auditivo externo (también conocido como el canal auditivo).
- Reproducir la incisión se describe en 3.1.4 en el lado contralateral y hacer un corte a lo largo de la línea media de la superficie interior del hueso inter-parietal del inicio de la sutura sagital.
- Plantar el iristijeras en el hueso frontal, justo entre los ojos, en la sutura sagital y luego abrirlas para dividir el cráneo en dos.
- Levante el cerebro, el acaparamiento de los bulbos olfatorios y el uso de las tijeras iris para cortar las conexiones nerviosas en su superficie ventral.
- Retire el cerebro y lo coloca en una placa de Petri de 60 mm que contenía PBS helado para el aislamiento de vaca. Sumerja por completo el cerebro en el PBS. Si el cerebro se fijó con PFA al 4% (para la sección posterior y la inmunotinción o manchas regular), guardarlo en un baño de PFA al 4% a 4 ° C durante 24 horas.
- El aislamiento del polígono de Willis
NOTA: Se requiere un microscopio de disección para el aislamiento de vaca. El cerebro debe mantenerse a 4 ° C durante todo el procedimiento.- Ponga el cerebro al revés (es decir, en su superficie dorsal) para visualizar la vaca.
- Utilizar unas pequeñas pinzas para agarrar las arterias cerebrales anteriores (ACA) en la base de los lóbulos olfativos ( a, Figura 1) y ejercer presión para disociarlos del continuo buque. Utilice el mismo procedimiento para cortar las arterias cerebral media (MCA) en B (figura 1).
- Usa los extremos afilados de las pinzas para levantar y quitar las arterias principales que forman la vaca de la corteza.
- Levantar el inicio de las arterias comunicante posterior (PCA) para desconectarlos de cerebro, sujetando las arterias cerebrales medias (MCA) con los fórceps. Recoger las arterias anterior (ACA y MCA) y tirar de ellos suavemente sobre el quiasma óptico en una dirección anterior-dorsal. Para evitar la interrupción de la vaca, interrumpir el procedimiento para hacer frente a las otras arterias.
- Repetir los pasos 3.2.2 y 3.2.3 de las arterias cerebelosas superior y posterior (SCA) / (PCA) (C, figura 1) y para la arteria basilar (BA) (d, Figura 1), tirando de ellos en un dorsal- dirección anterior. Detener al final del procedimiento descrito in 3.2.4.
- Retire toda la vaca por tirando suavemente con las pinzas. Coloque la vaca en un plato de 60 mm de Petri llena de helado de PBS y remover el tejido cerebral unida restante con dos pinzas, la celebración de la vaca en su lugar con pequeños alfileres.
- Mantenga el CoW cosechado a -80 ° C para su posterior procesamiento para la purificación de ARN (rendimientos de extracción de ARN de grandes cantidades de ARN - aproximadamente 500 ng) o la extracción de proteínas.
Nota: La vaca se puede mantener ex vivo durante 24 horas, adaptando el sistema de baño de órganos desarrollado por la arteria olfativa aislada del ratón 7.

Figura 1: Diagrama esquemático de una vista ventral del cerebro de ratón Destacando Comité de lo que la vaca se forma a partir de las dos arterias carótidas internas (MCA), que se derivan de las dos arterias cerebrales anteriores (ACA);. la basilararteriales (BA) se ramifica en el posterior (ACP) y superior (SCA) arterias cerebrales, y dos arterias vertebrales (VA).
Access restricted. Please log in or start a trial to view this content.
Resultados
El ratón perfundidos con PBS se mata y se aísla la vaca como se describe en la sección 3.2 del protocolo. Cuando la disección se realiza correctamente, la vaca debe salir en una sola pieza y debe ser ligeramente transparente debido a la ausencia de sangre residual en la vasculatura.
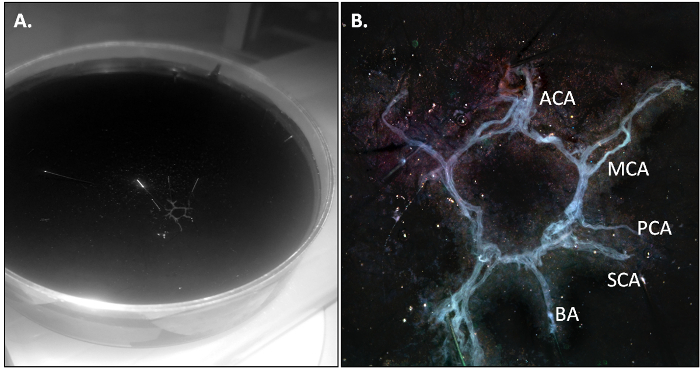
Figura 2: La vaca del ratón después d...
Access restricted. Please log in or start a trial to view this content.
Discusión
Se describe aquí un protocolo reproducible para el aislamiento del círculo de Willis. Los trastornos cerebrovasculares más comunes que implican el CdT son vasculopatías CAA-asociado, aterosclerosis intracraneal y aneurisma intracraneal, todos los cuales afectan a las paredes de los vasos arteriales. Los factores de riesgo son bien conocidos, pero la patogénesis molecular de estos trastornos cerebrales sigue siendo poco conocida y los marcadores biológicos específicos para predecir su ocurrencia son insuficientes....
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este trabajo fue apoyado por la Universidad de París VI y una donación de Pierre Fabre Innovación.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
Referencias
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados